发酵条件对胆固醇降解能力的影响
,,,, ,大卫,,顾瑞
(扬州大学食品科学与工程学院,江苏省乳品生物技术与安全控制重点实验室,江苏扬州 225001)
发酵条件对胆固醇降解能力的影响
戴颖,瞿恒贤,瓦云超,黄玉军,陈霞,陈大卫,杨正泉,顾瑞霞*
(扬州大学食品科学与工程学院,江苏省乳品生物技术与安全控制重点实验室,江苏扬州 225001)
通过对混合菌株发酵条件进行优化,提高混合菌株胆固醇降解能力与活菌数,旨在获得高效降胆固醇的混合菌株,为乳酸菌应用提供依据。选取四株具有辅助降胆固醇活性乳酸菌将其1∶1∶1∶1混合,并通过单因素实验和响应曲面分析方法,以胆固醇降解率和活菌数为指标对混合菌株培养基和培养条件进行了优化。以MRS培养基为基础,更换不同碳氮源,确定混合菌株最适发酵条件为:乳糖24.19 g/L、胰蛋白胨8.41 g/L,培养温度28.28 ℃,培养时间30 h,接种量5.24%。经优化后,混合菌株胆固醇降解率由39.56%提高到53.43%,增加了35.06%;活菌数由8.87 lgCFU/mL提高到9.63 lgCFU/mL,与优化前相比上升了一个数量级。
混合乳酸菌,降胆固醇,发酵条件,响应面分析法
随着人们生活水平的提高,膳食营养越来越丰富,但伴随的负面影响却是冠心病、高血压、动脉粥样硬化等心血管和脑血管疾病的发病率持续上升。这些疾病对人类健康造成严重危害。如何减少胆固醇摄入和降低人体血清中胆固醇的水平已经受到越来越多的关注,研究不限饮食、不影响食品风味、经济实用的降低食品及人体血清中胆固醇水平的方法已成为当前的研究热点[1]。
乳酸菌可以降低血清胆固醇,调节血脂水平,因此其受到国内外营养学、医学、微生物学等各界人士的普遍关注。国内外大量实验证实,服用乳酸菌及其产品可以减少人体血清胆固醇,具有降低心脑血管疾病发病率的功效[2-3]。赖文等[4]从四川泡菜中分离到一株植物乳杆菌,该菌不仅具有较强降胆固醇能力,同时还具有较强耐酸、耐高浓度胆汁盐的能力并将其作为未来菌种开发的菌源。然而,目前的研究仍然存在一些问题:体外实验虽然证明乳酸菌可以吸收胆固醇分子,但这些体外实验多是在pH为6.0或更低的水溶液内进行的,胆固醇的减少是源于被菌体吸收还是被菌体吸附的问题仍存在争议。
已有的研究针对单菌株比较多,而对多菌株混合降胆固醇研究甚少,本实验在前期实验研究的基础上,以实验室保藏的四株具有辅助降胆固醇作用的乳酸菌为原料,将其混合并对混合菌株培养基碳氮源、起始pH、培养温度、培养时间及接种量进行优化,以改善混合菌株发酵条件,使其降胆固醇能力和活菌数得到充分提高,为生产高效降胆固醇功能性乳制品奠定基础并提供参考依据。
1 材料与方法
1.1材料与仪器
四株具有辅助降胆固醇特性的鼠李糖乳杆菌(L.rhamnosus)grx10、干酪乳杆菌(L.casei)g9、发酵乳杆菌(L.Fermentum)f5和长双歧杆菌(B.longum)w10及其1∶1∶1∶1简单混合菌株 实验室筛选保存;胆固醇、三氯化铁、蔗糖酯等化学试剂 国药集团化学试剂有限公司。
JF-SX-500全自动灭菌锅 日本TOMY公司;SPX-150BSH-Ⅱ生化培养箱 上海新苗医疗器械制造有限公司;Legend mach1.6R高速冷冻离心机 美国塞默飞世尔科技有限公司;Bio-Tck ELX800酶标仪 美国宝特公司。
1.2实验方法
1.2.1 菌株活化 将四株菌株参照文献[5]中的方法进行活化。
1.2.2 试剂配制 MRS培养基[6]、富胆固醇培养基[7-8];茚三酮显色液[9]、硫磷铁试剂(P-Fe-S)[10]配制方法参照文献方法进行配制。
1.2.3 胆固醇降解率的测定 将活化好的乳酸菌按5%的接种量接种在富胆固醇培养基中,37 ℃培养24 h,1800×g离心10 min,取上清液0.2 mL,加4.8 mL的无水乙醇,4000×g离心5 min,取上清液2 mL,加2 mL硫磷铁显色剂,混匀,待反应管冷却到室温后,在20 min内测定560 nm处的OD值记作OD测量,以不接菌的富胆固醇培养基为对照测定560 nm处的OD值记作OD空白,计算出胆固醇降解率D,每个处理做3个重复,取平均值。降解率换算如下:
D(%)=(OD空白-OD测量)/OD空白×100
1.2.4 菌株同化率及沉淀胆固醇能力测定 参照文献[9]方法,将1.2.3中得到的菌体沉淀,用无菌生理盐水洗涤3遍,补充生理盐水至5 mL,1800×g 离心10 min,分别测定560 nm处的OD值记做OD沉淀,以不接菌的富胆固醇培养基为对照测定560 nm处的OD值记作OD空白,计算出洗涤液中胆固醇降解率D2,D2即为胆固醇沉淀率,D1为乳酸菌同化率。
D2(%)=OD沉淀/OD空白×100
D1=D-D2
1.2.5 活菌数测定 按照GB4789.35-2010[11],采用MRS平板倾注法进行测定。
1.2.6 胆盐水解酶(BSH)活性测定[12]取1 mL在MRS培养基中培养24 h的菌株培养液,4 ℃、10000 r/min离心10 min,菌体用磷酸钠缓冲溶液(0.1 mol/L,pH6.5)充分洗涤2次,再用3.5 mL磷酸钠缓冲溶液悬浮,冰浴中进行超声波破碎15 min(100 W,工作时间/间隙时间为3 s/5 s),1800×g离心10 min,取0.1 mL的上清液,加入1.8 mL 磷酸钠缓冲溶液和0.1 mL的6 mmol/L牛磺胆酸钠于试管中,振荡混匀,37 ℃水浴30 min后,加入2.0 mL 15%的三氯乙酸充分混匀终止反应后,离心(1800×g,10 min),取上清液2 mL,加入1 mL的茚三酮显色液,旋涡振荡后,煮沸15 min,冷却后测定其在570 nm处的吸光度值。按照文献[13]中计算公式计算出BSH酶活。
BSH酶活=(aa×V反应液体积)/(V酶液×30)
式中,aa表示吸光度值对照标准曲线得到的氨基酸量,单位mmol/L;V反应液体积表示的显色液的体积,本实验中为3 mL;V酶液表示参加反应的酶液量,本实验中为0.1 mL;30表示反应时间30 min。
1.2.7 单因素实验 以MRS培养基为基础,分别以葡萄糖、淀粉、乳糖、蔗糖为碳源,添加量20 g/L,以大豆蛋白胨、胰蛋白胨、鱼粉蛋白胨、聚蛋白胨为氮源,添加量10 g/L,接种量5%,37 ℃培养24 h,测定活菌数及胆固醇降解率。
以筛选出的最佳碳氮源作为富胆固醇培养基碳氮源,添加量分别为20 g/L和10 g/L。
将混合菌株按5%的接种量接种到10 mL pH为6.5的富胆固醇培养基中,分别在28、30、33、35、37、40和42 ℃培养24 h,测定活菌数及胆固醇降解率。
将菌液按5%的接种量接种到10 mL pH为6.5的富胆固醇培养基中,37 ℃培养,分别在20、25、30、35、40和45 h取样,测定活菌数及胆固醇降解率。
将菌液分别按1%、3%、5%、7%、9%的接种量接种到10 mL pH为6.5的富胆固醇培养基中,37 ℃培养24 h取样,测定活菌数及胆固醇降解率。
将菌液按5%的接种量接种到10 mL pH分别为5.0、5.5、6.0、6.5、7.0、7.5、8.0的富胆固醇培养基中,37 ℃培养24 h,测定活菌数及胆固醇降解率。
1.2.8 响应面实验 根据单因素实验结果,以混合菌株碳源、氮源及温度和接种量为考察因素,利用Box-Behnken实验设计进行参数优化,因素水平设计见表1,以活菌数及胆固醇降解率为响应值。
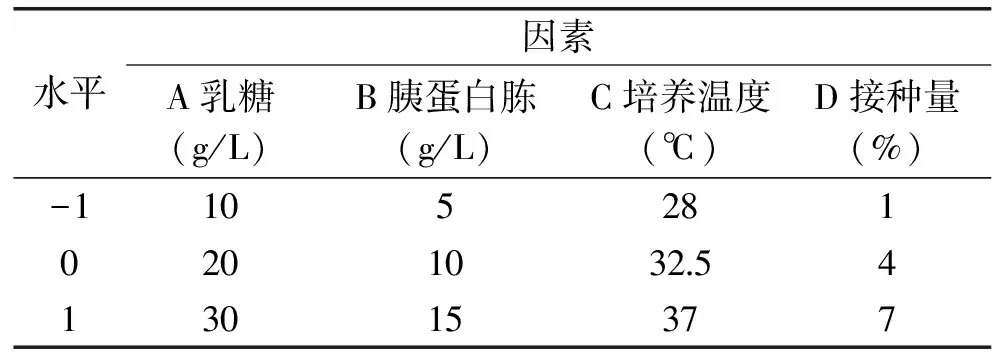
表1 响应面实验因素水平表Table 1 The factors and levels of response surface experiment
1.2.9 数据处理 应用软件SPSS 17.0,Excel,Origin2016,Design-Expert8.0.6进行数据分析。
2 结果与分析
2.1单因素实验
2.1.1 不同碳氮源对混合菌株活菌数及胆固醇降解率的影响 不同碳氮源对乳酸菌生长和胆固醇降解率的影响结果如图1和图2所示。
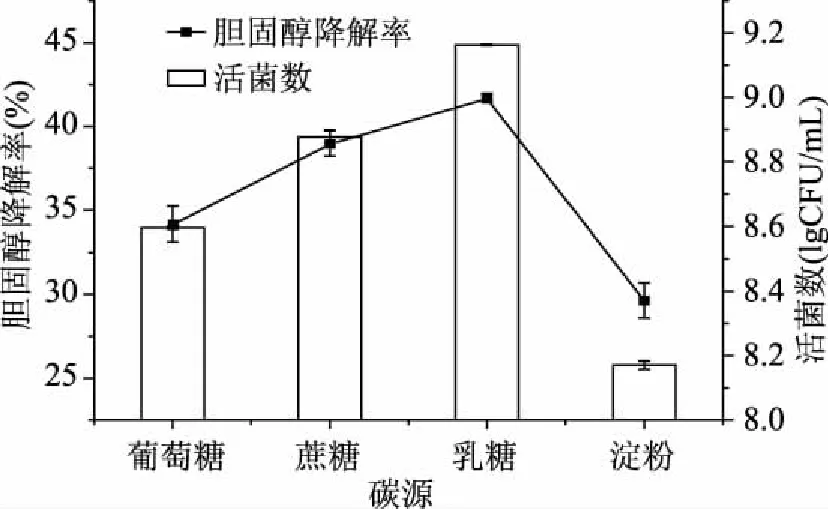
图1 不同碳源对胆固醇降解率及活菌数的影响Fig.1 The effect of carbon source on the cholesterol reducing ability and total colonies
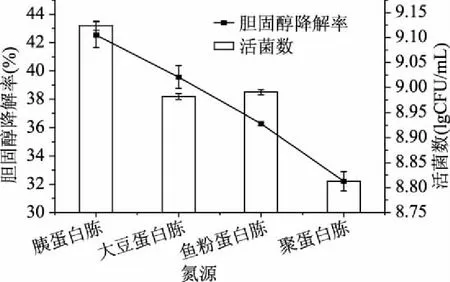
图2 不同氮源胆固醇降解率及活菌数的影响Fig.2 The effect of nitrogen source on the cholesterol educing ability and total colonies
由图1可以看出,当以乳糖为单一碳源时,混合菌株胆固醇降解率和活菌数明显高于葡萄糖、蔗糖和淀粉。以乳糖为碳源时,胆固醇降解率达到41.73%左右,活菌数达到9.16 lgCFU/mL左右,远远高于其他碳源。虽然乳糖为双糖,但其可水解为葡萄糖和半乳糖,而这两种糖都是可以被乳酸菌利用的,混合菌株对淀粉的利用效果不太理想,这可能是由于淀粉是一种高分子多糖,需要充分的水解才能被吸收利用。因此,选择乳糖为碳源有利于提高混合菌株胆固醇降解率和活菌数。同时,根据碳源添加量实验结果(文中未列出)进一步确定了培养基碳源最佳添加量为20.0 g/L。
由图2可以看出,不同氮源对混合菌株胆固醇降解率和活菌数的影响相对比较大。当以胰蛋白胨为氮源时,混合菌株胆固醇降解率及活菌数均明显高于其他氮源,分别达到42.55%、9.12 lgCFU/mL。因此,为了有效地提高混合菌株降胆固醇能力、增加菌株活菌数,选择胰蛋白胨作为培养基氮源。进一步实验确定了培养基最佳氮源添加量为10.0 g/L。
2.1.2 不同培养温度对混合菌株活菌数及胆固醇降解率的影响 不同培养温度对乳酸菌生长和胆固醇降解率的影响结果如图3所示。由图3可以看出,温度差异对混合菌株胆固醇降解率和活菌数影响均较为显著,当培养温度在35 ℃左右时,可以获得较高的胆固醇降解率和活菌数,分别达到42.54%和9.11 lgCFU/mL,而当温度太高或太低时,菌株胆固醇降解率及活菌数都处于较低水平。
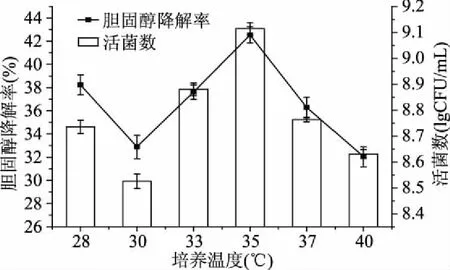
图3 培养温度对胆固醇降解率及活菌数的影响Fig.3 The effect of temperature on the cholesterolreducing ability and total colonies
2.1.3 不同培养时间对混合菌株活菌数及胆固醇降解率的影响 不同培养时间对乳酸菌生长和胆固醇降解率的影响结果如图4所示。从图4可以得到,时间对菌株胆固醇降解率的影响要高于对活菌数的影响。菌株培养30 h左右时,胆固醇降解率和活菌数均达到最高值,分别为53.24%和9.45 lgCFU/mL。因此,混合菌株最佳培养时间定为30 h。

图4 培养时间对胆固醇降解率及活菌数的影响Fig.4 The effect of fermentation time on the cholesterolreducing ability and total colonies
2.1.4 不同接种量对混合菌株活菌数及胆固醇降解率的影响 不同接种量对乳酸菌生长和胆固醇降解率的影响结果如图5所示。由图5可看出,接种量的差异对混合菌株胆固醇降解率和活菌数的影响均较为显著,当接种量在5%左右时,胆固醇降解率和活菌数均明显高于其他接种量,达到44.35%、9.21 lgCFU/mL。
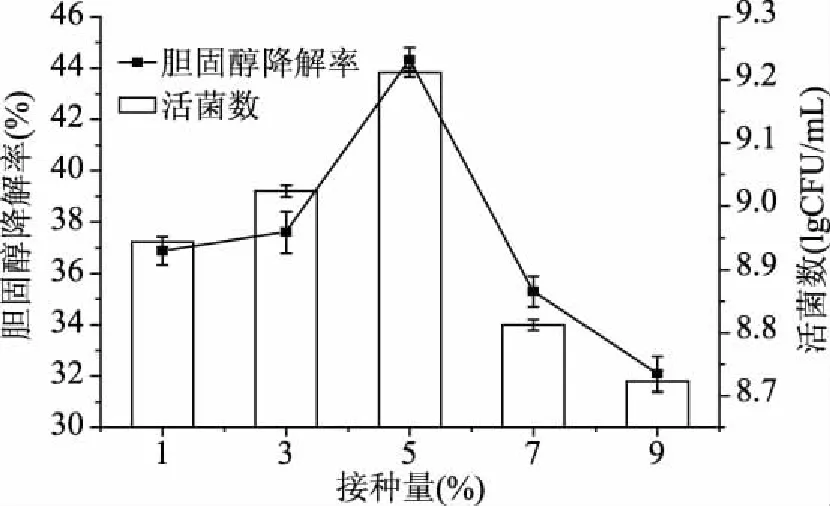
图5 接种量对胆固醇降解率及活菌数的影响Fig.5 Effect of inoculum size on the cholesterol reducing ability and total colonies
2.1.5 不同起始pH对混合菌株活菌数及胆固醇降解率的影响 不同pH对乳酸菌生长和胆固醇降解率的影响结果如图6所示。从图6可以看出,当pH为6.5时,菌株胆固醇降解率明显高于其他pH时的胆固醇降解率。因此,将培养基起始pH维持在6.5左右。
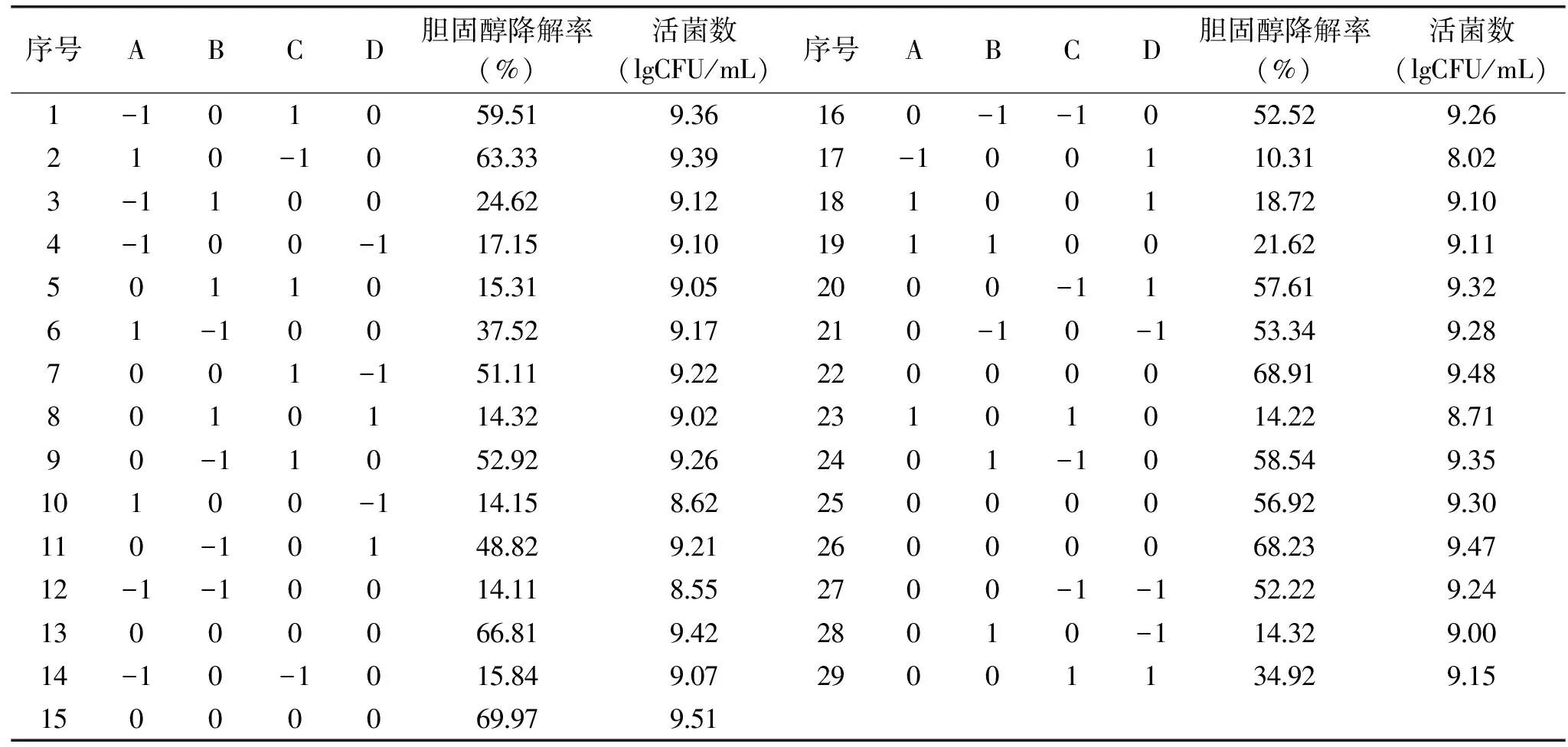
表2 响应面设计及实验结果Table 2 The experiment results of response surface
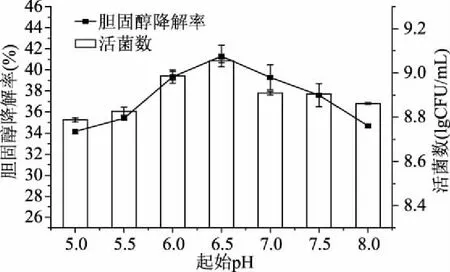
图6 不同起始pH对胆固醇降解率及活菌数的影响Fig.6 The effect of pH on the cholesterol reducingability and total colonies
2.2培养基碳氮源使用量及发酵条件优化
利用软件对表2中实验数据进行回归分析,经拟合得到回归方程:
Y(胆固醇降解率)=+66.17+2.34A-9.21B-6.01C-1.47D-6.60AB-23.20AC+2.85AD-10.91BC+1.13BD-5.39CD-28.24A2-16.13B2-1.12C2-18.75D2
Y(活菌数)=+9.45+0.071A-6.667E-003B-0.073C-0.051D-0.16AB-0.24AC+0.38AD-0.075BC+0.022BD-0.038A2-0.12B2+3.250E-003C2-0.26D2
对模型进行方差分析(表3、表4),胆固醇降解率回归模型p值<0.0001且失拟项的p值>0.05,表示模型极显著,活菌数回归模型p值<0.01且失拟项的p值>0.05,表示模型极显著。胆固醇降解率模型项系数R2=0.9118,表明预测值与真实值之间有高度的相关性,活菌数模型项系数R2=0.8315,说明模型拟合程度好。模型回归方程的系数显著性检验如下,各因素对胆固醇降解率的影响顺序为B胰蛋白胨>C培养温度>A乳糖>D接种量,各因素对活菌数的影响顺序为C培养温度>A乳糖>D接种量>B胰蛋白胨。
各交互显著项的响应面图见图7~图10。由图7和图8可以看出,乳糖-培养温度(p<0.01)和胰蛋白胨-培养温度(p<0.05)的交互影响对胆固醇降解率的影响较为显著;由图9和图10可以看出乳糖-培养温度(p=0.0194<0.05)和乳糖-接种量(p=0.001<0.01)的交互影响对混合菌株活菌数的影响较为显著。通过响应面设计与分析对各个影响因素进行优化组合最终得到混合菌株优化后的培养条件为:乳糖24.19 g/L,胰蛋白胨8.41 g/L,培养温度28.28 ℃,接种量5.24%。
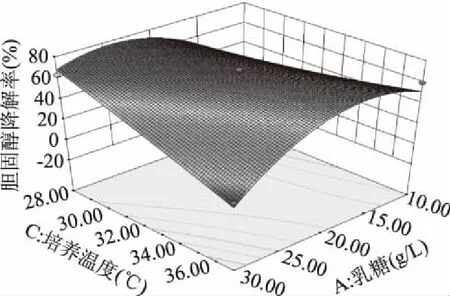
图7 乳糖和培养温度对胆固醇降解率交互影响三维曲面图Fig.7 Surface of interaction for lactose and temperature on the cholesterol reducing ability
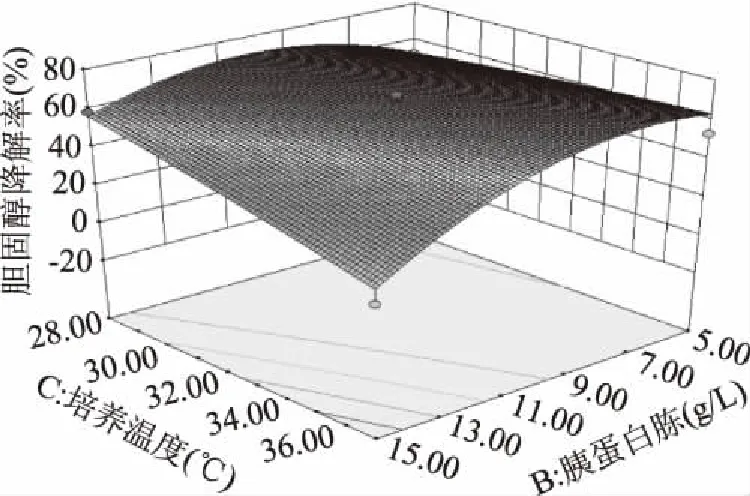
图8 胰蛋白胨和培养温度对胆固醇降解率交互影响三维曲面图Fig.8 Surface of interaction for tryptone and temperature on the cholesterol reducing ability
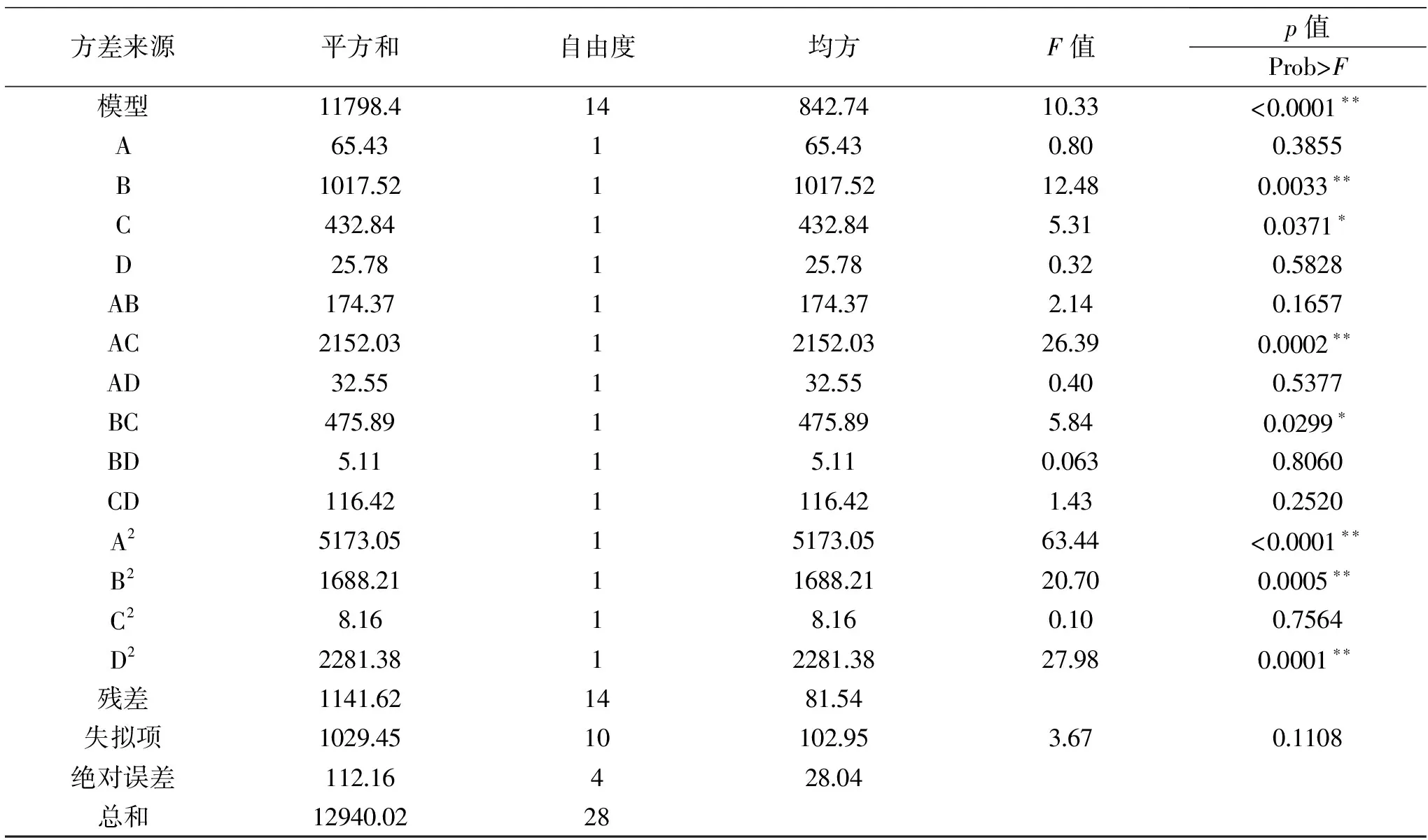
表3 胆固醇降解率的方差分析Table 3 Variance analysis of cholesterol degradation rate
注:*表示在0.05水平上具有显著差异,**表示在0.01水平上具有极显著差异。表4同。

表4 活菌数的方差分析Table 4 Variance analysis of viable count

表5 优化前后混合菌株活菌数、BSH酶活及胆固醇去除能力的对比Table 5 Comparison of growth,BSH activity and cholesterol-reducing ability of mixstrain
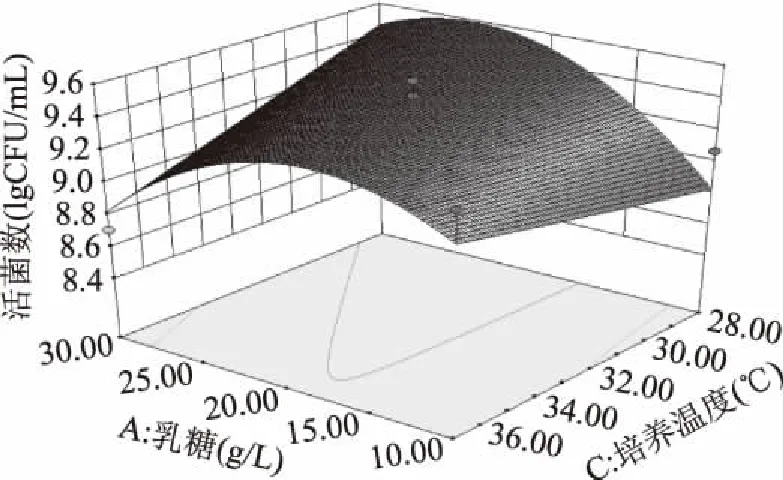
图9 乳糖和培养温度对活菌数交互影响的三维曲面图Fig.9 Surface of interaction for lactose and temperature on total colonies
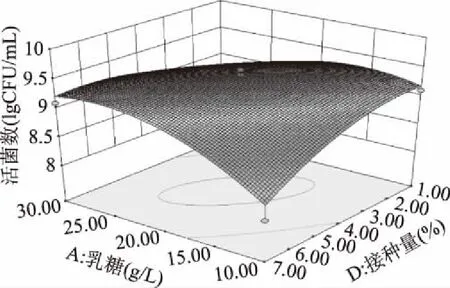
图10 乳糖和接种量对活菌数交互影响的三维曲面图Fig.10 Surface of interaction for lactose and inoculum size on total colonies
注:与优化前相比,*表示具有显著性差异(p<0.05)。2.3混合菌株优化前后活菌数、胆盐水解酶酶活及胆固醇去除能力比较
大量研究表明,双歧杆菌[14]、干酪乳杆菌[15]、植物乳杆菌[16]等乳酸菌都可产生胆盐水解酶。而这种酶可以结合胆酸分解为游离胆酸,从而与胆固醇结合形成沉淀共同沉淀下来。本实验对混合菌株优化前后活菌数、胆盐水解酶酶活及胆固醇去除能力进行比较,结果见表5。
由表5可知,在MRS培养基中,混合菌株的胆固醇降解率为39.56%,优化后混合菌株的胆固醇降解率达到53.43%,提高了35.06%,显著高于优化前胆固醇降解率(p<0.05),其中,沉淀率提高了52.73%,而同化率只提高了29.88%。此外,胆盐水解酶酶活也增加了48.26%,说明发酵条件优化主要是通过提升菌株胆盐水解酶酶活和加强菌株共沉淀进而来提高菌株胆固醇去除能力的。从表5中也可以看出,优化前混合菌株活菌数为8.87 lgCFU/mL,优化后达到9.63 lgCFU/mL,活菌数增加了一个数量级,具有显著性差异(p<0.05)。
3 结论
综合单因素、响应曲面分析结果,混合菌株在乳糖24.19 g/L,胰蛋白胨8.41 g/L(MRS中其他成分不变),培养温度28.28 ℃,培养时间30 h,接种量5.24%的条件下培养,混合菌株的胆固醇降解率达到53.43%,较优化前提高了35.06%,其中,沉淀率提高了52.73%,而同化率只提高了29.88%。此外,胆盐水解酶酶活也增加了48.26%,说明发酵条件优化主要是通过提升菌株胆盐水解酶酶活和加强菌株共沉淀进而来提高菌株胆固醇去除能力。活菌数由8.87 lgCFU/mL提高到9.63 lgCFU/mL,比优化前增加了一个数量级。
[1]刘奕琼,张灏,田丰伟. 微生物降胆固醇作用研究进展[J].
食品与机械,2003(1):6-9.
[2]Lin.SY,AyresJW,William Winkler JR,et al. Lacrobacillus effects on cholesterol-invitroandinvivoresults[J]. Journal of Dairy Science,1989,72(11):2885-2899.
[3]AkalinAS,Gone S. Influence of yogurt and acidophilus yogurt on serum cholesterol levels in mice[J]. Dairy Sci,1997,80:2721-2725.
[4]Mang V,Spoerry A. Study of surfactant and chloesteremia in the Massai[J]. American Journal of Clinical Nutrition,1974,27:464-469.
[5]陆路,黄秀,胡耀东. 戊糖片球菌C1C-4菌株培养基、发酵条件及其发酵产品储藏温度的优化[J]. 四川农业大学学报,2015(1):57-61.
[6]凌代文,东秀珠. 乳酸细菌分类鉴定及实验方法[M]. 北京:中国轻工业出版社.
[7]王俊国. 降胆固醇益生乳杆菌的筛选及其降胆固醇作用的研究[D]. 内蒙古:内蒙古农业大学,2008.
[8]GB/T5009. 128-2003. 食品中胆固醇的测定方法[S]. 北京:中国标准出版社,2003:135-138.
[9]刘勇. 降胆固醇乳酸菌的筛选及高密度培养[D]. 郑州:河南工业大学,2011.
[10]徐小军,余国珍,陈鉴东. 硫磷铁法测定大豆甾醇提取物中总甾醇含量[J]. 中国药业,2010(8):35-36.
[11]食品安全国家标准GB4789.35-2010. 食品微生物学检验-乳酸菌检验[S]. 中华人民共和国国家标准,2010.
[12]刘静,王瑾.具有胆固醇去除能力和胆盐水解酶活性的乳酸菌的体外筛选[J]. 食品科技,2011,36(5):18-22.
[13]Dashkevicz MP,Feighner SD. Development of a Differential Medium for Bile-Salt Hydrolase ActivityLactobacillusspp[J]. Appl Environ Microbiol,1989,55(1):11-16.
[14]Borja Sa’nchez,Marie-Christine Champomier-Verge’s Marl’a del Carmen Collado. Low-pH adaptation and the acid tolerance response of Bifidobacterium longum biotype longum[J]. Applied and Environmental Microbiology,2007,73(20):6450-6459.
[15]Yoo Heon PARK,Jong Gun KIM,Yong Won Shin,et al. Effects of Lactobacillus acidophilus 43121 and a mixture ofLactobacilluscaseiandBifidobacteriumlongumonthe serum cholesterol level and fecal sterol excretionin hypercholesterolemia-included pigs[J].Bioscience Biotechnology Biochemistry,2008,72(2):595-600.
[16]Belviso,S Giordano,M Dolci,et al.Invitrocholesterol-lowering activity of Lactobacillus plantarum and Lactobacillus paracasei strains isolated from the Italian Castelmagno PDO cheese[J]. Dairy Science and technology,2009,89(2):169-176.
Effectsoffermentationconditionsoncholesteroldegradability
DAIYing,QUHeng-xian,WAYun-chao,HUANGYu-jun,CHENXia,CHENDa-wei,YANGZheng-quan,GURui-xia*
(College of Food Science and Engineering,Yangzhou University,Key Laboratory of Dairy Biotechnology and Safety Control,Yangzhou 225001,China)
In order to improve the ability of cholesterol degradation and the number of viable bacteria,the study optimized the fermentation conditions of mixed strains,aiming at obtaining high efficient cholesterol-degrading strains and providing the basis for the application of lactic acid bacteria. Four strains of lactic acid bacteria with auxiliary cholesterol-lowering activity were selected and mixed with 1∶1∶1∶1 mixture. The single factor experiment and response surface analysis were used to study the effects of cholesterol degradation rate and viable count. Conditions were optimized. The optimum fermentation conditions were as follows:lactose 24.19 g/L,tryptone 8.41 g/L,culture temperature 28.28 ℃,culture time 30 h,inoculation amount 5.24%. After optimization,the degradation rate of cholesterol in the mixed strains increased from 39.56% to 53.43%,increased by 35.06%. The totol colonies was increased from 8.87 lgCFU/mL to 9.63 lgCFU/mL. The viable count was an order of magnitude higher than that before optimization.
mixed lactic acid bacteria;cholesterol-lowering;fermentation conditions;response surface methodology
2016-11-30
戴颖(1991-),女,硕士研究生,主要从事乳品科学方面的研究,E-mail:1245364260@qq.com。
*通讯作者:顾瑞霞(1963-),男,博士,教授,主要从事乳品科学方面的研究,E-mail:rxgu@yzu.edu.cn。
国家自然科学基金(31571855);“十二五”国家科技支撑计划项目(2013BAD18B12);江苏省科技支撑项目(BN2014080);江苏省高校自然科学研究重大项目(12KJA550003)。
TS201.3
:A
:1002-0306(2017)12-0123-06
10.13386/j.issn1002-0306.2017.12.023

