草鱼鱼皮不同分子量肽段体外抗氧化性能的研究
,,,,,*, ,,
(1.渤海大学食品科学与工程学院,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁省食品安全重点实验室,辽宁锦州 121013; 2.西南大学食品科学学院,重庆北碚 400716; 3.大连天宝绿色食品有限公司,辽宁大连116001; 4.浙江兴业集团有限公司,浙江舟山315200; 5.大连东霖食品股份有限公司,辽宁大连116007)
草鱼鱼皮不同分子量肽段体外抗氧化性能的研究
蔡路昀1,2,冷利萍1,李秀霞1,吕艳芳1,励建荣1,2,*,赵葳3,马永钧4,沈琳5
(1.渤海大学食品科学与工程学院,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁省食品安全重点实验室,辽宁锦州 121013; 2.西南大学食品科学学院,重庆北碚 400716; 3.大连天宝绿色食品有限公司,辽宁大连116001; 4.浙江兴业集团有限公司,浙江舟山315200; 5.大连东霖食品股份有限公司,辽宁大连116007)
采用碱性蛋白酶对草鱼皮进行水解,并将水解产物通过截留分子量为10、5和3 kDa的超滤膜,得到>10、5~10、3~5和<3 kDa 四种不同分子量肽段组分。主要研究了粗蛋白水解产物经截留后不同分子量肽段的体外抗氧化活性及其功能,结果表明相同浓度下3~5和<3 kDa肽段组分在清除1,1-二苯基-2-三硝基苯肼(DPPH)和2,2′-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)自由基方面比蛋白水解产物或其它肽段组分的效果显著(p<0.05),而>10 kDa肽段组分与Fe2+螯合能力最强。然而,与还原型的L-谷胱甘肽相比,>10、5~10、3~5 kDa肽段组分具有较弱的清除超氧阴离子自由基能力,肽的氨基酸序列在其抗氧化活性中起到关键作用。结果表明,<3 kDa肽段组分可作为功能性天然抗氧化剂添加到保健食品中。
草鱼,鱼皮,水解产物,抗氧化能力,不同分子量肽段
人体和其它需氧生物体内均会发生氧化反应进而引发许多健康问题[1]。氧化过程中会产生自由基,其在信号传导中起主要作用[2]。然而,过多的自由基能够迅速与其它氧化物质反应,进而对细胞组织或机体造成多种损伤和病变[3]。一些合成抗氧化剂如二丁基羟基甲苯(BHT)和叔丁基氢醌(TBHQ)能够用于减缓食品中的氧化反应。然而,为了避免合成抗氧化剂对健康造成潜在危害,开发一种既安全又廉价的天然抗氧化剂,已成为现代食品、医药和保健品行业的热门课题之一。
蛋白质是天然生物活性肽的主要来源,蛋白质水解是食品中蛋白质通过胃消化、蛋白酶水解和微生物酶共同作用而发生的[4-5],多肽和游离氨基酸即为蛋白质的水解产物。事实上,一些生物活性多肽用于治疗诸如高血压、高血脂、炎症、糖尿病、微生物感染、免疫障碍甚至癌症等疾病时效果显著[5]。目前已知它们可以作为抑制由活性氧诱导的氧化损伤的自由基清除剂,因此从食物来源中提取天然抗氧化肽已经引起研究者的广泛关注[6]。
草鱼(Ctenopharyngodonidella)是一种在亚洲及北美洲湖泊河流中常见的淡水鱼。草鱼目前主要加工成鱼糜制品,而在生产鱼糜制品的过程中,会产生鱼皮等废弃物,因此如果对草鱼皮进行加工利用,不仅可以提高鱼类的利用价值和水产产业附加值,同时还能减少资源浪费和环境污染。草鱼蛋白含有丰富的甘氨酸(Gly)、脯氨酸(Pro)、丙氨酸(Ala)、谷氨酸(Glu)和精氨酸(Arg)[7]。Ren等[8]报道草鱼肌肉蛋白的水解产物具有抗氧化性质。另外有研究报道了草鱼鱼皮胶原蛋白的提取条件和鱼皮蛋白水解产物的功能特性[9-10],然而,却很少有对草鱼鱼皮肽段体外抗氧化活性的研究。本研究旨在确定草鱼鱼皮蛋白水解产物及其通过分子量截留后不同大小的肽段组分,测定草鱼皮酶解产物中不同肽段的抗氧化性,便于进一步分离纯化,并分析其氨基酸组成和体外抗氧化能力,将来可以根据不同肽段的不同强弱抗氧化性进行区别应用,为其他研究鱼皮或水产品抗氧化肽的研究者提供研究借鉴,也为我们下一步的研究基础做好探索。
1 材料与方法
1.1材料与仪器
草鱼鱼皮 锦州当地水产加工企业提供;1,1-二苯基-2-三硝基苯肼(DPPH)、还原型L-谷胱甘肽(GSH)、亚油酸、ABTS、乙二胺四乙酸(EDTA)、三氯乙酸(TCA)、邻苯三酚 美国Sigma公司;碱性蛋白酶(2.0×105U/g) 江苏瑞阳生物科技有限公司;截流分子10、5、3 kDa Pellicon纤维素平板膜,有效膜面积均为0.5 m2Millipore公司;其余试剂 均为分析纯,锦州国药器化玻有限公司。
PL602-L电子天平 梅特勒-托利多仪器(上海)有限公司;DF-101S集热式恒温加热磁力搅拌器 郑州长城科工贸有限公司;Optima 4300 DV电感耦合等离子体发射光谱仪 美国Perkin Elmer公司;L-8900氨基酸分析仪;PE Victor X3酶标仪 美国Perkin elmer公司;高速冷冻离心机 Thermo公司;Free Zone2.5真空冷冻干燥机 美国Labconco公司;超声波清洗器 上海科导超声仪器有限公司;UV-2550紫外分光光度计 日本岛津公司;Pellicon小型超滤系统 美国Millipore公司。
1.2实验方法
1.2.1 草鱼皮蛋白水解产物的制备 将冷冻干燥的草鱼皮切成(0.5×0.5 cm2)小块,取干燥的鱼皮(10 g)浸泡在500 mL异丙醇中用于脱脂,并在室温下连续搅拌。将脱脂鱼皮溶解在400 mL蒸馏水中,并且使用0.1 mol/L NaOH将混合物的pH调节至8.5,随后加入碱性蛋白酶(12000 U/g)。将混合物在50 ℃的条件下连续搅拌加热120 min[8]。酶解后取出水解产物,90 ℃水浴10 min灭酶,然后以10000×g离心20 min。取出上清液在真空冷冻干燥机(压力0.035 mBar,温度-48 ℃)中冻干24 h得到草鱼皮蛋白水解产物粉末(GPH)。
1.2.2 不同分子量肽段制备 将300 mg GPH加入到6 mL蒸馏水中并充分混和。将GPH溶液通过0.22 μm过滤膜过滤。将获得的混合物通过10、5和3 kDa的一次性超滤膜截留,得到四个截留组分:>10、5~10、3~5和<3 kDa。将所得多肽组分分别冻干并保存在-20 ℃的干燥装置中。
1.2.3 基本组成分析 参考AOAC[11]方法分析测定水分、蛋白质、脂肪和灰分的含量。
1.2.4 氨基酸组成测定 取100 mg GPH或肽段的粉末溶于6 mol/L HCl中,充氮密封后于110 ℃水解24 h。结束后转移到旋转蒸发仪上50 ℃进行旋蒸,并将残余物溶解在0.1 mol/L HCl中定容至25 mL。最后取20 μL上样测定各样品的氨基酸组成。
1.2.5 抗氧化活性的测定 参考张华[12]设计实验浓度,将GPH和四种不同分子量的肽段组分分别配制成浓度为1、3和5 mg/mL,进行体外抗氧化活性的测定实验。
1.2.5.1 DPPH自由基清除力测定 DPPH自由基的清除能力使用96孔板测定。将样品溶解于含有1.0%(w/v)Triton X-100的磷酸盐缓冲液(0.1 mol/L,pH7.0)中,将DPPH自由基溶解于95%乙醇中。将样品溶液等分成0.1 mL与0.1 mL的DPPH溶液混合,最后得到多肽的测定浓度分别为1、3和5 mg/mL,随后将混合溶液放在黑暗中反应30 min。反应结束后,使用酶标仪在517 nm处测定溶液的吸光度。磷酸盐缓冲液等分成0.1 mL与0.1 mL DPPH溶液混合作为空白。使用浓度为1 mg/mL的GSH做为对照。DPPH自由基清除能力的公式如下:
DPPH自由基清除率(%)=[(Ab-As)/Ab]× 100
式中,Ab是空白的吸光度,As是样品的吸光度。
1.2.5.2 还原力测定 按照Oyaizu[13]的还原力测定法进行测定。

表1 草鱼皮蛋白水解液和不同分子量的肽段的基本组成Table 1 Proximate compositions of GPH and its different molecular weight peptide fractions
注:同行不同小写字母代表差异显著(p<0.05);表2同。1.2.5.3 超氧阴离子自由基的清除率测定 按照Xie[14]方法测定超氧阴离子自由基的清除率。
1.2.5.4 ABTS自由基清除能力测定 按照Wiriyaphan[15]的方法测定ABTS。
1.2.5.5 Fe2+螯合能力测定 按照Decker和Welch[16]螯合FeCl2的方法进行测定。
1.2.5.6 亚油酸体系测定抗氧化能力 按照Farvin[17]的亚油酸体系测定抗氧化能力。
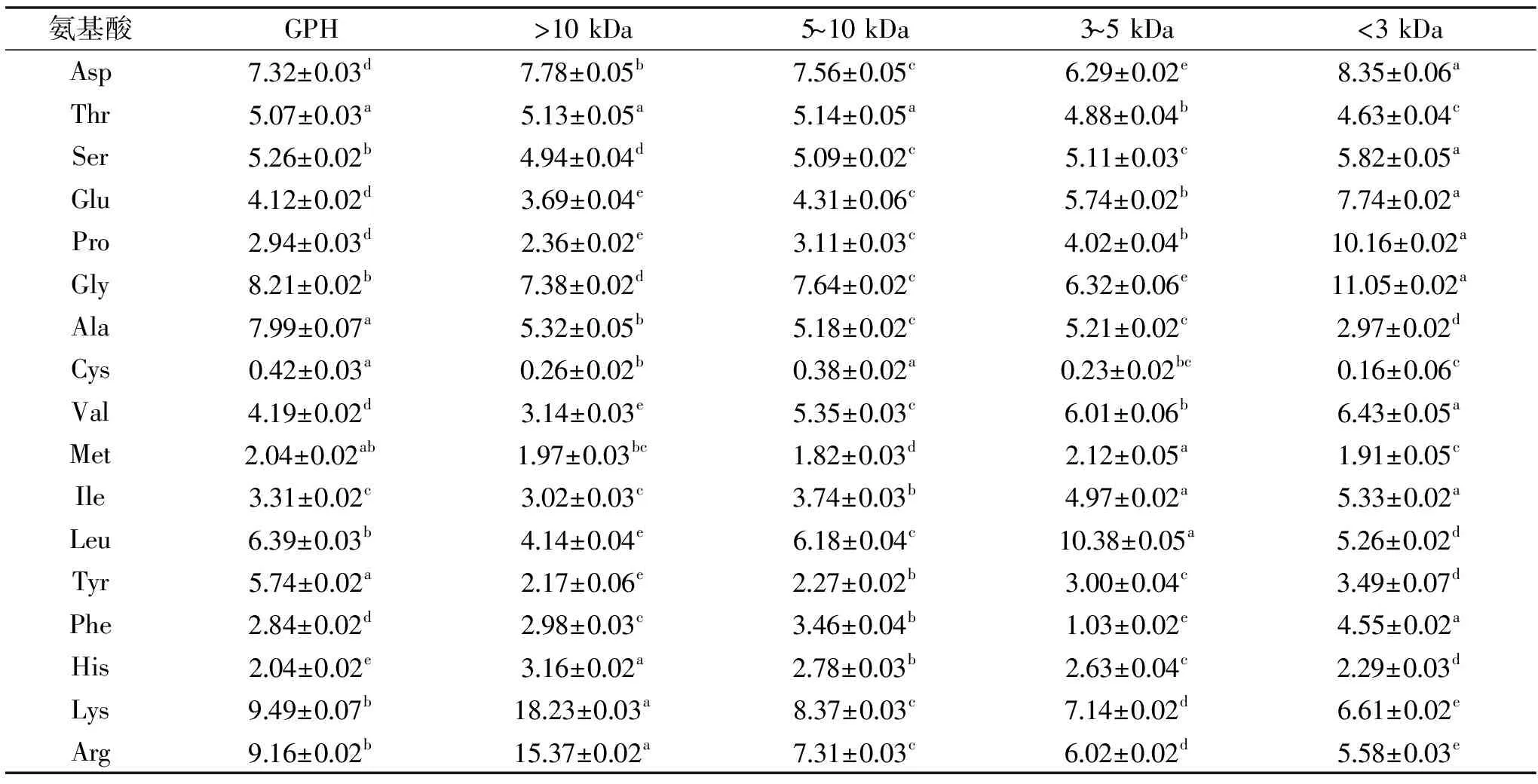
表2 草鱼皮蛋白水解液和不同分子量肽段的氨基酸组成(%)Table 2 Amino acid compositions of GPH and its different molecular weight peptide fractions(%)
1.3数据处理
所有实验都进行三次重复测量,结果表示为平均值±标准偏差。将数据进行单因素方差分析(ANOVA),使用Duncan’s多重范围检验(SAS版本8.1),p<0.05被认为是有显著差异。
2 结果与讨论
2.1草鱼不同分子量肽段的基本组成分析
通过截留分子量为10、5、3 kDa的超滤膜来获得GPH的不同分子量的肽段,并获得四个肽段组分(>10、5~10、3~5、<3 kDa)。GPH和不同分子量肽段的基本组成成分如表1所示。所有样品含有非常高的蛋白质含量(GPH:82.1%;>10 kDa:89.1%;5~10 kDa:90.4%;3~5 kDa:90.2%;<3 kDa:92.3%)和非常低的脂肪含量(0.03%~0.88%)。王立峰等[18]研究发现不同分子量肽段的抗氧化活性的强弱与氨基酸的种类、组成、疏水性以及其在肽链中的位置有关。氨基酸是构成蛋白质的基本单位,赋予蛋白质特定的分子结构形态,使它的分子具有生化活性。结果表明草鱼鱼皮蛋白质含量非常丰富,说明草鱼皮是制备抗氧化肽的良好来源。
低脂肪含量可能是通过异丙醇和水解脱脂使脂肪含量降低。Gbogouri等[19]报道酶蛋白水解产物脂肪含量低。在酶水解的过程中,由于草鱼皮去除了脂质结构,细胞膜倾向于收缩并形成不溶性物质[20]。GPH和肽段各组分的灰分含量分别为9.3%、6.8%、2.9%、2.5%和3.3%,这与Ktari等[21]通过酶处理乌贼加工副产物得到的结果相似。
2.2氨基酸组成分析
GPH和四种肽段的氨基酸组成成分如表2所示。由表2可知,在GPH和四种不同分子量的肽段中氨基酸的占比不尽相同,GPH和>10 kDa组分中Lys和Arg含量较高,3~5 kDa组分中Leu含量最高,<3 kDa组分中Gly和Pro含量较高。有学者发现,多肽中包含疏水性氨基酸(Val、Pro、Tyr、Leu、Ala、Lys、Met)都普遍具有较强的抗氧化性能[22-23]。Udenigwe和Aluko[5]报道疏水性氨基酸在DPPH自由基清除,超氧化物自由基清除和还原力的测定中发挥主要作用,表2表明除>10 kDa(23.1%)肽段外,GPH和其它肽段组分具有更高的疏水性氨基酸水平(34.2%~38.8%),这可能对DPPH自由基清除,超氧化物自由基清除和还原力的抗氧化效果有一定的贡献。Hernández等[24]研究发现His在OH清除剂、金属离子螯合剂等方面表现出很强的抗氧化性能,因此被认为是对抗氧化性有较大贡献的氨基酸之一,相比其它组分,>10 kDa组分中His含量最高,这与抗氧化能力测试中其亚铁离子清除率最高比较吻合。Segura-Campos等[25]表明芳香族氨基酸(Phe、Tyr、Trp)的存在有助于增强抗氧化能力,是因为这些氨基酸中吲哚基和苯环可供氢,缓解或终止自由基链式反应,自身的稳定性可以通过共振来维持[24],其中GPH中芳香族氨基酸含量最高(8.58%)、5~10和<3 kDa组分含量次之(7.73%和7.04%),这与具体的抗氧化结果有一定的关系。Saito等[26]认为His对于亚油酸的过氧化有抑制作用,GPH和5~10、3~5、<3 kDa组分中His含量在2.0%~3.2%之间。
2.3肽段的体外抗氧化活性分析
在本研究中,通过不同的抗氧化机制来评价肽段的抗氧化活性。采用六种体外测定方法评价肽段的抗氧化性质:DPPH自由基清除能力、还原力、超氧阴离子自由基清除能力、ABTS自由基清除能力、与金属离子螯合能力和抑制亚油酸氧化。
2.3.1 DPPH自由基清除能力分析 图1表示GPH和各分子量肽段组分在清除DPPH自由基方面具有较高的抗氧化活性,且随着样品浓度的增加,自由基的清除能力也随之增强,这与之前Farvin等[16]报道结果一致。各组分在5 mg/mL 浓度清除DPPH自由基能力均显著(p<0.05)高于1和3 mg/mL。在四个组分中,<3 kDa组分表现出最强的DPPH自由基清除能力,当浓度为5 mg/mL时,DPPH自由基的清除能力为70.14%,仅次于1 mg/mL GSH(94.96%),而GPH和3~5 kDa组分在5 mg/mL浓度时的DPPH自由基清除率无显著差异(p>0.05)。整体看来,<3 kDa组分表现出最强的DPPH自由基清除能力,而>10和5~10 kDa组分在清除DPPH自由基方面显著低于其它组分(p<0.05),结合氨基酸组成的分析,可能是<3 kDa组分中疏水性氨基酸的含量和有效作用综合提高了其DPPH自由基清除能力,>10 kDa组分中疏水性氨基酸的含量少和5~10 kDa组分中疏水性氨基酸的有效抗氧化基团暴露程度降低了其DPPH自由基清除能力。这与张翀[27]在大黄鱼蛋白源抗氧化肽的制备、性质及抗氧化机理研究中发现,利用不同截留分子量的超滤膜分离大黄鱼蛋白源抗氧化粗肽,<3 kDa组分表现出最强的DPPH自由基清除能力结果类似。张荣华[28]在猪皮胶原蛋白酶解物的抗氧化特性中研究不同分子量的猪皮胶原蛋白酶解物组分对DPPH自由基的清除能力,发现在浓度为5 mg/mL时,5~10 kDa组分对DPPH自由基的清除能力的最强,清除率为27.03%。研究结果发现在浓度为5 mg/mL时,不同分子量的肽组分对DPPH自由基的清除率都要比猪皮胶原酶解物组分对DPPH自由基的清除能力强,尤其<3 kDa组分,对自由基的清除率为70.14%。

图1 草鱼皮蛋白水解液和不同分子量肽段组分的DPPH自由基清除能力Fig.1 DPPH radical scavenging activities of GPH and different molecular weight peptide fractions注:不同小写字母代表组内不同浓度的差异显著性(p<0.05),不同大写字母代表组间同等浓度的差异显著性(p<0.05);图2~图5同。
2.3.2 还原力测定分析 还原力测定通常用于评价抗氧化剂得失电子和稳定自由基的能力。如图2所示,GPH和肽段组分都具有一定程度的还原力,并均随浓度的增大而增强,比较GPH和肽段组分发现,<3 kDa组分具有显著的还原力(p<0.05)。Bougatef等[29]研究发现肽的还原力随着样品浓度的增加而增加,这与本文趋势一致。浓度同为1 mg/mL,四种肽段组分的还原能力都在0.128~0.315内,较相同浓度下的GSH(1.34)还原能力显著降低(p<0.05),而5 mg/mL的<3 kDa组分还原力能力大大增强,仅次于1 mg/mL的GSH,这可能与<3 kDa组分中疏水性氨基酸的含量有关,此浓度下暴露出更多有效抗氧化基团,作为良好的电子供体,起到抗氧化的功效。

图2 草鱼皮蛋白水解液和不同分子量肽段组分的还原力Fig.2 Reducing power of GPH and different molecular weight peptide fractions
2.3.3 超氧阴离子自由基的清除率测定分析 GPH和四种肽段组分对超氧阴离子自由基的清除率如图3所示。当样品浓度达到最大时,所有样品对超氧阴离子自由基的清除率最高为5 mg/mL的<3 kDa组分(40.88%),5 mg/mL的GPH次之(36%),该结果均低于抗氧化剂GSH的值(91.37%)。Wang等[30]从玉米蛋白水解产物多肽中也得到了类似的结果,其清除超氧阴离子自由基的清除率为34.94%,略低于本文研究。Samak等[31]从植物提取物中也发现其酶解液中具有清除超氧阴离子自由基的能力,其效果稍好于本研究发现的<3 kDa组分。Wang等[32]从蚌类水解产物中提取新型的抗氧化肽在相同浓度下清除超氧阴离子自由基的能力与我们结果相似。然而,同等度下>10 kDa和5~10 kDa组分对于超氧阴离子自由基清除能力无显著差异(p>0.05),<3 kDa组分的清除能力较GPH的略高,这些结果表明可能清除超氧阴离子自由基的抗氧化基团主要是小分子肽段,经超滤膜分离后多集中在<3 kDa组分中,>10 kDa和5~10 kDa组分中截留分子量较大。

图3 草鱼皮蛋白水解液和不同分子量肽段组分的超氧阴离子自由基清除能力Fig.3 Superoxide radical scavenging activities of GPH and different molecular weight peptide fractions

图4 草鱼皮蛋白水解液和不同分子量肽段组分的ABTS自由基清除能力Fig.4 ABTS radical scavenging activities of GPH and different molecular weight peptide fractions
2.3.4 ABTS自由基清除能力测定分析 ABTS自由基清除实验(图4)显示,ABTS自由基清除率与样品浓度呈线性关系。随着浓度的增加,其ABTS自由基清除能力也逐渐增加。Cheung等[33]研究太平洋鳕鱼蛋白水解产物也得到同样趋势。低于5 mg/mL浓度时,GPH和四种组分的清除能力较弱,而5 mg/mL浓度下,<3和3~5 kDa组分的ABTS自由基清除率分别为51.78%和43.64%,GPH次之(40.62%),均低于GSH(94.62%,1 mg/mL)对ABTS自由基的清除率。与超氧阴离子结果相似,相同浓度下>10和5~10 kDa两种组分对于清除ABTS自由基无显著差异(p>0.05)。Hernández等[26]将发酵乳中水溶部分通过RP-HPLC进行分离纯化得到抗氧化肽,研究其活性发现Tyr对ABTS自由基清除贡献较大,这类氨基酸的苯环可供氢,而从表2中氨基酸分析结果来看,GPH、>10、5~10、3~5、<3 kDa组分的Tyr含量分别为5.47%、2.17%、2.27%、3%、3.49%,其中>10和5~10 kDa两种组分的含量接近均偏低,这与Hernández等的发现吻合。
2.3.5 Fe2+螯合能力测定 过渡金属离子Fe2+、Cu2+和Co2+可以作为电子供体,并与过氧化物迅速反应,形成烷氧自由基[34]。因此,螯合过渡金属离子可以评估其抗氧化能力。此外,亚铁离子可促进脂质氧化物的分解,进而形成有活性的烷氧基和挥发性氧化产物,因此,螯合亚铁离子可以抑制脂质氧化。GPH和四种肽段与EDTA及亚铁离子的螯合能力如图5所示,同种样品,随着浓度的增加,亚铁离子的螯合能力均逐渐增强。当5 mg/mL浓度时,除5~10 kDa组分外的其它所有组分与Fe2+螯合率均超过40%,并显著低于EDTA与Fe2+的螯合能力(96.34%,1 mg/mL)。在3和5 mg/mL浓度下,>10 kDa组分均表现出最高的Fe2+螯合率。Ajibola等[35]研究非洲豆薯种子的蛋白质水解产物也表现出相似的金属螯合率。吴金鸿[36]以丝绸废水中的丝胶为原料,水解得到三个抗氧化肽,发现特征肽段氨基酸组成中均含有氨基酸Lys和/或Pro,从氨基酸组成结果中发现>10 kDa组分中Lys含量最高(18.23%),<3 kDa组分中Pro含量最高(10.16%),这与>10 kDa组分具有最高的Fe2+螯合率一致。同时,Saiga等[37]也通过研究证实亚铁离子螯合与多肽中的特定氨基酸密切相关。

图5 草鱼皮蛋白水解液和不同分子量肽段组分的亚铁离子清除能力Fig.5 Fe2+ chelating activities of GPH and different molecular weight peptide fractions
2.3.6 亚油酸体系测定抗氧化能力 脂质氧化是多不饱和脂肪酸中的亚甲基碳自由基失去氢原子的过程。图6表示相同浓度下(1 mg/mL)GPH和四种肽段组分在7 d中抑制亚油酸氧化的能力,并用空白组和天然抗氧化剂GSH(1 mg/mL)作对照。3和5 mg/mL浓度与1 mg/mL浓度抑制效果无显著差异,因此仅采用1 mg/mL浓度下实验数据进行分析。图6显示空白组(无抗氧化剂)的吸光度在第3 d达到峰值为0.923,在3 d后呈下降趋势,这可能是由于亚油酸氧化产物的形成和分解[38]。较高的吸光度表示较高的氧化程度,然而各个组分具有较低的吸光度。因此,与空白组相比,四种组分在抑制亚油酸氧化方面均具有显著作用(p<0.05),并且效果与GSH活性相似,四种组分抑制能力相当,均可作为本研究抑制亚油酸氧化,整体趋势与Girgih等[39]从鲑鱼肽得到的结果类似。Saito等[26]提出His对于亚油酸的过氧化有抑制作用,各组分含量均在2.5%左右,对于亚油酸氧化的抑制能力无显著差异,可能是由于His可以作为电子受体,并接受不饱和脂肪酸在氧化过程中产生的自由电子,进而可以抑制脂肪的氧化。

图6 草鱼皮蛋白水解液和不同分子量肽段组分的抑制油脂氧化能力Fig.6 Inhibition of lipid oxidation activities of GPH and different molecular weight peptide fractions
3 结论
草鱼鱼皮蛋白水解产物通过三种不同截留分子量的超滤膜,得到四种不同分子量的肽段组分,通过分析发现它们在体外具有不同的抗氧化能力。实验表明,在大多数的体外测定实验中,低分子量的肽段较其它肽段组分具有显著的抗氧化能力,尤其是5 mg/mL的<3 kDa肽段组分清除DPPH自由基效果显著,清除率为70.14%,可作为功能性天然抗氧化剂添加到保健食品中;>10 kDa(5 mg/mL)肽段组分与Fe2+具有较强的螯合能力,可用于减少亚铁离子引起的氧化;1 mg/mL的GPH和四种肽段组分均可用于亚油酸氧化抑制方面,便于缓解高脂食品的氧化。相比GSH,<3 kDa肽段组分在超氧阴离子、ABTS自由基清除能力方面还有不足,还需深入细化研究,因为抗氧化活性强弱与氨基酸的种类、组成、疏水性以及其在肽链中的位置排列有关。因此,下一步我们将对不同分子量的肽段进行分离、纯化鉴定,研究抗氧化肽的抗氧化具体机制,探索抗氧化肽的结构与功能的关系,并将纯抗氧化肽用于要求较高的医疗卫生方面。
[1]Chalamaiah M,Dinesh,Kumar B,Hemalatha R,et al. Fish protein hydrolysates-Proximate composition,amino acid composition,antioxidant activities and applications-A review[J]. Food Chemistry,2012,135(4):3020-3038.
[2]Poole L B,Schöneich C. Introduction-What we do and do not know regarding redox processes of thiols in signaling pathways[J]. Free Radical Biology and Medicine,2015,80:145-147.
[3]Sae-leaw T,O’callaghan Y C,Benjakul S,et al. Antioxidant,immunomodulatory and antiproliferative effects of gelatin hydrolysates from seabass(Latescalcarifer)skins[J]. International Journal of Food Science & Technology,2016,51(7):1545-1551.
[4]Hamed I,Özogul F,Regenstein J M. Industrial applications of crustacean by-products(chitin,chitosan,and chitooligosaccharides):A review[J]. Trends in Food Science & Technology,2016,48:40-50.
[5]Udenigwe C C,Aluko R E. Chemometric analysis of the amino acid requirements of antioxidant food protein hydrolysates[J]. International Journal of Molecular Sciences,2011,12(5):3148-3161.
[6]Nikoo M,Benjakul S. Potential application of seafood-derived peptides as bifunctional ingredients,antioxidant-cryoprotectant-A review[J]. Journal of Functional Foods,2015,19:753-764.
[7]Zhang Y,Liu W,Li G,et al. Isolation and partial characterization of pepsin-soluble collagen from the skin of grass carp(Ctenopharyngodon idella)[J]. Food Chemistry,2007,103(3):906-912.
[8]Ren J,Zhao M,Shi J,et al. Purification and identification of antioxidant peptides from grass carp muscle hydrolysates by consecutive chromatography and electrospray ionization-mass spectrometry[J]. Food Chemistry,2008,108(2):727-736.
[9]Liu D,Wei G,Li T,et al. Effects of alkaline pretreatments and acid extraction conditions on the acid-soluble collagen from grass carp(Ctenopharyngodon idella)skin[J]. Food chemistry,2015,172:836-843.
[10]Wasswa J,Tang J,Gu X,et al. Influence of the extent of enzymatic hydrolysis on the functional properties of protein hydrolysate from grass carp(Ctenopharyngodon idella)skin[J]. Food Chemistry,2007,104(4):1698-1704.
[11]Horwitz W. Official methods of analysis of the AOAC International[M]. Gaithersburg,MD,USA. The Association,2000.
[12]张华. 比目鱼皮抗氧化肽的制备及分离纯化[D]. 天津大学,2013.
[13]Oyaizu M. Studies on products of browning reaction-antioxidative activity of products of browning reaction[J]. Japanese Journal of Nutrition,1986,44(6):307-315.
[14]Xie Z,Huang J,Xu X,et al. Antioxidant activity of peptides isolated from alfalfa leaf protein hydrolysate[J]. Food Chemistry,2008,111(2):370-376.
[15]Wiriyaphan C,Chitsomboon B,Yongsawadigul J. Antioxidant activity of protein hydrolysates derived from threadfin bream surimi byproducts[J]. Food Chemistry,2012,132(1):104-111.
[16]Decker E A,Welch B. Role of ferritin as a lipid oxidation catalyst in muscle food[J]. Journal of Agricultural and Food Chemistry,1990,38(3):674-677.
[17]Farvin K H S,Andersen L L,Nielsen H H,et al. Antioxidant activity of Cod(Gadus morhua)protein hydrolysates-Invitroassays and evaluation in 5% fish oil-in-water emulsion[J]. Food Chemistry,2014,149:326-334.
[18]王立峰,王玉梅,张晶,等. 菜籽蛋白水解物体外和细胞内抗氧化性评价及氨基酸分析研究[J]. 食品科学,2014(13):49-53.
[19]Gbogouri G A,Linder M,Fanni J,et al. Influence of hydrolysis degree on the functional properties of salmon byproducts hydrolysates[J]. Journal of Food Science,2004,69(8):C615-622.
[20]Shahidi F,Han X Q,Synowiecki J. Production and characteristics of protein hydrolysates from capelin(Mallotusvillosus)[J]. Food Chemistry,1995,53(3):285-293.
[21]Ktari N,Fakhfakh N,Balti R,et al. Effect of degree of hydrolysis and protease type on the antioxidant activity of protein hydrolysates from cuttlefish(Sepiaofficinalis)by-products[J].Journal of Aquatic Food Product Technology,2013,22(5):436-448.
[22]Elias R J,Kellerby S S,Decker E A. Antioxidant activity of proteins and peptides[J]. Critical Reviews of Food Science and Nutrition,2008,48:430-441.
[23]Guo H,Kouzuma Y,Yonekura M. Structures and properties of antioxidative peptides derived from royal jelly protein[J]. Food Chemistry,2009,113:238-245.
[24]Hernández L B,Dávalos A,Bartolomé B,et al. Preparation of antioxidant enzymatic hydrolysates fromα-lactalbumin andβ-lactoglobulin. Identification of active peptides by HPLC-MS/MS[J]. Journal of Agricultural and Food Chemistry,2005,53(3):588-593.
[25]Segura-Campos M,Ruiz-Ruiz J,Chel-Guerrero L,et al. Antioxidant activity of Vigna unguiculata L. walp and hard-to-cookPhaseolusvulgarisL. protein hydrolysates[J]. CyTA-Journal of Food,2013,11(3):208-215.
[26]Saito K,Jin D H,Ogawa T,et al. Antioxidative properties of tripeptide libraries prepared by the combinatorial chemistry[J]. Journal of Agricultural and Food Chemistry,2003,51(12):3668-3674.
[27]张翀. 大黄鱼蛋白源抗氧化肽的制备、性质及抗氧化机理研究[D]. 福州:福建农林大学,2016.
[28]张荣华. 猪皮胶原蛋白酶解物的抗氧化特性研究[D]. 雅安:四川农业大学,2012.
[29]Bougatef A,Nedjar-Arroume N,Manni L,et al. Purification and identification of novel antioxidant peptides from enzymatic hydrolysates of sardinelle(Sardinellaaurita)by-products proteins[J]. Food Chemistry,2010,118(3):559-565.
[30]Wang X,Zheng X,Kopparapu N,et al. Purification and evaluation of a novel antioxidant peptide from corn protein hydrolysate[J]. Process Biochemistry,2014,49(9):1562-1569.
[31]Samak G,Shenoy R P,Manjunatha S M,et al. Superoxide and hydroxyl radical scavenging actions of botanical extracts of Wagatea spicata[J]. Food Chemistry,2009,115(2):631-634.
[32]Wang B,Li L,Chi C F,et al. Purification and characterisation of a novel antioxidant peptide derived from blue mussel(Mytilusedulis)protein hydrolysate[J]. Food Chemistry,2013,138(2):1713-1719.
[33]Cheung I W Y,Cheung L K Y,Tan N Y,et al. The role of molecular size in antioxidant activity of peptide fractions from Pacific hake(Merlucciusproductus)hydrolysates[J]. Food Chemistry,2012,134(3):1297-1306.
[34]Gordon M. Antioxidant in food[M]. New York-CRC Press,2001:7-21.
[35]Ajibola C F,Fashakin J B,Fagbemi T N,et al. Effect of peptide size on antioxidant properties of African yam bean seed(Sphenostylisstenocarpa)protein hydrolysate fractions[J]. International Journal of Molecular Sciences,2011,12(10):6685-6702.
[36]吴金鸿. 丝胶肽的制备及其生物活性功能和结构的研究[D]. 无锡:江南大学,2008.
[37]Saiga A I,Tanabe S,Nishimura T. Antioxidant activity of peptides obtained from porcine myofibrillar proteins by protease treatment[J]. Journal of Agricultural and Food Chemistry,2003,51(12):3661-3667.
[38]Jayaprakasha G K,Singh R P,Sakariah K K. Antioxidant activity of grape seed(Vitisvinifera)extracts on peroxidation modelsinvitro[J]. Food Chemistry,2001,73(3):285-290.
[39]Girgih A T,Udenigwe C C,Hasan F M,et al. Antioxidant properties of Salmon(Salmosalar)protein hydrolysate and peptide fractions isolated by reverse-phase HPLC[J]. Food Research International,2013,52(1):315-322.
Evaluationoftheinvitroantioxidantpropertiesofdifferentmolecularweightpeptidefractionsfromgrasscarp(Ctenopharyngodonidella)skin
CAILu-yun1,2,LENGLi-ping1,LIXiu-xia1,LVYan-fang1,LIJian-rong1,2,*,ZHAOWei3,MAYong-jun4,SHENLin5
(1.College of Food Science and Engineering of Bohai University,National & Local Joint Engineering Research Center of Storage,Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products,Food Safety Key Lab of Liaoning Province,Jinzhou 121013,China; 2.College of Food Science,Southwest University,Chongqing 400716,China; 3.Dalian Tianbao Green Foods Co.,Ltd.,Dalian 116001,China; >4.Zhejiang Xingye Group Co.,Ltd.,Zhoushan 315200,China; 5.Dalian Donglin Food Co.,Ltd.,Dalian 116007,China)
Grass carp skins were hydrolyzed using alcalase to obtain crude protein hydrolysate,which was then fractionated by molecular mass into four fractions->10,5~10,3~5,and<3 kDa.Invitroantioxidant activities of the crude hydrolysate and its fractions were studied. Results indicated that the 3~5 and<3 kDa fractions were significantly(p<0.05)higher in scavenging 1,1-Diphenyl-2-picrylhydrazyl(DPPH)and 2,2′-azino-bis(3-ethylbenzothiazoline-6-sulphonic acid)diammonium salt radicals(ABTS)than crude hydrolysate or other fractions,while the>10 kDa fraction had the highest Fe2+chelating activity. However,the>10,5~10,and 3~5 kDa fractions were weaker superoxide radical scavengers compared with reduced L-glutathione. The amino acid sequences of the peptide fractions might play a crucial role in their antioxidant activities. These results indicate that the<3 kDa fraction has the potential to be used as a natural antioxidant in health food.
Ctenopharyngodonidella;fish skin;hydrolysate;antioxidant activity;different molecular weight peptides fraction
2016-11-23
蔡路昀(1981-),男,博士,副教授,主要从事水产品贮藏加工和功能食品方面的研究,E-mail:clyun2007@163.com。
*通讯作者:励建荣(1964-),男,博士,教授,主要从事水产品和果蔬贮藏加工及质量安全控制方面的研究,E-mail:li34008@126.com。
国家自然科学基金(31401478);中国博士后基金面上项目(2015M570760);辽宁省自然科学基金(20170540006);重庆市博士后特别资助项目(Xm2015021)。
TS254.1
:A
:1002-0306(2017)12-0058-07
10.13386/j.issn1002-0306.2017.12.011

