TGF-β1、PTEN在口腔鳞癌组织中的表达及意义①
杨永超,段 峰,张 璇
(1.佳木斯大学研究生学院,黑龙江 佳木斯 154007;2.佳木斯大学附属第二医院口腔医学院,黑龙江 佳木斯 154002)
TGF-β1、PTEN在口腔鳞癌组织中的表达及意义①
杨永超1,段 峰2,张 璇1
(1.佳木斯大学研究生学院,黑龙江 佳木斯 154007;2.佳木斯大学附属第二医院口腔医学院,黑龙江 佳木斯 154002)
目的:检测TGF-β1及PTEN蛋白在口腔鳞癌(OSCC)和口腔癌旁正常组织中的表达,旨在探讨两者在OSCC发展过程中可能存在的机制。方法:采用免疫组化SABC法,检测51例口腔鳞癌组织和18例口腔癌旁正常组织样本中TGF-β1及PTEN蛋白的表达情况。结果:TGF-β1及PTEN在OSCC组织和癌旁正常组织中均有表达,TGF-β1在OSCC组织及癌旁正常组织中的表达率为67.2%、16.7%(P<0.05);而PTEN表达率分别为39.2%、77.8%(P<0.05);TGF-β1、PTEN在OSCC组织中的阳性率与年龄、性别以及吸烟指数无关(P>0.05),但与临床分期、淋巴转移有关(P<0.05);PTEN的阳性率还与分化程度有关(P<0.05);且TGF-β1与PTEN的表达呈负相关(r=-0.295,P<0.05)。结论:TGF-β1的高表达和PTEN的低表达可能与OSCC的发生发展密切相关,并有可能成为OSCC的临床诊断依据。
TGF-β1;PTEN;口腔鳞癌
口腔鳞状细胞癌(oralsquamouscellcarcinomaOSCC)是口腔颌面部最常见恶性肿瘤,比例约占90%[1]。虽然OSCC的临床效果已逐渐提高,然而总的5年生存率却很低。扩散和转移是影响恶性肿瘤患者生存时间和生存质量的主要因素之一[2],其生存率高度依赖于肿瘤的诊断阶段。转化生长因子β1 (TGF-β1)一个调节细胞生长与分化、细胞凋亡的多功能因子,具有调节肿瘤生长等作用。第10染色体同源缺失性磷酸酶-张力蛋白基因(PTEN)是一种抑癌基因,在多种肿瘤中出现表达下调和缺失现象,提示PTEN在肿瘤的发展过程中可能起抑制作用。本实验通过SABC法分别检测在OSCC、癌旁正常组织中TGF-β1及PTEN的表达情况,旨在探讨两者在OSCC发展过程中可能存在的机制,进一步为临床诊断治疗提供依据。
1 材料和方法
1.1 材料
标本来源于2014-08~2016-03佳木斯大学附属口腔医院口腔颌面外科手术切除并且术后病理诊断为OSCC的成年患者,共51例。其中男30例,女21例;年龄>60岁组织标本31例;≤60岁组织标本20例;按照TNM分类标准进行临床分期,Ⅰ~Ⅱ期33例,Ⅲ~Ⅳ期18例;伴有颈部淋巴结转移14例,未见淋巴结转移37例;按照2005年WHO制定的标准分为高-中分化41例,低分化10例;吸烟指数≤400有29例,>400有22例。另取18例癌旁正常组织,并经HE染色,镜下观察证明无任何黏膜疾病。上述患者均有完整的临床病理学资料,术前3个月内均未接受放化疗治疗。
1.2 试剂
兔抗人TGF-β1、PTEN亲和纯化抗体,SABC检测试剂盒以及DAB显色试剂盒,均购于武汉博士德生物有限公司。
1.3 免疫组化检测
组织标本全部均经10%福尔马林固定;常规石蜡包埋后按照4μm厚度作连续切片;抗原热修复;SABC法染色(染色步骤严格按照试剂盒说明书进行操作)。在相同条件下与已知的阳性切片作阳性对照,用PBS代替一抗作阴性对照。
1.4 结果判定
标本组织细胞中出现黄色或黄褐色为阳性着色。TGF-β1的表达产物位于细胞质及细胞核中;PTEN的表达产物位于细胞质及细胞膜中。本实验结果根据标本切片的着色强度以及阳性细胞数在总细胞数中的占比这两方面进行综合分析判定。判定OSCC细胞的着色强度:无着色(-),淡黄色(+),黄色(),黄褐色()。判定阳性OSCC细胞占比:400倍显微镜下在切片中随机选择5个细胞视野,阳性细胞占比≤10%(-),11%~25%(+),26%~49%();≥50%();(-)、(+)、()、()分别代表0分、1分、2分、3分。每张切片的总分按着色强度与阳性细胞百分比两项分值相加得出。阴性(<2分),阳性(≥2分)。
1.5 统计学方法
采用SPSS21.0软件,采用卡方进行组间数据比较;使用Spearman秩相关检验分析指标之间的关系。均以α=0.05为检验标准。
2 结果
2.1TGF-β1、PTEN在OSCC、癌旁正常组织中的表达
TGF-β1蛋白、PTEN蛋白在OSCC组织中阳性表达率分别为62.7%(32/51)、39.2%(20/51);在癌旁正常组中阳性表达率为16.7%(3/18)、77.8%(14/18)。组间差异有统计学意义(P<0.05)。见表1。
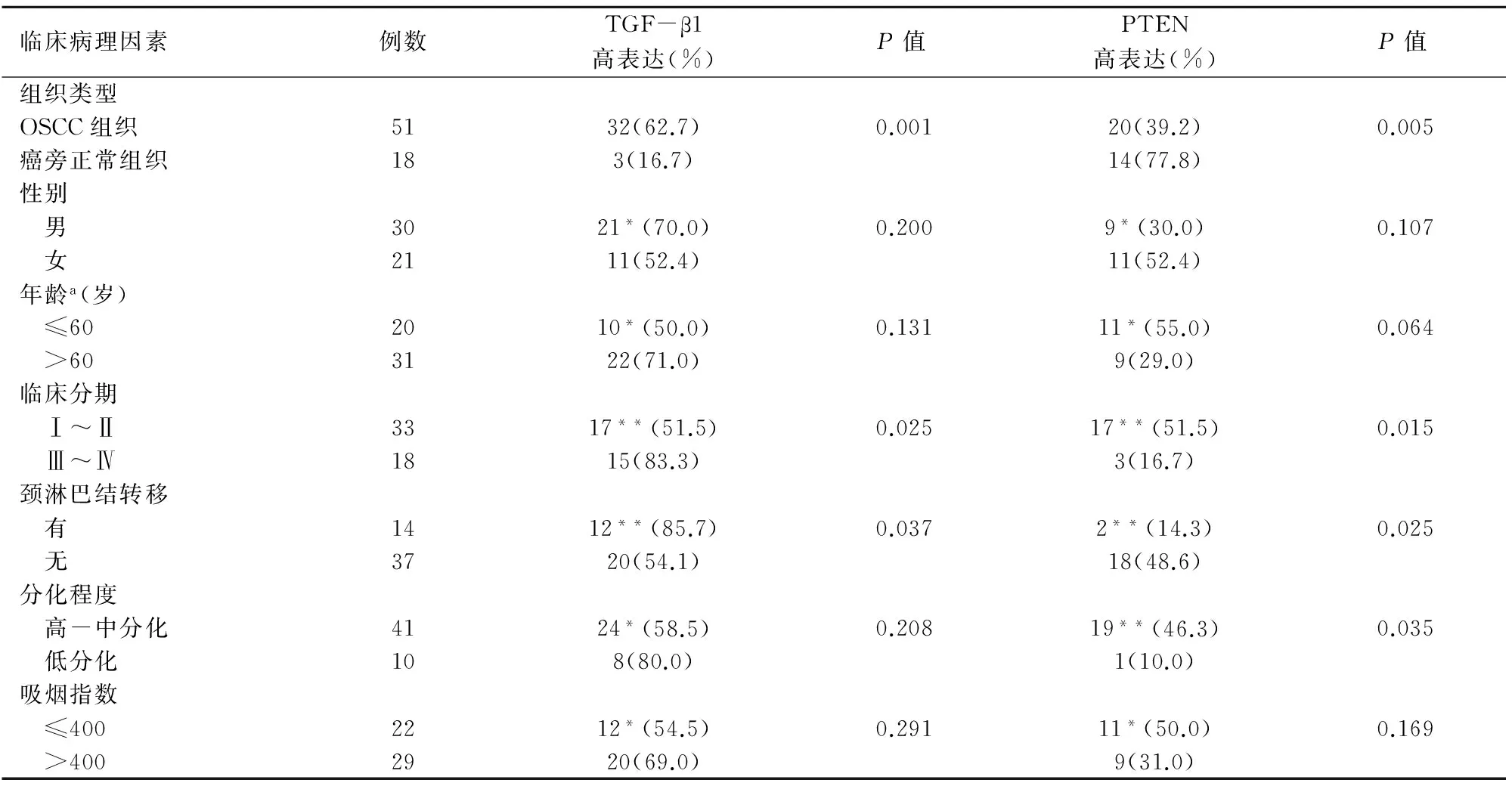
表1 TGF-β1、PTEN在OSCC组织中的表达与病理因素之间的关系
与同组比较*P>0.05,与同组比较**P<0.05,a患者手术时的中位年龄。
免疫组化SABC法检测OSCC组织中TGF-β1、PTEN的表达,见图1~2。

图1TGF-β1(× 400)
图2 PTEN (× 400)
2.2TGF-β1、PTEN在OSCC组织中的表达与病理因素之间的关系
TGF-β1、PTEN在OSCC组织中阳性表达率与年龄、性别以及吸烟指数无关(P>0.05),与临床分期、颈淋巴转移有关(P<0.05)。PTEN的阳性率还与分化程度有关(P<0.05)。见表1。
2.3TGF-β1、PTEN在OSCC组织中表达关系
在51例OSCC组织标本中,TGF-β1与PTEN同时为阳性和阴性表达的分别为9例,8例;TGF-β1阳性表达,PTEN为阴性表达为23例;TGF-β1阴性表达,PTEN为阳性表达为11例。联合检测TGF-β1、PTEN在OSCC组织中的表达水平,两者呈负相关关系(r=-0.295,P<0.05),见表2。
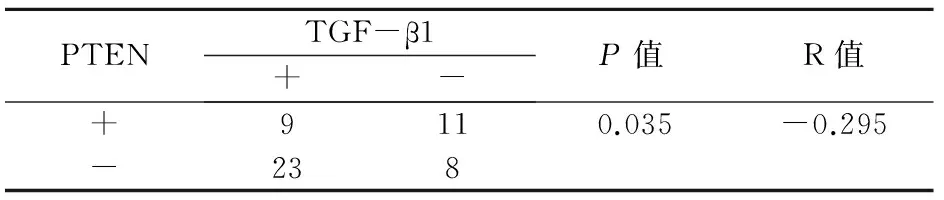
表2 TGF-β1、PTEN在OSCC组织中表达关系
3 讨论
转化生长因子(transforminggrowthfactor,TGF)β是一组调节细胞生长与分化、细胞凋亡的多功能生长因子家族,在肿瘤的形成等过程中发挥重要作用。研究发现规范的TGF-β途径主要是通过Smad蛋白的表达完成信号传导;而非规范TGF-β信号通路是通过MAPK信号通路完成传导,在细胞迁移以及上皮-间质转化过程中此信号通路具有至关重要的作用[3]。TGF-β1是TGF-β家族中重要成员之一,研究表明TGF-β1可调节细胞周期,促进血管生成以及肿瘤细胞的免疫逃逸[4,5]。在肿瘤的形成过程中TGF-β1发挥着相反的作用:在肿瘤生长早期,TGF-β1可作为肿瘤的抑制物,使肿瘤细胞生长停止,抑制肿瘤发展;但随着肿瘤的进展,TGF-β1成为促进肿瘤生长的促进因子,促进肿瘤的生长,浸润和转移[6]。本实验结果显示TGF-β1在OSCC组中的阳性表达率为62.7%,而癌旁正常组为16.7%(P<0.05),可见TGF-β1蛋白表达是下调的,提示TGF-β1可能促进OSCC的发生。在不同TNM分期中,TGF-β1蛋白的表达量分别Ⅰ~Ⅱ为51.5%,Ⅲ~Ⅳ为83.3%(P<0.05);同时伴颈部淋巴结转移组中其阳性表达率(85.7%)明显高于颈淋巴结未转移组(54.1%)(P<0.05),表明TGF-β1表达率升高与肿瘤的临床分期、转移密切相关,提示其可作为判断病情进展的一个依据。但TGF-β1在OSCC组织中的表达与年龄、性别以及吸烟指数均无关(P>0.05)。有文献报道[7],TGF-β1蛋白的高表达与分化程度相关。本实验对不同分化程度的OSCC组织进行分析,发现低分化组的TGF-β1蛋白阳性表达率(80.0%)比高-中分化组(58.5%)高,但差异无显著性(P>0.05),此结果可能受抗体稀释浓度、实验步骤等多种因素影响。
第10染色体同源缺失性磷酸酶-张力蛋白基因(PTEN)是被发现的第一个具有双重磷酸酶活性的肿瘤抑制基因。研究发现PTEN蛋白具有蛋白性磷酸酯酶活性,通过选择性抑制有丝分裂原激活蛋白激酶MAPK途径,使细胞生长阻滞于G1期,抑制肿瘤细胞的生长,促进其程序性细胞死亡。同时还具有脂质磷酸酶活性,构成了PI3K/PTEN/AKT通路,从而抑制细胞增殖分化,调节细胞凋亡[8]。近十余年来,研究发现PTEN可通过抑制血管生成、抑制细胞外基质降解、促进细胞分化等作用抑制肿瘤生成。PTEN蛋白的表达下降、缺失大多是在肿瘤进展的后期阶段被发现,如子宫颈癌[9]等。本实验结果显示,在OSCC组中PTEN的阳性表达率为39.2%,明显低于癌旁正常组(77.8%)(P<0.05),提示PTEN蛋白表达降低或缺失可能促使细胞突变。在TNM分期中PTEN蛋白的表达率分别Ⅰ~Ⅱ为51.5%,Ⅲ~Ⅳ为16.7%(P<0.05),表明PTEN的表达与OSCC的浸润程度相关;发现OSCC分化程度降低,PTEN的阳性率也降低,低分化PTEN的阳性率为10% ,高-中分化阳性率为46.3%(P<0.05),提示PTEN蛋白表达下调可能加剧了口腔鳞癌的恶化进程。同时无颈淋巴结转移的OSCC中PTEN蛋白表达率(48.6%)高于有颈淋巴结转移组(14.3%),提示PTEN蛋白表达降低或缺失使OSCC易于转移。此外PTEN在OSCC组织中的表达与年龄、性别以及吸烟指数皆无关(P>0.05)。以上结果与有关学者[10]在非小细胞肺癌组织中关于PTEN的研究相似。同时对TGF-β1、PTEN在OSCC组织中的表达水平进行联合统计分析后,发现两者呈负相关关系(r=-0.295,P<0.05),两者在OSCC组织中的表达具有拮抗性。推测在OSCC中TGF-β1可能是通过MAPK信号途径来调节PTEN的表达,TGF-β1对PTEN的生成起到负向调节作用,使PTEN的抑癌作用减弱。
综上所述,本实验可得出TGF-β1在OSCC中呈高表达,而PTEN呈低表达,且与部分临床病理因素关系密切,并且两者的表达水平在口腔鳞癌组织中呈负相关;通过联合检测分析TGF-β1与PTEN在OSCC中的表达情况,对OSCC的临床诊断具有一定的意义,有助于指导临床治疗,两者有望成为诊断口腔鳞癌的检测因子。
[1]TangH,WuZ,ZhangJ,etal.SalivarylncRNAasapotentialmarkerfororalsquamouscellcarcinomadiagnosis[J].MolecularMedicineReports, 2013, 7(3):761-766
[2]陈哲, 柳宏志, 刘继光. 口腔鳞癌Ezrin蛋白和CD44v6表达及其与淋巴转移的相关性研究[J]. 黑龙江医药科学, 2010, 33(1):82-83
[3]ChapnickDA,WarnerL,BernetJ,etal.Partnersincrime:theTGFβandMAPKpathwaysincancerprogression[J].Cell&Bioscience, 2011, 1(1):1-8
[4]GuYY,WangH,WangS.TGF-β1C-509TandT869Cpolymorphismsandcancerrisk:ametaanalysis[J].InternationalJournalofClinical&ExperimentalMedicine, 2015, 8(10):868
[5]FlavellRA,SanjabiS,WrzesinskiSH,etal.ThepolarizationofimmunecellsinthetumourenvironmentbyTGF-βNaturereviews[J].Immunology,2010,10(8):554-567
[6]DrabschY,DijkePT.TGF-βSignalinginBreastCancerCellInvasionandBoneMetastasis[J].JournalofMammaryGlandBiology&Neoplasia, 2011, 16(2):97-108
[7]马颖, 杨向红, 田保玲,等. 大肠肿瘤中PTEN和TGF-β1表达及意义[J]. 中国组织化学与细胞化学杂志, 2012, 21(1):53-56
[8]AlexiouGA,VoulgarisS.TheroleofthePTENgeneinmalignantgliomas[J].NeurolNeurochirPol,2010,44:80-86
[9]RizviMM,AlamMS,AliA,etal.AberrantpromotermethylationandinactivationofPTENgeneincervicalcarcinomafromIndianpopulation[J].JCancerResClinOncol,2011,137: 1255-1262
[10]鲍文华, 刘忠鑫, 刘磊.MMP-7和PTEN在非小细胞肺癌的表达及其意义[J]. 黑龙江医药科学, 2011, 34(2):1-3
佳木斯大学研究生科技创新项目,编号:LM2015-040。
杨永超(1990~)男,安徽马鞍山人,在读硕士研究生。
段峰(1972~)男,黑龙江齐齐哈尔人,学士,副教授,副主任医师,硕士研究生导师。E-mail:duanffeng60@sohu.com。
R
A
1008-0104(2017)03-0072-03
2016-12-08)

