视网膜色素上皮细胞光损伤模型的建立与评估
罗向艳,罗 萍*,颜家朝,李传课,李 波,陈向东
(1.湖南中医药大学,湖南 长沙 410208;2.湖南中医药大学第一附属医院眼科,湖南 长沙 410007)
视网膜色素上皮细胞光损伤模型的建立与评估
罗向艳1,罗 萍2*,颜家朝2,李传课2,李 波2,陈向东2
(1.湖南中医药大学,湖南 长沙 410208;2.湖南中医药大学第一附属医院眼科,湖南 长沙 410007)
目的 通过不同光照时间和光照强度,探索建立最佳视网膜色素上皮细胞光损伤模型,为视网膜光损伤细胞造模方法提供理论依据。方法 选取原代大鼠视网膜色素上皮细胞和大鼠视网膜色素上皮细胞系,LED白色冷光灯模拟自然光源,选取(2 500、5 000、7 500、10 000 Lux)作为光照强度,以不同光照时间(6、12 h)对细胞进行照射,建立光损伤模型,镜下观察细胞形态,采用MTT法检测细胞活力。结果 光照处理后,RPE细胞活力受到抑制,随着光照强度及时间增强,细胞活力降低明显,原代细胞 6 h 7 500、10 000 Lux 和 12 h 5 000、7 500、10 000 Lux,细胞系 6 h 10 000 Lux 和 12 h 7 500、10 000 Lux,视网膜色素上皮细胞活力均低于空白组(P<0.01)。结论 RPE细胞活力受光照时间及强度抑制,原代细胞较细胞系对光损伤更敏感。
视网膜色素上皮细胞;光损伤;光照时长;光照强度;原代细胞;细胞系
视网膜光损伤主要包括三种:机械损伤、光化学损伤、热损伤,三种损伤方式各不同,光化学损伤是视网膜光损伤主要方式之一[1]。伴随着社会发展,灯光的大量使用、高科技仪器和电子产品盛行,增加了视功能的损伤,长期接触导致眼底病变,临床上常见的眼底视网膜疾病,如年龄相关性黄斑变性等均与光照过度有关[2]。近几十年里,针对视网膜色素上皮细胞(retinal pigment epithelial cells,RPE细胞)光损伤进行过大量的实验研究,大部分实验基于长时间低强度和细胞系的研究,甚至根据不同波长进行光损伤研究[3-6]。为全面探索RPE细胞光损伤模型及实验进一步研究,我们通过不同光照时间和光照强度,建立最佳RPE细胞光损伤模型,为视网膜光损伤细胞造模方法提供理论依据。
1 材料和方法
1.1 材料及试剂
大鼠视网膜色素上皮细胞系 (购自上海赛齐生物工程公司),原代大鼠视网膜色素上皮细胞(购自上海赛齐生物工程公司),MTT细胞增殖与细胞毒性检测试剂盒(购自贝博生物公司),DMEM培养基、胎牛血清、胰酶消化液(购自Invitrogen公司),倒置显微镜 (OLYMPUS IX71),CO2恒温培养箱(SANYO),Smart spec 3 000型酶联免疫检测仪(美国Bio-Rad公司),自制直落式LED白色冷光灯。
1.2 方法
1.2.1 细胞的复苏、传代及培养 细胞复苏:将有1 mL细胞悬液的冻存管放在37℃水浴中,振荡解冻,加10 mL DMEM培养液混合均匀,在1 000 RPM转速下离心4 min,弃除上清液,补加1~2 mL DMEM培养液后吹匀,然后将所有细胞悬液加入含有5mL完全培养基的培养瓶中静置培养,在37℃,5%CO2,90%湿度的培养箱中培养,48 h后换液并检查细胞密度,待细胞贴壁后,每3天换液1次,直到细胞融合,行1∶2传代,倒置显微镜下观察细胞形态改变,选择1~2代对数生长期细胞,制备成单细胞悬液,细胞系复苏同方法[7]。
细胞传代:如果细胞密度达80%~90%,既可进行传代培养:弃去培养液,用不含钙、镁离子的PBS洗 1~2次,加入 2 mL 0.25%胰蛋白酶,消化 15 min,置于37℃培养箱中2 min,然后在倒置显微镜下观察细胞消化状况,若细胞大部分变圆并脱落,迅速拿回操作台,轻敲培养瓶,后加10 mL小牛血清终止消化,按3 mL/瓶补加完全培养基,轻敲打匀后吸出,在1 000 r/min转速下离心4 min,弃除上清液,补加2 mL完全培养液后吹匀,将细胞悬液按1∶2到1∶5的比例分到新的含5 mL完全培养基的培养瓶中,在37℃,5%CO2,90%湿度的培养箱中培养,48 h后换液并检查细胞密度,待细胞贴壁,直到细胞融合,制备成单细胞悬液,细胞系传代同方法。
1.2.2 构建细胞光损伤模型及分组 将制备好的单细胞悬液培养于96孔培养板内,每组6孔,每孔100 μL, 置 37 ℃、5%CO2培养箱内培养 12 h,待细胞贴壁后进行实验,以白色LED冷光灯作光源,采取直落式照射,光照在培养箱内密闭进行,无自然光干扰,测定光照强度,调整光源与培养板之间的距离,使被照细胞同一水平的光照强度(2 500、5 000、7 500、10 000 Lux)相同,用上述光照器照射细胞6、12 h,作为光损伤模型组,同时设立空白对照组,不作光照处理。
1.2.3 镜下观察细胞形态改变 倒置相差显微镜下观察正常对照组和不同光损伤模型组的细胞贴壁情况及形态学变化。
1.2.4 MTT检测细胞活力 各组细胞在检测时间点时,每孔加10 uL MTT溶液,在37℃、5%CO2培养箱中培养4 h。选择490 nm波长,在酶联免疫监测仪上检测各孔光吸收值,记录结果为:光照强度为横坐标,吸光值为纵坐标,最终绘制细胞生长图。
1.3 统计学方法
2 结果
2.1 镜下观察细胞形态
培养的原代大鼠RPE细胞和大鼠RPE细胞系,大小均一、呈圆形、富含黑色素,细胞贴壁后变扁平,伸出伪足,呈不规则形态,可见清晰透明细胞核,细胞呈现集簇融合样生长。细胞融合后呈多种形态改变,圆形、梭形或不规则形态,细胞黑色素随传代次数增加而减少,逐渐至透明,在各光照组的孔板中,细胞量随时间及强度的增加而减少。原代细胞6 h 2 500 Lux和12 h 5 000 Lux,细胞系6 h 10 000 Lux和12 h 7 500 Lux,其中部分细胞拉长或崩解,偶见细胞浮起,细胞量明显减少,折光性减弱,镜下见对照组细胞呈圆形或椭圆形,细胞周围可见丰富微绒毛,胞质内可见大量游离核糖体,偶见黑色素颗粒,细胞核内见数个核仁,细胞间见细胞连接体。
2.2 MTT 检测细胞活力
RPE细胞使用不同时间(6、12 h)和不同光照强度(2 500、5 000、7 500、10 000 Lux)进行光损伤造模处理,白色LED光源置于细胞培养箱内。结果显示,光照处理后,RPE细胞活力受到抑制,细胞受到白光的损伤,随着光照强度增强,细胞活力降低明显。原代细胞6 h 7 500、10 000和12 h 5 000 Lux、7 500、10 000 Lux, 细胞系 6 h 10 000 Lux和12 h 7 500、10 000 Lux,RPE细胞活力与均低于空白组,差异有显著统计学意义(P<0.01);原代细胞与细胞系对比,光照时长及强度均低,对光损伤更敏感。见表1。
表1不同光照强度、时间对RPE的细胞系和原代细胞活力影响勤 (±s,n=3,吸光值)
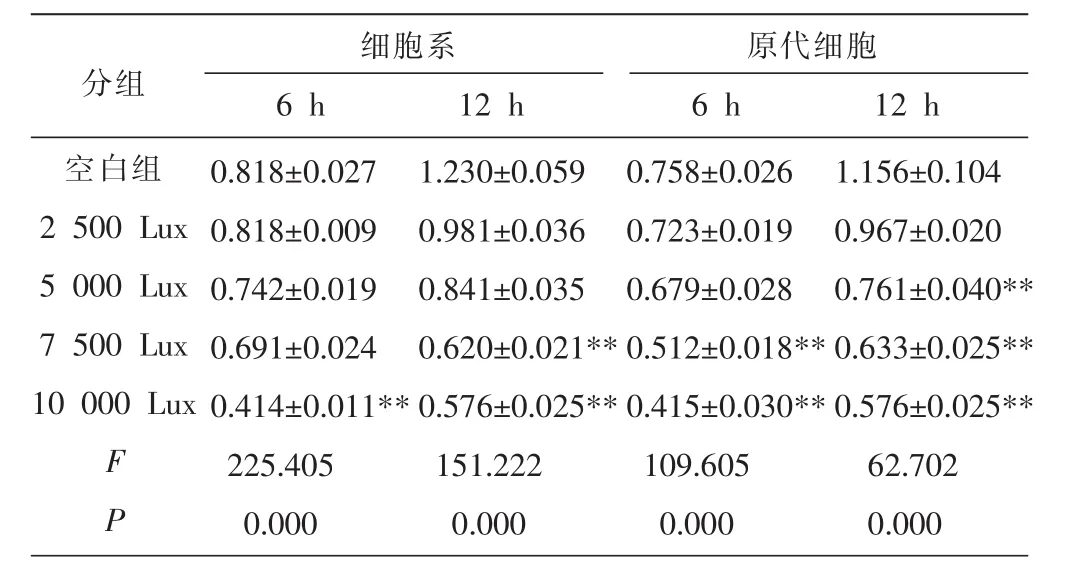
表1不同光照强度、时间对RPE的细胞系和原代细胞活力影响勤 (±s,n=3,吸光值)
注:与空白组比较,*P<0.05,**P<0.01。
分组细胞系 原代细胞6 h 12 h 6 h 12 h空白组2 500 Lux 5 000 Lux 7 500 Lux 10 000 Lux FP 0.818±0.027 0.818±0.009 0.742±0.019 0.691±0.024 0.414±0.011**225.405 0.000 1.230±0.059 0.981±0.036 0.841±0.035 0.620±0.021**0.576±0.025**151.222 0.000 0.758±0.026 0.723±0.019 0.679±0.028 0.512±0.018**0.415±0.030**109.605 0.000 1.156±0.104 0.967±0.020 0.761±0.040**0.633±0.025**0.576±0.025**62.702 0.000
3 讨论
光损伤是由于过强的光照射或者长时间直视光源对视网膜造成的损伤。视网膜是眼睛接受光能、产生视觉的重要组织结构,同时,也是眼组织中最容易受光损害的重要部位[1]。在近30年中,许多研究人员利用各种实验动物进行了大量有关视网膜光损伤及其机制的研究探索。其中,国外关于LED辐射对人类视网膜色素上皮细胞的影响进行了大量研究。结果表明:在12 h辐射中可减少细胞生存能力75%~99%,并增加66%~89%的细胞凋亡,同时还增加活性氧产量和DNA损伤,未照射细胞的凋亡是3.7%[8]。国内视网膜色素上皮细胞光损伤研究集中在通过转换成光照度研究,且大部分实验选择大鼠RPE细胞系及长时间低强度光照。
本实验使用白色LED冷光灯作光源,通过延长光照时间及采用低中高强度,模拟日常生活光照时间及强度,选择原代细胞与细胞系对照,探索视网膜光损伤模型建立。实验结果显示,原代细胞6 h 7 500、10 000 Lux 和 12 h 5 000、7 500、10 000 Lux 组,细胞系 6 h 10 000 Lux和 12 h 7 500、10 000 Lux组,两者造模均成功。表明RPE细胞活力受光照时间及强度抑制,时间越长强度越大,抑制越明显。原代细胞比细胞系光照时长及强度均低,对光损伤更敏感。从结果中得出,原代细胞在一定程度上更符合人眼视网膜色素上皮细胞状态,更适合光损伤模型的选择。已知原代培养的细胞是组织刚刚离体,生物性状尚未发生明显变化,一定程度上能反映体内状态,具有特异性,是进行光损伤研究的优选材料。细胞系是不断生长、分化的细胞群,因其经过遗传改造,生存稳定性强,致使其具有无限增长的潜能,同时,原代细胞保留细胞系所没有基因,细胞系在传代过程中会丢失部分基因,所以使用原代细胞研究细胞凋亡更有实验意义。
视网膜色素上皮细胞对视网膜的健康至关重要,它们容易受到过度光损伤而衰老死亡。视网膜光损伤模型的理论研究目前取得了进展,但其根本机制仍不十分清楚,随着视网膜光损伤机制认识的不断加深,建立良好的视网膜光损伤模型至关重要,将为视网膜光损伤的研究奠定实验基础。
[1]彭 华,董 玉.视网膜光损伤发生机制及治疗研究进展[J].中国中医药,2013,11(9):162-165.
[2]Kent M, Neubauer AS, Liegl RG, et al.Sorafenib prevents human retinal pigment epithelium cells from light-induced overexpression of VEGF, PDGF and PIGF[J].Br J Ophthalmol,2010, 94(11):1533-1539.
[3]Yi xiang Liu,Di Zhang,Yongpei Wua,et al.Docosahexaenoic acid aggravates hotooxidative damage in retinal pigment epithelial cells via lipid peroxidation[J].Journal of Photochemistry and Photobiology B:Biology.2014(140):85-93.
[4]Yong Wang,Di Zhang,Yi Xiang Liu,et al.The protective effects of berry-derived anthocyanins against visible light-induced damage in human retinal pigment epithelial cells[J].SCI.6 June 2014.
[5]Yixiang Liu,Xue Song1,Di Zhang,et al.Blueberry anthocyanins:protection against ageing and light-induced damage in retinal pigment epithelial cells[J].British Journal of Nutrition[J].(2012),108,16-27.
[6]Kazuhiro Tsuruma,Yuhei Nishimura,Seiya Kishi,et al.SEMA4A Mutations Lead to Susceptibility to Light Irradiation,Oxidative Stress,and ER Stress in Retinal Pigment Epithelial Cells[J].Retinal Cell Biology.2012,53(10):6729-6737.
[7]林少芬,毛羽翔.人视网膜色素上皮细胞原代培养冻存和复苏方法改进[J].实用医技杂志,2012,8(19)791-793.
[8]Eva Chamorro,Cristina Bonnin-Arias,María Jesús Pérez-Carras-CO2,et al.Effects of Light-emitting Diode Radiations on Human Retinal Pigment Epithelial Cells In Vitro[J].Photochemistry and Photobiology,2013,89:468-473.
(本文编辑 杨 瑛)
Establishment and Evaluation of Light-Induced Retinal Pigment Epithelial Cells Damage Models
LUO Xiangyan1,LUO Ping2,YAN Jiachao2,LI Chuanke2,LI Bo2,CHEN Xiangdong2
(1.Hunan University of Chinese Medicine,Changsha,Hunan 410208,China;2.Department of Ophthalmology,the First Affiliated Hospital of Hunan University of Chinese Medicine,Changsha,Hunan 410007,China)
Objective To establish the best light-induced retinal pigment epithelial cells damage models through different light application time and light intensity,explore,and provide the theoretical basis for building this model.Methods The primary retinal pigment epithelial cells and cell lines in rats were selected,LED cold light lamp simulate natural white light source,select 2 500,5 000,7 500,10 000 lux as light intensity,with different illumination time(6 h,12 h)irradiation on cells,light damage model was established.The cell morphology was observed by microscope,cell vitality was determined by MTT method.Results After light treatment,RPE cell vitality was restrained.The cell vitality reduced obviously with increasing intensity and time of light.The cell vitality of primary cell at 6 h 7 500,10 000 lux,12 h 5 000,7 500,10 000 lux,cell line at 6 h 10 000 lux and 12 h 7 500,10 000 lux,was lower than the blank group,there are significant differences(P<0.01).Conclusion Retinal pigment epithelial cell vitality is inhibited by the time and intensity of light.The primary cell is more sensitive than cell lines on light-induced damage.
retinal pigment epithelial cells;light-induced damage;illumination time;light intensity;primary cell;cell line
R779.1;R965.1
A
doi:10.3969/j.issn.1674-070X.2017.06.005
本文引用:罗向艳,罗 萍,颜家朝,李传课,李 波,陈向东.视网膜色素上皮细胞光损伤模型的建立与评估[J].湖南中医药大学学报,2017,37(6):599-601.
2016-12-06
国家自然科学基金青年基金项目(81303007/H2713);国家中医药管理局全国名老中医药专家李传课传承工作室(国中医药人教发2013(47)号)。
罗向艳,女,在读硕士研究生,研究方向:中医药治疗眼底病。
*罗 萍,女,主任医师,中医药防治眼底病的研究,E-mail:381526630@qq.com。

