不同产地黄精经不同方法炮制后多糖、5-羟甲基糠醛的含量变化Δ
宋艺君,郭 涛,周晓程(.陕西中医药大学药学院,陕西咸阳 7046;.解放军第45医院中医药研究所,西安 70054)
不同产地黄精经不同方法炮制后多糖、5-羟甲基糠醛的含量变化Δ
宋艺君1*,郭 涛2,周晓程1(1.陕西中医药大学药学院,陕西咸阳 712046;2.解放军第451医院中医药研究所,西安 710054)
目的:研究不同产地黄精经不同方法炮制后多糖和5-羟甲基糖醛(5-HMF)的含量变化,为不同产地黄精炮制工艺和不同炮制品质量标准的制订提供理论依据。方法:采用紫外分光光度法和高效液相色谱法分别测定黄精样品中多糖、5-HMF的含量,并比较不同产地[陕西略阳县、陕西黄陵县、云南富民县(道地产区)、陕西太白县]黄精鲜切、干切、清蒸、酒蒸样品中多糖及5-HMF的含量差异。结果:鲜切黄精以道地产区云南富民县样品多糖含量最高(13.4%),且未检测到5-HMF(0);黄精鲜切、干切、清蒸、酒蒸后多糖含量分别为10.8%~13.4%、8.9%~10.8%、5.5%~6.9%,5.6%~6.5%,5-HMF含量分别为0、0、0.21%~0.50%、0.25%~0.72%。与未炮制样品(鲜切)比较,黄精经干切、清蒸、酒蒸后多糖含量依次减少,清蒸、酒蒸后5-HMF含量依次增加。结论:建议在制订道地和非道地产区黄精炮制工艺时应考虑产地因素;在黄精清蒸和酒蒸后的炮制品的质量标准中应增加5-HMF含量测定指标。
黄精;产地;炮制工艺;5-羟甲基糠醛;多糖
黄精是百合科黄精属植物黄精(Polygonatum sibiricum Red.)、多花黄精(Polygonatum cyrtonema Hua.)、滇黄精(Polygonatum kingianum Coll.et Hemsl.)的干燥根茎[1]。其中黄精主产于陕西、河北、内蒙古等省区,多花黄精主产于云南、贵州、湖南等省区,滇黄精主产于云南、贵州、广西等省区,道地产区为云南[2-3]。黄精为临床常用滋阴补益药,其味甘、性平,具有补气养阴、健脾润肺及益肾的功效[4],其所含化学成分丰富,有多糖、皂苷、蒽醌类化合物、生物碱、强心苷、木脂素等[5]。其中,多糖是黄精的主要功能性成分,具有抗肿瘤、降血糖、免疫调节、抑菌消炎等活性,药用价值较高[6]。但在多糖的贮存和生产加工过程中,不可避免地会发生糖苷键的水解和糖的脱水反应而生成5-羟甲基糖醛(5-HMF)。据文献报道,5-HMF虽具有防治神经退行性疾病、减轻认知损害和抗心肌缺血的作用[7],但对黏膜、眼睛、皮肤有刺激性,可与人体蛋白质结合而引起毒性,造成横纹肌麻痹和内脏损害,并且具有神经毒性和潜在的遗传及生殖毒性[8],故5-HMF含量的多少会直接影响黄精及其相关制剂的疗效。因而,本文对不同产地不同炮制方法黄精炮制前后多糖、5-HMF的含量进行测定,为黄精炮制工艺的优化和质量标准的制订提供理论依据。
1 材料
1.1 仪器
UV-2550紫外分光光度仪(日本岛津公司);U3000高效液相色谱(HPLC)仪(赛默飞世尔科技公司);ST-803切片机(瑞安市赛特机电有限公司)。
1.2 药材、药品与试剂
黄精药材采自陕西略阳县、陕西黄陵县、云南富民县(道地产区)、陕西太白县,经陕西中医药大学药学院王继涛教授鉴定为百合科植物黄精(PolygonatumsibiricumRed.)的新鲜根茎;无水葡萄糖、5-HMF对照品(中国食品药品检定研究院,批号分别为:110833-201304、111626-201101,纯度:均不低于99%);黄酒(浙江绍兴县第三酒厂);甲醇为色谱纯,其余试剂均为分析纯。
2 方法与结果
2.1 黄精炮制品的制备
2.1.1 鲜切黄精取黄精新鲜药材,除去须根、霉变品及泥沙杂质,洗净,沥干水分,切片,60干燥至水分小于18.0%,即得[9]。
2.1.2 干切黄精取黄精新鲜药材,除去须根、霉变品及泥沙杂质,洗净,晾干,软化,切片,60干燥至水分小于15.0%,即得[1]。
2.1.3 清蒸黄精取黄精新鲜药材,除去须根、霉变品及泥沙杂质,洗净,沥干水分,切片,置于不锈钢容器内蒸18h,至色泽黑润后取出,放冷,60干燥至水分小于15.0%,即得[10]。
2.1.4 酒蒸黄精取黄精新鲜药材,除去须根、霉变品及泥沙杂质,洗净,沥干水分,切片,加20%黄酒,浸润6 h,置于不锈钢容器内蒸18h,至色泽黑润后取出,放冷,60干燥至水分小于15.0%,即得[11]。
2.2 多糖的含量测定
[1]方法测定。
2.2.1 对照品溶液制备取经105干燥至恒质量的无水葡萄糖对照品3.76mg,精密称定,置于10mL量瓶中,加水溶解并稀释至刻度,摇匀,即得。
2.2.2 供试品溶液制备取60干燥至恒质量的炮制品细粉约0.25g,精密称定,置于圆底烧瓶中,加80%乙醇150mL,置于水浴中加热回流1h,趁热滤过,残渣用80%热乙醇洗涤3次,每次10mL;将残渣及滤纸置于烧瓶中,加水150mL,置于沸水浴中加热回流1h,趁热滤过,残渣及烧瓶用热水洗涤4次,每次10mL;合并滤液与洗液,放冷,转移至250mL量瓶中,加水至刻度,摇匀,即得。
2.2.3 线性关系考察精密量取对照品溶液0.1、0.2、0.3、0.4、0.5、0.6mL,分别置于10mL干燥试管中,各加水至2.0mL,摇匀,在冰水浴中缓缓滴加0.2%蒽酮-硫酸溶液至刻度,混匀,放冷后置于水浴(98~100)中保温10min,取出,立即置于冰水浴中冷却10min,取出。以上述加入的各试剂为空白,照紫外分光光度法,在582 nm波长处测定吸光度。以质量浓度为横坐标(x)、吸光度为纵坐标(y)作图,得回归方程y=3.245x+0.0695(r=0.9992)。结果表明,多糖在质量浓度0.00376~0.02256mg/mL范围内与吸光度线性关系良好。
2.2.4 精密度、稳定性、重复性、加样回收率试验按相关方法进行考察。结果,精密度试验中吸光度的RSD为1.27%(n=6),表明精密度较好;稳定性试验中吸光度的RSD为1.97%(n=5),表明供试品溶液在30min内稳定;重复性试验中多糖含量的RSD为2.08%(n=6),表明方法重复性良好;加样回收率试验中多糖平均回收率为99.4%(RSD=2.5%,n=6),表明方法准确度好。
2.2.5 样品中多糖含量测定精密量取供试品溶液1 mL,置于10mL具塞干燥试管中,照“2.2.3”项下方法,自“加水至2.0mL”起进行操作,测定吸光度,计算供试品溶液中含无水葡萄糖的质量(mg),即得。
2.35 -HMF的含量测定
参考文献[12-13]方法测定。2.3.1对照品溶液制备取5-HMF对照品适量,精密称定,用甲醇溶解制备成10μg/mL的对照品溶液。
2.3.2 供试品溶液制备取样品0.2g,精密称定,加甲醇15mL,超声提取20min,滤过。滤渣加甲醇10mL,超声提取10min,滤过,滤液定容至25mL量瓶中,即得。2.3.3色谱条件与系统适用性考察色谱柱为HypurityC1(8250mm×4.6mm,5μm),流动相为甲醇-水(8∶92),流速为1.0mL/min,检测波长为280nm,柱温为30,进样量为10μL。取“2.3.1”“2.3.2”项下溶液进样分析,色谱图见图1。
2.3.4 线性关系考察分别吸取对照品溶液2、6、10、14、18μL,进样测定,记录色谱峰峰面积。以进样量为横坐标(x)、峰面积为纵坐标(y)进行线性回归,得到回归方程为y=37.975x+0.0145(r=0.9999),结果表明,5-HMF进样量在0.02~0.18μg范围内与峰面积线性关系良好。
2.3.5 精密度、稳定性、重复性、加样回收率试验按相关方法进行考察,所采用样品为陕西略阳县酒蒸黄精。结果,精密度试验中峰面积的RSD为1.66%(n=6),表明方法精密度较好;稳定性试验中峰面积的RSD为1.87%(n=5),表明供试品溶液在10h内稳定;重复性试验中5-HMF含量的RSD为2.04%(n=6),表明方法重复性良好;加样回收率试验中5-HMF平均回收率为98.7%(RSD=1.9%,n=6),表明方法准确度好。
2.3.6 样品5-HMF含量测定 精密取供试品溶液10 μL,进样测定,计算各样品中5-HMF含量。
2.4 不同产地不同方法炮制样品含量测定结果
根据“2.2”“2.3”项下方法测定各样品中多糖和5-HMF含量,结果,不同产地黄精经过不同方法炮制后,多糖含量减少,5-HMF含量不变或增加,结果详见表1。
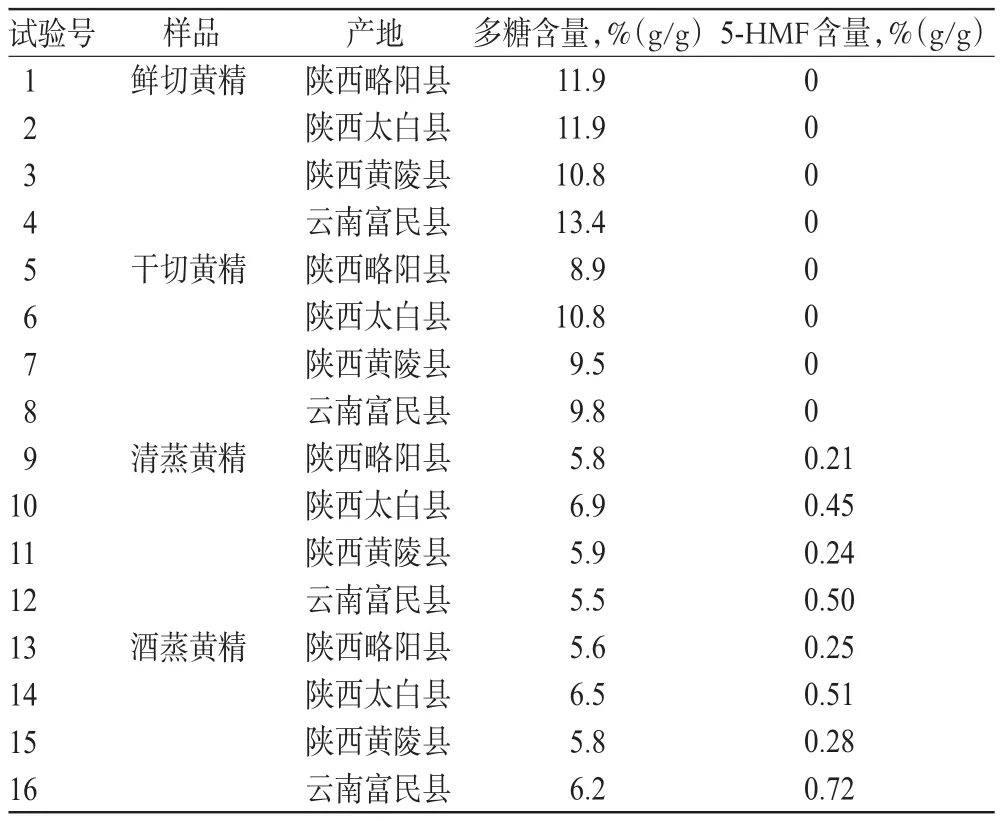
表1 不同产地、不同方法炮制黄精中多糖和5-HMF含量测定结果(n=3)Tab 1 Results of contents determ ination of polysaccharide and 5-HM F in Polygonati rhizom a from different producing areas by different processingmethods(n=3)
由表1可见,鲜切黄精中以道地产区云南富民县样品多糖含量最高(13.4%),且未检测到5-HMF;黄精鲜切、干切、清蒸、酒蒸后多糖含量分别为10.8%~13.4%、8.9%~10.8%、5.5%~6.9%,5.6%~6.5%,5-HMF含量分别为0、0、0.21%~0.50%、0.25%~0.72%。与未炮制样品(鲜切)比较,黄精经干切、清蒸、酒蒸后多糖含量依次减少,清蒸、酒蒸后5-HMF含量依次增加。不同产地黄精,鲜切和干切炮制后均未检测到5-HMF,而清蒸和酒蒸炮制后检测到5-HMF,其含量由高到低依次为云南富民县、陕西太白县、陕西黄陵县、陕西略阳县样品。
3 讨论
本课题选取的黄精样本经专家鉴定是百合科黄精属植物黄精的根茎,分别来源于道地产区和非道地产区。道地产区为云南富民县,非道地产区为陕西(黄精的主要栽培区),分别选取陕西北部(陕西黄陵县)、南部(陕西略阳县)和中部(陕西太白县)的样品,所选样品具有代表性。
本文中传统黄精样品是按照炮制的固定操作程序来处理,即2015年版《中国药典》中黄精饮片项下“黄精”的处理方法[1],是标准的常用方法;本课题研究黄精产地加工炮制一体化技术,故采用新鲜黄精直接切片后分别晒干、清蒸、酒蒸,相应得到新鲜黄精、清蒸黄精、酒蒸黄精,各炮制方法及条件均由本课题前期试验优化而得。
根据不同方法炮制后样品中多糖和5-HMF含量的变化,提示在制订道地和非道地产区黄精炮制工艺时应考虑产地因素,产地气候等条件差别较大时,应制订不同的炮制工艺参数。
2015年版《中国药典》干切和酒蒸黄精含量测定项下均只列有多糖的含量测定,考虑到炮制条件的不同,其化学组成的变化方式也不相同[14],故此标准不能很好地反映黄精炮制品的化学物质组成变化。因而笔者认为在黄精清蒸和酒蒸后的炮制品中增加5-HMF含量测定指标很有必要。
黄精炮制以清蒸和酒蒸为主,炮制前后颜色差异较大,炮制后药物表面呈棕褐色至黑色,有光泽,中心棕色至浅褐色,可见筋脉小点,质地柔软,味甜。黄精炮制后多糖含量减少,主要是因为黄精中的糖类成分和氨基酸多肽蛋白类成分在高温下发生了十分复杂的美拉德反应所致[15]。
参考文献
[1] 国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2015:306-307.
[2] 孙哲.三种黄精资源调查及卷叶黄精质量评价[D].北京:北京中医药大学,2009.
[3] 陈兴荣,陈玲,马志敏.滇黄精的药用价值与开发利用[J].医药导报,2003,22(4):261-263.
[4] 吴毅,王栋,郭磊,等.三种黄精炮制前后呋喃类化学成分的变化[J].中药材,2015,38(6):1172-1176.
[5] 庞玉新,赵致,袁媛,等.黄精的化学成分及药理作用[J].山地农业生物学报,2003,22(6):547-550.
[6] 陆建平,张静,张艳贞,等.黄精多糖的功能活性及应用前景[J].食品安全质量检测学报,2013,4(1):273-278.
[7] 吴毅,许妍,赵雯,等.参麦注射液中5-羟甲基糠醛的含量测定[J].齐鲁药事,2012,31(1):11-12.
[8]Guo M,Xu XT,Wu ZW.Bindingmechanism of rhaponticin and human serum album in[J].Acta Pharm Sin,2011,46(9):1084-1092.
[9] 杨琳.黄精的产地初加工工艺研究[D].咸阳:西北农林科技大学,2012.
[10] 刘玲,鲍家科,刘建军,等.蒸黄精的不同炮制方法比较[J].中国实验方剂学杂志,2014,20(24):14-17.
[11] 刘玲,鲍家科,刘建军,等.酒黄精的不同炮制方法比较[J].中国实验方剂学杂志,2015,21(10):26-29.
[12] 杨云,许闽,冯云霞,等.黄精不同炮制品中5-羟甲基糠醛的含量测定[J].中药材,2008,31(1):17-19.
[13]常亮,陈珍珍,王栋,等.HPLC和GC-MS法测定三种黄精炮制过程中5-羟甲基糠醛的含量[J].中国药师,2015,18(3):387-390.
[14] 张村,李丽,肖永庆.炮制与药性相关性研究方法探讨[J].世界科学技术:中医药现代化,2010,12(6):876-881.
[15] Chen S,Jin S,Chen C.Relative activities of glucose and galactose in browning and pyruvaldehyde formation in sugar/glycine model systems[J].Food Chem,2005,92(4):597-602.
Contents Changes of Polysaccharide and 5-HMF in Polygonati Rhizoma from Different Producing Areas after Different Processing
SONG Yijun1,GUO Tao2,ZHOU Xiaocheng1(1.School of Pharmacy,Shaanxi University of Chinese Medicine,Shaanxi Xianyang 712046,China;2.Institute of Traditional Chinese Medicine,No.451 Hospital of PLA,Xi’an 710054,China)
OBJECTIVE:To study the contents changes of polysaccharide and 5-HMF in Polygonati rhizoma from different producing areas after different processing,and provide reference for the development of processing technology of Polygonati rhizoma from different producing areas and the quality standard of different processing products.METHODS:UV spectrophotometry and HPLC were conducted to respectively determ ine the contents of polysaccharide and 5-HMF,and compare the content differences of polysaccharide and 5-HMF in Polygonati rhizoma from different producing areas[Shaanxi Lueyang County,Shaanxi Huangling County,Yunnan Fum in County(genuine producing areas),Shaanxi Taibai County]by fresh-cutting,dry-cutting,steam ing and steaming w ith w ine.RESULTS:Polysaccharide of sample from Yunnan Fumin County showed the highest content in fresh-cut samples(13.4%),no 5-HMF(0)was detected;polysaccharide contentswere respectively 10.8%-13.4%,8.9%-10.8%,5.5%-6.9%,5.6%-6.5%after fresh-cut,dry-cut,steamed and steamed w ith w ine,5-HMF contents were 0,0,0.21%-0.50%,0.25%-0.72%. Compared w ith no processing samples(fresh-cut),polysaccharide contents in Polygonati rhizoma were decreased in turn after drycut,steamed and steamed w ith w ine,5-HMF contents were increased in turn after steamed and steamed w ith w ine.CONCLUSIONS:It is suggested to consider origin factor in developing processing technology of Polygonati rhizoma from genuine and nongenuine producing areas.5-HMF content determination index should be added into quality standard of processing products after steamed and steamed w ith w ine.
Polygonati rhizoma;Produced area;Processing technology;5-hydroxymethyl furfural;Polysaccharide
R283
A
1001-0408(2017)16-2256-03
2016-09-26
2016-11-02)
(编辑:刘 萍)
陕西省教育厅重点实验室科学研究计划项目(No.14JS023)
*讲师,博士。研究方向:中药饮片规范化。电话:029-38185172。E-mail:songyijun200506@126.com
DOI10.6039/j.issn.1001-0408.2017.16.26

