氯化钾部分替代氯化钠对猪肉肌原纤维蛋白凝胶特性的影响
齐鹏辉,陈倩,逄晓云,孔保华
(东北农业大学食品学院,黑龙江哈尔滨150030)
氯化钾部分替代氯化钠对猪肉肌原纤维蛋白凝胶特性的影响
齐鹏辉,陈倩,逄晓云,孔保华*
(东北农业大学食品学院,黑龙江哈尔滨150030)
将不同配比的NaCl和KCl复合盐,按照0.6 mol/L+0 mol/L、0.5 mol/L+0.1 mol/L、0.4 mol/L+0.2 mol/L和0.3 mol/L+0.3mol/L的比例添加到猪肉肌原纤维蛋白溶液中,热诱导形成凝胶。通过对凝胶的持水性、硬度、水分分布和微观结构的分析来考察氯化钾部分替代氯化钠对肌原纤维蛋白凝胶性质的影响。结果表明,与单独添加NaCl的对照组相比,添加0.4mol/LNaCl+0.2mol/LKCl的复合盐能显著提高凝胶的持水性和凝胶强度(P<0.05)。低场核磁技术对凝胶中水分分布和迁移的分析表明,添加0.4mol/LNaCl+0.2mol/LKCl的复合盐可缩短肌原纤维蛋白凝胶的弛豫时间T2b、T21和T22,表明凝胶可以增强对结合水及不易流动水的结合能力,但添加不同配比的复合盐对凝胶的微观结构影响不显著。
肌原纤维蛋白;凝胶特性;替代;NaCl;KCl
肉制品品种丰富,在营养、质构和风味等方面受到消费者的欢迎。在肉制品的生产加工过程中,氯化钠起着非常重要的作用。氯化钠是肉制品中常用的腌制剂,它可以促进肌原纤维蛋白的溶解,降低产品的水分活度,抑制病原微生物的生长,影响产品最终的风味[1]。但是,过量的摄入食盐会引起很多疾病,如高血压、动脉粥样硬化和胃癌等疾病[2]。因此,对低盐肉制品的开发就变得十分必要。
目前,肉制品中低盐的研究主要集中在直接减少氯化钠和替代氯化钠两个方面。其中,直接采用减少氯化钠的方法会对肉制品品质及安全性产生不利的影响。Pietrasik等[3]研究了氯化钠替代物和鲜味剂对重组火腿加工特性的影响,结果发现直接减少氯化钠添加量对重组火腿的质构特征会产生不利影响。Chin等[4]研究发现肌原纤维蛋白热诱导凝胶的蒸煮损失随着离子强度的降低而增加了,直接减少氯化钠含量会导致保水性能的下降。因此,采用氯化钠部分替代的方法是近些年研究的热点。关于氯化钠替代的研究主要是集中在肉制品中,而关于替代物在肌原纤维蛋白中的研究相对较少。肉制品中氯化钠替代物的种类有很多,如氯化钾、氯化钙、氯化镁[5-6]、乳酸钾[7]和咸味肽[8]等。其中,氯化钾对肉制品的品质影响最小[9]。
目前,关于氯化钠替代物对肌原纤维蛋白影响的研究多集中在氯化钠浓度对其凝胶特性的影响。贾娜等[10]研究氯化钠浓度对肌原纤维蛋白-食用胶混合物凝胶特性的影响。韩敏义等[11-12]用拉曼光谱技术和低场核磁共振技术分别研究氯化钠浓度对猪肉肌原纤维蛋白凝胶硬度及凝胶水分分布和移动性的影响。而关于等离子强度条件下部分氯化物替代对肌原纤维蛋白凝胶特性影响的研究鲜见报道。本文研究在等离子强度下,使用氯化钾部分替代氯化钠的复合盐,研究其对肌原纤维蛋白凝胶持水性、硬度、水分分布以及微观结构的影响,为低盐肉类制品的开发和加工提供理论依据。
1 材料与方法
1.1 材料
新鲜猪背最长肌:哈尔滨大润发超市;哌嗪-N,N-2-乙磺酸(PIPES)及牛血清蛋白(BSA):美国 Sigma公司;β-mercaptoethanol(β-ME)、乙二醇-双-(2-氨基乙醚)四乙酸(EGTA):美国 AMRESCO 公司;NaCl、KCl等试剂均为国产分析纯;其它试剂均购于国药集团化学试剂有限公司。
1.2 仪器与设备
JD500-2型电子天平:沈阳龙腾电子称量仪器有限公司;PHS-3C精密PH计:上海雷磁仪器厂;冷冻离心机:美国Beckman公司;721型可见分光光度计:上海元析仪器有限公司;WSC-S型测色色差计:上海物理光学仪器厂;TA-XT plus型质构分析仪:英国Stable Micro System;Mq-20低场核磁共振分析仪:德国布鲁克公司。
1.3 试验方法
1.3.1 猪肌原纤维蛋白的提取
肌原纤维蛋白的提取过程在4℃条件下进行。根据Park等[13]的方法,取一定质量新鲜的猪背部最长肌,去除结缔组织,切碎,加入4倍体积的提取液(pH 7.0,10 mmol/L 磷酸盐缓冲液、0.1 mol/L NaCl、2 mmol/L MgCl2和 1 mmol/L EGTA),在匀浆机中匀浆 60 s,形成的肉浆在3 500 r/min的离心转速下冷冻离心15 min,除去上清液,保留沉淀,按照上面的步骤重复进行两次,最后得到粗肌原纤维蛋白沉淀,接着在此沉淀中加入4倍体积预先预冷的0.1 mol/L NaCl洗液,匀浆机中匀浆 60 s,3 500 r/min,冷冻离心 15 min,取沉淀,重复上述操作一次,再取沉淀加入4倍体积0.1 mol/L NaCl洗液,匀浆60s,用4层纱布过滤,滤液用0.1mol/L HCl调节pH值至6.0,在3 500 r/min的离心转速下冷冻离心15min,除去上清液,得到的肌原纤维蛋白2℃~4℃保存,在48 h内利用。
1.3.2 肌原纤维蛋白凝胶的制备
参考李银等[14]的方法,将提取的肌原纤维蛋白,用含有(0.3 mol/L NaCl和 0.3 mol/L KCl、0.4 mol/L NaCl和0.2 mol/L KCl、0.5 mol/L NaCl和 0.1 mol/L KCl、0.6 mol/L NaCl)4种 50 mmol/L的 PIPES缓冲液(pH 6.0)配制,将其浓度调至40 mg/mL后,分别置于烧杯中,混合均匀后,放入4℃冰箱中,经过24 h后,放到凝胶瓶中(高为50 mm,直径为30 mm),在72℃下水浴10 min,然后立即取出冷水浴后,进行后续指标测定。
1.3.3 肌原纤维蛋白凝胶持水性的测定
根据Xia等[15]的方法。取约5 g凝胶样本放入直径30 mm的离心管中,4℃,1 000 r/min,离心10 min,除去离心出的水分,测定离心前后凝胶的重量。根据下面公式计算WHC(%):

式中:m0是离心管重量,g;m1是离心前离心管和凝胶重量,g;m2是离心后离心管和凝胶重量,g。
1.3.4 肌原纤维蛋白凝胶强度的测定
根据Jiang[16]的方法,称取10.0 g肌原纤维蛋白样品放在凝胶瓶中(高为50 mm,直径为30 mm),在72℃的水浴锅里加热10 min,形成凝胶。用质构仪利用穿刺的模式测定凝胶强度。采用P/0.5探头,测前速度 2.0 mm/s,测试速度 0.3 mm/s,测后速度 2.0 mm/s,穿刺距离为10.0 mm,穿透力(N)即为凝胶的强度。
1.3.5 维持肌原纤维蛋白凝胶作用力的测定
根据Jiang和Xiong[17]的方法,略作修改。将2.0 g蛋白凝胶分别溶解在18.0 mL含3种不同变性剂的缓冲液中,在80℃下加热30 min,迅速冷却到室温后,于5 000 g离心15 min。3种缓冲液体系如下:(1)含有8 mol/L尿素(Urea)和 50 mmol/L磷酸盐(pH 7.0),用于测定凝胶中的氢键;(2)含有0.5%的十二烷基磺酸钠(SDS)和 50 mmol/L磷酸盐(pH 7.0),用于测定凝胶中的疏水相互作用;(3)0.25%β-巯基乙醇(β-ME)和50 mmol/L磷酸盐溶液(pH 7.0),用于测定凝胶中的二硫键。采用双缩脲方法测定上清液的蛋白含量。蛋白溶解度即为溶出的蛋白量占总蛋白量的百分比。
1.3.6 肌原纤维蛋白凝胶中水分分布的测定
参考吴烨等[18]的方法并稍加修改,采用低场核磁共振(Lowfield-nuclear magnetic resonance,LF-NMR)技术测定凝胶样品中水分分布情况。将2.0 g的蛋白凝胶样品放入专用的核磁管中,在LF-NMR分析仪中进行横向驰豫时间(T2)的测定。分析仪的磁场强度为0.47 T,质子共振频率为20 MHz。采用Carr-Purcell-Meiboom-Gill(CPMG)程序测定凝胶的横向弛豫时间T2,每个样品自动扫描16次,每次重复的间隔时间为2 s。测定后的每个样品的T2,通过CONTIN软件进行反演,得到相应的弛豫时间T2与对应的峰面积A2。
1.3.7 肌原纤维蛋白凝胶微观结构的测定
根据韩敏义等[12]的方法,取肌原纤维蛋白凝胶在2.5%(体积分数)戊二醛溶液中固定14 h,取样(1 cm×1 cm×1cm)并用0.1 mol/L磷酸缓冲液(pH6.5)漂洗数次,用10 g/L四氧化锇固定,再用同样的缓冲液漂洗,然后乙醇梯度脱水,冷冻干燥,喷金,最后通过扫描电镜进行观察并拍照,加速电压为15 kV,每个样品观察8个区域。
1.3.8 统计分析
每个试验重复3次,结果表示为平均数±SD。数据统计分析采用 Statistix8.1(分析件,StPaul,MN)软件包中Linear Models程序进行,差异显著性(P<0.05)分析使用Tukey HSD程序。采用sigmaplot 11.1软件作图。
2 结果与分析
2.1 氯化钾部分替代氯化钠对肌原纤维蛋白凝胶持水性的影响
氯化钾部分替代氯化钠对肌原纤维蛋白凝胶持水性的影响见图1。
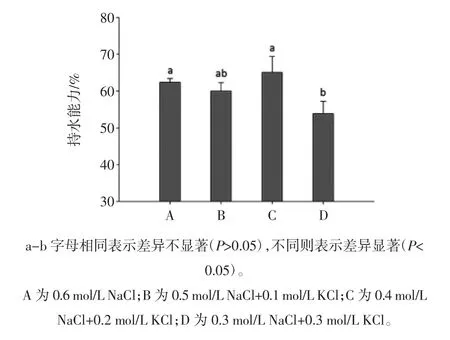
图1 氯化钾部分替代氯化钠对肌原纤维蛋白凝胶持水性的影响Fig.1 The effect of partial substitution of NaCl with KCl on the water holding capacity of myofibrillar protein gel
如图1所示,KCl替代量对肌原纤维蛋白凝胶保水性的影响不大,只有添加0.3 mol/L NaCl+0.3 mol/L KCl水平的盐离子才产生差异性,保水性由对照组(0.6 mol/L NaCl)的62%降低到53%,降低了9%(P<0.05)。凝胶持水性可以反映凝胶网状结构特点,凝胶结构越细密、均匀,其持水性越好[19]。在凝胶网络结构形成过程中,氢键、疏水和静电相互作用等均会影响凝胶的网络结构,结构的变化会影响到凝胶的持水能力。其中,离子种类和强度对这些作用力的效果有很大的影响。本研究选择了等离子强度的盐离子,结果表明,KCl替代NaCl一定程度上降低了蛋白凝胶的持水性。
2.2 氯化钾部分替代氯化钠对肌原纤维蛋白凝胶强度的影响
氯化钾部分替代氯化钠对肌原纤维蛋白凝胶强度的影响见图2。

图2 氯化钾部分替代氯化钠对肌原纤维蛋白凝胶强度的影响Fig.2 The effect of partial substitution of NaCl with KCl on the strength of myofibrillar protein gel
本试验比较了不同配比的NaCl和KCl的复合盐对肌原纤维蛋白凝胶强度的影响,结果见图2。如图2所示,与单独添加NaCl的对照组相比,添加0.3 mol/L NaCl+0.3 mol/L KCl的复合盐显著的降低了凝胶的强度(P<0.05)。添加 0.4 mol/L NaCl+0.2 mol/L KCl和0.5 mol/L NaCl+0.1 mol/L KCl的复合盐与单独添加NaCl相比差异不显著(P>0.05)。这一结果和Guàrdia的报道一致,其研究结果也表明添加氯化钾替代也会影响产品的硬度[20]。
2.3 蛋白凝胶中主要作用力的分析
在肌原纤维蛋白凝胶中,肌球蛋白是参与蛋白凝胶的主要蛋白,其主要通过疏水相互作用、氢键和二硫键来形成凝胶[21]。因此,本试验采用不同的变性剂处理肌原纤维蛋白凝胶,考察其在含有不同变性剂缓冲液中的溶解情况,分析参与蛋白凝胶作用的作用力,结果见图3。

图3 氯化钾部分替代氯化钠对肌原纤维蛋白凝胶在不同变性剂(尿素、SDS和β-巯基乙醇)中溶解度的影响Fig.3 The effect of partial substitution of NaCl with KCl on the solubility of myofibrillar protein gel in different solvents(Urea,SDS and β-ME)
从图3中可知,蛋白质在添加SDS变性剂缓冲液中溶解度最高,尿素次之,β-巯基乙醇最低,它们对应可以破坏疏水相互作用,氢键和二硫键。其中,氢键是弱偶极键,在蛋白质凝胶体系中的数量极大,是增加凝胶强度的重要化学键,对稳定结合水起重要作用;二硫键是肌原纤维蛋白热诱导凝胶形成的主要化学键。凝胶化过程中肌球蛋白头部的二硫键在凝胶形成的过程中起重要作用[22]。如图3所示,与对照组相比,0.4 mol/L NaCl+0.2 mol/L KCl和0.5 mol/L NaCl+0.1 mol/L KCl的蛋白凝胶在含有尿素的缓冲液中溶解性无显著性差异(P>0.05),而 0.3 mol/L NaCl+0.3 mol/L KCl试验组的蛋白溶解性显著降低了(P<0.05),说明氯化钾的添加减弱了氢键的作用力;随着氯化钾的添加量增加,在对照组、0.4 mol/L NaCl+0.2 mol/L KCl和0.5 mol/L NaCl+0.1 mol/L KCl 3组之间的溶解性不存在显著性差异,当氯化钾的添加量增至0.3 mol/L时溶解度发生了降低(P<0.05),该结果说明了氯化钾增加到一定程度后蛋白凝胶中的疏水相互作用力降低了,0.3 mol/L氯化钾的替代对肌原纤维蛋白成胶的抑制。该结论与凝胶强度增加的趋势基本一致,说明由0.3 mol/L氯化钾替代处理导致的蛋白内部疏水基团的暴露不利于凝胶强度的增加;采用β-巯基乙醇处理后的蛋白凝胶溶解度变化趋势与前两种作用力相似,添加0.3 mol/L NaCl+0.3 mol/L KCl的复合盐的凝胶,蛋白之间的二硫交联作用显著减少。综上,在氯化钾替代的凝胶中氢键、二硫键和疏水相互作用对蛋白质凝胶起着一定的作用。
2.4 氯化钾部分替代氯化钠对肌原纤维蛋白凝胶中水分分布的影响
采用低场核磁弛豫时间(T2)来反映猪肉肌原纤维蛋白凝胶体系中水的分布和迁移情况[23]。在水分分布图谱中共出现 4 个特征峰,分别为 T2b、T21、T22和 T23,对应的弛豫起始时间见表1。

表1 氯化钾部分替代氯化钠对肌原纤维蛋白凝胶低场核磁弛豫时间的影响Table 1 The effect of partial substitution of NaCl with KCl on relaxation time of myofibrillar protein gel
弛豫时间T2越短说明样品中水分子与底物结合的越紧密,T2时间越长表明水分子越自由[24]。其中,弛豫时间在0~10 ms之间的为结合水(T2b);弛豫时间在10 ms~100 ms之间,表示不易流动水(T21和 T22);弛豫时间在 100 ms~1 000 ms之间为自由水(T23)[25]。
由表1可知,随着氯化钾替代量的增多,T2的弛豫时间发生了变化。添加0.3 mol/L NaCl+0.3 mol/L KCl、0.4 mol/L NaCl+0.2 mol/L KCl和 0.5 mol/L NaCl+0.1 mol/L KCl 3组复合盐和单独添加NaCl组的肌原纤维蛋白热诱导凝胶T2b的弛豫时间没有显著差异(P>0.05),大部分研究结果表明,T2b与肉的宏观和微观结构及机械压力的变化无关[26-27]。在添加0.4 mol/L Na-Cl+0.2 mol/L KCl的复合盐和单独添加NaCl组中T21没有显著差异(P>0.05),但与其他两组差异显著。而在单独添加NaCl组与其余3组的T22相比较,均差异显著,说明增加氯化钾的替代量由于形成良好的凝胶结构,限制了水的移动,水的可移动性降低,造成了弛豫时间下降。T23代表自由水,与单独添加NaCl组相比较,添加0.3 mol/L NaCl+0.3 mol/L KCl的复合盐的T23弛豫时间显著增加了,说明了其中的自由水含量显著增多,其他组份均无显著差异。
氯化钾部分替代氯化钠对肌原纤维蛋白凝胶低场核磁峰面积的影响见表2。
由表2可知,不同氯化钾的替代量猪肉肌原纤维蛋白热诱导凝胶的不同状态水的峰面积有显著差异。增加氯化钾的替代量,降低了自由水(T23)的峰面积,增加了部分不易流动水(T22)的峰面积,该结果说明提高氯化钾的替代量有利于三维网状凝胶结构的形成,将水分束缚于凝胶网络中,减少水分的损失[25]。

表2 氯化钾部分替代氯化钠对肌原纤维蛋白凝胶低场核磁峰面积的影响Table 2 The effect of partial substitution of NaCl with KCl on peak area of myofibrillar protein gel
综上所述,氯化钾部分替代的肌原纤维蛋白凝胶可使T21、T22所对应的组份的水的移动性下降,但对添加0.4 mol/L NaCl+0.2 mol/L KCl的复合盐弛豫时间的影响并不是完全线性的,可以得出,相对于全盐组,添加0.4 mol/L NaCl+0.2 mol/L KCl的复合盐的不易流动水的保水性是最强的。
2.5 蛋白凝胶的微观结构
添加不同配比的NaCl+KCl的复合盐的肌原纤维蛋白形成凝胶微观结构的变化如图4所示。

图4 氯化钾部分替代氯化钠对肌原纤维蛋白凝胶凝胶微观结构的影响Fig.4 The effect of partial substitution of NaCl with KCl on the microstructure of myofibrillar protein gel
由图4中可以看出,添加复合盐组中所成凝胶结构与单独添加NaCl组的凝胶样品无明显差异。因为,该凝胶是在等离子强度条件下制备的,等离子条件对凝胶微观结构内部的改变没有显著的影响。
3 结论
在肌原纤维蛋白凝胶形成过程维持凝胶结构的主要作用力包括,疏水相互作用、氢键和二硫键。添加0.4 mol/L NaCl+0.2 mol/L KCl的复合盐能够显著提高蛋白凝胶的凝胶强度,但是凝胶持水性与单独添加NaCl组相比无显著差异。通过低场核磁共振测定肌原纤维蛋白凝胶的横向弛豫时间T2,研究凝胶中结合水、不易流动水和自由水3种状态水的分布情况,结果显示,添加0.4 mol/L NaCl+0.2 mol/L KCl的复合盐能够缩短凝胶的T21、T22弛豫时间,增大A3峰面积,因此提高了凝胶的保水性,改善了肌原纤维蛋白热诱导凝胶的持水性、硬度及水分分布的性质。电镜分析表明,等离子强度对蛋白凝胶结构的影响不显著。
[1] Ruusunen M,Puolanne E.Reducing sodium intake from meat products[J].Meat Science,2005,70(3):531-541
[2] 郭秀云,张雅玮,彭增起.食盐减控研究进展[J].食品科学,2012(21):374-378
[3] Pietrasik Z,Gaudette N J.The impact of salt replacers and flavor enhancer on the processing characteristics and consumer acceptance of restructured cooked hams[J].Meat Science,2014,96(3):1165-1170
[4] Chin K B,Go M Y,Xiong Y L.Konjac flour improved textural and water retention properties of transglutaminase-mediated,heat-induced porcine myofibrillar protein gel:effect of salt level and transglutaminase incubation[J].Meat Science,2011,31(5):727-730
[5] Gou P,Guerrero L,Gelabert,et al.Potassium chloride,potassium lactate and glycine as sodium chloride substitutes in fermented sausages and in dry-cured pork loin[J].MeatScience,1996,42(1):37-48
[6] Zanardi E,Ghidini S,Conter M,et al.Mineral composition of Italian salami and effect of NaCl partial replacement on compositional,physico-chemical and sensory parameters[J].Meat Science,2010,86(3):742-747
[7] 朱辉,于荟.低盐火腿中食盐替代品的研究进展[J].科技资讯,2013(14):226-226
[8] 武彦文,欧阳杰.氨基酸和肽在食品中的呈味作用[J].中国调味品,2001(1):21-24
[9] Campagnol P C B,Santos B A D,Wagner R,et al.The effect of yeast extract addition on quality of fermented sausages at low NaCl content[J].Meat Science,2011,87(3):290-298
[10]贾娜,芦嘉莹,刘登勇,等.NaCl浓度对肌原纤维蛋白-食用胶混合物功能特性的影响[J].食品工业科技,2014,35(11):83-86
[11]韩敏义,李伟锋,王鹏,等.拉曼光谱研究NaCl浓度对猪肉肌原纤维蛋白凝胶硬度的影响[J].核农学报,2014,28(12):2193-2199
[12]韩敏义,刘永安,王鹏,等.低场核磁共振法研究NaCl对肌原纤维蛋白凝胶水分分布和移动性的影响[J].食品科学,2014,35(21):88-93
[13]Boatright W L,Hettiarachchy N S.Spray-dried soy protein isolate solubility,gelling characteristics,and extractable protein as affected by antioxidants[J].Food Science,1995,60(4):806-809
[14]李银,李侠,张春晖,等.羟自由基导致肉类肌原纤维蛋白氧化和凝胶性降低[J].农业工程学报,2013,29(12):286-292
[15]Xia X F,Kong B H,Xiong Y L,et al.Decreased gelling and emulsifying properties of myofibrillar protein from repeatedly frozenthawed porcine longissimus muscle are due to protein denaturation and susceptibility to aggregation[J].Meat Science,2010,85(3):481-486
[16]蒋将.pH偏移处理诱导熔球态大豆蛋白的结构变化及功能性质的改善[D].无锡:江南大学,2011:67-84
[17]Jiang J,Xiong Y L.Extreme pH treatments enhance the structurereinforcement role of soy protein isolate and its emulsions in pork myofibrillar protein gels in the presence of microbial transglutaminase[J].Meat Science,2013,93:469-476
[18]吴烨,许柯,徐幸莲,等.低场核磁共振研究pH值对兔肌球蛋白热凝胶特性的影响[J].食品科学,2010,31(9):6-11
[19]Lakemond C M M,Jongh H H J,Paques M,et al.Gelation of soy glycinin influence of pH and ionic strength on network structure in relation to protein conformation[J].Food Hydrocolloids,2003,17(3):365-377
[20]Guàrdia MD,Guerrero L,Gelabert J,et al.Sensory characterization and consumer acceptability of small calibre fermented sausages with 50%substitution of NaCl by mixtures of KCl and potassium lactate[J].Meat Science,2008,80:1225-1230
[21]Visessanguan S,Ogawa M,Nakai S.Physiological changes and mechanism of heat induced gelation of arrowtooth flounder[J].journal of agricultural and food chemistry,2000,48:1016-1023
[22]Hossain M I,Itoh Y,Morioka K,et al.Contribution of the polymerization of protein by disulfide bonding to increased gel strength of walleye Pollack surimi gel with preheating time[J].Fish Science,2001,67(4):710-717
[23]Li Cb,Liu Dy,Zhou Gh,et al.Meat quality and cooking attributes of thawed pork with different low field NMR T21[J].Meat Science,2010,92:79-83
[24]韩敏义,费英,徐幸莲,等.低场NMR研究pH对肌原纤维蛋白热诱导凝胶的影响[J].中国农业科学,2009,42(6):2098-2104
[25]Tornberg E,Wahlgren M,Brøndum J,et al.Pre-rigor conditions in beef under varying temperature and pH falls studied with rigometer NMR and NIR[J].Food Chemical,2000,69(4):407-418
[26]Pearce K L,Rosenvold K,Andersen H J,et al.Water distribution and mobility in meat during the conversion of muscle to meat and ageing and the impacts on fresh meat quality attributes-a review[J].Meat Science,2011,89(2):111-124
[27]Mcdonnell C K,Allen P,Morin C,et al.The effect of ultrasonic saltingonproteinandwater-protein interactions in meat[J].Food Chemistry,2014,147:245-251
Effects of Partial Substitution of NaCl with KCl on the Gel Properties of Porcine Myofibrillar Proteins
QI Peng-hui,CHEN Qian,PANG Xiao-yun,KONG Bao-hua*
(College of Food Science,Northeast Agricultural University,Harbin 150030,Heilongjiang,China)
Complex salts of different ratio in NaCl and KCl(0.3 mol/L+0.3 mol/L,0.4 mol/L+0.2 mol/L,0.5 mol/L+0.1 mol/L and 0.6 mol/L+0 mol/L)were added to porcine myofibrillar protein gel to examine their impacts on gelling properties of myofibrillar proteins by the measurements of water holding capacity,hardness,moisture distribution and microstructure.The results showed that the addition complex salts of 0.4 mol/L Na-Cl and 0.2 mol/L KCl could improve the water holding capacity of gel,enhance the interactions between disulfide bonds and hydrophobic interaction,increase gel strength significantly (P<0.05)and shorten the relaxation time T2b,T21and T22of myofibrillar protein gel,which indicating that the water binding capacity increased in gel with bound water and immobilized water.However,the effect of adding complex salts of different ratio on the microstructure of gel was not significant.
myofibrillar proteins;gel properties;substitution;NaCl;KCl
2016-10-19
黑龙江省应用技术研究与开发计划重大项目(GA15B302)
齐鹏辉(1990—),男(汉),硕士研究生,研究方向:畜产品加工及贮藏工程。
*通信作者:孔保华(1963—),女(汉),教授,博士,研究方向:畜产品加工及贮藏工程。
10.3969/j.issn.1005-6521.2017.13.004

