基于柔性微电极芯片活体电穿孔提高PD-1质粒DNA转染效率
张卫凯,胡志远,李智涛
·基础医学·
基于柔性微电极芯片活体电穿孔提高PD-1质粒DNA转染效率
张卫凯1,胡志远2,李智涛1
目的 开发一种柔性微电极芯片提高以PD-1质粒为模版的DNA转染效率。方法 运用微机电系统加工柔性衬底的微电极芯片,在体外对HEK293细胞进行电转染GFP质粒,验证柔性微电极芯片的可靠性。在活体动物进行电穿孔转染PD-1质粒实验,BALB/C小鼠共分3组,每组5只,分别给予0 V·cm-2, 100 V·cm-2, 200 V·cm-2不同电场强度进行电穿孔,间接ELISA法检测电转后不同时间点的血清中抗PD-1抗体滴度。结果制备的柔性微电极芯片,能够转染GFP质粒到HEK293细胞内表达蛋白;在活体实验中,采用微电极芯片电穿孔免疫5次后2周,小鼠血清中PD-1抗体达到峰值。结论 基于柔性微电极芯片的活体电穿孔能够有效提高DNA转染效率,增强免疫应答。
电穿孔;DNA转染;PD-1
程序性死亡分子1 (programmed death-1,PD-1)又称CD279,是一种表达于T细胞膜表面的负性免疫共刺激分子[1]。正常机体内,组织细胞表面的PD-1配体(programmed death-ligand 1,PD-L1)与淋巴细胞表面的PD-1结合,抑制淋巴细胞活化,诱导活化的淋巴细胞凋亡,从而在自身免疫耐受的形成以及防止自身免疫疾病中发挥重要作用。许多肿瘤细胞表面高表达 PD-L1,抑制局部T淋巴细胞功能而使肿瘤细胞逃避机体免疫监视[2-3]。通过对PD-1/PD-L1信号通路进行阻断,可有效提高T淋巴细胞对肿瘤细胞的杀伤效果[4-5]。目前,在肺癌、淋巴瘤等疾病的临床免疫治疗中应用PD-1单克隆抗体取得显著的疗效[6-9]。传统方法采用原核细胞表达重组蛋白作为免疫原,由于缺乏糖基化修饰及正确的空间构象,严重影响中和活性抗体的产生。DNA免疫将目的基因导入机体,表达天然蛋白,有利于产生特异性抗体[11]。但是传统的基因枪转染效率低,影响机体的免疫应答效果。电穿孔技术是一种有效提高转染效率的新技术[12-14]。本研究采用一种平行叉指电极的柔性聚对二甲苯芯片,提高DNA的转染效率,增加目的蛋白表达,有效刺激小鼠产生较强的免疫应答,现报道如下。
1 材料与方法
1.1 实验材料
1.1.1 实验试剂 质粒提取试剂盒[天根生化科技(北京)有限公司],透明质酸酶(SIGMA公司),DMEM培养基(Hyclone公司),胎牛血清(Gibco公司),酶标板和细胞培养板(Corning公司)。硅片(天津西力卡公司),PDMS(聚二甲基硅氧烷)(道康宁公司),光刻胶(苏州瑞红电子化学品有限公司),GFP质粒(北京大学分子医学研究所赵德尧博士惠赠)。
1.1.2 实验动物与细胞系 雌性BALB/C小鼠,体质量18~25 g,购自北京维通利华生物技术有限公司;HEK293 购自北京协和细胞库。
1.1.3 主要仪器 电穿孔仪ECM 830(美国BTX公司),高速冷冻离心机(德国艾本德股份公司)。紫外光刻机(德国SUSS公司),反应等离子体刻蚀机RIE-200(德国SENTECH公司),PDS2010聚对二甲苯涂层系统(美国NIST 公司), Nanodrop 2000 (美国Thermo scientific 公司)。
1.2 实验方法
1.2.1 柔性聚对二甲苯芯片的制备 采用微机电系统(micro-electro-mechanical system,MEMS)技术加工柔性聚对二甲苯芯片,基本操作过程如下:在直径为13.3 cm圆形硅片上涂一层10 μm厚的聚对二甲苯薄膜作为基底,聚对二甲苯薄膜上溅射一层30 nm厚的金属铬作为聚对二甲苯薄膜和金之间的黏接层。金属铬上溅射0.1 μm的金作为种子层,种子层上涂一层15 μm厚的光刻胶作为掩膜层,光刻后在种子层上电镀12 μm厚的金作为电极。为避免电镀过程中光刻胶脱落,采用六甲基二硅氮烷 (hexamethyl-disilazane,HMDS)来增强光刻胶和种子层之间的黏结强度。电镀结束依次用硝酸和氧等离子体去除光刻胶。分别用碘化钾溶液和硝酸铈铵溶液对整个贴片进行处理,将多余的金/铬种子层去除。在去离子水中将柔性聚对二甲苯衬底芯片从硅片上剥离。
1.2.2 PD-1 质粒提取pCDNA3.1-PD-1-his 质粒由北京科诺信诚生物有限公司提供。取2 μL质粒转化100 μL DH5α感受态细胞,42 ℃加热90 s, 冰中放置2 min。加入900 μL 液态LB培养基,200 r·min-1,37 ℃振荡培养60 min。涂于含有氨苄的固态LB培养基,37 ℃过夜培养。次日,挑取单菌落,接种于5 mL含氨苄的液态LB 培养基,振荡培养过度。接种到200 mL 液态LB培养基,振荡培养12 h。收集菌液,室温8000 r·min-1,离心2 min,彻底去除上清。按质粒提取试剂盒操作说明书提取质粒,Nanodrop 2000核酸定量仪检测核酸浓度,保存于-20 ℃备用。
1.2.3 HEK293细胞转染实验 人肾上皮细胞系293(human embryonic kidney 293 cells,HEK293)培养于DMEM培养基,含1%的双抗(青霉素,链霉素),10%的胎牛血清,细胞生长至对数期,收集细胞。细胞离心1000 r·min-1,5 min。用艾本德电穿孔缓冲液重悬细胞,调整细胞密度为2×106个·mL-1,然后加入GFP质粒(2 g·L-1) 终浓度为20 mg·L-1,混合均匀。取20 μL 混合物滴加入柔性聚对二甲苯衬底芯片表面,并给予3个脉冲,电压60 V,脉宽0.1 ms, 两次脉冲间隔2 s。将电转后的混合物转入含有200 μL 培养基的微孔板中,放置37 ℃,5%的二氧化碳培养箱中培养。
1.2.4 动物活体电穿孔实验 取15只BALB/C小鼠,雌性,6~8周,随机分为3组,每组5只。第一组,注射质粒,不电转;第二组:注射质粒,低电压100 V·cm-2电转;第三组:注射质粒,高电压200 V·cm-2电转。实验前1 d,采用商品化的脱毛膏,对小鼠脱毛预处理。实验时,在小鼠大腿上部肌肉注射透明质酸酶,每只20 μL,作用20 min。取PD-1质粒0.5 mL,注射至透明质酸酶处理部位,10 min后进行电穿孔。3%戊巴比妥钠麻醉小鼠,每只30 μL。将柔性聚对二甲苯芯片,紧密贴合至小鼠后腿上部,芯片正负极连接至电穿孔仪ECM 830。调整电穿孔参数如下:0 V·cm-2, 100 V·cm-2和200 V·cm-2,分别进行2次电转,间隔1 min,每次5个脉冲,脉宽20 ms,脉冲间隔2 s。DNA免疫的周期:间隔7 d、7 d、10 d、10 d;从第4次免疫起,每次免疫后1周左右采血检测。第75 d、78 d再次进行电转, 1周后采血检测。
1.2.5 ELISA实验 取10 μg PD-1蛋白(1 g·L-1),用0.05M碳酸盐缓冲液pH9.6稀释至1 mg·L-1, 加入酶标板中,每孔100 μL,4 ℃孵育过夜;PBST 缓冲液洗1次,5%脱脂奶粉封闭,每孔100 μL,37 ℃孵育1 h后去除封闭液;小鼠血清均1∶1000稀释,加入酶标板中,每孔100μL ,37 ℃孵育1h;同时加入阳性对照(PD-1蛋白免疫的小鼠血清)。PBST 缓冲液洗3次,加入HRP标记的山羊抗小鼠二抗(1∶5000), 每孔100 μL,37 ℃孵育1 h,PBST洗5次。最后每孔加入100 μL TMB试剂避光显色10 min,每孔50 μL 2M H2SO4终止反应。测定450 nm处吸光值。
2 结果
本研究的流程主要包括3个部分:①柔性聚对二甲苯衬底芯片的制备;②HEK293细胞实验;③基于柔性芯片的活体电穿孔。
2.1 柔性聚对二甲苯衬底芯片的制备 用MEMS技术加工柔性微电极芯片,使用柔性较好的聚对二甲苯透明薄膜,同时可以作为金属电极的绝缘层。由于金具有很好的导电性和生物兼容性,所以选择金作为电极材料。作者设计的直角交叉式微电极,可以在微电极芯片形成均匀分布的电磁场。电极宽度和间隔分别为200 μm和500 μm。为了适应实验小鼠肿瘤和肌肉组织的大小,电极芯片的有效区域设计为100 mm3。
2.2 PD-1质粒提取 PD-1质粒构建谱图如图1所示。质粒提取过程,按照试剂盒说明书进行。Nanodrop 2000核酸定量仪检测核酸浓度,用无菌水调整质粒浓度为2 g·L-1。保存于-20 ℃备用。
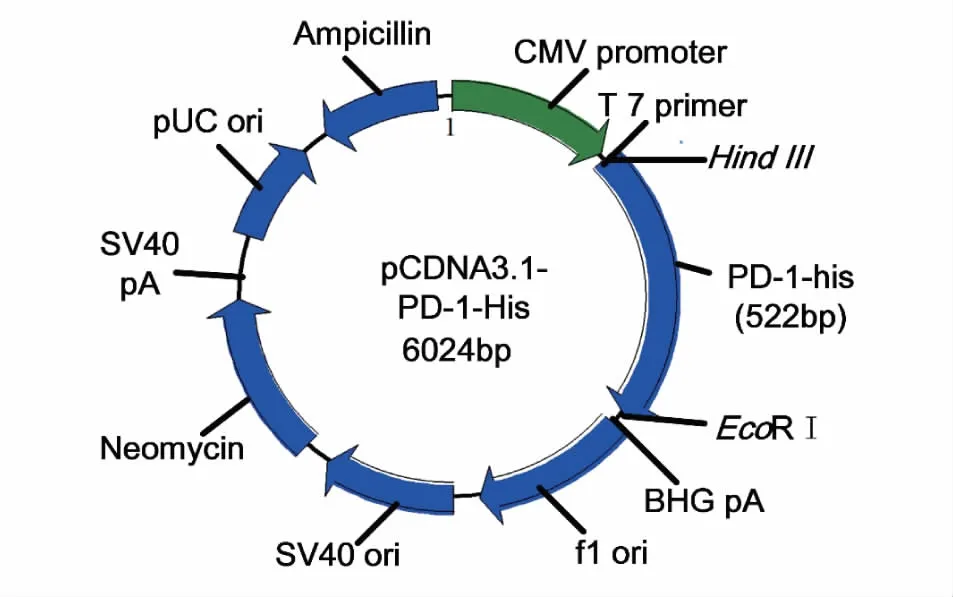
图1 PD-1质粒图谱 PD-1的C末端添加6×his标签
2.3 HEK293 细胞转染实验 为验证柔性聚对二甲苯芯片的可靠性,用HEK293细胞进行电转染实验。HEK293细胞转染GFP质粒后,接种于96孔板培养12 h,荧光显微镜观察GFP表达情况;如图2所示:GFP有明显表达,转染效率大约70%~80%左右。本实验说明,柔性聚对二甲苯芯片能够有效地转染质粒DNA至细胞内,并表达蛋白。

A:表示明场;B:表示488 nm激发荧光;物镜×10,标尺50 μm。BF:Bright Field, GFP:Green Fluorescent Protein。图2 HEK293细胞电转染GFP
2.4 抗PD-1抗体滴度检测 ELISA间接法检测抗PD-1抗体的滴度,分别在第4次免疫后1周(31 d)采血检测;第5次免疫后第1、2、3、4周(即41 d、48 d、56 d、63 d)采血检测;第75 d、78 d免疫后1周(85 d)采血检测。结果如图3所示:A 组不电转,检测不到抗体滴度;B、C两组施加电场,小鼠抗PD-1抗体滴度高于不施加电场的A组。高电场C组的抗体滴度高于低电场B组。本组实验说明,柔性聚对二甲苯衬底芯片能够转染质粒DNA至活体动物细胞,激发免疫应答;通过增加的电场强度,可以提高转染的效率,从而提升血清中抗PD-1抗体的滴度。第5次免疫后的2周,血清滴度达到峰值;第3、4周血清滴度持续降低。并于第75 d、78 d连续两次加强免疫,1周后(85 d)采血检测滴度仍持续下降。

A组:注射质粒,不电转;B组:注射质粒,100 V·cm-2电压;C组:注射质粒,200 V·cm-2电压;D组:阳性对照,PD-1蛋白免疫血清。图3 小鼠免疫血清滴度
3 讨论
电穿孔技术,通过瞬时电场使细胞膜形成微孔,使细胞胞外物质在电场作用下,经过电渗或离子电泳的作用,增加细胞摄取DNA,从而提高转染效率[15]。目前,电穿孔技术广泛应用于细胞的转染,而且在临床的基因治疗方面,可以增强免疫效果,成为DNA免疫重点研究的方向[16-18]。
活体电穿孔技术在DNA转染中,仍然有许多限制的条件,比如:免疫的周期、电穿孔脉冲参数、DNA体内的降解等。在微电极芯片基底材料选择上,本研究使用柔韧性较好的聚对二甲苯透明薄膜,让芯片上的电极与具有不同表面轮廓的活体组织紧密接触。同时,聚对二甲苯可以充当金属电极间的绝缘层。电极材料选择上,本研究采用导电性和生物兼容性的金作为电极。基于此设计的直角交叉式柔性微电极,在整个芯片电极区域形成均匀分布的电磁场。
HEK293细胞电转染GFP 证明本方法能够有效转染质粒DNA进入细胞内,活体动物实验也表明本方法可以有效转染PD-1质粒并有效表达,刺激机体免疫系统产生高效价的抗体。本研究中质粒DNA免疫5次停止后,血清中抗PD-1抗体滴度持续下降,推测可能由于PD-1质粒DNA在机体内持续表达蛋白,作为内源性抗原,形成免疫耐受,也可能由于内源性抗原诱导细胞免疫应答从而抑制了体液免疫应答。
本研究成功研制的柔性聚对二甲苯微电极芯片,可以有效地提高DNA活体转染效率,为基因免疫治疗后续工作奠定良好的基础。
[1] Okazaki T,Honjo T.PD-1 and PD-1 ligands: from discovery to clinical application[J].Int Immunol,2007,19(7):813-824.
[2]Keir ME,Butte MJ,Freeman GJ,et al.PD-1 and its ligands in tolerance and immunity[J].Annu Rev Immunol,2008,26(1):677-704.
[3]Sharpe AH,Wherry EJ,Ahmed R,et al. The function of programmed cell death 1 and its ligands in regulating autoimmunity and infection[J].Nat Immunol,2007,8(3):239-245.
[4]Paterson AM,Brown KE,Keir ME,et al.The programmed death-1 ligand 1:B7-1 pathway restrains diabetogenic effector T cells in vivo[J].J Immunol,2011,187(3):1097-1105.
[5]Mahoney KM,Freeman GJ,McDermott DF. The next immune-checkpoint inhibitors: PD-1/PD-L1 blockade in melanoma[J].Clin Ther,2015,37(4):764-782.
[6]Sehgal A,Whiteside TL,Boyiadzis M.Programmed death-1 checkpoint blockade in acute myeloid leukemia[J].Expert Opin Biol Ther,2015,15(8):1191-1203.
[7]He J,Hu Y,Hu M,et al.Development of PD-1/PD-L1 pathway in tumor immune microenvironment and treatment for non-small cell lung cancer[J].Sci Rep,2015,5:13110.
[8]Chen N,Fang W,Zhan J,et al.Upregulation of PD-L1 by EGFR activation mediates the immune escape in EGFR-driven NSCLC:implication for optional immune targeted therapy for NSCLC patients with EGFR mutation[J].J Thorac Oncol,2015,10(6):910-923.
[9]Dong Y,Sun Q,Zhang X.PD-1 and its ligands are important immune checkpoints in cancer[J].Oncotarget,2017,8(2):2171-2186.
[10]Geng S,Qian S,Pan Z,et al.Preparation of monoclonal antibodies against SpiC protein secreted by T3SS-2 of salmonella spp[J].Monoclon Antib Immunodiagn Immunother,2015,34(6):432-435.
[11]Khademi F,Mostafaie A,Parvaneh S,et al.Construction and characterization of monoclonal antibodies against the extracellular domain of B-lymphocyte antigen CD20 using DNA immunization method[J].Int Immunopharmacol,2017,43:23-32.
[12]Wu M,Zhao D,Zhong W,et al.High-density distributed electrode network, a multi-functional electroporation method for delivery of molecules of different sizes[J].Sci Rep,2013,3(7477):3370.
[13]Lambricht L,Lopes A,Kos S,et al.Clinical potential of electroporation for gene therapy and DNA vaccine delivery[J].Expert Opin Drug Deliv,2016,13(2):295-310.
[14]Vandermeulen G,Vanvarenberg K, De Beuckelaer A,et al.The site of administration influences both the type and the magnitude of the immune response induced by DNA vaccine electroporation[J].Vaccine,2015,33(28):3179-3185.
[15]Wei Z,Li Z.Continuous cell electroporation for efficient DNA and siRNA delivery based on laminar microfluidic chips[M]//Li S,Cutrera J,Heller R,et al.Electroporation protocols:preclinical and clinical gene medicine.New York: Springer New York,2014:99-110.
[16]De Vry J,Vanmierlo T,Martnez-Martinez P,et al.Delivery of DNA into the central nervous system via electroporation[M]//Li S,Cutrera J,Heller R,et al.Electroporation protocols:preclinical and clinical gene medicine.New York:Springer New York,2014:157-163.
[17]Lee SH,Danishmalik SN,Sin JI.DNA vaccines, electroporation and their applications in cancer treatment[J].Hum Vaccin Immunother,2015,11(8):1889-1900.
[18]Nilsson C,Hejdeman B,Godoy-Ramirez K,et al.HIV-DNA given with or without intradermal electroporation is safe and highly immunogenic in healthy Swedish HIV-1 DNA/MVA vaccinees:a phase I randomized trial[J].PLoS One,2015,10(6):e0131748.
Improving Transfection Efficiency of PD-1 Plasmid DNA Based on Electroporation in Vivo of A Flexible Microelectrodes Chip
ZHANG Wei-kai1, HU Zhi-yuan2, LI Zhi-tao1
(Medical College,Henan University of Science and Technology, Luoyang 471000, China; National Center for Nanoscience, Beijing 100190, China)
ObjectiveTo develop a flexible microelectrodes chip improving transfection efficiency of PD-1 plasmid DNA.MethodsThe microelectrodes with a flexible substrate was fabricated based on micro-electro-mechanical system (MEMS). To verify the reliability of microelectrodes, GFP plasmid was employed to transfect HEK293 cells in vitro with electroporation. Then the electroporation experiments of PD-1 plasmid were performed with live animals in vivo. The BALB/C mice were divide into three groups (five mice per group) and exposed to different voltages, 0 V·cm-2, 100 V·cm-2, 200 V·cm-2respectively. The serum titers of PD-1 antibody were measured by indirect ELISA on different time points.ResultsBased on electroporation of flexible microelectrodes chip, GFP plasmid were efficiently delivered into HEK293 cell and express protein. PD-1 antibodies, which were derived from mice serum after 2 weeks of the fifth immunization, were reached to peak in vivo experiments.ConclusionThe electroporation based on flexible microelectrodes chip could improve the efficiency of DNA transfection and enhance the immune response in vivo.
electroporation; DNA transfection;programmed death-1
1672-688X(2017)02-0081-04
10.15926/j.cnki.issn1672-688x.2017.02.001
科技部863计划(2015AA020408)
2017-05-02
1.河南科技大学医学院,河南洛阳471003 2.国家纳米科学中心,北京 100190
张卫凯(1988—),男,河南开封人,从事免疫学应用研究。
李智涛,男,副教授,E-mail:lizhitao@haust.edu.cn
R392-33
A

