玉米大斑病菌STK1与EGFP融合基因载体的构建及其在毕赤酵母中的表达
张运峰
玉米大斑病菌与融合基因载体的构建及其在毕赤酵母中的表达
张运峰
唐山师范学院生命科学系,河北唐山 063000

张运峰. 玉米大斑病菌STK1与EGFP融合基因载体的构建及其在毕赤酵母中的表达. 生物工程学报, 2017, 33(6): 986–994.Zhang YF. Construction of Setosphaeria turcica STK1-EGFP fusion gene vector and its expression in Pichia pastoris. Chin J Biotech, 2017, 33(6): 986–994.
基因是玉米大斑病菌调控分生孢子发育、渗透胁迫调节和致病性的重要MAPK基因。本文首先构建了含有增强型绿色荧光蛋白基因 () 的毕赤酵母GSS115 (GS115) 表达载体pPIC3.5K-EGFP,再以玉米大班病菌模式菌株01-23的菌丝cDNA为模板,PCR扩增基因,克隆到pPIC3.5K-EGFP,构建了融合基因的GS115表达载体pPIC3.5K-STK1-EGFP。利用电击转化法将该融合基因表达载体转化到GS115感受态细胞内,利用MD培养基筛选、PCR鉴定,获得了融合基因的毕赤酵母转化子。通过RT-PCR和荧光观察,发现基因和基因均可以高效稳定地表达。另外,在试验中我们还发现,在基因起始密码子前加入Kozak序列可以使融合基因的表达强度增强4.8倍。以上研究结果为基因表达蛋白的亚细胞功能定位和抗体制备奠定了基础。
玉米大斑病菌,融合基因,毕赤酵母,基因表达
玉米大斑病菌是玉米上一种重要的病原真菌,由其引起的玉米大斑病是玉米上的重要叶部病害,在流行年份常造成50%的减产损失[1]。植物病原真菌促分裂原活化蛋白激酶(Mitogen activated protein kinase,MAPK) 信号途径是重要的信号途径,主要参与调控植物病原真菌的生长、发育及致病性等[2-4]。基因是玉米大斑病菌中一个重要的MAPK基因,前期研究表明该基因主要参与调控玉米大斑病菌分生孢子的发育、渗透胁迫调节、分生孢子萌发、附着胞产生和致病性等[5]。毕赤酵母表达系统是一种成熟的蛋白表达系统,表达蛋白能够正确折叠并行使功能[6]。
基因是玉米大斑病菌MAPK信号传导途径中的关键基因[7],但对于研究STK1蛋白的结构及细胞内功能定位目前尚无报道。本实验通过构建适于毕赤酵母GS115中稳定、高效表达融合基因的甲醇诱导型表达载体,为进一步制备STK1蛋白结晶体及其抗体、明确STK1蛋白的功能定位奠定基础。
1 材料
1.1 菌株和质粒
菌株:毕赤酵母GS115 (GS115) 和玉米大斑病菌模式菌株01-23由河北农业大学董金皋教授惠赠。
质粒:酵母表达载体pPIC3.5K和增强型绿色荧光蛋白表达载体pEGFP-N1由南开大学生化与分子生物学实验室惠赠。
1.2 试剂
TMDNA聚合酶、Pyrobest高保真DNA聚合酶、T4 DNA连接酶、酵母基因组DNA提取试剂盒等购自TaKaRa公司;真菌总RNA快速抽提试剂盒、M-MuLV逆转录酶,YNB、生物素、甘油、甲醇和无水乙醇等试剂均购自BBI公司。
PCR扩增和等基因的引物由BBI公司合成 (表1)。
2 方法
2.1 玉米大斑病菌基因cDNA的克隆
玉米大斑病菌模式菌株01-23的总RNA提取和第一条链的合成参照王梅娟等[8]的试验方法进行,然后以获得的cDNA为模板,分别利用引物对STK1-F1/STK1-R和STK1-F2/STK1-R扩增在起始密码子前不含有Kozak序列的基因 (STK1-A) 和在起始密码子前含有Kozak 序列的基因 (STK1-B)。PCR扩增体系:cDNA模板50 ng,10×缓冲液5 μL,dNTPs 4 μL,引物(10 μmol/L) 各2 μL,TMDNA聚合酶(5 U/μL) 0.25 μL,补ddH2O至50 μL。PCR反应条件:95 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1.5 min,30个循环;72 ℃保温10 min。琼脂糖凝胶电泳后回收并纯化扩增片段。
2.2 毕赤酵母表达载体的构建
以pEGFP-N1质粒为模板,利用引物EGFP-F和EGFP-R扩增基因,用RⅠ和Ⅰ双酶切后利用DNA连接酶将EGFP克隆入载体pPIC3.5K,构建基因载体pPIC3.5K-EGFP。将基因和pPIC3.5K- EGFP同时进行RⅠ和Ⅰ双酶切,然后利用连接酶将基因克隆入基因载体pPIC3.5K-EGFP,构建融合基因表达载体pPIC3.5K-STK1-EGFP。
2.3 毕赤酵母GS115菌株电击转化感受态细胞的制备、转化和筛选
毕赤酵母GS115菌株感受态细胞的制备、转化和筛选参照高炳淼等方法[9]。
2.4 酵母转化子的PCR鉴定
利用酵母基因组DNA提取试剂盒提取酵母转化子的基因组DNA,用和的特异引物进行PCR体系扩增:酵母DNA 40 ng,2.5 mmol/L MgCl21.5 μL,2.5 mmol/L dNTPs 1.5 μL,上下游引物 (10 μmoL/L) 各1.0 μL,10×PCR缓冲液2.0 μL,r0.2 μL,补足ddH2O至20 μL。在PCR仪上94 ℃预变性5 min;94 ℃变性30 s,退火30 s (m见表1),72 ℃延伸1.5 min,35个循环,72 ℃保温10 min。1%琼脂糖凝胶电泳后,用凝胶成像系统检测。
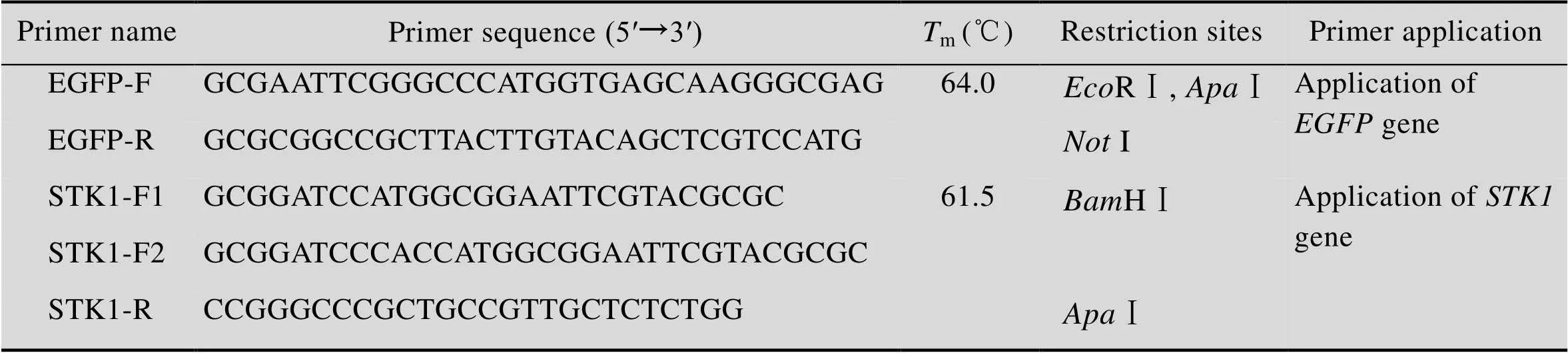
表1 试验用引物及其用途
2.5和基因表达的RT-PCR检测
参照Zuo等[10]的试验对转化子进行甲醇诱导表达。毕赤酵母菌总RNA的提取和第一条链的合成参照王梅娟等[8]的试验方法进行,然后以获得cDNA为模板进行EGFP和STK1序列的扩增检测,体系如下:cDNA模板5 μL,10×缓冲液2 μL,dNTPs 1.5 μL,STK1 (或EGFP) 上下游引物(10 μmol/L) 各1 μL,TMDNA聚合酶(5 U/μL) 0.15 μL,补ddH2O至20 μL。PCR反应条件:95 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1.5 min,30个循环;72 ℃ 10 min;4 ℃终止。经过电压4 V/cm的琼脂糖凝胶电泳20 min后,凝胶成像系统检测。
2.6和基因表达的荧光检测
用BMMY液体培养基培养酵母转化子,离心收集菌体,用磷酸盐缓冲液 (Phosphate buffered saline,PBS) 悬浮菌体,激光共聚焦荧光显微镜 (Olympus FV1200) 观察融合蛋白的荧光情况[11]并照相,利用ImageJ软件对酵母细胞的荧光强度进行分析,每个实验组选取100个酵母细胞[12]。
3 结果与分析
3.1和-融合基因载体的构建
通过提取玉米大斑病菌模式菌株01-23的总RNA反转获得的cDNA为模板,利用特异引物STK1-F1/STK1-R和STK1-F2/STK1-R进行PCR获得大约1 071 bp的STK1-A和含有Kozak序列的STK1-B基因序列;以pEGFP-N1为模板,利用基因特异引物进行PCR获得726 bp的绿色荧光蛋白的基因序列。首先将质粒pPIC3.5K和基因同时进行RⅠ和Ⅰ限制性内切酶酶切、回收和连接最终获得pPIC3.5K-EGFP质粒。再分别对STK1-A (或STK1-B) 基因和质粒pPIC3.5K-EGFP的RⅠ和Ⅰ酶切、回收和连接,获得了pPIC3.5K- STK1-EGFP(A) (或pPIC3.5K-STK1-EGFP(B)) 表达载体。经过对pPIC3.5K-EGFP、pPIC3.5K- STK1-EGFP(A) 和pPIC3.5K- STK1-EGFP (B) 表达载体的酶切鉴定,3种表达载体结构正确 (图1),经过生工生物工程 (上海) 股份有限公司测序,确定3种载体序列正确。
3.2 EGFP和STK1-EGFP酵母转化子筛选和鉴定
通过电击转化,分别将pPIC3.5K-EGFP、pPIC3.5K-STK1-EGFP(A) 和pPIC3.5K-STK1- EGFP(B) 表达载体转入毕赤酵母GS115中,通过在筛选培养基 (MD) 上的培养,获得GS115-EGFP、GS115-STK1-EGFP(A) 和含有KozaK序列的GS115-STK1-EGFP(B) 3种转化子。经过在组氨酸缺失的MD培养基培养,发现转化子的生长速度显著高于野生型,表明3种载体转入了酵母基因组中,并得到了正常表达 (图2A)。分别利用EGFP和STK1的引物对转化子进行PCR鉴定,结果显示GS115-EGFP转化子中能够获得717 bp左右的特异片段;GS115-STK1- EGFP(A)、GS115-STK1-EGFP(B) 转化子也能够扩增出1 071 bp左右的基因片段 (图2B)。
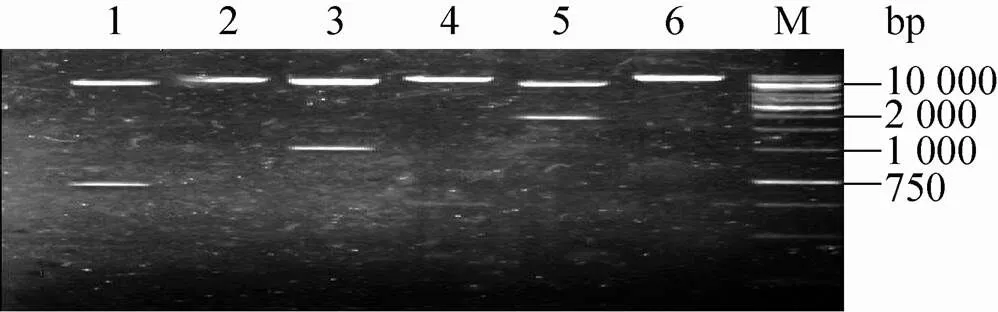
图1 质粒酶切鉴定

图2 酵母转化子的MD筛选(A) 和PCR (B)鉴定
3.3及-融合基因mRNA的检测
试验提取了酵母野生型GS115及其转基因转化子的总RNA,并通过Oligo(dT)18反转录成总cDNA。利用EGFP和STK1特异性引物分别对4种酵母总cDNA进行了检测,在酵母野生型GS115和GS115-EGFP转化子中没有检测到的mRNA,但是GS115-EGFP、GS115- STK1-EGFP(A) 和GS115-STK1-EGFP(B) 转化子中检测到了721 bp的基因(图3A),而在酵母野生型GS115和GS115-EGFP(A) 转化子中没有检测到基因的mRNA,但是GS115-STK1-EGFP (A) 转化子和GS115-STK1- EGFP(B) 转化子中检测到了大约1 071 bp的基因(图3B)。
3.4 STK1-EGFP融合蛋白在酵母中的荧光观察
3.4.1 Kozak序列对STK1-EGFP融合蛋白表达载体的影响
在激光共聚焦显微镜下观察GS115-STK1- EGFP(A) 和GS115-STK1-EGFP(B) 转化子发现,GS115-STK1-EGFP(B) 转化子的荧光强度显著高于GS115-STK1-EGFP(A) 转化子,利用Image J软件分析发现GS115-STK1-EGFP(B) 转化子绿色荧光强度约为前者的4.8倍。表明在融合基因起始密码子前加入Kozak序列(CCCACC) 显著增强了融合蛋白表达的强度(图4)。
3.4.2 STK1-EGFP融合蛋白在毕赤酵母中的荧光观察
分别在明场和蓝光激发的情况下观察转基因酵母的形态发现:GS115在激发条件下没有发现荧光,而GS115-EGFP和GS115-STK1- EGFP(B) 转化子的细胞中发现了清晰的绿色荧光,但是,与GS115-EGFP转化子相比,GS115- STK1-EGFP(B) 转化子的荧光在细胞内局部区域呈现集聚态 (图5)。以上结果表明了EGFP蛋白和STK1-EGFP融合蛋白在酵母细胞中得到了正确表达,且STK1融合EGFP蛋白后并未影响EGFP的结构和功能;GS115-STK1-EGFP(B) 转化子中荧光状态显著区别于GS115-EGFP转化子,推测是由于STK1蛋白与酵母中Hog1信号蛋白具有结构和功能相似性[6,13],STK1蛋白参与了Hog1信号蛋白的部分生理功能。
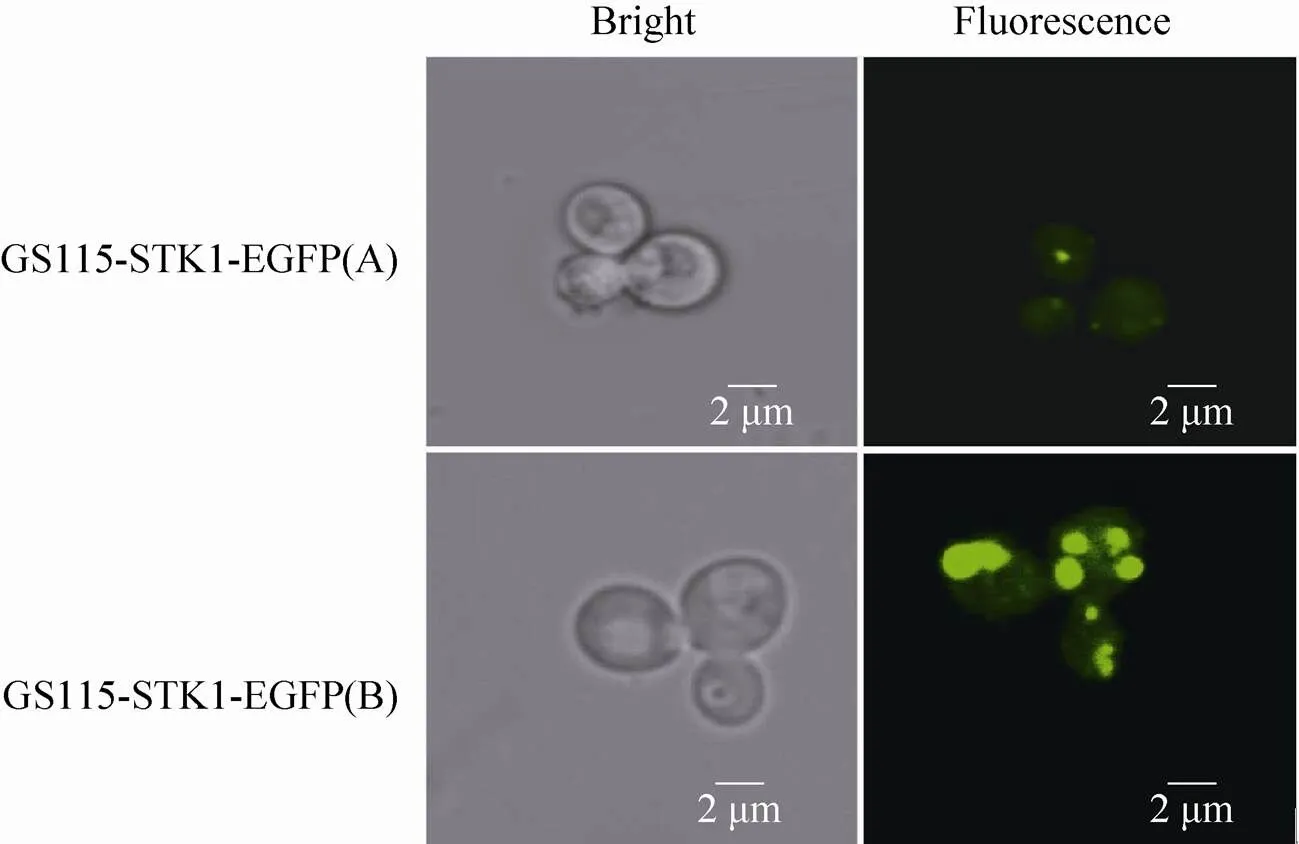
图4 Kozak序列对STK1-EGFP融合蛋白在酵母中表达荧光强度的影响

图5 不同转化子在明场和蓝光激发条件下的荧光结果
4 讨论
大量研究表明,在动物、植物、真菌中MAPK级联途径是一条重要的细胞信号传导途径[14],这些途径调控着组织形态发生、细胞增殖和分化以及适应性免疫等一系列生理反应[15-17]。在植物与病原真菌互作的过程中,病原真菌的MAPK 级联途径参与调控其致病相关的过程,其中包括病菌分生孢子形成、附着胞发育及其侵入与定殖等[18-19]。
本试验克隆了玉米大斑病菌基因,构建了基因和绿色荧光蛋白基因融合基因的表达载体pPIC3.5K-STK1-EGFP(A) 和含有Kozak序列的pPIC3.5K-STK1-EGFP(B),并经过了酶切鉴定和测序分析,证明了表达载体序列准确。然后通过电击转化和营养缺陷培养基 (MD培养基) 初步筛选出了对应的酵母转化子;利用对转化子基因组DNA中基因和基因的PCR扩增及其mRNA的RT-PCR检测,确定融合基因在插入了毕赤酵母基因组DNA中并能够正常转录;最后,试验利用激光共聚焦显微镜观察,发现融合基因表达蛋白在毕赤酵母细胞中发出绿色 荧光。
Kozak序列是提高基因表达的一个上游调控元件[20],能够调控起始翻译过程,并且能决定翻译效率[21]。本试验通过构建pPIC3.5K-STK1- EGFP(A) 和含有Kozak序列的pPIC3.5K-STK1- EGFP(B),并通过转化毕赤酵母,获得了相应的转化子GS115-STK1-EGFP(A) 和GS115-STK1- EGFP(B)。荧光显微镜观察显示GS115-STK1- EGFP(B) 转化子的荧光强度约是GS115-STK1- EGFP(A) 的4.8倍。表明构建融合基因表达载体pPIC3.5K-STK1-EGFP(B) 适用于毕赤酵母中诱导表达,且利于形成稳定、高效表达融合蛋白的转化子。
外源蛋白质在毕赤酵母中表达不仅可以用于蛋白功能的研究,而且在相关蛋白的晶体研究和抗体制备方面具有重要作用,例如张凯星等通过在酵母表达香蕉MaGBSSⅠ-3蛋白研究其生化特征[22];Huo等在毕赤酵母GS115中表达源于维氏气单胞菌几丁质酶Chi92基因并研究其活性[23];蔡立涛等[24]在毕赤酵母GS115中表达纳豆激酶 (NK) 基因用于制备NK的抗体。虽然利用毕赤酵母表达系统获得外源重组蛋白技术已经被广泛应用[25],但是研究发现毕赤酵母外源蛋白的产率较低[26-27]。Nocon等通过构建葡萄糖-6-磷酸脱氢酶 () 和葡糖酸内酯酶 () 过表达毕赤酵母转化子可以使酵母中人血超氧岐化酶 (hSOD) 的产率提高3.8倍[28]。在本研究中仅利用构建的含有Kozak序列的表达载体转化毕赤酵母,可以使GS115-STK1- EGFP(B) 转化子STK1-EGFP融合蛋白产率提高4.8倍。本研究将为我们明确玉米大斑病菌STK1蛋白的细胞功能定位、STK1蛋白抗体制备奠定了基础;为提高外源蛋白在毕赤酵母中产率的研究提供参考。
5 结论
本实验构建了适于在毕赤酵母GS115中表达的载体pPIC3.5K-EGFP和pPIC3.5K-STK1- EGFP,建立了适宜本实验要求的毕赤酵母转化体系,筛选出了酵母转化子;利用RT-PCR技术检测了诱导酵母菌的和基因的mRNA情况;利用激光共聚焦荧光显微镜在转基因酵母检测到STK1-EGFP融合蛋白的荧光信号,证明了STK1蛋白在GS115中稳定、高效表达。
[1] Zhang XX, Gao ZG, Zhou XK, et al.Identification of physiological races ofin northeastern China.Acta Agric Boreali-Sin, 2012, 27(3): 227–230 (in Chinese). 张秀霞, 高增贵, 周晓锟, 等. 东北地区玉米大斑病菌生理分化研究. 华北农学报, 2012, 27(3): 227–230.
[2] Wang N, Gu SQ, Fan YS, et al. Construction and expression of prokaryotic expression vector offrom. Sci Agric Sin, 2010, 43(18): 3876–3881 (in Chinese). 王宁, 谷守芹, 范永山, 等. 玉米大斑病菌原核表达载体的构建及其表达. 中国农业科学, 2010, 43(18): 3876–3881.
[3] Gong XD, Fan Y, Li P, et al. Localization ofofin the genome, characterization of its protein structure and expression in eukaryotic cells. Sci Agric Sin, 2013, 46(12): 2599–2606 (in Chinese).巩校东, 范钰, 李坡, 等. 玉米大斑病菌的基因组定位、蛋白质结构预测及其表达. 中国农业科学, 2013, 46(12): 2599–2606.
[4] Gu SQ. Cloning and functional analysis ofgenes regulating the growth, development and pathogenicity of[D]. Baoding: Agricultural University of Hebei Province, 2007 (in Chinese). 谷守芹. 调控玉米大斑病菌生长发育和致病性的基因的克隆与功能分析[D]. 保定: 河北农业大学, 2007.
[5] Zhang YF. Regulation ofgene on appressorium development and osmotic stress and construction of celluar-localized vector of[D]. Baoding: Agricultural University of Hebei Province, 2009 (in Chinese). 张运峰. 玉米大斑病菌基因对附着胞发育和渗透胁迫的调控及其细胞学定位载体构建[D]. 保定: 河北农业大学, 2009.
[6] Li P, Gu SQ, Shen S, et al., a MAP kinase gene from, confers preferable tolerance to sodium salt stress. Afr J Microbiol Res, 2012, 6(40): 6830–6837.
[7] Gong XD, Zhang XY, Tian L, et al. Genome-wide identification MAPK superfamily and establishment of the model of MAPK cascade pathway in. Sci Agric Sin, 2014, 47(9): 1715–1724 (in Chinese). 巩校东, 张晓玉, 田兰, 等. 玉米大斑病菌MAPK超家族的全基因组鉴定及途径模型建立. 中国农业科学, 2014, 47(9): 1715–1724.
[8] Wang MJ, Li P, Wu M, et al. Effect of hyperosmotic stress on the growth, development andexpression of. Sci Agric Sin, 2012, 45(19): 3965–3970 (in Chinese).王梅娟, 李坡, 吴敏, 等. 高渗胁迫对玉米大斑病菌生长发育及表达的影响. 中国农业科学, 2012, 45(19): 3965–3970.
[9] Gao BM, Tang TL, Zhangsun DT, et al. Conditions of high efficient electroporation transformation of. Chin J Mar Drugs, 2010, 29(2): 1–5 (in Chinese).高炳淼, 唐天乐, 长孙东亭, 等. 毕赤酵母高效电转化条件的研究. 中国海洋药物杂志, 2010, 29(2): 1–5.
[10] Zuo XH, Liu B, Gong X, et al. Expression of the mannosylated hLYZ/eGFP fusion protein inand subcellular localization in macrophages. Mil Med Sci, 2012, 36(4): 248–252 (in Chinese). 左小虎, 刘波, 巩新, 等. 甘露糖化hLYZ/eGFP融合蛋白的表达纯化及巨噬细胞定位. 军事医学, 2012, 36(4): 248–252.
[11] Wang XH. Expression of enhanced green fluorescent protein in DH5α. Food Sci, 2010, 31(21): 200–203 (in Chinese). 王晓辉. 增强型绿色荧光蛋白在DH5α大肠杆菌中的表达. 食品科学, 2010, 31(21): 200–203.
[12] Jiao MX, Mou YS, Bou G, et al. Research on key factors restricting efficiency of sperm-mediated gene transfer. Sci Agric Sin, 2014, 47(20): 4086–4095 (in Chinese). 焦明霞, 牟彦双, 格日乐其木格, 等. 精子介导的转基因效率关键影响因素. 中国农业科学, 2014, 47(20): 4086–4095.
[13] Wang CY, Zhuge B, Fang HY, et al. Cloning and characterization of anMAPK homologous genefrom. Acta Microbiol Sin, 2013, 53(10): 1103–1110 (in Chinese). 王晨莹, 诸葛斌, 方慧英, 等. 产甘油假丝酵母MAPK同源基因的克隆及特征分析. 微生物学报, 2013, 53(10): 1103–1110.
[14] Coulombe P, Meloche S. Atypical mitogen-activated protein kinases: structure, regulation and functions. Biochim Biophys Acta, 2007, 1773(8): 1376–1387.
[15] Pearson G, Robinson F, Gibson TB, et al. Mitogen-activated protein (MAP) kinase pathways: regulation and physiological functions. Endocr Rev, 2001, 22(2): 153–183.
[16] Madhala-Levy D, Williams VC, Hughes SM, et al. Cooperation between Shh and IGF-I in promoting myogenic proliferation and differentiation via the MAPK/ERK and PI3K/Akt pathways requires smo activity. J Cell Physiol, 2012, 227(4): 1455–1464.
[17] Wüthrich M, Deepe GS Jr, Klein B. Adaptive immunity to fungi. Annu Rev Immunol, 2012, 30: 115–148.
[18] Chen XX, Xu C, Qian Y, et al. MAPK cascade-mediated regulation of pathogenicity, conidiation and tolerance to abiotic stresses in the entomopathogenic fungus. Environ Microbiol, 2016, 18(3): 1048–1062.
[19] Kou YJ, Naqvi NI. Surface sensing and signaling networks in plant pathogenic fungi. Semin Cell Dev Biol, 2016, 57: 84–92.
[20] Petty AP, Dick CL, Lindsey JS. Translation of an atypical human cDNA requires fidelity of apurine-pyrimidine repeat region and recoding. Gene, 2008, 414(1/2): 49−59.
[21] Mohan RA, van Engelen K, Stefanovic S, et al. A mutation in the Kozak sequence ofhampers translation in a family with atrial septal defects. Am J Med Genet A, 2014, 164A(11): 2732–2738.
[22] Zhang KX, Miao HX, Xun PG, et al. Subcellular localization andexpression of MaGBSS I-3 from banana (). Genom Appl Biol, 2016, 35(4): 963–969 (in Chinese). 张凯星, 苗红霞, 孙佩光, 等. 香蕉() MaGBSSⅠ-3蛋白的亚细胞定位及其在毕赤酵母中的表达. 基因组学与应用生物学, 2016, 35(4): 963–969.
[23] Huo FM, Ran C, Yang YL, et al. Gene cloning, expression and characterization of an exo-chitinase with high β-glucanase activity fromB565. Acta Microbiol Sin, 2016, 56(5): 787–803 (in Chinese). 霍凤敏, 冉超, 杨雅麟, 等. 一种具有高β-葡聚糖酶活性的几丁质外切酶基因的克隆、表达和性质鉴定. 微生物学报, 2016, 56(5): 787–803.
[24] Cai LT, Xu X, Wang TT, et al. Expression, purification of nattokinase inand preparation of its polyclonal antibody. Chin J Biochem Pharm, 2010, 31(1): 10–13 (in Chinese). 蔡立涛, 徐祥, 王婷婷, 等. 纳豆激酶基因在毕赤酵母中的表达纯化及抗体制备. 中国生化药物杂志, 2010, 31(1): 10–13.
[25] Gasser B, Prielhofer R, Marx H, et al.: protein production host and model organism for biomedical research. Future Microbiol, 2013, 8: 191–208.
[26] Heyland J, Fu J, Blank LM, et al. Carbon metabolism limits recombinant protein production in. Biotechnol Bioeng, 2011, 108: 1942–1953.
[27] Jorda J, Jouhten P, Camara E, Maaheimo H, Albiol J, Ferrer P. Metabolic flux profiling of recombinant protein secreting Pichia pastoris growing on glucose:methanol mixtures. Microb Cell Factories, 2012, 11: 57.
[28] Nocon J, Steiger M, Mairinger T, et al. Increasing pentose phosphate pathway flux enhances recombinant protein production in Pichia pastoris. Appl Microbiol Biotechnol, 2016, 100(13): 5955–5963.
(本文责编 郝丽芳)
Construction offusion gene vector and its expression in
Yunfeng Zhang
Department of Life Sciences, Tangshan Normal University, Tangshan 063000, Hebei, China
is one important MAPK gene regulating the conidial development, osmotic stress and pathogenicity of Setosphaeria turcica. At first, theGS115 expression vector pPIC3.5K-EGFP containing enhanced green fluorescent protein gene () was constructed, thengene was first amplified by PCR with the template of cDNA ofmodel isolate 01-23, and then cloned into the vector pPIC3.5K-EGFP with enhanced green fluorescent protein gene () to construct thefusion gene expression vector pPIC3.5K-STK1-EGFP. The vector was transformed into the susceptible cells ofGS115 by electric shock process, and the transformants were identified by MD medium screening and PCR determination. Thegene andgene could be expressed effectively and stably in the transformants as detected by RT-PCR and fluorescence observation. In addition, we also found that the Kozak sequence before the start codon ofgene could increase 4.8 folds expression level offusion gene. The above research results laid a good foundation for subcellular localization and antibody preparation of STK1 protein.
,fusion gene,, gene expression
10.13345/j.cjb.160406
October 28, 2016; Accepted:April 14, 2017
Yunfeng Zhang. Tel: +86-315-3863376; E-mail: zyfikx@126.com
Supported by: Science and Technology Research Project of Hebei Higher Education (No. QN2017415), Natural Science Foundation of Hebei Province (No. C2014105067), Hebei Overseas Students Science and Technology Activities Merit Aid Projects (No. C2015005009), Science Research Foundation of Tangshan Normal University (Nos. 2016C05, 2014E04).
河北省高等学校科学技术研究项目 (No. QN2017415),河北省自然科学基金 (No. C2014105067),河北省留学人员科技活动择优资助项目(No. C2015005009),唐山师范学院科学研究基金 (Nos. 2016C05, 2014E04) 资助。
网络出版时间:2017-05-03
http://kns.cnki.net/kcms/detail/11.1998.Q.20170503.1704.008.html

