多西他赛联合阿帕替尼二线治疗非鳞癌非小细胞肺癌的有效性及安全性分析
郭运杰 井小会
多西他赛联合阿帕替尼二线治疗非鳞癌非小细胞肺癌的有效性及安全性分析
郭运杰 井小会
目的:观察多西他赛联合阿帕替尼二线治疗晚期非鳞癌非小细胞肺癌的疗效及安全性。方法:选取2015年2月至2016年8月平顶山市第一人民医院收治的符合标准的晚期非小细胞肺癌患者39例,随机进入研究组和对照组。研究组接受多西他赛60 mg/m2,d1,甲磺酸阿帕替尼500 mg/d,d1~21,21 d为1个周期。对照组接受多西他赛单药化疗,直到疾病进展(progressive disease,PD)或不良反应不可耐受。分析两组患者的疾病控制率(disease control rate,DCR)、不良事件发生率、无进展生存时间(progression-free survival,PFS)。结果:中位随访时间4.6个月,研究组和对照组的DCR率分别为63.2%和30.0%,两组比较具有统计学意义(P=0.039);研究组最常见的3~4级不良事件为血液学毒性(47.3%),与对照组(15%)比较差异具有统计学意义(P=0.032)。研究组和对照组的中位PFS分别为5.6个月(95%CI:4.8~6.3)和3.0个月(95%CI:1.8~4.1),两者比较差异有统计学意义(χ2=4.17,P=0.04)。结论:多西他赛联合阿帕替尼二线治疗晚期非鳞癌非小细胞肺癌不良反应可控,可显著提高DCR及PFS。
多西他赛 阿帕替尼 非小细胞肺癌 血管生成
肺癌为世界范围内常见的恶性肿瘤之一,其中非小细胞肺癌约占80%,大部分患者最终出现复发或转移[1]。含铂类双药联合化疗为晚期非小细胞肺癌的一线标准治疗手段,多西他赛单药为二线标准方案选择,其有效率不足10%,中位总生存时间仅为5~8个月[2-3]。如何提高二线治疗的有效率及改善患者生存是目前的研究方向,其中化疗联合抗血管生成治疗成为研究热点之一[4]。阿帕替尼为新型小分子血管内皮生长因子受体抑制剂,具有很强的抗血管生成活性,具有给药方便、依从性好的特点,已在胃癌中显示了良好疗效[5]。本研究探索多西他赛联合阿帕替尼作为二线治疗方案在晚期非鳞癌非小细胞肺癌中的疗效及安全性。
1 材料与方法
1.1 一般资料
选取2015年2月至2016年8月平顶山市第一人民医院收治的符合标准的晚期非小细胞肺癌患者39例,采用随机数字表法随机分为研究组及对照组。两组患者的基线特征基本相当:研究组和对照组的中位年龄分别为61(33~72)岁和58(36~75)岁,男女比例分别为10/9和10/11,腺癌/非腺癌分别为18/1和20/0,EGFR阳性/阴性(未知)分别为6/13和8/12。
入组标准:经组织学证实的复发转移性非鳞癌非小细胞肺癌患者,接受含铂类方案化疗或小分子酪氨酸激酶抑制剂(TKI)治疗后进展,ECOG评分0~1分。排除标准:接受过含多西他赛或贝伐单抗治疗,脑转移,高血压未控,肝肾功能不全,有出血倾向或正接受抗凝治疗者。本研究通过平顶山市第一人民医院伦理委员会审查批准,所有患者治疗前被告知目前标准治疗方案及替代治疗方案并签署知情同意书。
1.2 方法
1.2.1 治疗方案 研究组:多西他赛60 mg/m2,静滴60 min,d1,甲磺酸阿帕替尼500 mg/d,口服,d1~21,21 d为1个周期。对照组:多西他赛60 mg/m2,静滴60 min,d1,21 d为1个周期。直到疾病进展或不良反应不可耐受。多西他赛给药前常规应用地塞米松预处理。所有患者均接受最佳支持治疗。出现3级白细胞或血小板降低者下个周期化疗第5 d开始行重组人粒细胞刺激因子或血小板生成素治疗。出现4级血液学不良反应者除以上支持治疗外,下个周期化疗剂量降低25%。如出现3~4级阿帕替尼相关不良事件,则阿帕替尼减量至250 mg/d。
1.2.2 疗效评价及不良反应评价标准 采用RECIST 1.1版进行疗效评价,分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(PD)。客观缓解率(objective response rate,ORR)为CR+PR所占的比例。疾病控制率(disease control rate,DCR)为CR+PR+SD所占的比例。治疗中每2个周期复查CT进行疗效评价。不良事件的分级采用CTCAE v4.0标准进行评价。本研究的主要终点为无进展生存期(progression-free survival,PFS),次要终点为安全性及疾病控制率。
1.3 统计学分析
采用SPSS 22.0对数据进行统计学分析,频数资料用百分率(%)表示,频数资料组间比较采用χ2检验,计量资料采用x±s描述。生存分析采用Kaplan-Meier法,生存期组间比较采用Log-rank法,以P<0.05为差异具有统计学意义。
2 结果
2.1 近期疗效
研究组中位化疗6(1~21)个周期,阿帕替尼中位口服4.8(1~17.5)个月,对照组中位化疗4.5(1~18)个周期。两组均无患者达到CR。研究组和对照组的ORR分别为31.6%和10.0%(χ2=2.78,P=0.10),DCR分别为63.2%和30.0%(χ2=4.31,P=0.039,表1)。2.2 不良事件及安全性分析
研究组最常见的不良反应为3~4级血液学毒性。研究组和对照组3~4级血液学毒性分别为47.3%和15.0%,两者比较差异有统计学意义(χ2=4.79,P=0.032)。研究组中手足综合症2例、蛋白尿2例、出血3例、高血压1例,均为1~2级(表2)。

表1 研究组和对照组的近期疗效比较Table 1 Comparison of the recent effect in two arms n(%)

表2 两组患者不良事件比较Table 2 Comparison of adverse events in two arms n(%)
2.3 随访及无进展生存
中位随访4.6个月。研究组6例患者需化疗剂量减量,3例患者阿帕替尼减量至250 mg/d,没有治疗相关性死亡。研究组和对照组的中位PFS分别为5.6个月(95%CI:4.8~6.3)和3.0个月(95%CI:1.8~4.1),两者比较差异有统计学意义(χ2=4.17,P=0.04,图1)。
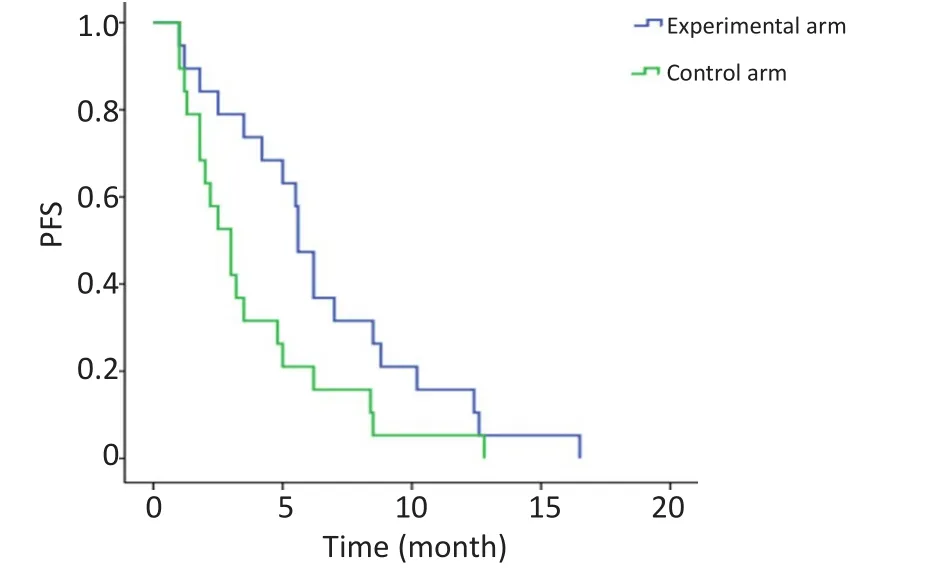
图1 两组患者的PFSFigure 1 PFS in two groups of patients
3 讨论
已在大多数肿瘤中发现血管内皮生长因子(vas⁃cular endothelial growth factor,VEGF)过表达,包括非小细胞肺癌[6]。研究认为,VEGF与肿瘤生长、复发、转移有关[7]。血管内皮生长因子受体(VEGFR)家族包括VEGFR-1、VEGFR-2、VEGFR-3等,VEGF/VEG⁃FR信号通路在生理及病理性血管再生过程中起关键作用,VEGF/VEGFR信号通路的激活与肿瘤细胞的存活、增殖、迁移及分化密切相关[6-7]。VEGFR-2主要表达于内皮细胞,在调节细胞有丝分裂、血管生成中起重要作用,因此,VEGFR-2被认为与肿瘤血管生成关系最为密切[8]。阿帕替尼为新型口服小分子抗血管生成药物,对血管内皮生长因子受体-2(VEGFR-2)有高度亲和性,通过与VEGFR-2结合,竞争性抑制VEGF与VEGFR-2结合及VEGFR-2自动磷酸化,从而发挥抗血管生成作用,抑制肿瘤生长[8]。
国外有多个研究证明,化疗联合抗血管生成治疗可提高晚期非小细胞肺癌的疗效[9-11]。REVEL研究为一随机对照Ⅲ期临床研究,该研究中多西他赛联合抗血管生成药物雷莫芦单抗二线治疗非鳞癌非小细胞肺癌的中位PFS为4.5个月,较多西他赛单药的3.0个月显著提高,并可显著提高中位总生存(10.5个月vs.9.1个月)[9]。本研究中,多西他赛联合阿帕替尼在晚期非鳞癌非小细胞肺癌的二线治疗中显示出良好效果。研究组和对照组的DCR分别为63.2%和30.0%,两组的中位PFS分别为5.2个月和3.1个月,差异具有统计学意义。因本研究样本量较少,ORR比较无统计学意义。既往的Ⅲ期临床研究中,多西他赛单药二线治疗的ORR为7%~9%,中位PFS为2~3个月,同本研究的数据一致。
值得注意的是,多西他赛联合阿帕替方案的血液学毒性及非血液学毒性均有所提高。3~4级中性粒细胞减少和血小板减少的发生率分别为31.5%和15.7%,为化疗减量的主要原因。15.7%的患者出现3级及以上的乏力,为阿帕替尼减量的主要原因。阿帕替尼相关的其他不良反应如高血压、蛋白尿、出血均为1~2级。REVEL研究中,多西他赛联合雷莫芦单抗的3级及以上中性粒细胞减少达49%,对照组为40%,两组各有5%和6%治疗相关性死亡,明显高于本研究数据[9],基于此将多西他赛及阿帕替尼设定为相对较低剂量,联合治疗的不良反应总体可控。
综上所述,多西他赛联合阿帕替尼可显著提高非小细胞肺癌二线治疗的疗效,使DCR及中位PFS显著提高;同时,阿帕替尼联合治疗的不良事件相对增多,通过减少剂量及积极对症支持治疗均可控制。多西他赛联合阿帕替尼作为晚期非鳞癌非小细胞肺癌的二线治疗值得进一步研究。
[1] Reck M,Popat S,Reinmuth N,et al.Metastatic non-small-cell lung cancer(NSCLC):ESMO Clinical Practice Guidelines for diagnosis,treatment and follow-up[J].Ann Oncol,2014,25(Suppl 3):iii27-39.
[2] Bunn PA Jr,Thatcher N.Systemic treatment for advanced(stageⅢb/Ⅳ)non-small cell lung cancer:more treatment options;more things to consider[J].Oncologist,2008,13(Suppl 1):37-46.
[3] Hanna N,Shepherd FA,Fossella FV,et al.Randomized phase III trial of pemetrexed versus docetaxel in patients with non-small-cell lung cancer previously treated with chemotherapy[J].J Clin Oncol,2004,22(9):1589-1597
[4] Majem M,Pallare's C.An update on molecularly targeted therapies in second and third-line treatment in non-small cell lung cancer:focus on EGFR inhibitors and anti-angiogenic agents[J].Clin Transl Oncol,2013,15(5):343-357
[5] Geng R,Li J.Apatinib for the treatment of gastric cancer[J].Expert Opin Pharmacother,2015,16(1):117-122.
[6] Kris MG,Johnson BE,Berry LD,et al.Using multiplexed assays of oncogenic drivers in lung cancers to select targeted drugs[J].JAMA,2014,311(19):1998-2006.
[7] Sandler A,Gray R,Perry MC,et al.Paclitaxel-carboplatin alone or with bevacizumab for non-small-cell lung cancer[J].N Engl J Med,2006,355(24):2542-2550.
[8] Yan TY,Peng F.Clinical research advances of apatinib in the treatment of malignancies[J].Chin J Clin Oncol,2016,43(12)545-548.[涂艳,彭枫,阿帕替尼治疗恶性肿瘤的临床研究进展[J].中国肿瘤临床,2016,43(12):545-548].
[9] Garon EB,Ciuleanu TE,Arrieta O,et al.Ramucirumab plus docetaxel versus placebo plus docetaxel for second-line treatment of stage IV non-small-cell lung cancer after disease progression on platinum-based therapy(REVEL):a multicentre,double-blind,randomised phase 3 trial[J].Lancet,2014,384(9944):665-673.
[10]Heist RS,Fidias P,Huberman M,et al.A phaseⅡstudy of oxaliplatin,pemetrexed,and bevacizumab in previously treated advanced non samll cell lung cancer[J].J Thorac Oncol,2008,3(10):1153-1158.
[11]Reck M,Kaiser R,Mellemgaard A,et al.Docetaxel plus nintedanib versus docetaxel plus placebo in patients with previously treated non-small-cell lung cancer(LUME-Lung 1):a phase 3,double-blind,randomized controlled trial[J].Lancet Oncol,2014,15(2):143-155.
(2017-02-28收稿)
(2017-04-13修回)
(编辑:杨红欣 校对:武斌)
Efficacy and safety of docetaxel plus apatinib as a second-line treatment for advanced nonsquamous non-small cell lung cancer
Yunjie GUO,Xiaohui JING
Yunjie GUO;E-mail:gyj5302@126.com
The First People's Hospital of Pingdingshan,Pingdingshan 467000,China
Objective:To observe the efficacy and safety of docetaxel plus apatinib as a second-line treatment for advanced non-squamous non-small cell lung cancer.Methods:From February 2015 to August 2016,39 eligible patients were randomly assigned to experimental arm(19 cases)and control arm(20 cases).Patients in the experimental arm
60 mg/m2d1 docetaxel and 500 mg d1-21 apatinib for a 21-day cycle until disease progression or unacceptable toxicity occurred.Patients in the control arm received chemotherapy only.Disease control rate(DCR),incidence of adverse event,and progression-free survival(PFS)were analyzed.Results:The disease control rates(DCR)in the experimental and control arms were 63.2%and 30.0%,respectively,with statistical difference(P=0.039).The experimental arm experienced many grades 3-4 hematologic adverse events with statistical difference(P=0.032).The median PFS values were 5.6 months(95%CI=4.8-6.3)and 3.0 months(95%CI=1.8-4.1)with statistical difference(P=0.04).Conclusion:Docetaxel plus apatinib can be delivered safely with careful monitoring for the treatment of advanced non-squamous non-small cell lung cancer,and this treatment can significantly improve the DCR and PFS.
docetaxel,apatinib,non-small cell lung cancer,angiogenesis

10.3969/j.issn.1000-8179.2017.11.245
平顶山市第一人民医院肿瘤科(河南省平顶山市467000)
郭运杰 gyj5302@126.com
郭运杰 专业方向为乳腺癌、肺癌的内科综合治疗。
E-mail:gyj5302@126.com
——评《卵巢恶性肿瘤诊疗手册》

