微管相关蛋白2在胰腺神经内分泌肿瘤组织中的表达及预后意义*
宋甜甜 肖雨 白春梅 李乃适 陈洁 赵大春 宋玉立 金凯舟 朱丽明 于润 虞先濬陈原稼
·临床研究与应用·
微管相关蛋白2在胰腺神经内分泌肿瘤组织中的表达及预后意义*
宋甜甜①肖雨②白春梅③李乃适④陈洁⑤赵大春②宋玉立①金凯舟⑥朱丽明①于润⑦虞先濬⑥陈原稼①
目的:探索微管相关蛋白2(microtubule-associated protein 2,MAP2)与微管相关蛋白1B(microtubule-associated protein 1B,MAP1B)在预测胰腺神经内分泌肿瘤(pancreatic neuroendocrine tumors,PNETs)患者预后中的意义。方法:收集1999年12月至2016年12月来自于北京协和医院、中山大学附属第一医院、复旦大学上海癌症中心和Cedars-Sinai医学中心(洛杉矶)193例患者的193个原发肿瘤标本。免疫组织化学染色法分别检测193例、120例PNETs组织中MAP2、MAP1B的表达,随后分析蛋白表达与患者临床病理特征及预后的关系。结果:MAP2和MAP1B在PNETs患者中的阳性率分别为45.6%(88/193)和64.2%(77/120)。MAP2表达阳性的患者的总生存好于阴性患者(P=0.012)。另外,MAP2阳性Ⅱ、Ⅲ期患者的总生存也优于阴性者(P=0.017)。然而,MAP1B的表达与肿瘤大小、转移、肿瘤组织学分级、临床分期、总生存、无病生存均无相关性(P>0.05)。结论:MAP2为潜在的预测PNETs患者预后的指标。
微管相关蛋白2 胰腺神经内分泌肿瘤 预后
胰腺神经内分泌肿瘤(pancreatic neuroendocrine tumors,PNETs)是一组少见的肿瘤,其发病率在近三十年内显著上升[1-2]。虽然肿瘤的分级与分期可以预测PNETs患者的预后[2-4],寻找预后的分子标志物对一部分患者仍然十分必要[5]。
前期研究发现骨架蛋白α-internexin的表达与PNETs患者的总生存相关[6]。同时,有研究发现另一个骨架蛋白CK19的表达也与PNETs患者的预后相关[7-8]。最近本课题组蛋白组学的研究发现两个骨架蛋白微管相关蛋白2(microtubule-associated protein 2,MAP2)与微管相关蛋白1B(microtubule-associated protein 1B,MAP1B)在PNETs肿瘤组织中表达明显高于瘤旁组织。黑色素瘤不仅表达神经内分泌细胞的标志物[9],同时与神经内分泌肿瘤如PNETs有组织细胞共性[10],且研究发现MAP2在黑色素瘤中的表达与患者的预后相关[11]。MAP1B在肿瘤组织中表达的意义少有报道,虽然越来越多的研究提示微管相关蛋白参与调控肿瘤细胞的一系列生物学过程[12],MAP2与MAP1B在PNETs中的表达及意义却鲜有报道。因此,本研究旨在探索MAP2、MAP1B的表达能否预测PNETs患者的预后。
本课题组近期的多中心研究共纳入900余例PNETs患者,随访结果发现所有PNETsⅠ期患者均无病生存,而90%以上的Ⅳ期患者出现肿瘤复发或死亡[13]。欧洲一项研究结果与之类似,该研究共纳入1 072例PNETs患者,其中仅1例Ⅰ期(1/248)患者死于肿瘤,半数以上的Ⅳ期患者死于肿瘤[4]。以上研究提示预测Ⅱ、Ⅲ期患者的生存更有意义。因此本研究同时评估MAP2与MAP1B表达在Ⅱ、Ⅲ期PNETs患者中的预后价值。
1 材料与方法
1.1 病例收集及临床病理特征
本研究共纳入1999年12月至2016年12月来自于北京协和医院、中山大学附属第一医院、复旦大学肿瘤医院和Cedars-Sinai医学中心(洛杉矶)的193例患者共193个原发肿瘤。截止到2016年共对87.6%(169/193)的患者进行了随访。PNETs的诊断标准如之前所述[6]。肿瘤的分级与分期按照ENETS指南[14]。患者的临床病理特征在表1中进行了总结。
1.2 方法
1.2.1 免疫组织化学染色 石蜡包埋的193个肿瘤组织及121个配对的瘤旁组织脱蜡处理后,微波修复20 min,3%过氧化氢灭活内源性过氧化物酶(室温10min),滴加一抗抗MAP2(浓度1:100),4℃过夜,清洗后滴加兔抗鼠二抗(北京中杉金桥生物技术有限公司),室温孵育,DAB显色,镜下观察,随后苏木素复染。与之类似,共120个PNETs肿瘤组织与74个配对的瘤旁组织进行脱蜡处理,微波修复20 min,抗MAP1B(Santa Cruz,sc-58784,CA)浓度为1:400。盲法评估染色结果。当细胞胞浆着色为均匀棕黄色时认为阳性,<25%肿瘤细胞着色认为是染色阴性。
1.2.2 MAP2与MAP1B表达与临床病理特征的关系 首先,分析120个PNETs肿瘤组织中MAP1B表达与患者临床病理特征的关系并未发现相关性。然后,探讨193例PNETs患者中MAP2表达的意义,同时分析MAP2表达在82例Ⅱ、Ⅲ期PNETs患者中的预后意义。排除2例不明原因死亡患者,对167例随访患者采用Kaplan-Meier生存曲线及Log-rank检验进行生存分析,采用Cox回归模型进行多因素生存分析。
1.3 统计学分析
采用SPSS 21.0软件进行统计学分析。统计方法采用Fisher精确检验、χ2检验、秩和检验、Kaplan-Meier生存分析及Log-rank检验、Cox回归模型,采用双侧检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 临床病理特征
在193个肿瘤中,有100例胰岛素瘤,9例胃泌素瘤,6例胰高糖素瘤,1例VIP瘤及77例神经纤维瘤。193例患者的临床病理特征总结于表1中。中位随访时间为56(1~214)个月。
2.2 PNETs中MAP2与MAP1B的表达
MAP2在肿瘤组织的阳性率为45.6%(88/193)而瘤旁组织的阳性率为1.7%(2/121)(P=5.3×10-17,图1A)。MAP1B在PNETs中的阳性率为64.2%(77/120),而在瘤旁组织中的阳性率为1.4%(1/74)(P=4.4×10-18)。
2.3 MAP2与MAP1B表达与临床病理特征及预后的关系
MAP2的表达与确诊时年龄、肿瘤大小、分级、分期、总生存相关,而与性别、肿瘤部位及无病生存无相关性(表2)。
Kaplan-Meier生存分析显示MAP2阳性的PNETs患者具有较好的总生存(P=0.012,图2A,HR=3.26,95%CI:1.13~9.41,P=0.029,表4),但MAP2阳性患者的无病生存与阴性患者无差别(P=0.410,图2B)。Kaplan-Meier及多因素生存分析结果提示MAP2表达可能是独立的预测PNETs患者总生存的分子标志物。
MAP1B表达与临床病理特征如年龄、性别、肿瘤大小、转移、分期及生存等均无相关性(表3)。Ka⁃plan-Meier生存分析也显示MAP1B表达与总生存及无病生存均无相关性。
如前所述,PNETsⅣ期患者较Ⅰ期患者死亡率高,因此预测PNETsⅡ、Ⅲ期患者的预后更有意义。该研究发现肿瘤组织中MAP2阳性的PNETsⅡ、Ⅲ期患者较MAP2阴性的患者总生存好(P=0.017,图3A,HR=8.74,95%CI:1.11~69.05,P=0.040),而MAP2表达与Ⅱ、Ⅲ期患者的无病生存无相关性(P=0.302,图3B)。

表1 PNETs患者临床病理特征 n(%)Table 1 Summary of clinicopathological characteristics of PNETs patientsn(%)

图1 MAP2和MAP1B在PNETs及对应癌组织中的表达Figure 1 MAP2 and MAP1B expression in PNETs and paired pancreatic tissues
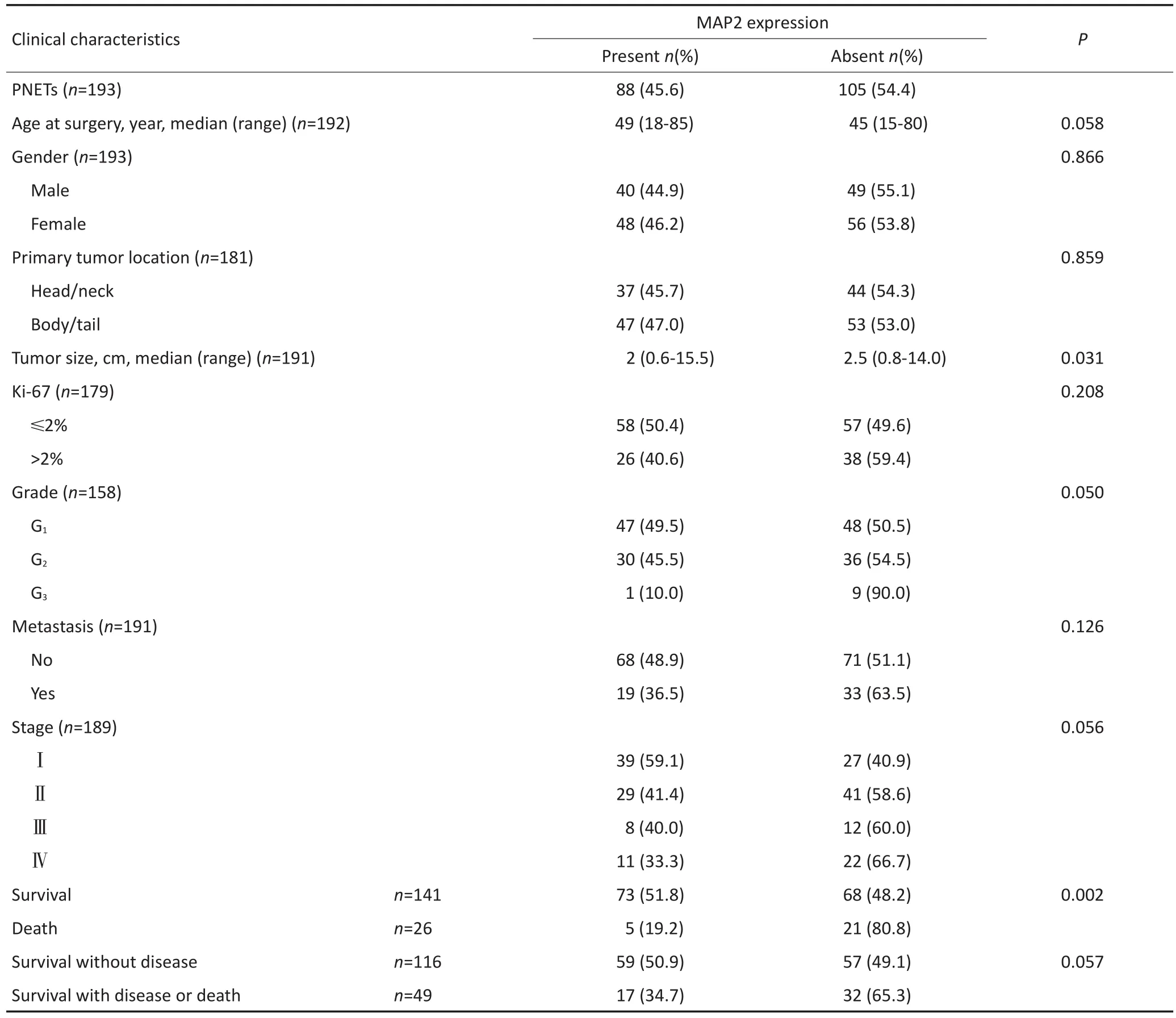
表2 MAP2表达与PNETs患者临床病理特征的关系Table 2 Correlation of clinicopathological characteristics with MAP2 expression

表3 MAP1B与PNETs患者临床病理特征的关系Table 3 Correlation of clinicopathological characteristics with MAP1B expression

表3 MAP1B与PNETs患者临床病理特征的关系(续表3)Table 3 Correlation of clinicopathological characteristics with MAP1B expression

图2 PNETs患者Kaplan-Meier生存曲线Figure 2 Kaplan-Meier plots of patients with PNETs

表4 PNETs患者总生存的Cox回归模型Table 4 Multivariable Cox model of overall survival

图3 不同MAP2表达在PNETsⅡ、Ⅲ患者中的预后分析Figure 3 Prognostic value of MAP2 expression in patients with stageⅡandⅢtumors
3 讨论
PNETs通常生长缓慢且恶性程度明显低于胰腺腺癌,但部分PNETs患者预后也较差,如果可以预测患者的预后,那么临床医生可以采取积极的治疗措施并紧密随访患者。虽然肿瘤的分级、分期、转移、肿瘤大小及铬粒素A水平可有效预测PNETs患者预后[2],但是对部分患者而言分子标志物仍然是必须的预后指标。
最近研究发现一些分子标志物可预测PNETs患者的预后。如PHD表达增多与PNETs的侵袭性及不良预后相关[15],此外 KIT[8]及 CK19[7-8]的表达也与PNETs预后相关。基于前期蛋白质组学的研究,本研究发现MAP2及MAP1B在PNETs肿瘤组织中表达明显高于瘤旁组织。值得注意的是,之前的研究发现另外2个骨架蛋白(CK19和α-internexin)也与PNETs患者预后相关[6-8]。本研究分析MAP2与MAP1B表达与PNETs患者的临床病理特征之间的关系,发现MAP2的表达与PNETs患者的年龄较小、肿瘤体积较小、临床分期低及总生存相关。肿瘤的大小是临床分期的主要依据之一,同时有研究发现肿瘤大小与患者的预后存在相关性[4],本研究发现MAP2表达阳性的患者肿瘤较小,而之前体外动物实验发现MAP2表达增加可抑制裸鼠黑色素瘤的生长[16]。研究发现原位黑色素瘤中MAP2表达显著高于良性色素瘤,同时转移的黑色素瘤肿瘤组织中MAP2的表达显著低于原位黑色素瘤[11],细胞实验发现MAP2表达增加可抑制肿瘤细胞的迁移及侵袭能力[16],前期研究发现黑色素瘤中MAP2表达阳性者预后较好[17],可能原因是MAP2通过稳定微管导致细胞周期停滞而抑制细胞分裂。同时,Song等[16]发现黑色素瘤细胞中腺病毒转染MAP2使其表达增加,导致黑色素瘤细胞凋亡及细胞周期停滞。黑色素瘤与PNETs具有相似的生物组织学特性[10],可部分解释本研究结果。然而,本研究并未发现Ki-67指数与MAP2表达之间存在相关性,而Ki-67指数为肿瘤细胞增殖分化的重要指标,是PNETs患者预后的独立预测因素[4]。在神经系统肿瘤或神经内分泌分化的肿瘤中MAP2的表达增加似乎是一个抑癌因素,可能作为肿瘤治疗的靶点。
MAP1B在生长发育阶段表达水平较高而在发育成熟时表达水平较低[18]。MAP1B可与多种蛋白质如微管蛋白结合。MAP1B还可抑制p53的转录,推测其可能在肿瘤形成中发挥作用[19]。然而,本研究尚未发现MAP1B的表达与PNETs患者的临床病理特征及预后相关。
Scarpa等[20]发现PNETsⅠ期患者与Ⅳ期患者的5年生存率分别为100%和35%。在10年的随访时间里仅1例Ⅰ期患者死于肿瘤而Ⅳ期患者的死亡率高达82%[20]。另一项欧洲的研究结果与此相符,该研究共纳入1 072例PNETs患者,248例Ⅰ期患者中仅1例(0.4%)死于肿瘤而半数以上Ⅳ期患者死于肿瘤[4]。另外,最近977例PNETs患者的回顾性研究也发现所有的Ⅰ期患者均无病生存,而90%以上的Ⅳ期患者出现肿瘤复发或死亡[13]。以上结果提示寻找预测Ⅱ、Ⅲ期患者结局的分子标志具有重要临床意义。
本研究的不足之处在于回顾性研究中一些关键的衡量指标无法测量、选择偏倚及信息偏差、无法得出因果关系等。此外,本研究病例来自于多个各研究中心可能存在一些变异。另外,本研究患者的中位随访时间为56个月,而大多数PNETs患者即使肿瘤复发总生存时间均>5年。
综上所述,本研究发现肿瘤组织中MAP2的表达可能是预测PNETs患者尤其是Ⅱ、Ⅲ患者总生存的标志物。
[1] Viudez A,De Jesus-Acosta A,Carvalho FL,et al.Pancreatic neuroendocrine tumors:Challenges in an underestimated disease[J].Crit Rev Oncol Hematol,2016,(101):193-206.
[2] Falconi M,Eriksson B,Kaltsas G,et al.ENETS consensus guidelines update for the management of patients with functional pancreatic neuroendocrine tumors and non-functional pancreatic neuroendocrine tumors[J].Neuroendocrinology,2016,103(2):153-171.
[3] Halfdanarson TR,Rabe KG,Rubin J,et al.Pancreatic neuroendocrine tumors(PNETs):incidence,prognosis and recent trend toward improved survival[J].Ann Oncol,2008,19(10):1727-1733.
[4] Rindi G,Falconi M,Klersy C,et al.TNM staging of neoplasms of the endocrine pancreas:results from a large international cohort study[J].J Natl Cancer Inst,2012,104(10):764-777.
[5] Castellano D,Grande E,Valle J,et al.Expert consensus for the management of advanced or metastatic pancreatic neuroendocrine and carcinoid tumors[J].Cancer Chemother Pharmacol,2015,75(6):1099-1114.
[6] Liu B,Tang LH,Liu Z,et al.Alpha-Internexin:a novel biomarker for pancreatic neuroendocrine tumor aggressiveness[J].J Clin Endocrinol Metab,2014,99(5):E786-795.
[7] Deshpande V,Fernandez-del Castillo C,Muzikansky A,et al.Cytokeratin 19 is a powerful predictor of survival in pancreatic endocrine tumors[J].Am J Surg Pathol,2004,28(9):1145-1153.
[8] Han X,Zhao J,Ji Y,et al.Expression of CK19 and KIT in resectable pancreatic neuroendocrine tumors[J].Tumour Biol,2013,34(5):2881-2889.
[9] Lee H,Torres FX,McLean SA,et al.Immunophenotypic heterogeneity of primary sinonasal melanoma with aberrant expression of neuroendocrine markers and calponin[J].Appl Immunohistochem Mol Morphol,2011,19(1):48-53.
[10]Jensen RT.Pancreatic endocrine tumors:recent advances[J].Ann Oncol,1999,(10 Suppl 4):170-176.
[11]Gambichler T,Rotterdam S,Radkowski K,et al.Differential expression of microtubule-associated protein 2 in melanocytic skin lesions[J].Am J Clin Pathol,2009,131(5):710-714.
[12]Parker AL,Kavallaris M,McCarroll JA.Microtubules and their role in cellular stress in cancer[J].Front Oncol,2014,(4):153.
[13]Zhu LM,Tang L,Qiao XW,et al.Differences and similarities in the clinicopathological features of pancreatic neuroendocrine tumors in China and the United States:a multicenter study[J].Medicine(Baltimore),2016,95(7):e2836.
[14]Rindi G,Kloppel G,Alhman H,et al.TNM staging of foregut(neuro)endocrine tumors:a consensus proposal including a grading system[J].Virchows Arch,2006,449(4):395-401
[15]Couvelard A,Deschamps L,Rebours V,et al.Overexpression of the oxygen sensors PHD-1,PHD-2,PHD-3,and FIH Is associated with tumor aggressiveness in pancreatic endocrine tumors[J].Clin Cancer Res,2008,14(20):6634-6639.
[16]Song Z,He CD,Sun C,et al.Increased expression of MAP2 inhibits melanoma cell proliferation,invasion and tumor growth in vitro and in vivo[J].Exp Dermatol,2010,19(11):958-964.
[17]Soltani MH,Pichardo R,Song Z,et al.Microtubule-associated protein 2,a marker of neuronal differentiation,induces mitotic defects,inhibits growth of melanoma cells,and predicts metastatic potential of cutaneous melanoma[J].Am J Pathol,2005,166(6):1841-1850.
[18]Villarroel-Campos D,Gonzalez-Billault C.The MAP1B case:an old MAP that is new again[J].Dev Neurobiol,2014,74(10):953-971.
[19]Lee SY,Kim JW,Jeong MH,et al.Microtubule-associated protein 1B light chain(MAP1B-LC1)negatively regulates the activity of tumor suppressor p53 in neuroblastoma cells[J].FEBS Lett,2008,582(19):2826-2832.
[20]Scarpa A,Mantovani W,Capelli P,et al.Pancreatic endocrine tumors:improved TNM staging and histopathological grading permit a clinically efficient prognostic stratification of patients[J].Mod Pathol,2010,23(6):824-833.
(2017-02-01收稿)
(2017-04-23修回)
(编辑:郑莉 校对:孙喜佳)
Expression of microtubule-associated protein 2 correlates with better prognosis of pancreatic neuroendocrine tumors
Tiantian SONG1,Yu XIAO2,Chunmei BAI3,Naishi LI4,Jie CHEN5,Dachun ZHAO2,Yuli SONG1,Kaizhou JIN6,Liming ZHU1,Run YU7,Xianjun YU6,Yuanjia CHEN1
Yuanjia CHEN;E-mail:yuanjchen@outlook.com
1Department of Gastroenterology,2Department of Pathology,3Department of Oncology,4Department of Endocrinology,Peking Union Medical College Hospital,Peking Union Medical College,Chinese Academy of Medical Sciences,Beijing 100730,China;5Department of Gastroenterology,the First Affiliated Hospital,Sun Yat-sen University,Guangzhou 510080,China;6Department of Pancreatic Surgery,Fudan University Shanghai Cancer Center,Shanghai 200032,China;7Division of Endocrinology,Cedars-Sinai Medical Center,and Division of Endocrinology,UCLA,David Geffen School of Medicine,Los Angeles 90048,USA
This work was supported by the National Natural Sciences Foundation of China(No.81450015)
Objective:To determine whether microtubule-associated protein 2(MAP2)and microtubule-associated protein 1B(MAP1B)could be prognostic biomarkers for patients with pancreatic neuroendocrine tumors(PNETs).Methods:With immunohistochemical staining,the expressions of MAP2 and MAP1B were examined in 193 and 120 primary tumors and peritumoral tissues,respectively.Then,the relationship between the expression of each protein and clinicopathological characteristics,including prognosis was analyzed.Results:MAP2 and MAP1B were expressed in 88 of 193(45.6%)and 77 of 120(64.2%)tumors,respectively.The expression of MAP2 was significantly associated with the favorable overall survival of patients with PNETs(P=0.012).Moreover,MAP2 expression was associated with the improved overall survival in a subset of patients with stageⅡand stageⅢtumors(P=0.017).The MAP1B expression did not correlate with other clinicopathological features and prognosis.Conclusion:MAP2 could be a novel,independent prognostic biomarker for PNETs.
microtubule-associated protein 2,pancreatic neuroendocrine tumors,prognosis

10.3969/j.issn.1000-8179.2017.11.190
①中国医学科学院,北京协和医学院,北京协和医院消化内科(北京市100730);②病理科;③肿瘤内科;④内分泌科;⑤中山大学附属第一医院消化内科;⑥复旦大学附属肿瘤医院胰腺外科;⑦Division of Endocrinology,Cedars-Sinai Medical Center,and Division of Endocrinology,UCLA,David Geffen School of Medicine,Los Angeles,California
*本文课题受国家自然科学基金应急管理项目(编号:81450015)资助
陈原稼 yuanjchen@163.com
宋甜甜 专业方向为胰腺神经内分泌肿瘤诊治。
E-mail:18701015732@163.com
——水芹主要害虫识别与为害症状

