地砷病区乳腺癌致病机制研究
张明明,李 婷,郑春雨,董 雪*
(1.吉林省人民医院,吉林 长春130021; 2.长春中医药大学)
地砷病区乳腺癌致病机制研究
张明明1,李 婷2,郑春雨2,董 雪2*
(1.吉林省人民医院,吉林 长春130021; 2.长春中医药大学)
目的 研究亚砷酸钠(NaAsO2)对小鼠乳腺上皮细胞(NMuMG)增殖的抑制作用机制,为地砷病区乳腺癌致病机制提供理论依据。方法 以不同浓度的NaAsO2(0,5,10,20,30 μM)处理的NMuMG,观察其形态的变化;经Cell Counting Kit-8 (CCK-8) 测定不同浓度NaAsO2对NMuMG增殖情况;用实时定量RT-PCR 分析增殖基因c-myc mRNAs的表达水平。结果 在一定浓度范围内,随亚砷酸钠浓度升高,其细胞间隙变宽、形状不规则,甚至凋亡。在一定浓度范围内,随着NaAsO2浓度增高其增殖明显受到抑制,呈明确的剂量-效应关系; 20 μM NaAsO2使c-myc mRNA表达水平明显降到11%。结论 亚砷酸钠抑制NMuMG的增殖是通过降低增殖基因c-myc的表达来实现的,这是地砷病区乳腺癌疾病高发的原因之一。
亚砷酸钠;增殖;c-myc
(ChinJLabDiagn,2017,21:1064)
乳腺癌是占女性死亡第二位的恶性肿瘤,且其发病率在近30年正逐渐上升[1,2]。流行病学调查显示,地砷病区其乳腺癌的发病率高于其他地区,吉林省就是饮水中砷含量超标的地砷病区[3]。在美国环境保护协会和国际癌症研究中心发布的Ⅰ类致癌药物砷已位列其中[4]。由于砷致癌机制十分复杂,目前不是十分清楚,本研究检测了一定剂量范围内亚砷酸钠对小鼠乳腺上皮细胞的形态及增殖影响。
1 材料与方法
1.1 细胞及试剂 亚砷酸钠(NaAsO2)、胰岛素,购于SIGMA公司;小鼠乳腺上皮细胞(NMuMG)由瑞典大学ARIS教授友情馈赠,Gibco公司提供(Dulbecco's Modified Eagle Media ,DMEM)培养基;北京元亨金马生物公司提供优级胎牛血清;碧云天公司提供CCK-8试剂盒购自于;Takara 公司提供Trizol试剂盒、RT-PCR 试剂盒;ABI 公司提供 2 *SYBR Green Ⅰ试剂。
1.2 细胞培养 NMuMG培养条件是在含10 %胎牛血清+10 μg/ml胰岛素的DMEM 培养基中,置于37 ℃、5 % CO2恒温培养箱中培养。
1.3 细胞形态的观察 将指数增长期的NMuMG制成单细胞悬液,接种于24孔板每孔密度3*103/ml,每孔1.5 ml培养基,待细胞长至70%-80%融合后,(0,5,10,20,30) μM NaAsO2溶液替换原有培养基,作用24 h后,利用共聚焦显微镜观察细胞形态,并照相。
1.4 细胞增殖情况检测 将指数生长期细胞制成单细胞悬液,接种于96 孔板, 5*103个细胞/ 孔,100 μl/ 孔,每孔均是不同浓度亚砷酸钠溶液(每个浓度设4个复孔),作用24小时后,将10 μl CCK-8加入每孔中,并将孔板重新置于培养箱中,继续孵育1 小时,室温下振荡5 分钟,酶标仪检测其在450 nm吸光度值,独立实验重复3次,并计算存活率。
细胞增殖抑制率(%)= [ (1-实验组平均OD值) /对照组平均OD值]*100%;
1.5 实时定量RT-PCR检测 提取细胞总RNA,并将mRNA逆转录为cDNA(具体操作步骤均按厂家产品说明书进行),其反应条件为:30℃、10 min,42℃、30 min,99℃、5 min,5℃、5 min。c-Myc采用实时定量RT-PCR(SYBR Green 法) 进行,反应体积为25 μl,反应程序为:50 ℃ 2 min;95 ℃ 10 min;92 ℃ 10 s,60 ℃ 30 s,共50个循环。引物由上海生工生物工程公司合成,引物序列见表1。
1.6 统计学处理
2 结果
2.1 细胞形态变化
利用共聚焦显微镜观察亚砷酸钠对NMuMG形态的影响,DIC照相。结果发现,0 μM对照组细胞呈上皮细胞的形态,细胞间连接紧密且贴壁生长,状态良好;经不同浓度亚砷酸钠作用24 h后,随着其浓度升高,细胞间隙逐渐变大,细胞形状不规则,有部分细胞出现空泡,漂浮的死细胞越来越多(图1)。
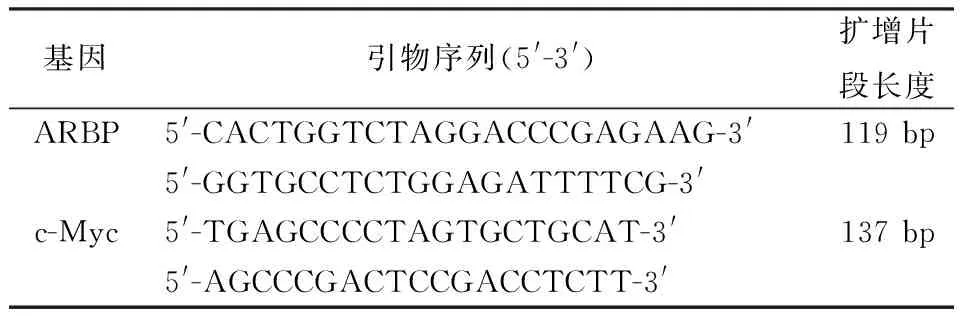
表1 PCR扩增所用引物

注:亚砷酸钠浓度A:0 μM B:5 μM C:10 μM D:20 μM E:30 μM图1 亚砷酸钠改变NMuMG的形态(200*)
2.2 NaAsO2抑制NMuMG增殖
用CCK-8试剂检测细胞增殖情况。以不同浓度的亚砷酸钠处理NMuMG,作用24 h后,发现随着亚砷酸钠浓度的增高,细胞增殖均呈不同程度的抑制(图2),当浓度达到10μM时,即有统计学意义(P<0.05),且有剂量-效应关系。
2.3 NaAsO2降低增殖基因c-Myc mRNA表达水平
c-Myc是细胞增殖相关基因,其表达水平降低,细胞增殖即受抑制,进而导致细胞凋亡。将20 μM的NaAsO2作用小鼠乳腺上皮细胞24 h后收集细胞,并提取RNA,同时进行实时定量RT-PCR检测。本实验结果均经过内参及未处理组校正过,每次2个副孔且实验重复3次。实验结果表明:NMuMG经20 μM NaAsO2作用后,其c-Myc的mRNA表达水平明显降低到11%,统计学有显著性差异(P<0.01),如图3所示,这表明NaAsO2通过降低c-Myc的mRNA表达水平来抑制NMuMG增殖。

*P<0.05 **P<0.01图2 亚砷酸钠抑制NMuMG增殖

**P<0.01图3 NaAsO2 抑制NMuMG C- MYC mRNA的表达
3 讨论
中国一直是饱受砷污染的国家,其中吉林、新疆、云南、山西等省份尤为严重,比较常见的是饮水中砷含量超标。这些地区的女性乳腺癌发病率远高于其他地区,为了解砷致乳腺癌的致癌机理,本研究以NMuMG为研究对象,观察砷对其毒性作用。
本研究中,NMuMG发现经不同浓度的NaAsO2作用后,其形态发生显著变化,细胞间隔变大,形态各异,且随着NaAsO2浓度上升,导致凋亡的细胞逐渐增多。CCK-8检测结果充分说明了NaAsO2明显抑制了NMuMG的增殖且呈典型的剂量-效应关系。Liy等人将5 μM As2O3牛主动脉内皮细胞,仅4 h即导致细胞 DNA 链的断裂[5],Barchowsky等人将5 μM As2O3作用血管内皮细胞仅4 h,其细胞DNA合成就受到抑制[6]。
c-Myc是与细胞增殖有关的基因,细胞增殖过程中其表达水平升高。在本研究中NMuMG经20μM NaAsO2作用24小时后,c-Myc的mRNA表达显著降低,说明NaAsO2对NMuMG的增殖抑制作用是通过抑制c-Myc表达而实现的。
许多研究结果表明,砷化物通过抑制细胞的增殖,从而引起凋亡来发挥其毒性作用的。如Shah P等人发现小鼠通过饮水长期摄入低剂量砷后,皮肤细胞的增殖受到抑制进而凋亡从而导致皮肤癌[7]。在我们的前期研究中就发现低浓度的亚砷酸钠即可抑制人脐静脉血管内皮细胞增殖[8]。Hu,Y等人研究发现低剂量的亚砷酸盐、长时间作用于正常人体细胞,常见的慢性砷中毒(地砷病)会通过下调NF-kB的DNA结合,而NF-kB是抗凋亡转录因子,凋亡细胞减少,引起肿瘤的发生[9]。本研究发现一定剂量的砷作用于小鼠乳腺上皮细胞导致其增殖受到抑制,这可能是其致乳腺癌机制之一。
[1]Upreti M,Jyoti A,Johnson SE,et al.Radiation-enhanced therapeutic targeting of galectin-1 enriched malignant stroma in triple negative breast cancer[J].Oncotarget,2016,7(27):41559.
[2]Pineda-Belmontes CP,Hernández-Ramírez RU,Hernández-Alcaraz C,et al.Genetic polymorphisms of PPAR gamma,arsenic methylation capacity and breast cancer risk in Mexican women[J].Salud Publica Mex,2016,58(2):220.
[3]张海涛,张秀丽,姜 爽,等.吉林省防砷改水现状分析[J].中国地方病防治杂志,2013,28(4):263.
[4]Morita T,Uneyama C.Genotoxicity assessment of 4-methylimidazole:regulatory perspectives[J].Genes Environ,2016,38(20).
[5]Liu F,Jan KY.DNA damage in arsenite- and cadmium-treated bovine aortic endothelial cells[J].Free Radic Biol Med,2000,28(1):55.
[6]Barchowsky A.Arsenic induces oxidant stress and NF-kappa B activation in cultured aortic endothelial cells[J].Free Radic Biol Med,1996,21(6):783.
[7]Shah P,Trinh E,Qiang L,et al.Arsenic Induces p62 Expression to Form a Positive Feedback Loop with Nrf2 in Human Epidermal Keratinocytes:Implications for Preventing Arsenic-Induced Skin Cancer[J].Molecules,2017,22(2):194.
[8]董 雪,史艳芬,吕 慧.亚砷酸钠对血管增殖效应的体内体外研究[J].中国实验诊断学,2010,14(11):1709.
[9]Vogt BL,Rossman TG.Effects of arsenite on p53,p21 and cyclin D expression in normal human fibroblasts-a possible mechanism for arsenite's comutagenicity[J].Mutat Res,2001,478(1-2):159.
Study on Pathogenic Mechanism of Breast Cancer in Arsenic Ward
ZHANGMing-ming,LiTing,ZHENGChun-yu,etal.
(People'sHospitalofJilinProvince,Changchun130021,China)
Objective The studies were carried out to explore the effect of sodium arsenite on the proliferation of mouse mammary epithelial cells (NMuMG) and its molecular mechanisms.Methods The changes of NMuMG were observed by Cell Counting Kit-8 (CCK-8) at different concentrations of NaAsO2(0,5,10,20,30 μM).The proliferation of NMuMG was determined by real-time quantitative RT The expression of proliferating gene c-myc mRNAs was analyzed by PCR.Results In a certain concentration range,with the concentration of sodium arsenate increased,the cell gap widened,irregular shape,and even apoptosis.In a certain concentration range,the proliferation was significantly inhibited with the increase of NaAsO2concentration,showing a clear dose-effect relationship;20 μM NaAsO2significantly reduced the expression of c-myc mRNA to 11%.Conclusion and Discussion:Sodium arsenite may further inhibit the proliferation of NMuMG by downregulating the expression of c-myc gene,which may be one of the mechanisms of endemic arsenic poisoning leading to breast cancer.
Arsenic;Proliferation;c-myc
吉林省教育厅项目(20163)
*通讯作者
1007-4287(2017)06-1064-03
R737.9
A
张明明,男,副教授,研究方向:神经内科及老年病学;董雪,女,博士,副教授,研究方向地方病学及老年病方面的研究。
2016-12-17)

