棉籽抗菌活性肽的分离纯化及鉴定
韩晓燕,包郁明,辛凤姣,黄 颖,Christophe BLECKER,戴小枫,*
(1.中国农业科学院农产品加工研究所,农业部农产品加工重点实验室,北京 100193;2.列日大学食品学院,比利时 列日 999013)
棉籽抗菌活性肽的分离纯化及鉴定
韩晓燕1,包郁明1,辛凤姣1,黄 颖1,Christophe BLECKER2,戴小枫1,*
(1.中国农业科学院农产品加工研究所,农业部农产品加工重点实验室,北京 100193;2.列日大学食品学院,比利时 列日 999013)
通过体外模拟消化系统对棉籽分离蛋白(cottonseed protein isolate,CPI)进行酶解,得到具有抗菌活性的酶解产物,并采用超滤(ultraf i ltration,UF)、阴离子交换色谱(anion exchange chromatography,AEC)、半制备高效液相色谱(semi-preparation high performance liquid chromatography,semi-P-HPLC)分离技术对棉籽抗菌活性肽进行分离纯化,用电喷雾串联质谱(electrospray ionization-tandem mass spectrometry,ESI-MS/MS)鉴定棉籽抗菌肽的氨基酸序列。在抗菌活性肽分离纯化过程中,用UF对具有抗菌活性的CPI酶解产物进行分离,得到3 个组分U-Ⅰ~U-Ⅲ。抗菌活性检测表明U-Ⅲ的抗菌能力最强;用AEC分离U-Ⅲ得到3 个组分QF-Ⅰ~QF-Ⅲ,其中QF-Ⅱ抗菌能力最强;进一步采用semi-P-HPLC分离QF-Ⅱ得到4 个组分PF-Ⅰ~PF-Ⅳ,其中PF-Ⅲ的抗菌能力最强,经HPLC检测为单一峰,ESI-MS/MS检测分析得到该肽的氨基酸序列为ISGLIyEETR(Ile-Ser-Gly-Leu-Ile-Tyr-Glu-Glu-Thr-Arg)。
棉籽分离蛋白酶解产物;抗菌活性肽;分离纯化;氨基酸序列
抗菌活性肽作为对抗病原体入侵的第一道防线,具有相对分子质量小、杀菌广谱、抗菌活性高等特点,对动物与人尤其是婴儿的免疫系统起着重要作用[1-2],自20世纪80年代发现第一个抗菌活性肽——天蚕素后[3],大量的天然抗菌活性肽相继被发现,且结构得到鉴定[4-6]。天然抗菌肽因其安全性和广谱性,作为抗菌产品在医药、生物等领域已有广泛应用[7]。
近年来,植物蛋白来源的生物活性肽作为功能因子引起了各国学者的广泛关注。我国是产棉大国,棉籽产量稳居世界首位(2015年约为750万 t),棉籽蛋白含量丰富,关于其酶解消化得到棉籽生物活性肽的研究具有重要意义。目前关于棉籽活性肽的研究主要集中在抗氧化活性[8-9]及血管紧张素转化酶抑制活性[10],而在抗菌活性方面的研究鲜有报道。本实验采用超滤(ultrafiltration,UF)、阴离子交换色谱(anion exchange chromatography,AEC)及半制备高效液相色谱(semipreparation high performance liquid chromatography,semi-P-HPLC),对具有抗菌活性的棉籽分离蛋白体外模拟消化的酶解产物进行分离纯化。超滤是按分子质量大小对物质进行分级和浓缩的一种技术[11],由于其简单轻便易操作[12],常被用于生物活性肽制备的第一步分离技术[13],离子交换色谱是根据样品表面所带电荷的不同而对其进行分离的,不同物质因其表面净电荷不同,与带相反电荷填料之间相互作用能力的强弱不同从而被结合或洗脱[14]。HPLC是根据样品极性的不同对其进行分离的,灵敏度较高,常作为样品分离纯化的最后一步[15]。
生物活性肽结构鉴定主要包括氨基酸序列分析仪测定法[16]和质谱(mass spectrometry,MS)法[17],目前,在小肽结构鉴定方面应用较多的是基质辅助激光解吸电离(matrix assisted laser desorption ionization,MALDI)-MS[18]和电喷雾(electrospray ionization,ESI)-MS技术[6,19]。在ESI-MS中,高分子质量的物质通常会带有多个电荷,电荷状态的分布可以精确对分子质量定量,并且可以同时提供精确的分子质量和结构信息,这是ESI-MS相对于其他电离质谱所特有的优点[20]。因此本实验选用ESI-MS/MS对纯化得到的棉籽抗菌活性肽的氨基酸序列进行鉴定,为棉籽蛋白的精深加工及功能性棉籽肽的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
棉籽分离蛋白(cottonseed protein isolate,CPI)本课题组自制[21];金黄色葡萄球菌 中国农业微生物菌种保藏管理中心;大肠杆菌 中国农业科学院农产品加工研究所棉花病害防治实验室。
Tris Base 美国Sigma公司;盐酸、氯化钠(均为分析纯) 国药集团化学试剂有限公司;乙腈(色谱纯) 美国Fisher公司;三氟乙酸(色谱纯) 萨恩化学技术有限公司。
1.2 仪器与设备
超滤管(10 kD及3 kD) 美国Millipore公司;5810 R型及5424 R型离心机 德国Eppendorf公司;UC-6 200型超声波清洗器 美瑞泰克科技有限公司;AKTA Pure型蛋白纯化系统 美国GE公司;Prostar 218 LC型semi-P-HPLC仪、1200 LC型HPLC仪美国安捷伦公司;Arium Comfort型超纯水仪 德国赛多利斯公司;Easy-nLC 1000型纳升级液相色谱仪、Q Exactive型质谱仪 美国Thermo Fisher公司。
1.3 方法
1.3.1 棉籽蛋白酶解产物制备
准确称取5.0 g棉籽分离蛋白粉,加入250 mL蒸馏水配制成2%的蛋白溶液,加入胃蛋白酶5 000 U/g底物,在37 ℃,pH 2.0条件下酶解2 h,用0.9 mol/L NaHCO3溶液调节pH值至5.3,加入胰蛋白酶5 000 U/g底物后,用1 mol/L NaOH溶液调节pH值至7.6,37 ℃恒温振荡酶解2 h,100 ℃灭酶10 min终止消化反应,并参照邻苯二甲醛(ortho-phthalaldehyde,OPA)法[22]测定其水解度。
冷冻干燥所得酶解产物,用灭菌水(121 ℃,高压蒸汽灭菌21 min)溶解,配成100 mg/mL的酶解产物溶液,用0.22 μm无菌微孔滤膜过滤除菌,检测其抗菌活性,并作为进一步实验样品备用。
1.3.2 抗菌活性测定
参考王娣等[23]报道的滤纸片-琼脂扩散法,以50 μg/mL的抗生素卡那霉素(kanamycin,Kan)为对照测定酶解产物及分离所得不同组分的抗菌活性。
将大肠杆菌和金黄色葡萄球菌分别接种于LB液体培养基、营养肉汁培养基中,37 ℃恒温摇床过夜培养,用紫外分光光度计在600 nm波长处调节菌悬液光密度(optical density,OD)值至1,即菌落形成约为1×108CFU/mL,再稀释1 000 倍(逐步依次稀释10 倍,稀释3 次),备用。
取熔化的LB固体培养基及营养肉汁-琼脂培养基约20 mL倒入无菌培养皿中,水平放置,待其凝固后,在培养皿底部标记菌种及滤纸片的摆放位置等。取100 μL菌液均匀涂布于相应固体培养基上,待菌液完全渗入培养基后,在不同的标记位置上放上对应药液浸泡后的滤纸片,重复3 次。在37 ℃恒温培养箱中培养18~24 h,测定抑菌圈直径大小,以此为指标确定抗菌能力。
1.3.3 UF分离
将具有抗菌活性的棉籽蛋白酶解产物依次经过截流分子质量(MW)为10 kD和3 kD UF膜进行离心超滤[24], 4 000 r/min,离心50 min,将酶解液按分子质量大小分为3 部分:U-Ⅰ(MW≥10 kD)、U-Ⅱ(10 kD>MW≥3 kD)及U-Ⅲ(3 kD>MW)。收集每部分的超滤液,真空冷冻干燥得到各组分肽粉,用灭菌水(121 ℃,高压蒸汽灭菌21 min)将所得各组分的肽粉配制成质量浓度为50 mg/mL的溶液,并检测其抗菌活性(检测方法见1.3.2节),选取抗菌活性最强的组分作为进一步分离纯化样品。
1.3.4 AEC分离
对UF后抗菌活性较强的组分进行AEC分离纯化,其纯化条件如下:色谱柱:QFF 1 mL GE;缓冲液:A为20 mmol/L Tris-HCl(pH 8.0),B为含1 mol/L NaCl的20 mmol/L Tris-HCl(pH 8.0);波长:220 nm;进样量:约为4 mL;流速:1 mL/min;洗脱条件:先用缓冲液A洗脱15 个体积,然后采用缓冲液B从0%~100%梯度洗脱20 个体积,再用A洗脱5 个体积。
收集每个洗脱峰,真空冷冻干燥,配成10 mg/mL的溶液,并检测每个洗脱峰的抗菌活性,选取抗菌活性最强的峰组分作为进一步分离纯化样品。
1.3.5 semi-P-HPLC分离
semi-P-HPLC对AEC得到的活性最高的组分进一步分离纯化,其分离条件为:色谱柱:Innoval C18(21.2 mm×250 mm,4.5 μm);洗脱液A:含0.5%三氟乙酸(trifluoroacetic acid,TFA)超纯水(超声处理15 min,以除去气泡),洗脱液B:乙腈;波长:220 nm;进样量:1 mL;流速:10 mL/min;采用梯度洗脱:0~50 min,洗脱液B从5%逐渐升至20%,A相应从95%降至80%;50~55 min,用20% B及80% A进行洗脱;55.0~55.1 min,洗脱液B从20%降至5%,A相应从80%升至95%;55.1~60.0 min,5% B及95% A洗脱5 min。
收集分离的单一峰,进行真空冷冻干燥,测定每个收集峰的抗菌活性,并用HPLC检测其纯度。
1.3.6 抗菌肽纯度检测
使用分析型HPLC对分离纯化出的棉籽抗菌活性肽进行纯度检测,色谱条件如下:色谱柱:Innoval C18( 4.6 mm×250 mm,4.5 μm);检测波长:220 nm;柱温:30 ℃;进样量:25 μL;流速:1 mL/min;流动相:含0.1% TFA的超纯水和乙腈;洗脱条件:5%~10%乙腈梯度洗脱30 min。
1.3.7 抗菌肽的氨基酸结构测定
首先采用毛细管HPLC对抗菌活性肽进行脱盐处理,色谱条件如下:色谱柱:Column Technology Inc RP-C18(0.15 mm×120 mm,1.9 μm);流动相:A为含0.1%甲酸的水溶液,B为含0.08%甲酸的80%乙腈溶液;检测波长:220 nm;柱温:300 ℃;进样量:5 μL;流速:600 nL/min;采用梯度洗脱:0~8 min,洗脱液B从6%逐渐升至9%,A相应从94%降至91%;8~24 min,洗脱液B从9%逐渐升至14%,A相应从91%降至86%;24~60 min,洗脱液B从14%逐渐升至30%,A相应从86%降至70%;60~75 min,洗脱液B从30%逐渐升至40%,A相应从70%降至60%;75~78 min,洗脱液B从40%升至95%,A相应从60%降至5%;78~85 min,95% B及5% A进行洗脱;85~86 min,洗脱液B从95%降至6%,A相应从5%升至94%;86~90 min,6% B及94% A进行洗脱。
酶解产物经毛细管HPLC脱盐及分离后用Q Exactive质谱仪进行质谱分析。检测方式:正离子;母离子扫描范围:m/z 50~750;多肽和多肽碎片的质量电荷比按照下列方法采集:一级质谱在m/z 200时分辨率为70 000;一级延迟时间:10 ms;每次全扫描后采集10 个碎片图谱;二级在m/z 200时分辨率为17 500;二级最大延迟时间:60 ms。
1.4 数据分析
2 结果与分析
2.1 体外模拟消化酶解CPI
体外模拟消化所得C P I酶解产物的水解度为(24.72±1.07)%,对大肠杆菌及金黄色葡萄球菌都有一定的抗性,其抑菌圈直径大小分别为(1.10±0.06) cm和(0.80±0.08) cm,对其进行进一步的分离纯化。
2.2 UP结果

表1 酶解物UP后各组分抑菌圈直径Table 1 Inhibitory zone diameters of ultrafiltration fractions of cottonseed protein hydrolysates
将具有抗菌活性的CPI酶解产物,依次通过10 kD、 3 kD分子截流量进行超滤,使其按分子质量大小分为U-Ⅰ、U-Ⅱ、U-Ⅲ,并通过滤纸片-琼脂扩散法测定各组分的抗菌活性。通过抑菌圈大小看出U-Ⅲ对大肠杆菌及金黄色葡萄球菌均有抗菌活性,其抑菌圈直径分别为(1.17±0.03)cm和(0.76±0.03)cm,而另外两个组分U-Ⅰ、U-Ⅱ对两种菌均未发现抑制活性(表1)。因此,选择抗菌活性最强的组分U-Ⅲ作为进一步分离纯化的样品。
2.3 AEC分析
使用AEC对U-Ⅲ进一步分离纯化,根据出峰情况收集得到3 个洗脱峰:QF-Ⅰ、QF-Ⅱ、QF-Ⅲ,如图1所示。

分离U-Ⅲ的洗脱图谱Fig. 1 Elution profile of U-图1 AECⅢ by AEC

表2 AEC分离U-Ⅲ所得组分抑菌圈直径Table 2 Inhibitory zone diameters of fractions separated from U-Ⅲ by AEC
以抑菌圈直径为指标,检测收集的洗脱峰的抗菌活性。由表2可知,QF-Ⅰ对金黄色葡萄球菌的抑菌圈直径为(0.70±0.05) cm,而对大肠杆菌没有抑制能力;QF-Ⅱ对大肠杆菌及金黄色葡萄球菌均有较强的抗菌能力,其抑菌圈直径分别为(1.25±0.06) cm和(1.10±0.04) cm,显著高于QF-Ⅰ和QF-Ⅲ(P<0.05)。因此,选择QF-Ⅱ进行抗菌肽的进一步分离纯化。
2.4 semi-P-HPLC分析
使用semi-P-HPLC技术对AEC所得的抗菌活性最强的组分QF-Ⅱ进行分离纯化,得到4 个主要肽峰PF-Ⅰ、PF-Ⅱ、PF-Ⅲ及PF-Ⅳ(图2)。

图2 semi-P-HPLC分离纯化QF-Ⅱ图谱Fig. 2 Semi-preparative HPLC profile of QF-Ⅱ

表3 semi-P-HPLC分离QF-Ⅱ所得组分抑菌圈直径Table 3 Inhibitory zone diameters of four fractions separated from QF-Ⅱ by semi-preparative HPLC
由表3可知,抗菌活性测定结果表明PF-Ⅲ的抑菌活性最强,对金黄色葡萄球菌的抑菌圈直径为(1.13±0.07) cm,对大肠杆菌的抑菌圈直径为(1.14±0.05) cm。PF-Ⅳ对大肠杆菌的抑菌圈直径为(0.97±0.08) cm,而对金黄色葡萄球菌未见抑制活性。
2.5 抗菌肽纯度分析
采用HPLC对抗菌活性肽PF-Ⅲ纯度进行检测结果如图3所示,其纯度(峰面积)在95%以上,可对其进行氨基酸序列分析。

图3 棉籽抗菌肽PF-Ⅲ的HPLC图谱Fig. 3 HPLC chromatogram of PF-Ⅲ
2.6 抗菌肽的氨基酸序列结果

图4 PF-Ⅲ的ESI-MS/MS图Fig. 4 ESI-MS/MS spectrum of PF-III
在ESI-MS/MS仪中,利用能量场对带电多肽离子进行轰击使其氨基酸序列断裂形成多肽片段离子,得到PF-Ⅲ二级质谱图(图4),根据碎片离子的断裂位置,片段离子可以分成6 种,即N端的a、b、c离子和C端的x、y、z离子,通常以b、y离子读出氨基酸序列,片段离子匹配容差为20 mmu。通过氨基酸序列分析图谱(图5)分析得到,该棉籽抗菌活性肽PF-Ⅲ的氨基酸序列为ISGLIyEETR(Ile-Ser-Gly-Leu-Ile-Tyr-Glu-Glu-Thr-Arg)。
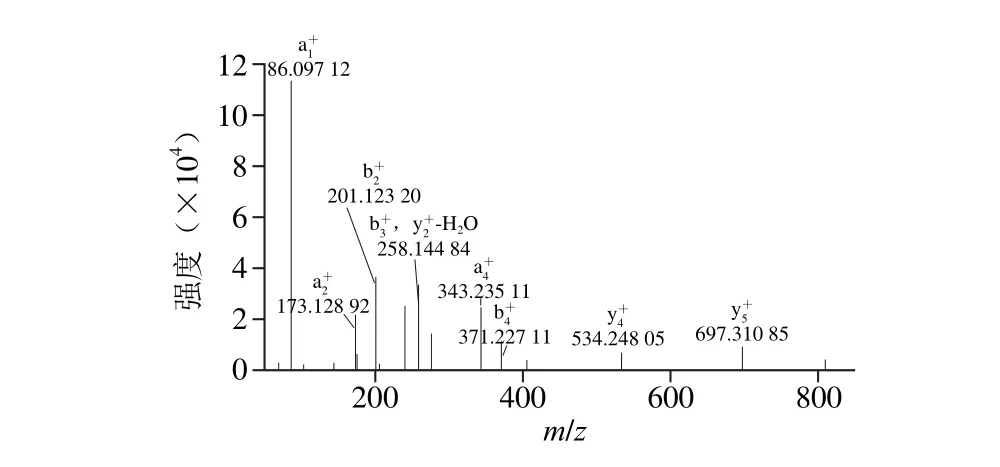
图5 PF-Ⅲ氨基酸序列分析图Fig. 5 Amino acid sequence analysis
3 讨 论
通过分子截流量为10 kD和3 kD的UF膜对棉籽分离蛋白的酶解产物进行分级得到U-Ⅰ(MW≥10 kD)、U-Ⅱ(10 kD≥MW≥3 kD)及U-Ⅲ(3 kD≥MW)3 个组分,所得组分的抗菌活性检测结果显示分子质量最小的UF组分(U-Ⅲ)抗菌活性最强,这与研究报道的抗菌活性肽分子质量较小相一致[13]。进一步采用AEC对U-Ⅲ进行分离得到3 个洗脱峰QF-Ⅰ、QF-Ⅱ及QF-Ⅲ,其中QF-Ⅱ的抗菌能力最强。采用semi-P-HPLC从QF-Ⅱ中分离纯化得到4 个洗脱峰,抗菌活性检测结果显示PF-Ⅲ的抗性最强,进一步使用分析型HPLC对其纯度进行分析,为单一峰,ESI-MS/MS分析得到其氨基酸序列为ISGLIyEETR。
尽管对抗菌活性肽做了大量研究[25-26],但其确切的作用机制尚不明确,可能是促使细胞形成跨膜孔[27],抑制细胞壁或核酸的合成[28],或者激活宿主细胞内的自溶酶系统从而抑制细菌的生长繁殖[29-30],因此可根据该抗菌活性肽的氨基酸序列进行化学合成,并对其抗菌机制展开研究。
[1] AGyEI D, DANQUAH M K. Rethinking food-derived bioactive peptides for antimicrobial and immunomodulatory activities[J]. Trends in Food Science and Technology, 2012, 23(2): 62-69. DOI:10.1016/ j.tifs.2011.08.010.
[2] KAI-LARSEN y, GUDMUNDSSON G H, AGERBERTH B. A review of the innate immune defence of the human foetus and newborn, with the emphasis on antimicrobial peptides[J]. Acta Paediatrica, 2014, 103(10): 1000-1008. DOI:10.1111/apa.12700.
[3] STCINER H, HULTMARK D, ENGSTROM A, et al. Sequence and spe-cif i city of two antibacterial proteins involved in insect immunity[J]. Nature, 1981, 292: 246-248. DOI:10.1091/mbc.E06-08-0670.
[4] yUST M. Rapeseed protein hydrolysates: a source of HIV protease peptide inhibitors[J]. Food Chemistry, 2004, 87(3): 387-392. DOI:10.1016/j.foodchem.2003.11.020.
[5] DOyEN A, SAUCIER L, BEAULIEU L, et al. Electroseparation of an antibacterial peptide fraction from snow crab by-products hydrolysate by electrodialysis with ultraf i ltration membranes[J]. Food Chemistry, 2012, 132(3): 1177-1184. DOI:10.1016/j.foodchem.2011.11.059.
[6] SILA A, NEDJAR-ARROUME N, HEDHILI K, et al. Antibacterial peptides from barbel muscle protein hydrolysates: Activity against some pathogenic bacteria[J]. LWT-Food Science and Technology, 2014, 55(1): 183-188. DOI:10.1016/j.lwt.2013.07.021.
[7] 李燕, 王嘉榕, 孙红宾. 抗菌肽的制备和抗菌机制研究进展[J]. 生物医学工程学杂志, 2015, 32(2): 465-469. DOI:10.7507/1001-5515.20150084.
[8] SUN H, yAO X, WANG X. Chemical composition and in vitro antioxidant property of peptides produced from cottonseed meal by solidstate fermentation[J]. CyTA-Journal of Food, 2015, 2(13): 264-272. DOI:10.1080/19476337.2014.948072.
[9] GAO D, CAO y, LI H. Antioxidant activity of peptide fractions derived from cottonseed protein hydrolysate[J]. Journal of the Science of Food and Agriculture, 2010, 90(11): 1855-1860. DOI:10.1002/ jsfa.4024.
[10] GAO D D, CHANG T, LI H X, et al. Angiotensin I-converting enzyme inhibitor derived from cottonseed protein hydrolysate[J]. African Journal of Biotechnology, 2010, 53(9): 8977-8983. DOI:10.5657/ FAS.2011.0283.
[11] CHAy P, TING B P, MINE y, et al. Comparative composition and antioxidant activity of peptide fractions obtained by ultraf i ltration of egg yolk protein enzymatic hydrolysates[J]. Membranes, 2011, 1(4): 149-161. DOI:10.3390/membranes1030149.
[12] 高林, 何东平, 陈涛, 等. 花生多肽的提取、分离及纯化研究[J]. 中国油脂, 2007, 32(4): 23-25. DOI:10.3321/ j.issn:1003-7969.2007.04.005.
[13] CHEN J, LIU S, yE R, et al. Angiotensin-I converting enzyme (ACE) inhibitory tripeptides from rice protein hydrolysate: purification and characterization[J]. Journal of Functional Foods, 2013, 5(4): 1684-1692. DOI:10.1016/j.jff.2013.07.013.
[14] LU C M, WU y J, CHEN C C, et al. Identif i cation of low-abundance proteins via fractionation of the urine proteome with weak anion exchange chromatography[J]. Proteome Science, 2011, 9(1): 1. DOI:10.1186/1477-5956-9-17.
[15] 艾散江, 艾海提, 王瑾, 等. 高效液相色谱法分离分析药食同源红花中羟基红花黄色素A[J]. 食品科学, 2016, 37(12): 152-155. DOI:10.7506/spkx1002-6630-201612027.
[16] CHANG E, POURMAL S, ZHOU C, et al. N-terminal amino acid sequence determination of proteins by N-terminal dimethyl labeling: pitfalls and advantages when compared with Edman degradation sequence analysis[J]. Journal of Biomolecular Techniques, 2016, 27(2): 61. DOI:10.7171/jbt.16-2702-002.
[17] KONDO T, SAWA S, KINOSHITA A, et al. A plant peptide encoded by CLV3 identif i ed by in situ MALDI-TOF MS analysis[J]. Science, 2006, 313: 845. DOI:10.1126/science.1128439.
[18] ENNAAS N, HAMMAMI R, BEAULIEU L, et al. Purification and characterization of four antibacterial peptides from protamexhydrolysate of Atlantic mackerel (Scomber scombrus) by-products[J]. Biochemical and Biophysical Research Communications, 2015, 462(3): 195-200. DOI:10.1016/j.bbrc.2015.04.091.
[19] LIU P, ZHAO M, CAO y, et al. Purification and identification of anti-oxidant soybean peptides by consecutive chromatography and electrospray ionization-mass spectrometry[J]. Rejuvenation Research, 2014, 17(2): 209-211. DOI:10.1089/rej.2013.1520.
[20] 王英武, 王玲, 顾景凯, 等. 电喷雾-串联四极杆-飞行时间质谱法分析寡肽的一级结构[J]. 分析化学, 2003, 31(6): 709-712. DIOI:10.3321/j.issn:0253-3820.2003.06.017.
[21] 赵小龙, 刘大川, 刘晔, 等. 棉籽分离蛋白制备工艺研究[J]. 中国油脂, 2014(12): 31-34.
[22] NIELSEN P M, PETERSEN D, DAMBMANN C. Improved method for determining food protein degree of hydrolysis[J]. Journal of Food Science, 2001, 66(5): 642-646. DOI:10.1111/j.1365-2621.2001.tb04614.x.
[23] 王娣, 许晖, 钱时权, 等. 麝香草酚对食品常见污染菌的抑菌作用[J].食品科学, 2013, 34(3): 119-122.
[24] PUCHALSKA P, GARCIA M C, MARINA M L. Identification of native angiotensin-I converting enzyme inhibitory peptides in commercial soybean based infant formulas using HPLC-QTOF-MS[J]. Food Chemistry, 2014, 157: 62-69. DOI:10.1016/ j.foodchem.2014.01.130.
[25] 肖向红, 徐义刚, 柴龙会. 中国林蛙皮肤抗菌活性肽的分离提取[J]. 东北林业大学学报, 2005, 33(1): 44-46. DOI:10.3969/ j.issn.1000-5382.2005.01.016.
[26] HUNTINGTON K M, yI T, WEI y, et al. Synthesis and antibacterial activity of peptide deformylase inhibitors[J]. Biochemistry, 2000, 39(15): 4543-4551. DOI:10.1021/bi992452y.
[27] SILA A, HEDHILI K, PRZyByLSKI R, et al. Antibacterial activity of new peptides from barbel protein hydrolysates and mode of action via a membrane damage mechanism against Listeria monocytogenes[J]. Journal of Functional Foods, 2014, 11: 322-329. DOI:10.1016/ j.jff.2014.10.006.
[28] 王兴顺, 耿艺介, 李文楚. 抗菌肽抗菌机制及其应用研究进展[J].微生物学免疫学进展, 2012, 40(4): 70-76. DOI:10.3969/ j.issn.1005-5673.2012.04.016.
[29] POWERS J S, HANCOCK R E W. The relationship between peptide structure and antibacterial activity[J]. Peptides, 2003, 24(11): 1681-1691. DOI:10.1016/j.peptides.2003.08.023.
[30] BIZIULEVICIUS G A. How food-borne peptides may give rise to their immunostimulatory activities: a look through the microbiologist’s window into the immunologist’s garden (hypothesis)[J]. British Journal of Nutrition, 2004, 6(92): 1009-1012. DOI:10.1079/BJN20041270.
Purification and Identification of Antibacterial Peptides from Cottonseed Protein Isolate Hydrolysates
HAN Xiaoyan1, BAO Yuming1, XIN Fengjiao1, HUANG Ying1, Christophe BLECKER2, DAI Xiaofeng1,*
(1. Key Laboratory of Agro-Products Processing, Ministry of Agriculture, Institute of Food Science and Technology, Chinese Academy of Agricultural Sciences, Beijing 100193, China; 2. Department of Food Science, University of Liège, Liège 999013, Belgium)
Cottonseed protein isolate (CPI) was digested in vitro to prepare hydrolysates with antibacterial activity. Ultrafiltration (UF), anion exchange chromatography (AEC), and semi preparative high performance liquid chromatography (semi-P-HPLC) were used to isolate and purify antibacterial peptides from CPI hydrolysates, and the purified peptides were sequenced by electrospray ionization-tandem mass spectrometry (ESI-MS/MS). During the purification process, CPI hydrolysates were separated into three fractions: U-Ⅰ, U-Ⅲ and U-III by UF and the obtained U-Ⅲ, with higher antibacterial ability, was further separated into QF-Ⅰ, QF-Ⅱ and QF-Ⅲ by AEC. After filtration, QF-Ⅱ, which showed higher antibacterial ability, was further fractionated using semi-P-HPLC into four subfractions: PF-Ⅰ, PF-Ⅱ, PF-Ⅲ and PF-Ⅳ, among which, PF-Ⅲ was determined to have the highest antibacterial activity. The purity of PF-Ⅲ showed a single peak in HPLC. Finally, by ESI-MS/MS, and the amino acid sequence of the peptide was identified as ISGLIYEETR (Ile-Ser-Gly-Leu-Ile-Tyr-Glu-Glu-Thr-Arg).
cottonseed protein isolate hydrolysates; peptide with antibacterial activity; isolation and purification; amino acid sequence
10.7506/spkx1002-6630-201711020
TS201.3
A
1002-6630(2017)11-0122-06
韩晓燕, 包郁明, 辛凤姣, 等. 棉籽抗菌活性肽的分离纯化及鉴定[J]. 食品科学, 2017, 38(11): 122-127. DOI:10.7506/ spkx1002-6630-201711020. http://www.spkx.net.cn
HAN Xiaoyan, BAO Yuming, XIN Fengjiao, et al. Purification and identification of antibacterial peptides from cottonseed protein isolate hydrolysates[J]. Food Science, 2017, 38(11): 122-127. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201711020. http://www.spkx.net.cn
2016-05-18
科技部国际科技合作项目(2016-X31)
韩晓燕(1989—),女,硕士,研究方向为食品生物技术。E-mail:hanxiaoyan131@126.com
*通信作者:戴小枫(1962—),男,研究员,博士,研究方向为加工有害生物防控。E-mail:daixiaofeng@caas.cn
——全棉籽的加工与利用

