还原协同加热处理对花生过敏原Ara h 2结构及抗原性的影响
李 坤,连 君,朱 瑾,曾 辛,陈红兵,吴志华,*
还原协同加热处理对花生过敏原Ara h 2结构及抗原性的影响
李 坤1,2,连 君1,3,朱 瑾4,曾 辛5,陈红兵1,6,吴志华1,6,*
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.南昌大学资源环境与化工学院,江西 南昌 330047;3.南昌大学食品学院,江西 南昌 330047;4.江西省儿童医院感染科,江西 南昌 330006;5.江西省妇幼保健院临床实验室,江西 南昌 330031;6.南昌大学中德联合研究院,江西 南昌 330047)
花生过敏能引起荨麻疹、呕吐甚至休克等症状,通常是终生性过敏。本研究运用加热处理、半胱氨酸还原对Ara h 2进行单独和复合处理,采用圆二色谱、紫外扫描光谱、间接竞争酶联免疫吸附法分别检测蛋白加工前后的结构与抗原性变化。结果显示,单一的加热和半胱氨酸还原处理过的蛋白结构与抗原性只发生部分变化。而复合处理中,在加热条件下,半胱氨酸还原蛋白的能力明显增强,还原后的蛋白二级结构与三级结构发生大幅变化,抗原性显著降低。研究结果表明,二硫键对于蛋白Ara h 2结构稳定具有重要作用,二硫键被还原和加热过程破坏后,蛋白的抗原性和结构即发生重大变化。还原协同加热处理有望大幅改善2S球蛋白的结构和致敏性,可以作为蛋白脱敏加工的备选方法。
花生;热加工;Ara h 2;二硫键;结构;抗原性
引文格式:
李坤, 连君, 朱瑾, 等. 还原协同加热处理对花生过敏原Ara h 2结构及抗原性的影响[J]. 食品科学, 2017, 38(11): 89-94. DOI:10.7506/spkx1002-6630-201711015. http://www.spkx.net.cn
LI Kun, LIAN Jun, ZHU Jin, et al. Synergistic effect of cysteine reduction and thermal treatment on structure and antigenicity of peanut allergen Ara h 2[J]. Food Science, 2017, 38(11): 89-94. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201711015. http://www.spkx.net.cn
随着人们生活质量的提高,对于食物的选择不再局限于温饱,更加注重的是安全和质量,而食物过敏的问题及研究也越来越受到重视,世界公认的八大过敏原中,花生位居其一[1-2]。由于花生蛋白的营养高风味佳,作为食物配料被广泛应用于食品工业,其致敏性引起了广泛关注[3-4]。目前已知的花生过敏原可分为4 类,分别为Cupin超家族(Ara h 1、3)、醇溶蛋白超家族(Ara h 2、6、7、9)、抑制蛋白家族(Ara h 5)、Bet V1同源蛋白(Ara h 8)以及另外两种:Oleosin油质蛋白(Ara h 10、11)、Defensin抵抗素(Ara h 12、13)[5]。其中Ara h 1、Ara h 2、Ara h 3、Ara h 6是花生的主要过敏原[6],而Ara h 2是最强的花生过敏原之一,并且能被90%的花生过敏患者血清识别,因此被认为是花生中同时具有强致敏性和广泛性的过敏原[7-8]。
Ara h 2属于2S种子贮藏蛋白家族,有Ara h 2.01和Ara h 2.02两个亚型,分子质量分别约为18.7 kD和20.1 kD,pI值为5.2,占花生蛋白总量的10%左右[7,9-10]。关于花生过敏原Ara h 2致敏性的研究,国内外已有了较多的报道[11-15],已有报道称二硫键对于蛋白Ara h 2的致敏性有重要影响[16-17],但这些研究采用的还原剂均为二硫苏糖醇(dithiothreitol,DTT),它因为具有高毒性而不被允许运用在食品加工中,而且这些研究中对于蛋白还原前后结构变化的细致探讨较少,本研究中选择半胱氨酸作为还原剂,半胱氨酸是一种天然的还原性氨基酸,在食品加工中具有广泛用途[18-20],而半胱氨酸是一种弱还原剂,本实验首先研究了加热条件下半胱氨酸还原能力的变化,然后运用圆二色谱法及紫外扫描色谱法测定表征蛋白在还原处理前后高级结构的变化,通过间接竞争酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)检测加工蛋白的抗原性变化,深入分析了半胱氨酸还原协同加热处理对于Ara h 2结构以及抗原性的影响,为半胱氨酸在食品加工中的进一步应用以及为脱敏或低致敏花生蛋白的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
花生产自江西省,为赣花花生品种,购自江西省南昌市青山湖市场。花生蛋白Ara h 2及其多克隆兔血清由食品科学与技术国家重点实验室自行制备[21]。
酶标板 美国Corning公司;其他试剂 美国Sigma公司。
1.2 仪器与设备
J-810圆二色谱仪 日本Jasco公司;UV WinLab V6紫外-可见分光光度仪 美国PerkinElmer公司;1860酶标仪 美国Bio-Rad公司。
1.3 方法
1.3.1 还原和加热处理
依照胡纯秋等[21]所述方法进行过敏原Ara h 2的纯化,纯化后的花生蛋白Ara h 2,其纯度在90%以上。为比较热加工与半胱氨酸还原单独处理或复合处理对Ara h 2过敏原蛋白的构象及抗原性影响,分别准备4组Ara h 2样品,样品经50 mmol/L的磷酸盐缓冲液(pH 7.5)稀释到1 mg/mL,第1组为未处理样品(记为N-Ara h 2),第2组为5 mmol/L的半胱氨酸常温(室温25 ℃,常温37 ℃:仅在还原程度分析中用到该样品)还原处理1 h样品(记为R-Ara h 2),第3组为80 ℃条件下加热处理1 h样品(记为H-Ara h 2),第4组为80 ℃条件下、5 mmol/L半胱氨酸还原处理1 h样品(记为RH-Ara h 2)。采用水浴加热的方法对蛋白液进行加工处理。取部分处理后的样品进行非还原性十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE),其余样品立即于-20 ℃进行保存。
1.3.2 蛋白还原程度测定
参照Ellman[22]的方法来测定上述4 组溶液中游离巯基基团的含量。将1 mL样品溶液加入到4 mL含有0.05 mL 0.01 mol/L的5,5’-二硫双(2-硝基苯甲酸)(5,5’-dithiobis-(2-nitrobenzoic acid),DTNB)的磷酸盐缓冲液中(0.1 mol/L,pH 8.0),混和,避光反应20 min后,在412 nm波长处测定其吸光度。
1.3.3 蛋白空间结构模拟分析
采用同源建模的方法模拟出Ara h 2空间结构模型,用已知晶体衍射结构的Ara h 6(PDB数据库编号为1W2Q)作为模板建模,登入SWISS MODEL网站(http:// swissmodel.expasy.org/),在自动建模模式下,输入Ara h 2的氨基酸序列,24 h内登入下载计算得到的蛋白模型文档。最后运用蛋白空间结构分析软件Pymol对得到的Ara h 2高级结构进行分析。
1.3.4 蛋白质二级结构分析
为表征蛋白的二级结构的变化,采用J-810圆二色谱仪分别对天然Ara h 2和3 个处理的蛋白样品进行色谱检测。扫描区间为240~190 nm,速率为500 nm/min,带宽1 nm,光谱间隔0.1 nm,3 次累积。将得到的数据导入到圆二色谱分析网站(http://dichroweb.cryst.bbk.ac.uk/html/ home.stml)中进行分析,得到各蛋白二级结构成分的含量,获知加工前后α-螺旋、β-折叠、β-转角以及无规卷曲结构的相对含量变化。
1.3.5 蛋白质三级结构分析
将天然Ara h 2和3 个处理的样品用UV WinLab V6紫外-可见分光光度仪进行紫外检测。扫描范围为250~350 nm,扫描速率为480 nm/min,光谱间隔1 nm。
1.3.6 抗原性分析
用间接竞争ELISA测定还原处理前后蛋白的抗原性[21],96 孔酶标板A中包被2.5 μg/mL的第1组样品未处理Ara h 2(100 μL/孔),4 ℃过夜。次日倾去板A中包被液,用250 μL/孔的PBST(含有0.05%吐温-20的磷酸盐缓冲液)洗涤3 次,每次5 min。然后,每孔加250 μL封阻液(5%脱脂乳),37 ℃孵育1 h,用PBST洗涤酶标板3 次。取另一块酶标板B以相同的方式封阻、洗净,然后加入60 μL的竞争蛋白(加工蛋白:第2、3、4组样品)和等体积的1∶5 000稀释的抗Ara h 2多克隆兔血清,实验空白对照组是将磷酸盐缓冲液替代竞争蛋白参与反应,37 ℃反应1 h。然后取100 μL B板中反应液加入到A板中,37 ℃反应1 h。洗板3 次后,每孔中加入100 μL 1∶5 000稀释的HRP酶标羊抗兔IgG,37 ℃反应1 h。反应结束后,洗板3 次,最后加OPD溶液显色15 min,用酶标仪在490 nm波长处测量其OD值。空白对照组的OD值为B0,各质量浓度(0.05、0.10、0.20、0.50、1.00、2.00、5.00、10.00 μg/mL)的加工蛋白对应的OD值为B。然后,以(B/B0)值为纵坐标,以相对应的竞争蛋白质量浓度为横坐标,利用Origin软件绘制竞争ELISA曲线,并利用该软件计算出IC50值,IC50值越小代表抗原性越强。
2 结果与分析
2.1 纯化和还原处理的Ara h 2的SDS-PAGE鉴定
如图1中泳道1所示,与标准蛋白Marker对比蛋白质分子质量,利用Quantity One软件分析,分离纯化的Ara h 2的纯度达到了95%以上,加热处理的Ara h 2的条带位置、强度均与天然蛋白相当,说明加热不会破坏蛋白Ara h 2的一级结构,并且保持较为稳定的溶解状态。而热加工联合半胱氨酸共同作用处理的Ara h 2(泳道4)与经半胱氨酸处理过的Ara h 2(泳道3)条带位置相当,且均处于天然蛋白的上方。推测原因为单独利用半胱氨酸处理的蛋白溶液与上样缓冲液混合后,由于加工蛋白添加有半胱氨酸,在100 ℃加热5 min条件下,蛋白Ara h 2的二硫键很可能全部被半胱氨酸还原,效果与加热联合半胱氨酸处理的蛋白相当,两种条件下均使其结构得到最大舒展,分子半径较大。由斯托克斯定律可知,蛋白泳动速率与分子半径成反比,因此,在非还原性SDS-PAGE中,蛋白受到凝胶孔径的影响,即表现出泳动较慢的特性。
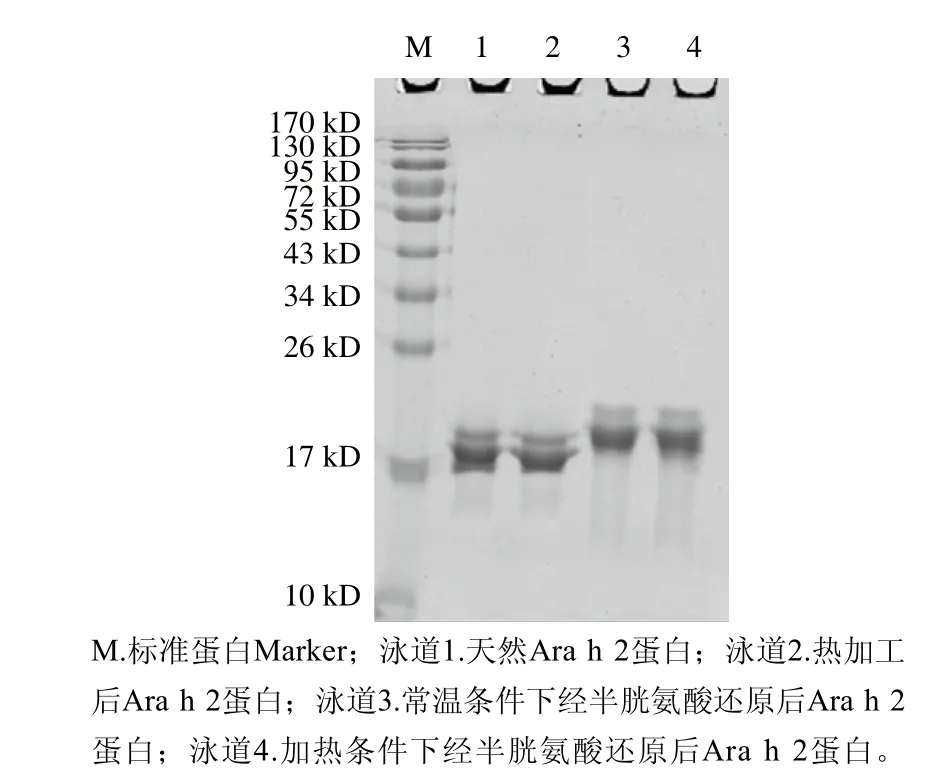
图1 天然与处理后Ara h 2 SDS-PAGE分析Fig. 1 SDS-PAGE of native and treated Ara h 2
2.2 蛋白还原程度分析
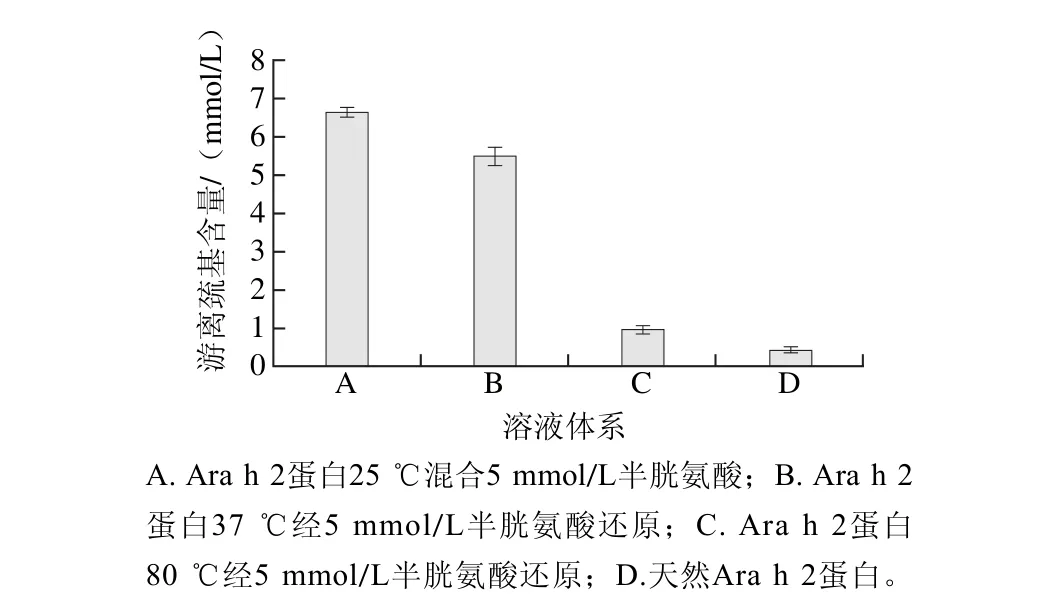
图2 经处理后蛋白质溶解体系中游离巯基含量变化Fig. 2 Content of free sulfhydryl groups in treated protein solution
溶液体系中游离巯基的含量变化可以初步评判蛋白的还原程度。如图2所示,37 ℃条件下蛋白经半胱氨酸常温还原1 h后,其反应体系中游离巯基含量相比于室温(25 ℃)降低了15.38%,而当半胱氨酸在较高温度(80 ℃)条件下加热处理蛋白后,其溶液体系中游离巯基含量显著降低,与体系A相比降低了86.15%。因此,25、37 ℃条件下半胱氨酸不能有效地还原蛋白Ara h 2,而加热处理则明显能促进半胱氨酸的还原反应。一部分原因是加热处理改变了蛋白的结构使得半胱氨酸与二硫键能得到更多的接触,另一部分原因是加热处理提供了反应足够的能量,使得还原反应顺利进行。因此,在加热条件下,经半胱氨酸处理的Ara h 2得到很好地还原,相比于半胱氨酸或热加工单独处理,复合处理能够对Ara h 2过敏原的抗原性及结构产生更大的影响[23]。
2.3 蛋白空间结构模拟分析
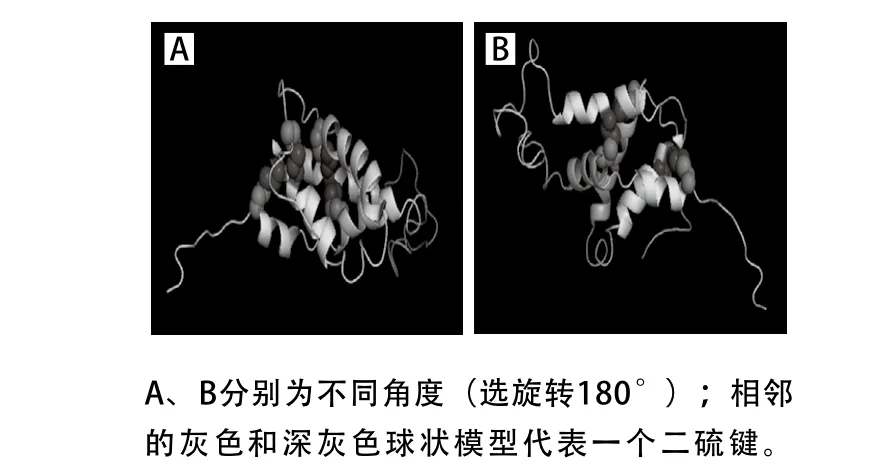
图3 Ara h 2.01蛋白空间结构Fig. 3 Spatial structure of Ara h 2.01
花生过敏原Ara h 2属于2S白蛋白家族,含有8 个半胱氨酸残基,形成了4 个保守的二硫键。图3展示的是同源建模得到的Ara h 2.01的三维空间结构模型,可以看出α-螺旋是蛋白二级结构的主体成分,β-折叠和β-转角含量次之,这与Koppelman[24]、Wu[25]等的研究结果类似。另外每个二硫键的两端都连接在两个不同的α-螺旋结构上,5 个α-螺旋结构中只有其中一个没有与二硫键相连接。由此可以从分子水平上初步推测二硫键对于Ara h 2蛋白α-螺旋结构以及高级结构的稳定具有很重要的作用。
2.4 加热和还原处理对Ara h 2远紫外区圆二色光谱的影响
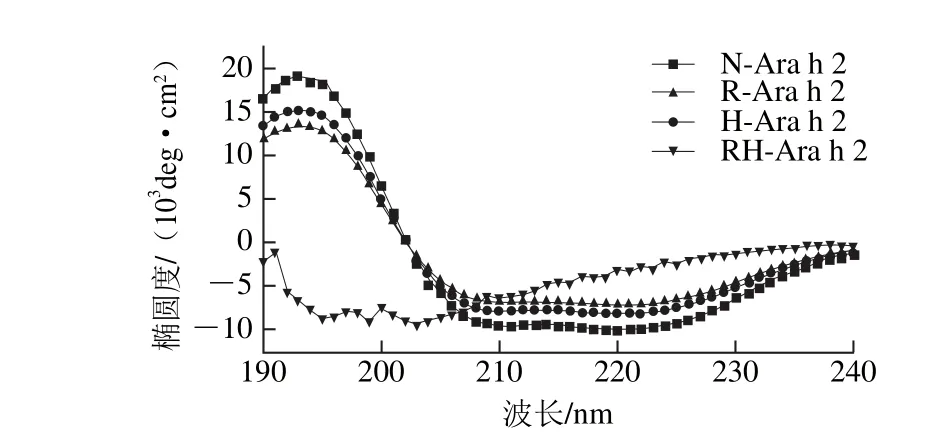
图4 热加工和还原处理对Ara h 2远紫外区圆二色谱的影响Fig. 4 Effect of heating and reducing treatment on the far-UV CD spectrum of Ara h 2
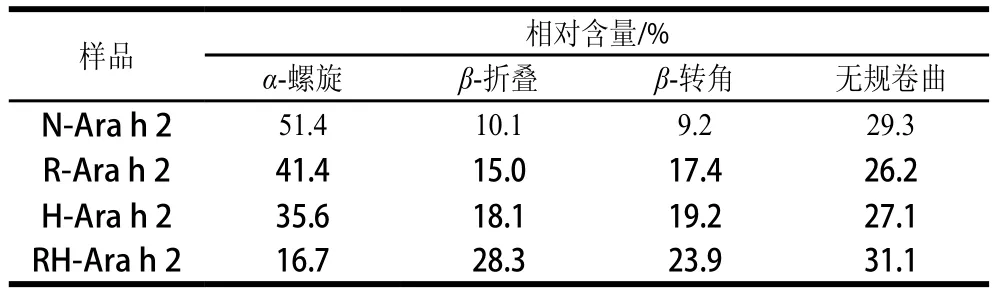
表1 Ara h 2蛋白二级结构经热加工和还原处理后各构象的相对含量Table 1 Percentages of conformational units in Ara h 2 secondary structures after heat and reducing treatment
蛋白质的远紫外圆二色光谱可以反映蛋白质二级结构信息,从图4可以看出,天然蛋白Ara h 2圆二色谱图在在190 nm附近有1 个正峰,222和208 nm有2 个负峰,说明天然Ara h 2存在α-螺旋结构,且相对含量如表1所示为51.4%,经过单一的加热处理和还原处理之后,蛋白的α-螺旋结构相对含量较天然蛋白均有了明显降低,β-折叠和β-转角相对含量均有了明显增加。但当蛋白经过加热和半胱氨酸还原复合处理之后,α-螺旋相对含量为16.7%,较天然蛋白降低了67.6%,β-折叠和β-转角相对含量均有了显著增加,分别增加了180.2%和159.8%,而无规卷曲相对含量却没有明显变化,这与Mattison等[26]的研究结果相似。结果表明,单一的加热处理和半胱氨酸还原处理均只能使蛋白二级结构发生部分变化,而加热和半胱氨酸还原复合处理能使蛋白二级结构发生大幅变化,蛋白的α-螺旋相对含量显著降低,β-折叠和β-转角相对含量显著增加。从实验结果可以推测,蛋白Ara h 2经过高温还原之后,分子内二硫键打开,其所连接的α-螺旋结构转变为了β-折叠和β-转角结构。
2.5 加热和还原处理对Ara h 2远紫外光谱的影响
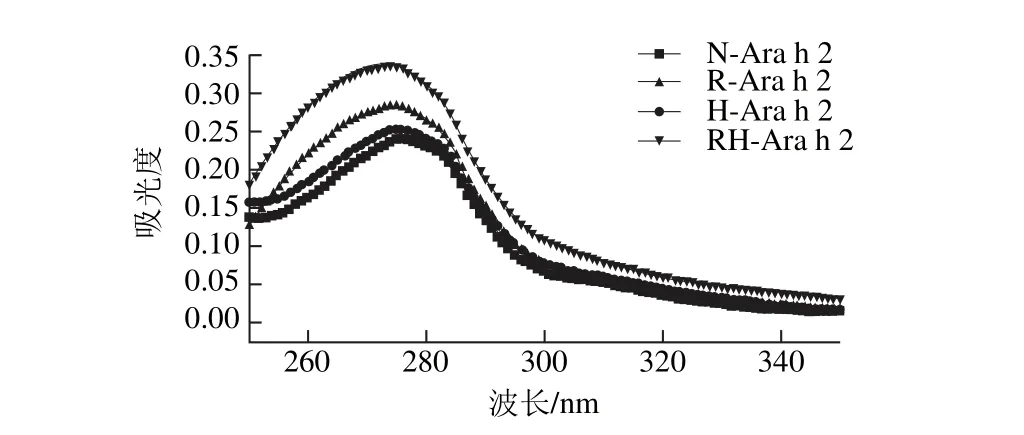
图5 热加工及还原处理对Ara h 2蛋白紫外吸收光谱的影响Fig. 5 Effect of heating and reducing treatment on the UV absorptionspectrum of Ara h 2
蛋白质分子上色氨酸和酪氨酸残基具有紫外有吸收的特性,吸收峰约在280 nm波长处[27]。因此,蛋白对紫外光吸收的情况可以反映蛋白构象的变化。由图5可知,加热处理蛋白的最大吸收峰略高于天然蛋白,当蛋白经过半胱氨酸还原后,蛋白在250~285 nm波段内紫外吸收强度要稍大于天然蛋白和热处理蛋白,但在285~350 nm波段内无明显差别,而当蛋白经过加热与还原联合处理后,其紫外吸收强度在整个波段内都要大于其他3 种蛋白,并且其最大吸收峰值有了显著增加,说明单一的加热处理和单一的半胱氨酸还原处理均只能使蛋白三级结构得到部分展开,而加热和半胱氨酸还原联合处理能使蛋白高级结构得到更充分展开,暴露出更多的色氨酸和酪氨酸等杂环氨基酸。
2.6 抗原性分析
为探索加热和还原处理对蛋白Ara h 2抗原性的影响,采用间接竞争ELISA法检测其与兔血清的反应强度[28]。由图6可知,天然Ara h 2的IC50值为0.91 μg/mL,热处理Ara h 2的IC50值为1.66 μg/mL,还原处理的Ara h 2的IC50值为1.75 μg/mL,热处理和还原复合处理后的Ara h 2,其IC50值为7.92 μg/mL,而IC50值越小代表抗原性越强。相比于天然Ara h 2,热处理和还原处理后蛋白的抗原性均有明显降低,但不显著(P>0.05),当蛋白经过加热和半胱氨酸还原联合处理后,其抗原性较其他3个蛋白均有显著降低(P<0.05)。过敏原的致敏性由其构象性表位和线性表位决定[29],加热处理和还原处理均可在一定程度上改变蛋白的结构,进而破坏原有的构象性表位。半胱氨酸是一个较弱的还原剂,加热处理则可以促进还原反应的进行,进而使蛋白结构发生改变,抗原性表位得到破坏或掩蔽,导致其抗原性有了显著降低[30]。
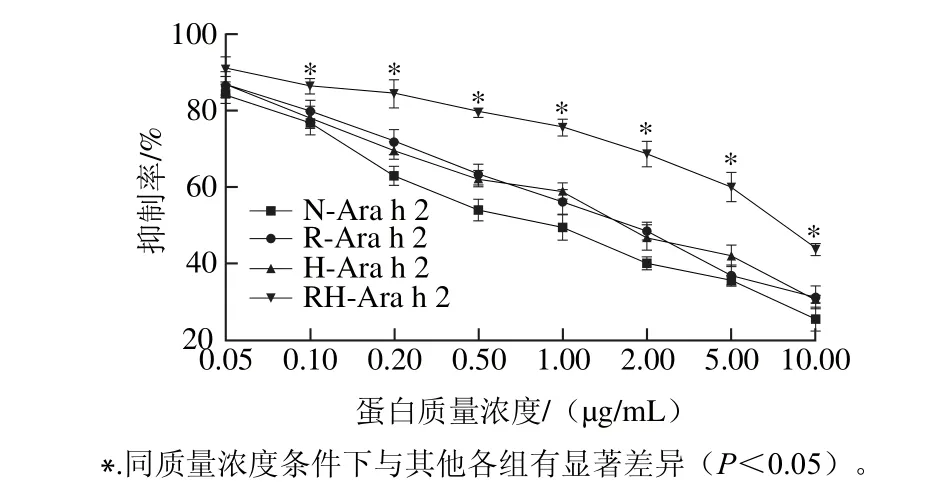
图6 热加工及还原处理对Ara h 2蛋白抗原性的影响Fig. 6 Effect of heating and reducing treatment on the antigenicity of Ara h 2
3 结 论
单独的加热处理和半胱氨酸还原处理均只能使蛋白结构和性质发生小的变化。而加热和半胱氨酸还原复合处理则能高效地还原Ara h 2,被还原后的蛋白结构发生大幅变化,α-螺旋相对含量显著降低,β-折叠和β-转角相对含量显著增加,更多的杂环氨基酸暴露在分子表面。结构上的改变使得过敏原的抗原性表位发生掩蔽或者破坏,导致Ara h 2的抗原性显著降低,进而推测Ara h 2的致敏性可能降低。由此可见,还原协同加热处理有望大幅改善2S球蛋白的结构和抗原性甚至是致敏性,因此可以作为蛋白脱敏加工的备选方法。
[1] VEREDA A, van HAGE M, AHLSTEDT S, et al. Peanut allergy: clinical and immunologic differences among patients from 3 different geographic regions[J]. Journal of Allergy and Clinical Immunology, 2011, 127(3): 603-607. DOI:10.1016/j.jaci.2010.09.010.
[2] CHEN X, NEGI S S, LIAO S, et al. Conformational IgE epitopes of peanut allergens Ara h 2 and Ara h 6[J]. Clinical and Experimental Allergy, 2016, 46(8): 1120-1128. DOI:10.1111/cea.12764.
[3] SHEWRy P R, NAPIER J A, TATHAM A S, et al. Seed storage proteins: structures and biosynthesis[J]. The Plant Cell, 1995, 7(7): 945. DOI:10.1105/tpc.7.7.945.
[4] HUSAIN Z, SCHWARTZ R A. Peanut allergy: an increasingly common life-threatening disorder[J]. Journal of the American Academy of Dermatology, 2012, 66(1): 136-143. DOI:10.1016/ j.jaad.2011.02.031.
[5] MUELLER G A, GOSAVI R A, POMÉS A, et al. Ara h 2: crystal structure and IgE binding distinguish two subpopulations of peanut allergic patients by epitope diversity[J]. Allergy, 2011, 66(7): 878-885. DOI:10.1111/j.1398-9995.2010.02532.x.
[6] WIJK F V, HARTGRING S, KOPPELMAN S, et al. Mixed antibody and T cell responses to peanut and the peanut allergens Ara h 1, Ara h 2, Ara h 3 and Ara h 6 in an oral sensitization model[J]. Clinical and Experimental Allergy, 2004, 34(9): 1422-1428. DOI:10.1111/j.1365-2222.2004.02062.x.
[7] STANLEy J S, KING N, BURKS A W, et al. Identif i cation and mutational analysis of the immunodominant IgE binding epitopes of the major peanut allergen Ara h 2[J]. Archives of Biochemistry and Biophysics, 1997, 342: 244-253. DOI:10.1111/j.1365-2222.2004.02062.x.
[8] LEHMANN K, HOFFMANN S, NEUDECKER P, et al. High-yield expression in Escherichia coli, purification, and characterization of properly folded major peanut allergen Ara h 2[J]. Protein Expression and Purif i cation, 2003, 31: 250-259. DOI:10.1016/s1046-5928(03)00190-6.
[9] McDERMOTT R, PORTERFIELD H, MEZAyEN R, et al. Contribution of Ara h 2 to peanut-specific, immunoglobulin E-mediated, cell activation[J]. Clinical and Experimental Allergy, 2007, 37: 752-763. DOI:10.1111/j.1365-2222.2007.02701.x.
[10] PALMER G W, DIBBERN D A, BURKS A W, et al. Comparative potency of Ara h 1 and Ara h 2 in immunochemical and functional assays of allergenicity[J]. Clinical Immunology, 2005, 115(3): 302-312. DOI:10.1016/j.clim.2005.02.011.
[11] RAMOS M L, HUNTLEy J J, MALEKI S J, et al. Identification and characterization of a hypoallergenic ortholog of Ara h 2.01[J]. Plant Molecular Biology, 2009, 69(3): 325-335. DOI:10.1007/s11103-008-9428-z.
[12] MALEKI S J, VIQUEZ O, JACKS T, et al. The major peanut allergen, Ara h 2, functions as a trypsin inhibitor, and roasting enhances this function[J]. Journal of Allergy and Clinical Immunology, 2003, 112(1): 190-195. DOI:10.1067/mai.2003.1551.
[13] BERNARD H, GUILLON B, DRUMARE M F, et al. Allergenicity of peanut component Ara h 2: contribution of conformational versus linear hydroxyproline-containing epitopes[J]. Journal of Allergy and Clinical Immunology, 2015, 135(5): 1267-1274. DOI:10.1016/ j.jaci.2014.10.025.
[14] ZHANG W, ZHU Q, ZHANG T, et al. Thermal processing effects on peanut allergen Ara h 2 allergenicity in mice and its antigenic epitope structure[J]. Food Chemitry, 2016, 212: 657-662. DOI:10.1016/ j.foodchem.2016.06.036.
[15] BENCHARITIWONG R, van der KLEIJ H P, KOPPELMAN S J, et al. Effect of chemical modifications on allergenic potency of peanut proteins[J]. Allergy Asthma Process, 2015, 36(3): 185-191. DOI:10.2500/aap.2015.36.3840.
[16] APOSTOLOVIC D, LUyKX D, WARMENHOVEN H, et al. Reduction and alkylation of peanut allergen isoforms Ara h 2 and Ara h 6; characterization of intermediate and end products[J]. Biochimica et Biophysica Acta-Biomembranes, 2013, 1834(12): 2832-2842. DOI:10.1016/j.bbapap.2013.10.004.
[17] STARKL P, FELIX F, KRISHNAMURTHy D, et al. An unfolded variant of the major peanut allergen Ara h 2 with decreased anaphylactic potential[J]. Clinical and Experimental Allergy, 2012, 42: 1801-1812. DOI:10.1111/cea.12031.
[18] NAIRN N W, BARIOLA P A, GRADDIS T J, et al. Cysteine as a monothiol reducing agent to prevent copper-mediated oxidation of interferon beta during pegylation by CuAAC[J]. Bioconjugate Chemistry, 2015, 26(10): 2070-2075. DOI:10.1021/acs. bioconjchem.5b00320.
[19] 焦凌霞, 孔瑾. 添加半胱氨酸对提高发酵型酸豆乳中益生菌存活力的研究[J]. 食品工业科技, 2006, 27(5): 88-89. DOI:10.13386/ j.issn1002-0306.2006.05.022
[20] 贾云芝, 陈志周. 还原剂对大豆蛋白/聚乙烯醇复合薄膜性能的影响[J]. 农业工程学报, 2012, 28(5): 312-316. DOI:10.3969/ j.issn.1002-6819.2012.z1.052.
[21] 胡纯秋, 高金燕, 陈红兵. 热加工对花生过敏原 Ara h 2抗原性及构象的影响[J]. 光谱学与光谱分析, 2010, 30(9): 2550-2554. DOI:10.3964/ j.issn.1000-0593( 2010) 09-2550-05.
[22] ELLMAN G L. Tissue sulfhydryl groups[J]. Archives of Biochemistry and Biophysics, 1959, 82(1): 70-77. DOI:10.1016/0003-9861(59)90090-6.
[23] WATANABE H, TODA M, SEKIDO H, et al. Heat treatment of egg white controls allergic symptoms and induces oral tolerance to ovalbumin in a murine model of food allergy[J]. Molecular Nutrition and Food Research, 2014, 58(2): 394-404. DOI:10.1002/ mnfr.201300205.
[24] KOPPELMAN S, de JONG G, LAAPER E M, et al. Purification and immunoglobulin E-binding properties of peanut allergen Ara h 6: evidence for cross‐reactivity with Ara h 2[J]. Clinical and Experimental Allergy, 2005, 35(4): 490-497. DOI:10.1111/j.1365-2222.2005.02204.x.
[25] WU Z H, LIAN J, HAN y L, et al. Crosslinking of peanut allergen Ara h 2 by polyphenol oxidase: digestibility and potential allergenicity assessment[J]. Journal of the Science of Food and Agriculture, 2016, 96(10): 3567-3574. DOI:10.1002/jsfa.7542.
[26] MATTISON C P, GRIMM C C, WASSERMAN R L, et al. In vitro digestion of soluble cashew proteins and characterization of surviving IgE-reactive peptides[J]. Molecular Nutrition and Food Research, 2014, 58(4): 884-893. DOI:10.1002/mnfr.201300299.
[27] NOBLE J E, BAILEy M J. Quantitation of protein[J]. Methods in Enzymology, 2009, 463: 73-95. DOI:10.1016/S0076-6879(09)63008-1.
[28] HU C Q, CHEN H B, GAO J y, et al. High-pressure microf l uidisationinduced changes in the antigenicity and conformation of allergen Ara h 2 purif i ed from Chinese peanut[J]. Journal of the Science of Food and Agriculture, 2011, 91(7): 1304-1309. DOI:10.1002/jsfa.4318.
[29] POMES A. Relevant B cell epitopes in allergic disease[J]. International Archives of Allergy and Immunology, 2010, 152(1): 1-11. DOI:10.1159/000260078.
[30] SEN M, KOPPER R, PONS L, et al. Protein structure plays a critical role in peanut allergen stability and may determine immunodominant IgE-binding epitopes[J]. Journal of Immunology, 2002, 169(2): 882-887. DOI:10.4049/jimmunol.169.2.882.
Synergistic Effect of Cysteine Reduction and Thermal Treatment on Structure and Antigenicity of Peanut Allergen Ara h 2
LI Kun1,2, LIAN Jun1,3, ZHU Jin4, ZENG Xin5, CHEN Hongbing1,6, WU Zhihua1,6,*
(1. State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China; 2. School of Environment and Chemical Engineering, Nanchang University, Nanchang 330047, China; 3. School of Food Science and Technology, Nanchang University, Nanchang 330047, China; 4. Department of Infectious Diseases, Children’s Hospital of Jiangxi Province, Nanchang 330006, China; 5. Clinical Laboratory, Jiangxi Province Maternal and Child Heath Hospital, Nanchang 330031, China; 6. Sino-German Joint Research Institute, Nanchang University, Nanchang 330047, China)
Peanut is listed among the eight major food allergens by the FAO, and peanut allergy is life-long and could cause hives, vomiting or other symptoms. In the present study, thermal treatment and cysteine reduction were applied individually and in combination on peanut allergen Ara h 2 to study their effect on the allergenic protein. The changes in the structure and antigenicity of Ara h 2 were characterized by circular dichroism (CD) spectroscopy, UV spectroscopy and indirect competitive enzyme linked immunosorbent assay (ELISA), respectively. The results showed that thermal treatment and cysteine reduction could individually change the structure of Ara h 2, leading to a slight decrease in the antigenicity. But the combined treatment resulted in a signif i cant decrease in the antigenicity of Ara h 2 due to the enhanced reducing capacity of cysteine under thermal conditions and consequent remarkable changes in the secondary and tertiary structures of the protein. Moreover, the disulf i de bonds played important roles in the structural stability of Ara h 2. When they were destroyed by reduction and heating, the structure and antigenicity changed signif i cantly. These results indicated that reduction combined with heating may be an effective method for eliminating the allergenicity of Ara h 2.
peanut; thermal treatment; Ara h 2; disulf i de bond; structure; antigenicity
10.7506/spkx1002-6630-201711015
TS255.1
A
1002-6630(2017)11-0089-06
2016-07-26
国家高技术研究发展计划(863计划)项目(2013AA102205);国家自然科学基金地区科学基金项目(31260411;81260103;31660446);江西省青年科学家培养对象计划项目(20142BCB23007);江西省自然科学基金项目(20114BAB205012)
李坤(1993—),女,硕士研究生,研究方向为生物化工。E-mail:1964366432@qq.com
*通信作者:吴志华(1976—),男,教授,博士,研究方向为食品科学。E-mail:wuzhihua@ncu.edu.cn

