HPLC法同时测定杏花中阿魏酸、芦丁和异槲皮苷
罗慧玉,闫伟伟,曾春萍,徐 鹏,査建蓬
HPLC法同时测定杏花中阿魏酸、芦丁和异槲皮苷
罗慧玉1,2,闫伟伟1,2,曾春萍1,徐 鹏1,査建蓬2
目的 建立HPLC法同时测定杏花中阿魏酸、芦丁和异槲皮苷。方法 色谱柱为YMC-Pack ODS-A C18柱(250 mm×4.6 mm,5 μm);流动相为乙腈-0.1%磷酸溶液(15∶85);体积流量1.0 mL/min;检测波长为343 nm;柱温为30 ℃。结果 阿魏酸、芦丁和异槲皮苷分别在0.029 08~0.290 8 μg (r=0.999 9)、0.548 4~5.484 2 μg (r=0.999 9)、0.033 07~0.330 7 μg (r=0.999 9)范围内线性关系良好;平均回收率分别为98.31%、98.93%、100.25%,RSD分别为1.0%、0.9%、1.1%。10批杏花样品中阿魏酸、芦丁、异槲皮苷含量测定结果分别为0.105~0.554、3.080~6.933、0.258~0.974 mg/g。结论 该方法多种成分同时测定,操作简便、准确,重复性好,可用于杏花药材的质量控制。
杏花;阿魏酸;芦丁;异槲皮苷;HPLC
0 引言
杏花为蔷薇科植物杏PrunusarmeniacaL.或山杏PrunusarmeniacaL.var.ansuMaxim.的干燥花。杏花除颇具观赏性外,还具有丰富的药用价值,其性温、味苦[1],具有活血补虚的功能,主治妇女不孕,肢体痹痛,手足逆冷[2]。杏花具有补中益气、祛风的作用,可用于营养肌肤,祛除面上粉滓[3-4]。近年研究表明,杏花中含杏花精油[5]及总黄酮类物质[6-7]。杏花虽然药用历史悠久,疗效确切,但在中国药典及各地方标准中均未对其进行收载,难以控制质量。为进一步研究其有效成分,笔者在初步试验的基础上,发现杏花中含有阿魏酸、芦丁、异槲皮苷等成分。本文建立了同时测定杏花中阿魏酸、芦丁和异槲皮苷含量的HPLC法,并用于测定10个不同产地杏花药材中的3种成分,为进一步评价不同产地杏花药材的质量和完善杏花的质量控制提供参考。
1 药材
杏花来源于江苏、陕西蓝田、浙江、陕西旬邑、山西、河南和安徽7个产地,采购于亳州药材市场,由河北省药品检验研究院段吉平主任药师鉴定为蔷薇科植物杏PrunusarmeniacaL.的干燥花,山杏花采摘于北京房山、张家口市区、张家口沽源,均由河北省药品检验研究院段吉平主任药师鉴定为蔷薇科植物山杏PrunusarmeniacaL.var.ansuMaxim.的干燥花。
2 仪器与试药
2.1 仪器 岛津 LC 2010A HT 高效液相色谱仪,SPD-M10A VP二极管阵列检测器,LC solution色谱管理系统(岛津公司),粉碎机,C9860A型超声波清洗仪(天津科贝尔光电技术有限公司,250 W,50 KHz),Sartorius CPA225D分析天平(德国赛多利斯集团),Milli-Q Integral 纯水/超纯水机(美国Millipore公司)。
2.2 试药 阿魏酸对照品(批号:110773-201012,含量:99.6%),芦丁对照品(批号:100080-201408,含量:90.2%),异槲皮苷对照品(批号:111809-201403,含量:92.9%),购自中国食品药品检定研究院;磷酸、乙腈为色谱纯,乙醇为分析纯。
3 方法与结果
3.1 溶液的制备
3.1.1 对照品溶液的制备 精密称取阿魏酸对照品14.60 mg,芦丁对照品30.40 mg,异槲皮苷对照品17.80 mg,分别置于100、10、100 mL 量瓶中,加70%乙醇溶液溶解并稀释至刻度,制成阿魏酸、芦丁和异槲皮苷对照品储备液。精密量取各储备液5 mL,置同一50 mL量瓶中,加70%乙醇溶液稀释至刻度,摇匀,制成每1 mL含阿魏酸14.541 6 μg、芦丁0.274 2 mg、异槲皮苷16.536 2 μg的混合对照品溶液。
3.1.2 供试品溶液的制备 取杏花粉末(过四号筛)约1.0 g,精密称定,置具塞锥形瓶中,精密加入70%乙醇20 mL,密塞,称定重量,超声处理30 min,放冷,再称定重量,用70%乙醇补足减失的重量,摇匀,滤过,用0.45 μm微孔滤膜滤过,取续滤液,即得。
3.2 色谱条件与系统适用性试验 本研究采用YMC-Pack ODS-A C18色谱柱(250 mm×4.6 mm,5 μm);流动相:乙腈-0.1%磷酸(15∶85);检测波长:343 nm;体积流量:1.0 mL/min;柱温:30 ℃;进样量:10 μL。在此色谱条件下,阿魏酸、芦丁和异槲皮苷均与样品中其他组分色谱峰基线分离。混合对照品(A)和样品(B)的色谱图见图1。
3.3 线性关系的考察 分别精密量取混合对照品溶液2、5、10、15、20 μL,按“3.2”项下色谱条件测定。以对照品的峰面积为纵坐标(Y)、对照品的进样量(μg)为横坐标(X),进行线性回归,得回归方程和相关系数。结果见表1。

图1 混合对照品(A)和供试品溶液(B)的HPLC图
3.4 定量限和检测限 按“3.2”项下色谱条件,用对照品溶液稀释的方法进样测定。结果当S/N=10时,阿魏酸、芦丁和异槲皮苷的定量限分别为0.01、0.01、0.01 μg;当S/N=3时,阿魏酸、芦丁和异槲皮苷的检测限分别为0.003、0.003、0.003 μg。
3.5 精密度试验 精密称取杏花粉末(产地:山西)1.0 g,按“3.1.2”项下的方法制备供试品溶液,精密吸取供试品溶液10 μL,按“3.2”项下色谱条件,连续进样6次,测定峰面积,结果显示,阿魏酸、芦丁、异槲皮苷峰面积的RSD值分别为1.0%、0.3%和0.4%,表明仪器的精密度良好。
3.6 重复性试验 精密称取杏花粉末(产地:山西)6份,每份1.0 g,按“3.1.2”项下的方法制备供试品溶液,按“3.2”项下色谱条件进行测定并计算。结果显示,阿魏酸、芦丁、异槲皮苷含量的RSD值分别为0.7%、0.3%、0.8%。表明该方法重复性良好。
3.7 稳定性试验 精密称取杏花粉末(产地:山西)1.0 g,按“3.1.2”项下的方法制备供试品溶液,分别在制备后的0、2、4、8、12、24、48 h,按“3.2”项下色谱条件进样,测定峰面积。结果显示,阿魏酸、芦丁、异槲皮苷峰面积的RSD值分别为1.2%、0.4%、0.6%,表明供试品溶液在室温下48 h内稳定。

表1 化合物的线性范围、回归方程和相关系数
3.8 加样回收率 精密称取已知含量(产地:山西,阿魏酸0.330 mg/g、芦丁6.933 mg/g、异槲皮苷0.321 mg/g)的样品6份,每份约0.5 g,分别精密加入阿魏酸、芦丁、异槲皮苷储备液各1.0、1.2、1.0 mL,按“3.1.2”项下的方法制备供试品溶液,并按“3.2”项下色谱条件进行测定,用回归方程计算回收率,结果见表2。结果显示,阿魏酸、芦丁、异槲皮苷的平均回收率(n=6)分别为98.31%、98.93%、100.25%,RSD分别为1.0%、0.9%、1.1%。
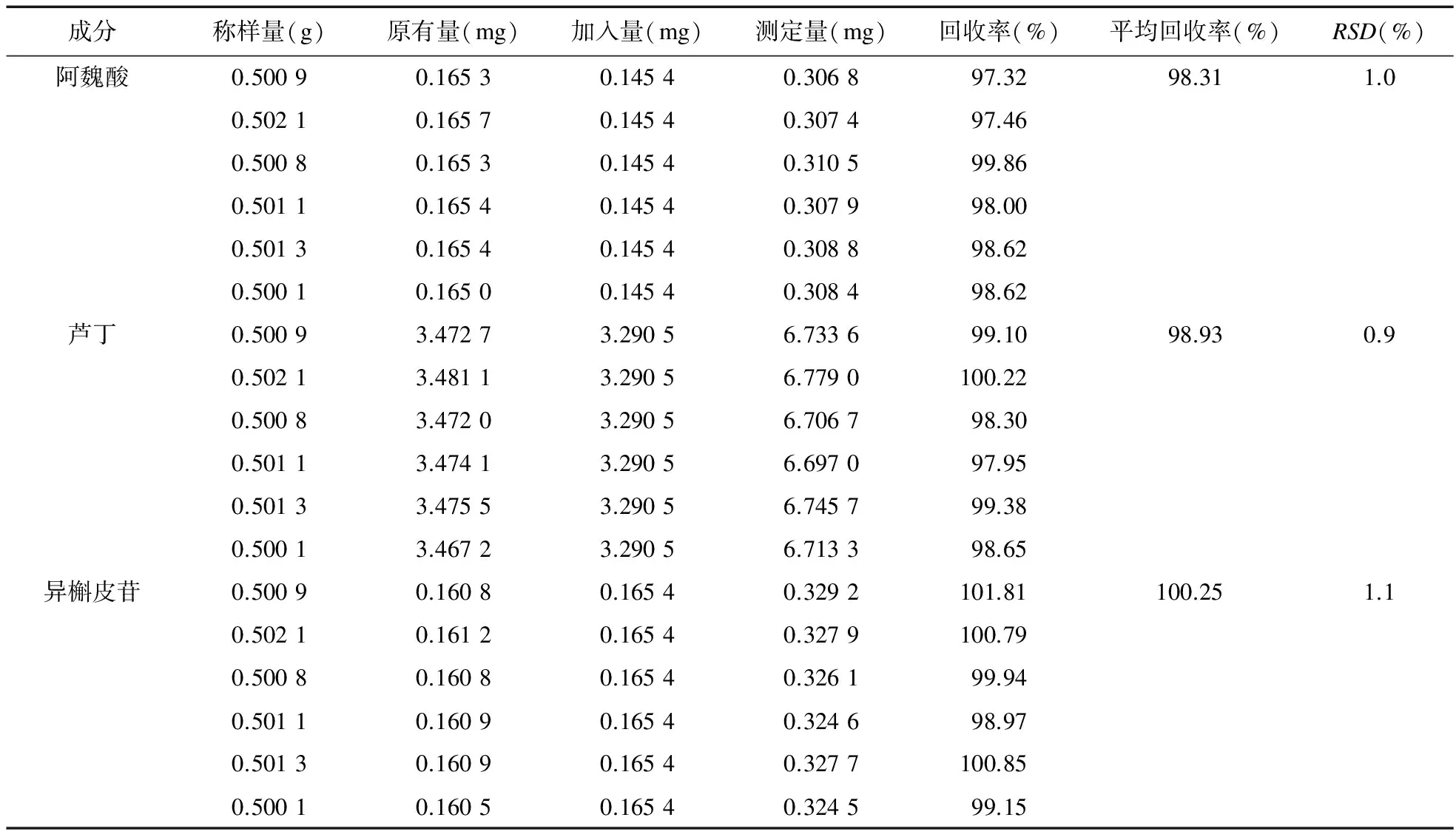
表2 回收率考察结果
3.9 样品测定 取10批次杏花药材粉末各1.0 g,精密称定,按“3.1.2”项下的方法制备供试品溶液,按“3.2”项下的色谱条件测定,按外标法计算3种成分在10批次药材中的含量。结果见表3。10批杏花样品中阿魏酸、芦丁、异槲皮苷的含量测定结果分别为0.105~0.554、3.080~6.933、0.258~0.974 mg/g。
4 结果与讨论
4.1 供试品溶液制备方法的选择与优化 考察了不同粒度药材粉末(过三、四、五号筛)、不同溶剂(水[8]、稀乙醇[9]、70%乙醇[10]和90%甲醇[11])及不同提取方式(超声处理、浸泡过夜和加热回流)对各指标成分提取效率的影响。结果显示,过四号筛粉末的提取量最大;以70%乙醇对各指标成分的提取效率最高;超声30 min与加热回流提取1 h及浸泡过夜(约18 h)对3个目标化合物的提取率相当,考虑到实际操作方便快捷,样品处理选择超声处理30 min。
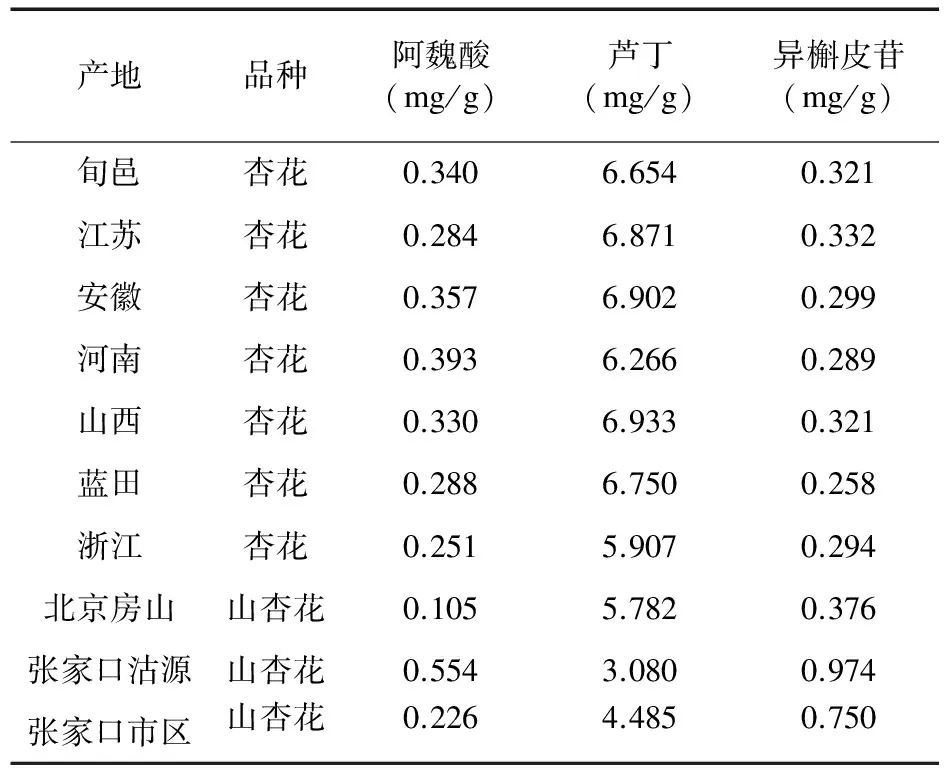
表3 不同产地杏花指标成分测定结果(n=2)
4.2 色谱条件的选择 本实验考察了甲醇-磷酸水溶液、乙腈-磷酸水溶液流动相系统及其不同比例配比等,结果显示,甲醇-磷酸水溶液作为流动相时阿魏酸与其他成分的分离度差,乙腈-0.1%磷酸水溶液(15∶85)作为流动相时,可使3个成分与其他成分很好分离,且峰形好,出峰时间适中,可作为合理流动相。分别对阿魏酸、芦丁和异槲皮苷对照品溶液在190~400 nm范围内通过二极管阵列检测器扫描,得阿魏酸在322 nm波长处有最大吸收,芦丁、异槲皮苷在202、255、356 nm波长处有3个最大吸收。兼顾3种物质的最大吸收,考察了不同波长下的出峰情况,发现在343 nm波长处,37成分吸收较稳定,基线平稳,满足定量测定的要求,故选择343 nm波长作为测定波长。
4.3 10批样品有效成分含量分析 由表3可见,杏花中阿魏酸、芦丁、异槲皮苷的含量范围分别为0.251~0.393、5.907~6.933、0.258~0.332 mg/g,分别最大相差1.6倍、1.2倍、1.3倍,差异较小。山杏花中阿魏酸、芦丁、异槲皮苷的含量范围分别为0.105~0.554、3.080~5.782、0.376~0.974 mg/g,分别最大相差5.3、1.9、2.6倍,存在较明显差异。
[1] 黄志杰.《本草纲目》花卉药物初探[J].甘肃中医,2002,15(2):5-8.
[2] 国家中医药管理局《中华本草》编委会.中华本草(第10卷)[M].上海:上海科学技术出版社,1999:2574-2578.
[3] 明·李时珍.尚志钧,任何校注.(金陵初刻本校注)本草纲目[M].合肥:安徽科学技术出版社,2001:1016.
[4] 明·佚名撰绘.宫廷写本:食物本草[M].北京:华夏出版社,2000:208.
[5] 耿明江,董丽,尚校军,等.正交实验法优选杏花精油的提取工艺[J].时珍国医国药,2008,19(2):464-465.
[6] 于佳佳,克热木·伊力,李焕荣.微波辅助提取杏花总黄酮工艺的研究[J].新疆农业科学,2010,47(3):577-582.
[7] 李焕荣,黄文书,陆萍,等.杏花总黄酮提取条件的研究[J].食品科技,2008,33(9):177-179.
[8] 吕惠卿,张小平,涂继芳,等.双波长RP-HPLC法测定解毒祛瘀滋阴方阿魏酸、异阿魏酸和芍药苷的含量[J].中华中医药学刊,2013,31(6):1245-1247.
[9] 国家药典委员会.中华人民共和国药典(一部)[S].北京:中国医药科技出版社,2015:61-62.
[10]周浓,杨勤,杨敏,等.HPLC法同时川楝子中芦丁、异槲皮苷和槲皮素的含量[J].药物分析杂志,2013,33(2):225-229.
[11]田源红,张永萍,李玮,等.HPLC法同时测定吉祥草中阿魏酸及芦丁[J].中成药,2015,37(3):603-606.
Simultaneous determination of ferulic acid,rutin and lsoquercitrin in prunus armeniaca flos by HPLC
LUO Hui-yu1,2,YAN Wei-wei1,2,ZENG Chun-ping1,XU Peng1,ZHA Jian-peng2
(1.Zhangjiakou Food and Drug Inspection Center,Zhangjiakou 075000,China;2.Hebei Medical University,Shijiazhuang 050017,China)
Objective To establish an HPLC method for the determination of ferulic acid,rutin and lsoquercitrin in prunus armeniaca flos.Methods A YMC-Pack ODS-A C18(250 mm×4.6 mm,5 μm) column was adopted.The mobile phase consisted of acetonitrile-0.1% phosphoric acid solution at a flow rate of 1.0 mL/min.The detection wavelength was 343 nm and the column temperature was 30 ℃.Results The standard curve of ferulic acid,rutin and lsoquercitrin showed a good linearity in the concentration range of 0.029 08~0.290 8 μg (r=0.999 9),0.548 4~5.484 2 μg (r=0.999 9),0.033 07~0.330 7 μg (r=0.999 9),and the average recoveries were 98.31%,98.93% and 100.25%,andRSDwere 1.0%,0.9% and 1.1%.The content of ferulic acid,rutin and lsoquercitrin were 0.105~0.554,3.080~6.933 and 0.258~0.974 mg/g,respectively,in 10 samples of prunus armeniaca flos.Conclusion This method is simple,accurate,reproducible and convenient for the quality control of prunus armeniaca flos.
Prunus armeniaca flos;Ferulic acid;Rutin;Lsoquercitrin;HPLC
2016-09-21
1.张家口市食品药品检验中心,河北 张家口 075000;2.河北医科大学,河北 石家庄 050017
张家口市科学技术发展计划项目(1521043D)
10.14053/j.cnki.ppcr.201706024

