万古霉素治疗革兰阳性球菌血流感染患者的血药浓度监测
王翠红,叶 蕊,吴小街,高懿卓,赵 立
万古霉素治疗革兰阳性球菌血流感染患者的血药浓度监测
王翠红,叶 蕊,吴小街,高懿卓,赵 立*
目的 了解本院革兰阳性球菌血流感染患者万古霉素的临床应用及血清谷浓度的监测。方法 采用荧光偏振免疫偏振法测定万古霉素血清谷浓度,并结合住院患者的临床资料(基础疾病、病原学结果、万古霉素血清谷浓度、疗效、肾功能情况等),对血流感染革兰阳性球菌并应用万古霉素的25例患者进行回顾性分析。结果 血流感染耐甲氧西林金黄色葡萄球菌(MRSA)11例(44.0%),屎肠球菌14例(56.0%);临床治愈率32.0%。25例患者共进行万古霉素血清谷浓度测定38例次,血清谷浓度范围2.99~39.1 μg/mL,均值(14.96±7.83)μg/mL,其中达到靶浓度15~20 μg/mL者8例(21.0%)。临床治愈组与临床无效组万古霉素血清谷浓度分别为(14.69±7.20)、(15.13±8.53)μg/mL(P=0.85)。肾毒性发生6例(24.0%),APACHE Ⅱ评分均值17分,均为临床无效组。11例MRSA血流感染中,1例万古霉素最低抑菌浓度(MIC)值为2 mg/L,其余万古霉素MIC值均为1 mg/L;临床治愈组万古霉素曲线下面积(AUC)与MIC浓度比值(AUC/MIC)为209±114。结论 按照指南的标准,25例血流感染患者万古霉素血清谷浓度达标率低,需加强对这一类患者血清谷浓度的监测力度,并随时调整用药,给出个体化的用药方案。
万古霉素;血清谷浓度;肾毒性
0 引言
万古霉素(Vancomycin)是一种三环糖肽类抗菌药物,它通过破坏细菌细胞壁肽聚糖的合成发挥作用,对耐药的G+球菌有强大的杀菌功效,万古霉素的血药浓度决定其临床疗效。2011年美国感染病学会(IDSA)制定的《治疗成人及儿童金黄色葡萄球菌感染的临床实践指南》[1]建议,为保证达到治疗目标和临床疗效,万古霉素血清谷浓度应控制在10~20 μg/mL,对复杂性感染,包括由耐甲氧西林金黄色葡萄球菌(MRSA)感染引起的菌血症、心内膜炎、骨髓炎、脑膜炎、医院获得性肺炎等,万古霉素血清谷浓度应达到15~20 μg/mL靶浓度。万古霉素主要经肾脏代谢,血药浓度升高,伴随着肾毒性的发生率增加,而且万古霉素这一靶浓度的制定主要依据欧美人群的循证医学资料,其是否适用于中国人乃至亚裔人种尚需进一步的验证。为此,本研究回顾性分析了我院成人住院革兰阳性球菌血流感染患者万古霉素的临床数据,以了解血流感染患者万古霉素的临床应用以及血清谷浓度的监测情况,现报道如下。
1 材料与方法
1.1 研究对象 回顾性分析我院2012年1月至2016年12月血流感染革兰阳性球菌并应用万古霉素的成人住院患者。入选标准:①年龄≥18岁,性别不限;②至少一份血标本分离出MRSA或屎肠球菌,并具有如发热、畏寒、低血压等全身感染的临床表现[2];③静脉使用商品名为稳可信的万古霉素,且至少有一次万古霉素血清谷浓度测定;④万古霉素初次使用后于第5剂相同剂量用药前30 min内抽取的血标本进行血药浓度检测。排除标准:①年龄<18岁;②合并应用替考拉宁或利奈唑胺的患者;③血药浓度标本采集时间早于第5剂相同剂量万古霉素使用前30 min;④无血药谷浓度测定结果的患者;⑤缺乏感染的临床和实验室评价指标,不能进行疗效评价者。研究信息采集:①人口学资料:年龄、性别、体重;②疾病诊断;③用药方案;④微生物检查结果;⑤用药疗程;⑥生命体征:应用万古霉素前及停药后±1 d的最高体温;⑦辅助检查:应用万古霉素前及停药后血常规、肌酐、肌酐清除率(Clearance of creatinine,CLcr),血气分析,血钾钠氯;⑧急性生理与慢性健康评分(Acute physiology and chronic health evaluation Ⅱ scoring system,APACHE Ⅱ)。
1.2 药品与仪器 注射用盐酸万古霉素(商品名:稳可信),规格:每瓶500 mg,礼来苏州制药有限公司生产。仪器为TDX-FLX 荧光偏振免疫分析仪及相应试剂,均为美国雅培公司产品,每次检测均随行质量控制标本。
1.3 血清药物浓度检测 所有患者均用荧光偏振免疫法(FPLA)测定万古霉素谷浓度。万古霉素给药至少4个维持剂量后监测血清浓度,在下一次给药前30 min采集血清浓度血样[3]。
1.4 观察指标与疗效评价 监测万古霉素用药过程中出现的至少连续2~3次肌酐升高超过基线50%或肌酐升高>0.5 mg/dL[3]视为肾毒性。
根据2015版《抗菌药物临床试验技术指导原则》制定临床疗效评价标准。①临床治愈:患者在治疗结束后访视时,所有入选时的症状、体征均已消失或完全恢复正常,且影像学和实验室检查等非微生物学指标均已恢复正常。在某些适应证中,治疗结束后访视时,可能仍会观察到一些临床症状或体征,或仍存在一些非微生物学指标的异常。如果上述情况是生理状态下存在的,或其仅提示感染后状态或基础疾病,而不是提示活动的感染,则也可认为是临床治愈。②临床无效:患者在治疗结束时,所有入选时的症状、体征持续或不完全消失或恶化;或者出现了这一疾病的新的症状或体征和/或使用了其他的针对这一疾病的抗菌治疗措施。细菌清除情况分为:清除,假定清除,未清除,假定未清除和替换。
1.5 数据处理 依据Cockcroft-Gault 公式计算肌酐清除率。根据AUC=24 h万古霉素用量(mg)/[(CLcr×0.79+15.4)×0.06]计算万古霉素24AUC[4]。根据血清药物浓度前后2 d内的血肌酐值,按AUC公式,结合万古霉素的MIC值,计算AUC/MIC。
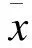
2 结果
2.1 一般资料 纳入符合入选标准的25例患者,男20例(占80%),年龄21~90岁,平均(62.0±18.5)岁,共收集体重数据20例,体重40~85 kg,平均 (66.1±12.5) kg,疗程3~22 d,平均 (9.8±5.7) d。病原菌:耐甲氧西林的金黄色葡萄球菌(MRSA)11例(44.0%),屎肠球菌14例(56.0%)。基础疾病:重症肺炎7例(28.0%),恶性肿瘤4例(16.0%),急性重症胰腺炎3例(12.0%),复合外伤4例(16.0%),梗阻性黄疸2例(8.0%),慢性阻塞性肺疾病1例(4.0%),消化道穿孔1例(4.0%),骨筋膜室综合征1例(4.0%),泌尿系结石1例(4.0%),急性妊娠脂肪肝1例(4.0%)。
2.2 万古霉素剂量 所有万古霉素均采用间歇维持剂量静脉滴注的给药方式,未给予首剂负荷剂量。单次万古霉素用药剂量0.25~1.0 g,qd、q12h、q8h静脉滴注。
2.3 万古霉素疗效评价及细菌清除 疗效:临床治愈8例(32.0%),临床无效17例(68.0%)。细菌感染:MRSA 11例,其中临床治愈组有1例万古霉素MIC值为2 mg/L,其余万古霉素MIC值均为1 mg/L;屎肠球菌14例。细菌清除:清除10(40.0%)例,假定清除2例(8.0%),未清除3例(12.0%),假定未清除4例(16.0%),细菌替换6例(24.0%)。
2.4 万古霉素血清谷浓度监测结果 共进行万古霉素血清谷浓度测定38例次,血清谷浓度范围2.99~39.1 μg/mL,平均(14.96±7.83)μg/mL,其中达到靶浓度15~20 μg/mL者8例(21.0%),>20 μg/mL者8例(21.0%)。万古霉素血清谷浓度具体分布见表1。
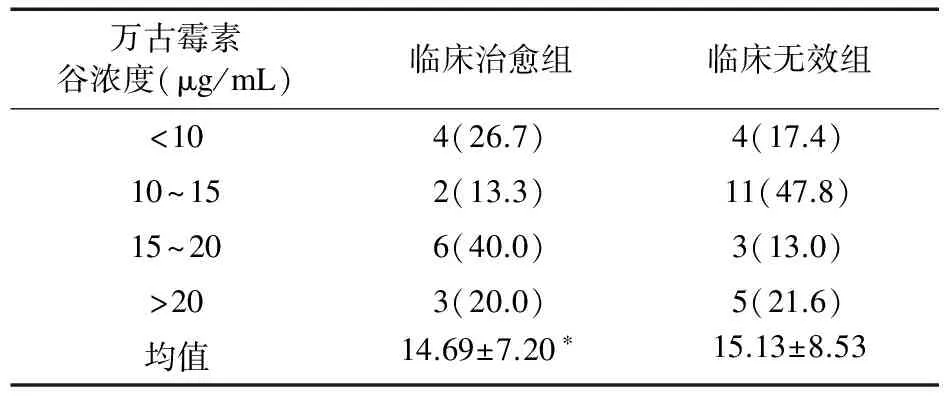
表1 万古霉素血清谷浓度的分布(例,%)
注:*与临床无效组比较,P=0.85
2.5 安全性评价 用药过程中因数据不全无法判定有无肾毒性者1例(4.0%),出现肾毒性6例(24.0%),均为临床无效组,年龄(64.5±18.9)岁,疗程(9.0±3.9)d,APACHE Ⅱ评分均值为17分,万古霉素血清谷浓度(15.87±11.14)μg/mL,首次血清谷浓度(16.26±13.37)μg/mL。
2.6 疾病严重程度评分 临床治愈组APACHE Ⅱ评分(15.3±7.4)分,临床无效组为(15.8±6.9)分,两组比较差异无统计学意义(P=0.85)。
2.7 MRSA菌血流感染患者万古霉素血清谷浓度与AUC/MIC的关系 见表2。

表2 MRSA菌血流感染患者万古霉素血清谷浓度与AUC/MIC的关系
3 讨论
万古霉素为时间依赖型杀菌性抗菌药物,对MRSA、肠球菌等有强大的抗菌活性,杀菌效应与血药浓度高于MIC的持续时间及后效应(PAE)有关,因此,IDSA制订了《治疗成人及儿童金黄色葡萄球菌感染的临床实践指南》[1]。对MRSA引起的复杂性感染,如菌血症、心内膜炎、骨髓炎、脑膜炎、医院获得性肺炎等,为了使感染灶内药物浓度达到有效杀菌浓度,建议将万古霉素血清谷浓度维持在15~20 μg/mL靶浓度。本研究共纳入25例患者,临床治愈组与临床无效组APACHE Ⅱ评分比较差异无统计学意义,两组疾病严重程度相当,排除了因疾病严重程度不同对预后及万古霉素血清谷浓度的影响[5-6]。本研究所有38例次万古霉素血清谷浓度监测中,达靶浓度者仅8例(21.0%),按照指南规定,25例患者总的靶浓度临床达标率低,以致68.0%临床无效,临床治愈率低。另外,虽然临床治愈组的靶浓度达标率高于临床无效组,但临床治愈组与临床无效组万古霉素血清谷浓度差异无统计学意义。由于本研究样本及数据量少,不能准确反映人群的情况,但临床治愈组在万古霉素血清谷浓度<10 μg/mL的情况下,仍有3例患者获得了很好的疗效,说明万古霉素在中国人群中可能存在个体差异的情况。对于某些患者,万古霉素血清谷浓度可能无须达到指南要求的靶浓度也能获得良好的疗效。
万古霉素对金黄色葡萄球菌的治疗成功率与其MIC值显著相关[7-9],指南要求对于万古霉素MIC<1 mg/L的患者应达到AUC/MIC>400的目标[3]。本研究中仅临床治愈组有1例万古霉素的MIC为2 mg/mL,其余菌株的万古霉素MIC均为1 mg/mL,而所有患者的AUC/MIC均值为(247±120),临床治愈组AUC/MIC均值为(209±114 )。虽然目前还没有权威的机构对MRSA血流感染设定目标的AUC/MIC值,但由本研究可见,MRSA血流感染患者的AUC/MIC值远低于金黄色葡萄球菌的目标值400。
万古霉素约80%~90%以原型经肾小球滤过排泄[10-12],国内外大量研究已证实,万古霉素血清浓度与肾功能明确相关,高浓度的万古霉素可导致肾毒性的发生[13-19],万古霉素血清浓度越高,发生肾毒性的相对危险度越大[17-18]。本研究中临床治愈组靶浓度达标率高于临床无效组,但只有临床治疗无效组出现肾毒性,说明在靶浓度范围内的万古霉素治疗是相对安全的。早在2011年,Moore等[6]的研究提出,APACHEⅡ评分≥14分时,急性肾功能不全的发生是普遍的(发生率40%),Hanrahan等[19]提出,APACHE Ⅱ评分是阳性预测急性肾功能损伤的一个重要指标,本研究中发生肾毒性患者的APACHEⅡ评分均值为17分,说明肾毒性的发生与患者本身疾病严重程度有关,但本研究中肾毒性均发生在临床无效组,可能是因为患者病情未得到有效控制,血流动力学不稳定,血供优先向脑、心脏、肺脏等重要脏器分布,肾脏血流减少,进而出现肾功能损伤。
总之,接受万古霉素延长疗程治疗的患者都应至少有第4次给药前的一次稳态下血清谷浓度测定,治疗达标后,血流动力学稳定的患者建议每周监测1次血清谷浓度值,血流动力学不稳定的患者进行较高频率的监测(有些情况甚至需要每天1次)[3],对血清谷浓度不在有效治疗窗范围内的病例,及时分析原因,调整给药剂量,使血清浓度维持在一个安全、有效的范围内是提高临床治愈率、减少肾毒性的关键。
本研究是回顾性分析,所入选的研究病例样本量小、数据量少,不能准确反映人群情况,我们期待进一步前瞻性、大样本的研究来评估万古霉素在治疗革兰阳性球菌血流感染时的疗效及安全性,评估万古霉素在治疗时是否存在个体差异。
[1] Liu C,Bayer A,Cosgrove SE,et al.Clinical practice guidelines by the infectious diseases society of america for the treatment of methicillin-resistant Staphylococcus aureus infections in adults and children[J].Clin Infect Dis,2011,52(3):18-55.
[2] 黄仲义,肖永红,张菁,等.万古霉素临床应用中国专家共识(2011版)[J].中国新药与临床杂志,2011,(8):561-573.
[3] Rybak MJ,Lomaestro BM,Rotschafer JC,et al.Vancomycin therapeutic guidelines:a summary of consensus recommendations from the infectious diseases Society of America,the American Society of Health-System Pharmacists,and the Society of Infectious Diseases Pharmacists[J].Clin Infect Dis,2009,49(3):325-327.
[4] Holmes NE TJD,Munckhof WJ.Vancomycin AUC/MIC ratio and 30-day mortality in patients with Staphylococcus aureus bacteremia[J].2013,57(4):1654-1663.
[5] Brown J,Brown K,Forrest A.Vancomycin AUC24/MIC ratio in patients with complicated bacteremia and infective endocarditis due to methicillin-resistant Staphylococcus aureus and its association with attributable mortality during hospitalization[J].Antimicrob Agents Chemother,2012,56(2):634-638.
[6] Moore CL,Lu M,Cheema F,et al.Prediction of failure in vancomycin-treated methicillin-resistant Staphylococcus aureus bloodstream infection:a clinically useful risk stratification too[J].Antimicrob Agents Chemother,2011,55(10):4581-4588.
[7] Lodise TP,Graves J,Evans A,et al.Relationship between vancomycin MIC and failure among patients with methicillin-resistant Staphylococcus aureus bacteremia treated with vancomycin[J].Antimicrob Agents Chemother,2008,52(9):3315-3320.
[8] Mavros MN,Tansarli GS,Vardakas KZ,et al.Impact of vancomycin minimum inhibitory concentration on clinical outcomes of patients with vancomycin-susceptible Staphylococcus aureus infections:a meta-analysis and meta-regression[J].Int J Antimicrob Agents,2012,40(6):496-509.
[9] Wi YM,Kim JM,Joo EJ,et al.High vancomycin minimum inhibitory concentration is a predictor of mortality in meticillin-resistant Staphylococcus aureus bacteraemia[J].Int J Antimicrob Agents,2012,40(2):108-113.
[10]Rubinstein E,Keynan Y.Vancomycin revisited - 60 years later[J].Front Public Health,2014,2:217.
[11]Schilling A,Neuner E,Rehm SJ.Vancomycin:a 50-something-year-old antibiotic we still don′t understand[J].Cleve Clin J Med,2011,78(7):465-471.
[12]周佳,朱月钮,张明军,等.基于儿科万古霉素血药浓度监测模拟临床给药方案优化的研究[J].中国小儿急救医学,2015,22(6):383-390.
[13]Dong MH,Wang JW,Wu Y,et al.Evaluation of body weight-based vancomycin therapy and the incidence of nephrotoxicity:a retrospective study in the northwest of China[J].Int J Infect Dis,2015,37:125-128.
[14]Liu Y,Yin Y,Liu XZ,et al.Retrospective analysis of vancomycin nephrotoxicity in elderly Chinese patients[J].Pharmacology,2015,95(5-6):279-284.
[15]Han HK,An H,Shin KH,et al.Trough concentration over 12.1 mg/L is a major risk factor of vancomycin-related nephrotoxicity in patients with therapeutic drug monitoring[J].Ther Drug Monit,2014,36(5):606-611.
[16]Contreiras C,Legal M,Lau TT,et al.Identification of risk factors for nephrotoxicity in patients receiving extended-duration,high-trough vancomycin therapy[J].Can J Hosp Pharm,2014,67(2):126-132.
[17]Hanrahan TP,Harlow G,Hutchinson J,et al.Vancomycin-associated nephrotoxicity in the critically ill:a retrospective multivariate regression analysis[J].Crit Care Med,2014,42(12):2527-2536.
[18]莫泽珣,陈蕊,肖飞,等.连续肾脏替代疗法对老年重症患者万古霉素血药浓度的影响[J].实用医学杂志,2015,31(23):3857-3860.
[19]Hanrahan TP,Kotapati C,Roberts MJ,et al.Factors associated with vancomycin nephrotoxicity in the critically ill[J].Anaesth Intensive Care,2015,43(5):594-599.
Analysis of serum concentration monitoring and clinical use of vancomycin in patients with Gram positive coccus bloodstream infection
WANG Cui-hong,YE Rui,WU Xiao-jie,GAO Yi-zhuo,ZHAO Li*
(Department of Respiratory,Shengjing Hospital of China Medical University,Shenyang 110004,China)
Objective To investigate the clinical application and serum trough concentration monitoring of vancomycin in patients with Gram positive coccus bloodstream infection in our hospital.Methods The clinical information,including primary diseases,bacteriological culture,serum trough concentration of vancomycin,clinical efficacy and renal function in 25 patients with Gram positive coccus bloodstream infection treated by vancomycin were analyzed retrospectively.Results The 25 patients were found with Gram positive coccus bloodstream infection,including methicillin-resistantStaphylococcusaureusin 11 patients (44.0%) andEnterococcusfaeciumin 14 patients (56.0%).All patients were treated by vancomycin and 8 patients were cured(32%).Serum trough concentration of vancomycin was tested 38 times by fluorescence polarization immunoassay.The median of serum trough concentration was 14.96±7.83 (ranging 2.99~39.1)μg/mL.The guideline-recommended target trough concentration of 15~20 μg/mL was reached only in 8 patients (21.0%).The serum trough concentration of vancomycin was of no difference between the clinical cure group [(14.69±7.20)μg/mL] and clinical failure group [(15.13±8.53)μg/mL],P=0.85.Six patients in clinical failure group (24.0%)experienced nephrotoxicity and their average value of APACHE Ⅱ was 17.In 11 patients with MRSA infection,minimum bacteriostasis concentration (MIC) of vancomycin was 2 mg/L in only one patient and 1 mg/L in others.Area under curve(AUC)/ MIC in clinical cure group was 209±114.Conclusion The rate of serum trough concentration achieving guideline-recommended target of 15~20 μg/mL is low.It is important to pay more attention to the monitoring of the serum trough concentration in patients with bloodstream infection and achieve an ideal individualized administration according to the results.
Vancomycin;Serum trough concentration;Nephrotoxicity
2016-09-04
中国医科大学附属盛京医院呼吸科, 沈阳 110004
*通信作者
10.14053/j.cnki.ppcr.201706009

