女性垂体腺瘤35例临床病理分析
曹芳芹,杨胜利,常红云
(1、渭南市妇幼保健院,陕西渭南714000;2、西安交通大学第一附属医院,陕西西安710061)
·检验与临床·
女性垂体腺瘤35例临床病理分析
曹芳芹1,杨胜利1,常红云2
(1、渭南市妇幼保健院,陕西渭南714000;2、西安交通大学第一附属医院,陕西西安710061)
目的研究女性垂体腺瘤的临床、病理学及预后特点。方法收集2014年4月至2014年10月西安交通大学第一附属医院经外科病理确诊的垂体腺瘤患者35例,回顾性分析其临床、放射学、随访资料及HE染色、免疫组化染色等临床病理特点。结果35例患者中,发病年龄20~67岁,平均46岁。根据影像学显示大小,分为微腺瘤6例,大腺瘤23例,巨大腺瘤6例。依据免疫组化结果显示生长激素型腺瘤7例,泌乳激素型腺瘤5例,促肾上腺皮质激素型腺瘤5例,其它混合型腺瘤17例,裸细胞腺瘤1例。患者术后随访时间14~21个月,平均随访时间18个月,其中5例(14.3%)复发。结论女性垂体腺瘤以大腺瘤为主。免疫组化染色结果与患者的临床表现密切相关,可根据免疫组化结果对其进行功能性分类、研究,并指导临床治疗。
女性垂体腺瘤;病理诊断;免疫组织化学
垂体腺瘤来源于垂体前叶细胞,为细胞的单克隆性增殖,临床以激素分泌过多或占位表现为特征。颅内肿瘤中垂体腺瘤约占5%~20%,为颅内常见的肿瘤[1]。伴随医学影像技术的发展,垂体腺瘤的发现率显著增加,垂体腺瘤在正常人群中随机MRI检查时的发现率为10%~38.5%(平均22.5%)[2]。在任何年龄段均可发生垂体腺瘤,其中30~60岁多见,有研究报道女性催乳素腺瘤的发病率明显高于男性[3]。近年来随着内分泌检查普及以及对垂体腺瘤的进一步认识,该病的检出率呈上升趋势,尤其是女性垂体腺瘤的发病率越来越高。目前,对于一般人群垂体腺瘤临床表现、病理特征及预后已有不少大样本的研究。但是缺乏对于女性垂体腺瘤的研究,其年龄、分布特征、临床表现、侵袭性、病理特点、治疗方式及预后与一般人群垂体腺瘤的异同之处还不清楚。故本研究通过收集本院35例女性垂体瘤的临床资料并进行14~21个月的随访.更加深刻的了解女性垂体腺瘤的特征。以便更好地指导女性垂体腺瘤的诊断、治疗及随访,提高女性患者的生活方式。
1 材料与方法
1.1 病例资料对2013年4月至2014年10月西安某医院神经外科手术治疗的35例女性垂体腺瘤患者的临床资料进行重新复习。包括临床一般状况、症状体征、术中所见肿瘤的浸润情况、放射学、检验及原始病理资料。本院病例标本全部经
10%中性福尔马林固定,石蜡包埋,切片厚5μm, HE染色,光镜观察。
1.2 影像学分类采用MRI来确定肿瘤确切的面积和侵犯的范围:直径≤1cm称为微小腺瘤,1cm<直径≤4cm称为大腺瘤,直径>4cm称为巨大腺瘤。
1.3 采用SP法免疫组化染色进行了催乳素(prolactin,PRL)、生长激素(growth hormone,hGH)、促肾上腺皮质激素(adrenocorticotropin,ACTH)、促黄体生成激素(1uteinizing hormone,LH)、甲状腺刺激激素(thyroid stimulating hormone,TSH)、卵泡刺激素(follice stimulating hormone,FSH)染色、Ki-67(克隆MIB-1)第一抗体均为单克隆抗体。单克隆抗体均购自福州迈新公司,DAB显色苏木素复染。用已知的中等程度阳性片作阳性对照;PBS取代第一抗体作为阴性对照。以肿瘤胞浆或胞核染成棕黄色为阳性。>25%的瘤细胞胞质内出现棕黄色颗粒为阳性,少数散在瘤细胞或仅在肿瘤边缘瘤细胞的胞质内出现棕黄色颗粒被视为阴性。
1.4 随访采用电话联系的方式进行随访。随访时间从患者手术之日起开始计算,截至2015年12月。35例患者均获得随访资料,随访时间14~21个月,平均随访时间18个月。其中5例复发。
1.5 统计学处理数据分析采用SPSS 18.0统计软件。
2 结果
2.1 临床特征在35例女性病例(见表1)中,发病年龄20~67岁,平均46岁,34例患者均因各种神经压迫症状或内分泌症状而入院接受手术治疗,1例为体检发现,临床主要表现为:视力下降21例、头痛9例、闭经6例、肢端肥大6例、向心性肥胖3例、库欣面容3例、月经紊乱1例。33例采用经单鼻孔蝶窦垂体瘤切除术,2例采取幕上开颅肿瘤切除术。其中肿瘤全切除24例,次全切或部分切除11例。其中19例术后行伽马刀治疗,16例未行伽马刀治疗。随访5例复发。
2.2 垂体瘤分类⑴根据影像学资料分类:微腺瘤6例、大腺瘤23例、巨腺瘤6例。⑵按照WHO (2004)标准[1]对垂体腺瘤进行病理分类:PRL腺瘤(泌乳素瘤)5例(14.3%)、促ACTH腺瘤5例 (14.3%)、生长激素腺瘤7例(20%)、其它混合型(包括二种及多种激素表达)腺瘤17例(48.6%),裸细胞腺瘤1例(2.9%)。⑶根据生物学行为分类:影像学资料、术中观察及病理学检查中有两项发现邻近组织浸润则判定为浸润性腺瘤。本组35例病例中未发现浸润性腺瘤。
2.3 病理检查
2.3.1 肉眼观肿瘤大小肿瘤大小0.2cm×0.1cm× 0.1cm~2.8cm×3.5cm×1cm,多为小组织或碎组织,质软,呈淡粉色。
2.3.2 镜下形态35例腺瘤细胞形态较一致。瘤细胞似正常前叶细胞或稍大,圆形或多角形,大小均匀,核分裂象罕见,排列成片状、条索状、假腺样或乳头状。间质纤细,血管丰富(见图1)。35例中2例可见嫌色细胞,2例嫌色与嗜酸细胞混合型,2例大量淋巴细胞、浆细胞浸润。肿瘤周边炎细胞浸润较明显,瘤细胞团内炎细胞浸润不明显,部分病例可见微小钙化或球形淀粉样小体(见图2)。
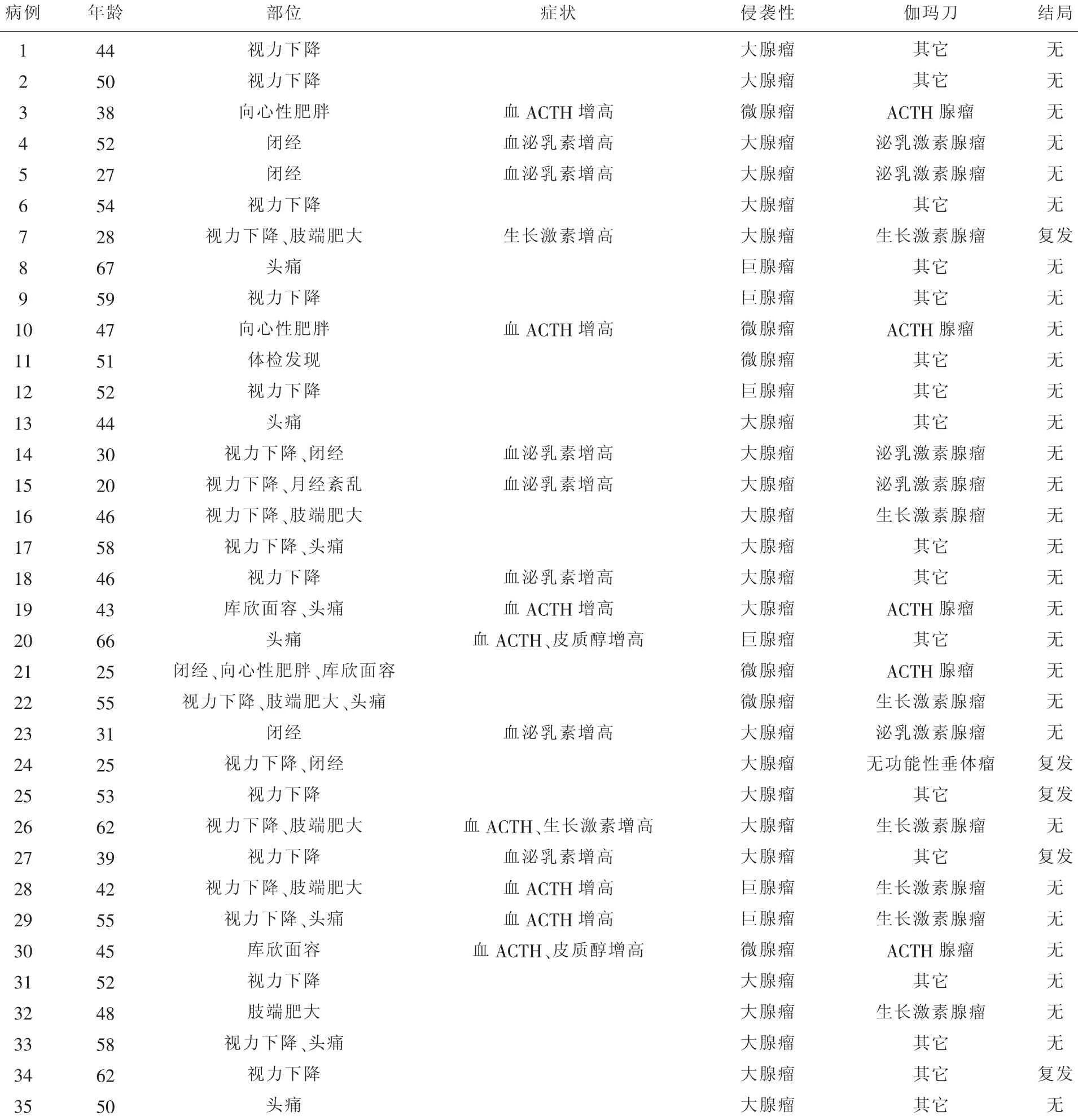
表1 35例女性垂体腺瘤的临床病理特征
2.4 免疫表型特点病理学观察根据免疫组化染色结果并结合临床症状及血清学分析结果对垂体腺瘤进行分类。35例均行免疫组化标记除SynNSECgA阳性外,其中3例瘤细胞PRL阳性,其余标记物均阴性;14例各项标记均阴性;2例瘤细胞ACTH阳性,其他标记物阴性;4例瘤细胞FSH阳性,其余标记物均阴性;1例瘤细胞hGH阳性,其他标记物均阴性;12例瘤细胞两种或两种以上阳性(如表2),Ki-67瘤细胞表达为1%-8%,其中7例5%,1例8%。
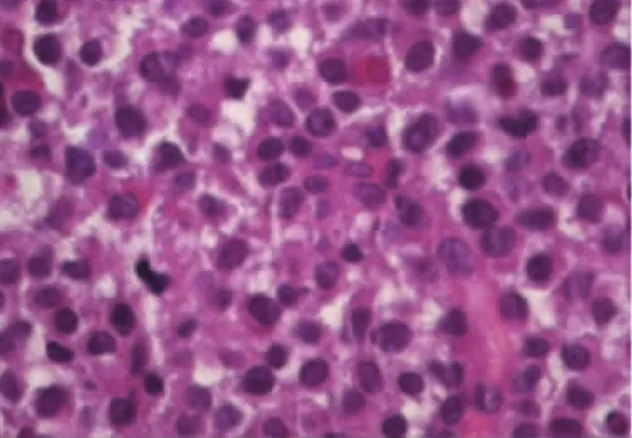
图1 肿瘤细胞排列成实性或小梁状,细胞单一的圆形或椭圆形,胞浆嗜酸或嫌色,核仁不明显
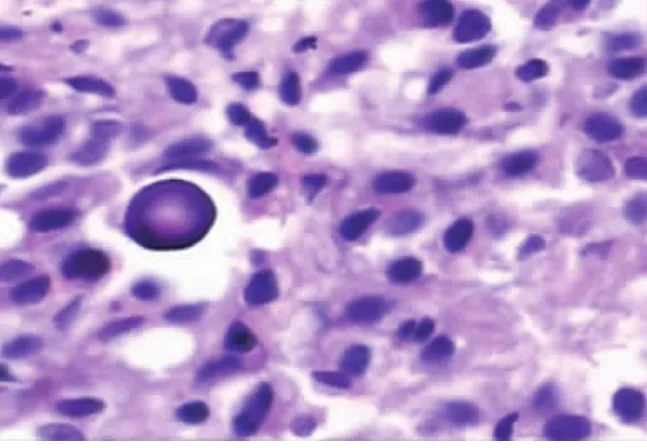
图2 瘤组织内见微小钙化的或球形淀粉样小体

图3 肿瘤细胞ACTH胞浆阳性
2.4.1 PRL型腺瘤5例,年龄20~52岁,平均32岁,表现为月经紊乱、闭经,部分患者伴头痛、视力障碍等。免疫组化显示:弥漫分布整个胞质。
2.4.2 GH型腺瘤7例,年龄28~62岁,平均47.6岁。免疫组化显示瘤细胞胞质内弥漫阳性。
2.4.3 ACTH型腺瘤5例,年龄25~47岁,平均39.6岁。免疫组化示:胞质内阳性颗粒(见图3)。
2.4.4 其它混合型腺瘤17例,年龄39~67岁,平均53.2岁。表现为视力下降、头痛等压迫症状。免疫组化示:相应的激素表达类型。
2.4.5 裸细胞腺瘤1例,年龄25岁。患者仅表现为视力下降、闭经,免疫组化示:垂体前叶分泌的六种激素全部阴性。MRI示:为大腺瘤。
3 讨论
有研究显示[4],垂体腺瘤多发生在21~50岁,本研究中20例育龄期垂体瘤女性患者中,各类型均以大腺瘤最常见,除催乳素腺瘤以年龄小于30岁多见外,其余肿瘤类型均以大于30岁多见。有研究发现[5]:性激素水平的改变,对乳腺疾病特别是乳腺癌的发生是有着重要作用的。绝大多数垂体瘤为良性肿瘤。
3.1 临床特征本组病例年龄20~67岁,平均46岁。垂体腺瘤患者多数出现某一或几种激素分泌过多而引起相应的临床症状,本组病例中,最常见的症状为视力下降21例占60%,其次为头痛9例占25.7%及闭经6例(17%)和肢端肥大6例(17%)。育龄期妇女(20~50岁)共20例,其中14例以内分泌症状为主,6例以压迫症状为主;老年组(51~67岁)共15例,其中11例以压迫症状为主,3例出现内分泌症状,1例为体检发现,说明肿瘤大小与年龄呈正相关。这与报道垂体腺瘤多发生于青壮年,70岁及以上人群中发病率相对较低[6]相符。可见育龄期常见垂体瘤类型中,大腺瘤最为多见。从良恶性角度分类,将其分为垂体良性肿瘤、侵袭性垂体瘤及垂体癌,绝大多数垂体瘤为良性肿瘤,极少数为癌(<0.2%)[7]。
3.2 影像学微腺瘤6例、大腺瘤23例、巨腺瘤6例。其中微腺瘤年龄分布为25~55岁,大腺瘤年龄分布为20~62岁,巨大腺瘤年龄分布为42~67岁。本组中老年组(大于50岁)15例中,5例(33.3%)为巨大腺瘤,8例(53.3%)为大腺瘤,2例(13.3%)为微腺瘤。育龄妇女组(20~50岁)中,15例(75%)为大腺瘤,4例(20)为微腺瘤,1例(5%)为巨腺瘤。垂体瘤中微腺瘤常表现为激素过多或是意外发现。而大腺瘤及巨腺瘤则以占位表现突出,或伴有激素过多表现。本组20例育龄期女性患者中,多数都是以内分泌表现就诊,且主要以停经、月经紊乱表现居多;占位表现中,主要出现的症状为头痛及视力下降。有研究显示,年龄越大、术前生长激素或催乳素水平越低者以占位效应表现就诊者居多[8]。本组研究与该报道结果相符.故认为女性垂体腺瘤的大小除与患者的病史有关,与患者的年龄可能有关。

表2 35例女性垂体腺瘤的免疫标记结果
3.3 病理及免疫组化特点垂体腺瘤的传统分类(嗜酸性、嗜碱性和嫌色性)不能提供功能和预后的信息,而免疫组化法检测可对垂体腺瘤行功能分类,能在形态学上证实和评价垂体腺瘤中的激素产物,提示临床症状与病理诊断的密切关系,从而得出形态与功能的结合。本次研究中PRL腺瘤(泌乳素瘤)5例(14.3%)、促ACTH腺瘤5例(14.3%)、生长激素腺瘤7例(20%)、其它混合型(包括二种及多种激素表达)腺瘤17例(48.6%),裸细胞腺瘤1例(2.9%)。多数患者临床症状表现出某种激素分泌过多,与免疫组化的结果基本相符。此组病例中以混合型腺瘤为主,部分免疫组化阳性腺瘤未出现相应的临床症状或血清学变化,考虑为瘤细胞产生的激素无生物学活性,或者是分泌的激素在细胞中降解所致[9]。本次研究发现:女性垂体腺瘤的临床症状轻重与免疫组化检测出某一激素阳性的强弱无关,分析认为患者的临床症状主要由血清中游离的激素水平所决定,肿瘤中激素阳性表达强弱可能与患者血清中游离的激素水平无关性。本组病例中裸细胞腺瘤1例占2.9%,与文献[10]相比偏少,可能与病例过少有关。裸细胞腺瘤缺乏各种激素表达症状,不易被早期发现。复发病例中,年龄及ki-67指数分别为28岁(2%)、24岁(3%)、53岁(1%)、39岁(5%)、62岁(3%),说明肿瘤复发与患者年龄及ki-67指数无明显相关性。
3.4 诊断及鉴别诊断女性垂体腺瘤易诊断,但仍需与脑膜瘤、颅咽管瘤、胶质瘤、淋巴瘤、脊索瘤、转移性癌以及生殖细胞瘤鉴别。大部分病例可以依靠HE染色及免疫组化染色作出明确诊断[11]。诊断女性垂体腺瘤还需与垂体增生鉴别,垂体增生可出现激素分泌过多的症状,免疫组化呈多种激素阳性现象,但形态结构与腺瘤不同。有研究者认为网状纤维染色可鉴别二者,垂体增生时正常结构保存尚好,网状纤维染色显示腺细胞团外周网状纤维网完整,而腺瘤则网状纤维减少、断裂以至消失[12]。除此之外,当瘤细胞核出现异型性、核仁及核分裂时,应与垂体癌鉴别,现认为垂体癌的诊断必需有转移扩散的证据。
3.5 治疗及预后垂体瘤的治疗包括手术、药物及放射治疗,手术治疗最为有效。随着显微外科技术的进一步发展,经单鼻孔蝶窦垂体瘤切除术已成为垂体腺瘤手术的首选治疗方式,尽可能切除全部肿瘤以恢复并保持正常血清内分泌激素水平,缓解临床症状。本组35例患者中33例采用经单鼻孔蝶窦垂体瘤切除术(其中肿瘤全切除24例、次全切或部分切除11例),2例采取幕上开颅肿瘤切除术,未见颈内动脉损伤等严重并发症发生。术后,患者病情得到不同程度的缓解。国外报道垂体腺瘤复发率为7%~35%[13]。本组病例复发率为14.2%,符合报道。杨洪发等认为术后定期复查垂体激素水平可更准确、更早地评估肿瘤复发情况。因此,对术中无法全切肿瘤和术后复查垂体激素水平下降不明显者,应及早放疗,以便减少复发率[14]。
35例病例中,育龄妇女组(小于等于50岁)共20例,其中复发2例(10%),中老年组(大于50岁)共15例,其中3例(20%)复发,故认为垂体瘤患者的预后(是否复发)与患者年龄无明显相关性。肿瘤切除完整与否及是否具有侵袭性被认为是垂体肿瘤术后复发的重要因素。肿瘤组织残余常是复发的根源,肿瘤切除的程度是影响复发的关键因素。本组复发者均为术中有瘤组织残留。
3.6 结论本文对35例女性垂体腺瘤的临床、影像、实验室检查、病理资料及随访资料行回顾性分析。认为女性垂体腺瘤混合型腺瘤为主,复发与肿瘤大小和切除是否完整有关,而与患者年龄、垂体腺瘤的免疫表型无明显相关性,免疫组化与患者的临床表现密切相关,可根据免疫组化对其进行功能性分类、研究,并指导临床治疗。
[1]Daly AF,Trichomirowa MA,Beckers A.The epidemiology and genetics of pituitary adenomas[J].Best Pract Res Clin Endocrinol Metab,2009,23:543-554.
[2]Ezzat S,Asa SL,Couldwell WT,et al.The prevalence of pituitary adenomas:a systematic review[J].Cancer,2004,101:613-619.
[3]Knosp E,Steiner E,Kitz K,et al.Pituitary adenomas with invasion of the cavernous sinus space:A magnetic resonance imaging classification compared with surgical findings[J].Neurosurgery,1993,33:610-618.
[4]孙敏娴,张木勤,雷霆,等.746例经手术治疗的垂体腺瘤患者l临床资料分析[J].中华内分泌代谢杂志,2010,26(8):657-661.
[5]刘宓,王伟等.绝经前期乳腺疾病患者血清性激素水平及其诊断价值的研究[J].实验与检验医学,2012,30(1):30-32.
[6]Dworakowska D,Korbonits M,Aylwin S,et al.The pathology of pituitary adenomas from a clinical perspective[J].Front Biosci(Schol Ed),2011;3:105-116.
[7]Kaltsas GA,Nomikos P,Kontogeorgos G,et al.Clinical review:Diagnosis and management of pituitary carcinomas[J].J Clin Endocrinol Metab,2005,90:3089-3099.
[8]黄新梅,刘军.387例育龄期垂体腺瘤女性临床特征及术后随访研究[J].中华内分泌代谢杂志,2014,12(30):1097-1104.
[9]Zhao D,Tomono Y,Tsuboi K,Nose T.Imunohistochenmical and ultrastructural study of clinically nonfunctioning pituitary adenomas [J].Neurol Med Chir Chir(Tokyo),2000,40(9):453-456.
[10]李小静,武景波等.垂体腺瘤108例临床病理分析[J].临床与实验病理学志,2011,27(12):1319-1324.
[11]Saeger W,Ludecke DK,Buchfelder M,et al.Pathological classification of pituitary tumors:10 years of experience with the German Pituitary Tumor Registry[J].Eur J Endocrinol,2007,156(2):203-16.
[12]吴华成,李晔,许海敏,叶挺军.垂体腺瘤100例临床病理分析[J].诊断学理论与实践,2003,2(2):113-6.
[13]Ronald JB,Wesley AK,Jane W,et al.Repeated transsphenoidal Surgery to treat recuIrent or residual pituitary adenoma[J].J Neurosurg,2005,102:1004-1012.
[14]杨洪发,马程远,别黎,等.垂体腺瘤手术前后内分泌激素测定的临床应用[J].中国实验诊断学,2008,12(10):1235-1237.
R736.4,R446.8
A
1674-1129(2017)03-0361-05
2016-07-14;
2017-03-07)
10.3969/j.issn.1674-1129.2017.03.021

