红树林土曲霉GX7-3B多糖的提取工艺优化及抗氧化活性研究
邓春梅,何兰珍,张国光,李思东,温燕梅,吴育廉,黄灯威,康信煌
(广东海洋大学化学与环境学院,广东 湛江 524088)
红树林土曲霉GX7-3B多糖的提取工艺优化及抗氧化活性研究
邓春梅,何兰珍,张国光,李思东,温燕梅,吴育廉,黄灯威,康信煌*
(广东海洋大学化学与环境学院,广东 湛江 524088)
通过正交实验对红树林土曲霉GX7-3B多糖的提取工艺进行优化,用Sevage试剂脱蛋白并纯化多糖,用DPPH 自由基清除能力和总抗氧化能力评价多糖的体外抗氧化活性。结果表明,红树林土曲霉GX7-3B多糖的最佳提取工艺为:提取温度75 ℃、提取时间3 h、料液比1∶30(g∶mL),在此条件下,多糖提取率达到3.14%;在实验浓度范围内,多糖清除DPPH自由基的能力及总抗氧化能力与其浓度呈正相关关系。表明红树林土曲霉GX7-3B多糖是一种天然抗氧化剂。
红树林;土曲霉;多糖;提取;抗氧化活性
红树林是生长于热带、亚热带海岸滩涂上的特殊森林植物,是陆地向海洋过渡的特殊生态系,兼具海洋与陆地的性质[1-2],具有丰富独特的真菌资源。红树林共附生真菌能产生许多药用活性次级代谢产物,是崛起的一类新型药用真菌[3-8]。作者[9-10]前期研究发现,红树林土曲霉GX7-3B能产生具有抗肿瘤活性的次级代谢产物以及新的活性化合物。在此基础上,作者进一步提取其中的多糖,对提取工艺进行优化并研究多糖的体外抗氧化活性,以期扩大红树林土曲霉GX7-3B的药用范围、提高其药用价值。
1 实验
1.1 菌种、试剂与仪器
红树林土曲霉GX7-3B:GenBankID为KC461499。
蒽酮、丙酮、浓硫酸、30%双氧水等均为国产分析纯试剂,市售。
80-2B型离心沉淀机,江苏新康医疗器械有限公司; 722S型紫外可见分光光度计,上海元析仪器有限公司; 电热鼓风干燥箱,上海博讯实业有限公司医疗设备公司;旋转蒸发器,上海亚荣生化设备公司;小型粉碎机;水浴摇床;三用恒温水箱。
1.2 菌种的培养
将红树林土曲霉GX7-3B接种于GPY培养基上,于25 ℃恒温培养28d,过滤,分离菌体与培养液;将菌体在甲醇中浸泡清洗3次后取出,自然晾干,待用。
1.3 多糖的提取与纯化
红树林土曲霉GX7-3B多糖的提取与纯化工艺:菌体粉碎→热水提取→旋转浓缩→加入95%乙醇,冰箱静置过夜→离心→干燥→粗多糖→溶解→Sevage法[11]脱蛋白→离心→取上清液→加95%乙醇,冰箱静置过夜→离心→干燥→多糖。
1.4 多糖提取率的计算
参照文献[12],采用苯酚-硫酸法绘制葡萄糖标准曲线;测定多糖溶液在490nm处吸光度(A490),依标准曲线计算多糖含量,再按式(1)计算多糖提取率。
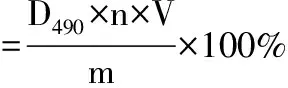
(1)
式中:D490为多糖含量;n为提取液稀释倍数;V为提取液的体积;m为菌体质量。
1.5 多糖抗氧化活性评价
1.5.1 DPPH自由基清除能力的测定
用移液枪取2.8 mL 1.0 mg·mL-1多糖溶液于24孔板中;再用移液枪从中移取1.4 mL多糖溶液于下一个孔中,加蒸馏水1.4 mL,混匀;再从中取1.4 mL多糖溶液于下一个孔中,按此法稀释得到5个梯度浓度多糖溶液,每个浓度做3个平行,空白对照为1.4 mL蒸馏水与1.4 mL无水乙醇混合液;然后用移液枪取1.4 mL 0.2 μmol·L-1DPPH溶液于多糖溶液及空白对照中,快速混匀,在黑暗中反应30 min后测定517 nm处吸光度,按式(2)计算清除率。

(2)
式中:A0为无水乙醇+DPPH溶液的吸光度;A1为多糖+DPPH溶液的吸光度。
1.5.2 总抗氧化能力的测定
称取6.1 mg FeSO4,配成水溶液;加入0.25 mL 18 mol·L-1H2SO4,定容后放入还原铁;取5.00 mL上述冷却溶液于50 mL容量瓶中,再加入蒸馏水配制成800 μmol·L-1FeSO4标准溶液;继续用蒸馏水稀释,制备25 μmol·L-1、50 μmol·L-1、100 μmol·L-1、200 μmol·L-1、400 μmol·L-1FeSO4标准溶液,测定593 nm处吸光度,绘制FeSO4标准曲线;采用FRAP法[13]测定总抗氧化能力。
2 结果与讨论
2.1 葡萄糖标准曲线
以葡萄糖标准溶液浓度为横坐标、吸光度(A490)为纵坐标绘制葡萄糖标准曲线,如图1所示。

图1 葡萄糖标准曲线
从图1可以看出,葡萄糖浓度在0.1~0.5 mg·mL-1范围内与A490呈线性关系。回归方程为y=1.059x-0.0167,R2=0.9988。
2.2 多糖提取工艺优化
在单因素实验的基础上,综合多糖提取过程中各个单因素的相互关系,以提取温度、提取时间及料液比为考察因素,以多糖提取率为评价指标,采用L9(34)正交实验优化多糖提取工艺。正交实验因素与水平见表1,结果与分析见表2。
由表2可知,各因素对多糖提取率的影响大小为:C>B>A,即影响最大的是料液比,其次是提取时间,提取温度影响最小,最优提取条件为A1B1C1,即提取温度75 ℃、提取时间3 h、料液比1∶30(g∶mL,下同),在此条件下,多糖提取率达到3.14%。

表1 正交实验的因素与水平Tab.1 Factors and levels of orthogonal experiment
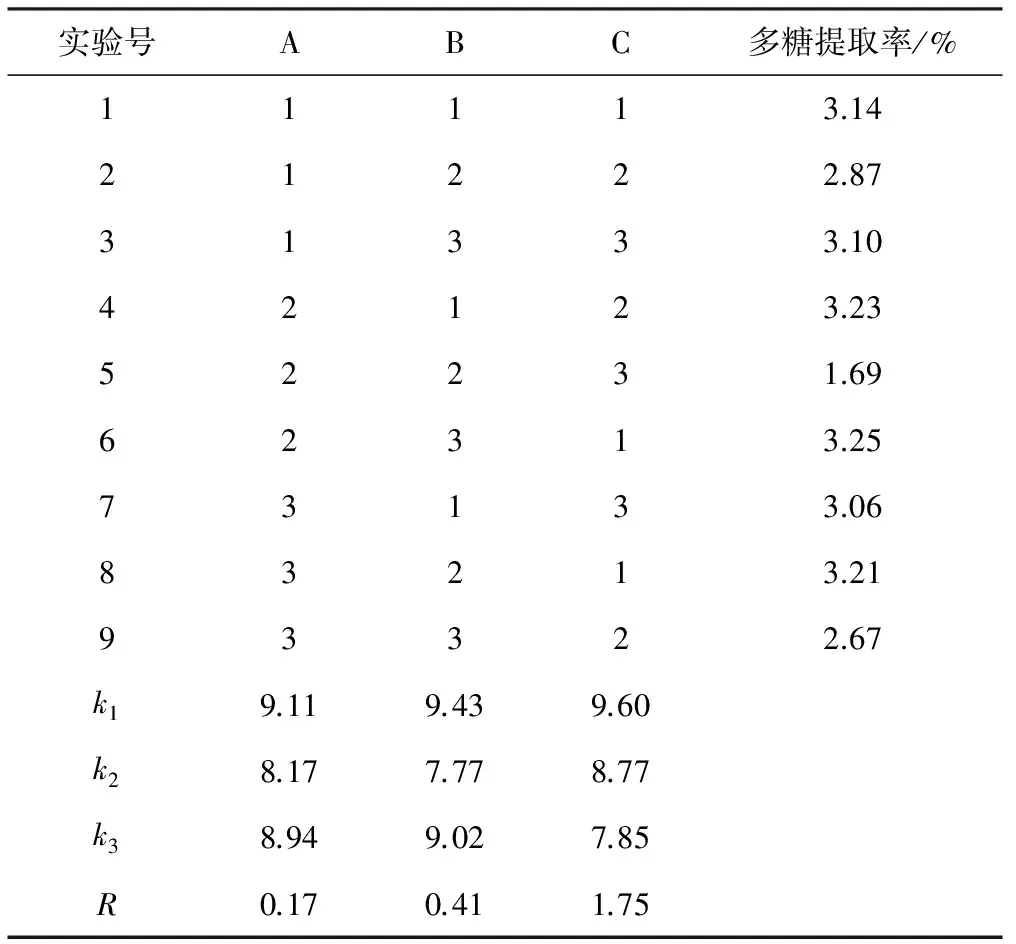
表2 正交实验结果与分析Tab.2 Results and analysis of orthogonal experiment
2.3 多糖的抗氧化活性评价
2.3.1 对DPPH自由基的清除能力
处于DPPH自由基中心位置的氮原子上的单电子对517 nm波长有强吸收,使得DPPH自由基醇溶液呈紫色。当存在自由基清除剂时,醇溶液褪色的程度与氮原子上单电子接受的电子数目呈剂量关系。本实验参照文献[14],采用紫外分光光度法测定了多糖对DPPH自由基的清除能力,结果如图2所示。
从图2可以看出,随着多糖浓度的增大,DPPH自由基清除率逐渐升高。表明,土曲霉GX7-3B多糖对DPPH自由基的清除能力与其浓度呈正相关关系。
2.3.2 总抗氧化能力
人体自由基的量在代谢正常的情况下是处于一种动态平衡中,当外界环境(如太阳光的辐射、吸入污染的气体、吸烟等)发生变化时,这种动态平衡极易被破坏,导致自由基积累,伤害人体正常组织,甚至引发肿瘤、心脏病和老年痴呆等。为了防止和减轻自由基造成的损害,需要合适的自由基清除剂。研究显示[15-16],大多数真菌多糖能通过增强谷胱甘肽过氧化物酶活性来清除自由基。为此,本实验采用FRAP法研究红树林土曲霉GX7-3B多糖的总抗氧化能力,FeSO4标准曲线见图3,多糖总抗氧化能力见图4。

图2 多糖对DPPH自由基的清除能力

图3 FeSO4标准曲线

图4 多糖的总抗氧化能力
从图4可以看出,在实验浓度范围内,当多糖浓度每增加一倍,总抗氧化能力会显著增强(P<0.01);当多糖浓度达到最大,即1 mg·mL-1时,FRAP值可以达到103.2,总抗氧化能力最强。表明,红树林土曲霉GX7-3B多糖的总抗氧化能力与其浓度呈正相关关系。
3 结论
通过正交实验确定红树林土曲霉GX7-3B多糖的最佳提取条件为:提取温度75 ℃、提取时间3 h、料液比1∶30(g∶mL),在此条件下,多糖提取率达到3.14%。红树林土曲霉GX7-3B多糖清除DPPH自由基的能力和总抗氧化能力与其浓度呈正相关关系。表明,红树林土曲霉GX7-3B多糖是一种较好的天然抗氧化剂,具有开发成为药物或功能食品的潜力。
[1] 林鹏.中国红树林生态系[M].北京:北京科学出版社,1997:167.
[2] LIN P.Mangrove Ecosystems in China[M].Beijing and New York:Science Press,1999:142-167.
[3] 丘柳明,左文健,王辉.角果木内生真菌Penicilliunsp.J54 代谢产物及活性研究[J].中国海洋药物,2015,34(2):17-21.
[4] HUANG C H,PAN J H,CHEN B,et al.Three bianthraquinone derivatives from the mangrove endophytic fungusAlternariasp.ZJ9-6B from the South China Sea[J].Marine Drugs,2011,9:832-843.
[5] XUE C B,WANG A L,MELONI D,et al.Discovery of INCB3344,a potent,selective and orally bioavailable antagonist of hunman and murine CCR2[J].Bioorganic & Medicinal Chemistry Letters,2010,20(24):7473-7478.
[6] HUANG Z,CAI X,SHAO C,et al.Chemistry and weak antimicrobial activities of phomopsins produced by mangrove endophytic fungusPhomopsissp.ZSU-H76[J].Phytochemistry,2008,69(7):1604-1608.
[7] XU J,KIER J,SENDKER J,et al.Cytosporones,coumarins,and an alkaloid from the endophytic fungusPestalotiopsissp.isolated from the Chinese mangrove plantRhizophoramucronata[J].Bioorganic and Medicinal Chemistry,2009,17(20):7362-7367.
[8] 胡谷平,佘志刚,吴耀文,等.南海海洋红树林内生真菌胞外多糖的研究[J].中山大学学报(自然科学版),2002,41(1):121-122.
[9] DENG C M,LIU S X,HUANG C H,et al.Secondary metabolites of a mangrove endophytic fungusAspergillusterreus(No.GX7-3B) from the South China Sea[J].Marine Drugs,2013,11(7):2616-2624.
[10] DENG C M,HUANG C H,WU Q L,et al.A new sesquiterpene from the mangrove endophytic fungusAspergillusterreus(No.GX7-3B)[J].Natural Product Research,2013,27(20):1882-1887.
[11] 王思芦,汪开毓,彭艳伶.野生鸡枞菌多糖的提取及其免疫活性[J].中国兽医科学,2011,41(12):1276-1281.
[12] 郑必胜,唐芳勇,闫文娟,等.苯酚-硫酸法测定广东虫草菌丝体多糖含量的研究[J].农产品加工·学刊,2008(8):17-21.
[13] 赵文恩,李茜倩.FRAP法测定大枣枣皮红色素的总抗氧化能力[J].郑州大学学报(工学版),2011,32(3):29-30.
[14] 罗萍,师莉莎,刘华忠.乌贼墨多糖的体外抗氧化作用[J].食品研究与开发,2013,34(8):1-4.
[15] HUA Y L,YANG B,TANG J,et al.Structural analysis of water-soluble polysaccharides in the fruiting body ofDictyophoraindusiataand theirinvivoantioxidant activities[J].Carbohydrate Polymers,2012,87(1):343-347.
[16] WANG Q,LI H,CHEN T T,et al.Yield,polysaccharides content and antioxidant properties ofPleurotusabalonusandPleurotusgeesteranusproduced on asparagus straw as substrate[J].Scientia Horticulturae,2012,134:222-226.
打击非法集资 共创社会和谐
——《化学与生物工程》编辑部
Optimization on Extraction Process of Polysaccharides from Mangrove EndophyticAspergillusterreusGX7-3B and Their Antioxidant Activity
DENG Chun-mei,HE Lan-zhen,ZHANG Guo-guang,LI Si-dong,WEN Yan-mei,WU Yu-lian,HUANG Deng-wei,KANG Xin-huang*
(SchoolofChemistryandEnvironment,GuangdongOceanUniversity,Zhanjiang534088,China)
TheextractionprocessofpolysaccharidesfrommangroveendophyticAspergillus terreusGX7-3Bwasoptimizedthroughanorthogonalexperiment.ThepolysaccharideswerepurifiedbydeproteinizationusingSevagereagent.Theantioxidantactivityin vitrowasevaluatedbythescavengingabilityofDPPHfreeradicalandthetotalantioxidantability.Resultsindicatedthattheoptimumextractionconditionsofpolysaccharideswereasfollows:extractiontemperatureof75 ℃,extractiontimeof3h,solid-liquidratioof1∶30(g∶mL).Theextractionrateofpolysaccharidesreached3.14%underaboveconditions.ThescavengingabilityofDPPHfreeradicalandthetotalantioxidantabilityshowedapositiverelationshipwiththeconcentrationofpolysaccharidesinrangeoftestingconcentrations,whichsuggestedthatpolysaccharidefrommangroveendophyticAspergillus terreusGX7-3Bwasanaturalantioxidant.
mangrove;Aspergillus terreus;polysaccharide;extraction;antioxidantactivity
湛江市科技局自然科学基金项目(A15445,A14457),广东海洋大学自然科学基金项目(E13503,Q14176)
2016-12-15
邓春梅(1968-),女,江西南昌人,博士,高级实验师,研究方向:天然药物化学,E-mail:dcm2382405@163.com;通讯作者:康信煌,副教授,E-mail:kang.xinhuang@gmail.com。
10.3969/j.issn.1672-5425.2017.06.009
O636.1 R931
A
1672-5425(2017)06-0041-04
邓春梅,何兰珍,张国光,等.红树林土曲霉GX7-3B多糖的提取工艺优化及抗氧化活性研究[J].化学与生物工程,2017,34(6):41-44.

