老年全麻患者术后血浆硫化氢水平与术后认知功能障碍的关系*
何庆标,黄 威,王育明,詹长春
(武警广东省总队医院麻醉科,广东 广州 510507)
随着外科手术及麻醉技术的日益提高,老年患者术后死亡率及严重神经系统并发症的发生率已明显下降,但术后认知功能障碍(POCD)依然是老年患者术后的主要并发症[1]。近年来,关于POCD的发病机制研究甚多,曾有过相当多的学说,目前仍不清楚。H2S是一种新型的气体信号分子,对神经系统的调节具有重要作用。血浆H2S可能是通过影响海马长时程形成及突触活动、抗氧化的神经保护作用以及降低脑血管张力等机制发挥保护作用[2]。有研究报道[3]H2S在脑缺血-再灌注损伤、Alzheimer病等的发病中起重要作用,但与POCD发生是否有关系却鲜有报道。本研究拟探讨体外循环(CPB)心脏瓣膜置换术后H2S水平的变化与术后早期认知障碍发生的关系,为临床提供参考。
1 资料与方法
1.1 一般资料
本研究已获得我院伦理委员会的批准,所有患者及家属都已经签署了知情同意书。选择2016-07—2016-11间在我院外科择期全麻手术老年患者60例,男34例,女26例;年龄65~80岁,体重指数为18~28 kg/m2;ASA分级Ⅱ或Ⅲ级,NYHA分级Ⅱ或Ⅲ级,EF>40%。手术种类分为:普外科24例,胸外科11例,骨科25例。术后根据是否发生POCD,将病人分成2组:POCD组和非POCD组。排除标准:(1)术前蒙特利尔认知评估(MoCA)评分<26分,(2) 有神经系统病史:脑梗死、脑出血或有脑卒中后遗症患者;(3)心、肺、肾功能衰竭者;(4)长期酗酒者;(5)有精神病史者或术前有需要服用精神类药物者;(6) 无法配合完成认知功能的测试患者。
1.2 麻醉方法
麻醉前30 min肌肉注射东莨菪碱0.3 mg。入室后常规监测心电图、血压、心率、血氧饱和度,开放静脉通路。所有患者采用静吸复合全身麻醉。麻醉诱导:静脉注射咪达唑仑0.1~0.5 mg/kg、舒芬太尼0.4~0.6 μg/kg和依托咪酯0.3 mg/kg,待患者睫毛反射消失后静脉注射维库溴铵0.15~0.2 mg/kg,气管插管后机械通气;麻醉维持:吸入1%~2%七氟醚,静脉输注异丙酚1~2 mg·kg-1·h-1、瑞芬太尼2~4 μg·kg-1·h-1。并间断静脉注射顺阿曲库,维持脑电双频指数于40~55。术毕送入麻醉复苏室。
1.3 标本采集
于麻醉诱导前(T0)、手术结束时(T1)、术后24h(T2)、48h(T3)和72 h(T4)时取患者的桡动脉血4 mL;用3000 r/min的速率进行离心处理,时间为10 min;将血清成功分离出来,放在-70 ℃低温冰箱内进行存储,备检测.
1.4 标本检测
根据敏感硫电极法(检测工具为PXS-270离子计,购自上海雷磁)来对血浆H2S分别进行测定,具体步骤:(1)对硫离子溶液进行标准化配置;(2)对抗氧化液进行科学配置;(3)对血浆H2S进行测定的各个程序:使用之前,将电极放入去离子水内进行活化,时间不少于2 h。开启离子计,对测定项予以调整,直至mV档;斜率设置为100%;把敏感硫、参比两种电极共同浸入样品;读数平稳后开始纪录;电极需放入去离子水内进行冲洗,单个样品完毕,电极应重新予以活化。测定之前,根据S2-溶液对标准曲线进行科学测定;(4)基本原理:血浆H2S,一般有两种常见的存在形态,其一为气体(1/3);其二为NaHS(2/3);掺加抗氧化液之后,H2S、NaHS能够和NaOH之间发生化学反应,得到产物S2-,根据敏感硫电极来对此时的血浆S2-进行检测,可以体现出H2S浓度[4]。
1.5 认知功能评定
于术前1 d、术后1~3 d采用MoCA评分评估患者认知功能,MoCA包括视空间、执行、命名、注意力、抽象、延迟记忆和定向力,总分30分。MoCA评分结果>26分为无认知功能障碍,评分≤26分为有认知功能障碍,≤23分诊断为POCD[5]。为减少误差,MoCA评分由同一名心理医师完成。
1.6 统计学方法

2 结果
2.1 两组患者一般资料情况
各组患者年龄、性别、受教育年限、ASA分级、手术时间、出血量等一般资料比较差异均无统计学意义(P>0.05),见表1。

表1 两组患者一般资料
2.2 两组患者术前术后评分情况
术前1 d、术后1 d、2 d、3 d 期间,15例发生POCD,发生率为25%。与术前1 d比较,非POCD组患者术后MoCA评分差异无统计学意义(P>0.05),POCD组患者术后1 d、2 d MoCA评分降低(P<0.05);与非POCD组比较,POCD组患者术后1 d、2 d MoCA评分降低(P<0.05),见表2。

表2 两组患者术前1 d、术后1 d、2 d、3 d MoCA评分情况 分
注:与术前1 d比较aP<0.05;与非POCD组比较bP<0.05。
2.3 两组各时点血浆H2S浓度情况
与T0比较,非POCD组术后各时点血浆H2S浓度的差异无统计学意义(P>0.05),POCD组T2、T3各时点血浆H2S浓度降低(P<0.05),T4时恢复至基础水平(P>0.05)。与非POCD组比较,POCD组T2、T3各时点血浆H2S浓度降低(P<0.05),见表3。
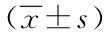
表3 两组各时点血浆H2S的浓度 μmol/L
注:与T0比较aP<0.05;与非POCD组比较bP<0.05。
2.4 POCD组血浆H2S浓度与MoCA评分
POCD组血浆H2S浓度与MoCA评分结果比较,呈显著正相关系(r=0.86,P<0.01)。
3 讨论
POCD为麻醉手术后常见的一种并发症,主要表现为精神错乱、记忆力下降、焦虑及人格的改变,多发于65岁以上的老年人。据报道,老年患者非心脏术后早期POCD的发生率高达9%~45%[6]。随着我国人口老龄化和医学技术不断发展,接受手术治疗的老年患者将会越来越多,POCD发生率也随之增加,严重影响患者生活质量。
POCD诊断尚无统一标准,目前主要依据神经心理学的测定进行评估,较常用的工具是MMSE和MoCA评分。本研究采用的MoCA评分包括10种以上不同语言和不同文化的版本,本文采用的是北京版,适于更广的教育水平和年龄层次,与MMSE评分相比具有更高的特异性和敏感性[7]。本研究显示,术后3 d期间POCD发生率为25%,与上述报道一致。本研究中POCD患者术后1 d、2 d MoCA评分均较术前1 d明显下降,术后3 d恢复,表明 POCD多发生在术后1~2 d,且持续时间甚短,为一过性的功能障碍,但也有研究[8]报道,少数可维存数月,甚至发展成为阿尔茨海默病。
H2S为除NO和CO外的第三类气体信号分子,它的生理作用与NO及CO存在极为相似的特性。胱硫醚-β-合酶(cystathionine-β-synthase,CBS)和胱硫醚-γ-裂解酶(cystathionine-γ-1yase,CSE)是参与生成内源性H2S的关键酶。颅内CBS大多分布于海马、小脑、大脑皮层和脑干等组织[9];CSE主要分布在血管组织中,颅内也少量存在。脑内的H2S大多通过钙离子/钙调素路径活化CBS催解L-半胱氨酸及α-丙戊二酸合成[10]。生理浓度的H2S不但能抑制及清除神经系统内的多种氧化性物质,具有减轻氧化应激所致细胞损伤的作用,而且还能对ATP钾通道起到调节作用,加快内皮细胞内部的NO释放,舒张血管平滑肌,增加脑血流量,改善脑血管的血供。同时,还可利用KATP/PKC/ERK1/2/Hsp90 关键的途径,对缺氧状态下的神经元提供可靠的保护。当机体处于麻醉及手术创伤应激状态或颅脑损伤,CBS的底物半胱氨酸相对生成不足致CBS生成不足,同时CBS的活性也会低下,导致血浆H2S含量减少[11]。
本研究显示,与T0比较,POCD组T2、T3各时点血浆H2S浓度显著降低,T4时恢复;而非POCD组术后血浆H2S浓度水平维持相对平稳,另外,POCD组患者血浆血浆H2S浓度与MoCA评分呈显著正相关(r=0.86,P<0.01),即血浆H2S浓度越低,MoCA评分越低,且术后3 d含量恢复与MoCA评分吻合。提示血浆H2S浓度降低可能参与了POCD发生的病理生理过程。
H2S参与POCD发病的可能机制目前认为与以下因素有关:(1)H2S通过长时程记忆增强(LTP)机制调节学习和记忆,H2S血清水平降低影响了海马LTP形成及其突触活动从而使学习和记忆能力受到相应的损害。(2)中枢神经系统的H2S具有明显的抗氧化功能,若其含量降低,其抗氧化的神经保护作用会受到影响。(3) H2S含量减少可引起脑血管张力增加,脑组织缺血。长期慢性脑组织缺血就会引起大脑认知功能的下降[12]。
总之,老年全麻患者术后血浆H2S水平降低可能参与了POCD发生的病理生理过程,为临床评估和发现POCD提供了重要的线索。
[1] 陈辉春,金凯,蒲青凡,等.围手术期血必净对老年腹部手术患者术后认知功能障碍的影响[J].实用医学杂志,2016,27(18):3400-3403.
[2] 隗世波,廖锋,杜军保,等.颅脑损伤患者血浆硫化氢含量的变化及其意义[J].生理学报,2012,64(6):681-686.
[3] 王勇,但艳萍,王大斌.肺动脉高压患儿血浆硫化氢的变化及其与预后的关系[J].实用医学杂志,2015,25(10):1593-1595.
[4] NASREDDINE Z S,PHIHIPS N A,BEDIRIAN V,etal.The montreal cognitive assessment,MoCA:a brief screening tool for mild cognitive impairment[J].J Am Geriatr Soc,2005,15(3):695-699.
[5] 王春燕,吴新民.全身麻醉术后对中老年病人认知功能的影响[J].中华麻醉学杂志,2002,22(6):332-335.
[6] 殷亚俊,刘志勇.硫化氢对大鼠肺缺血再灌注氧化损伤的影响[J].现代医学,2011,37(6):184-186.
[7] 温洪波,张振馨,牛富生,等.北京地区蒙特利尔认知量表的应用研究[J].中华内科杂志,2008,14(7):36-39.
[8] 张静,田鸣.老年患者术后认知功能障碍病理生理机制的研究进展[J].国际麻醉与复苏学杂志,2015,15(7):37-40.
[9] ETO K,ASADA T,ARIMA K,etal.Brain hydrogen sulfide is severely decreased in Alzheimer’s disease [J].Biophys Res Commn,2015,293(5): 1485-1488.
[10] LI Z,WANG Y,XIE Y,etal.Protective effects of exogenous hydrogen sulfide on neurons of hippocampus in a rat model of brain ischemia [J].Neurochem Res,2011,23(6): 1840-1849
[11] OSIPOV R M,ROBICH M P,Fang J,etal.Effect of hydrogen sulfide on myocardial protection in the setting of cardioplegia and eardiopul—monary bypass[J].Interactive Cardio Vascular and Thoracic Surgery,2010,10(4):506-507.
[12] MASAKI T,ANAN F,SHIMOMURA T,etal.Association between hippocampal volume and serum adiponectin in patients with type 2 diabetes mellitus [J].Metabolism,2012,61(8):1197-1200.

