HPLC法测定不同施肥模式栽培的金线莲中黄酮类成分
黄庆佐,杨晓灵,赵会贤,黄丽英
(1. 福建医科大学 药学院,福建 福州 350108; 2. 福建省泉州市卫生和计划生育委员会,福建 泉州 362000)
研究报告(114~119)
HPLC法测定不同施肥模式栽培的金线莲中黄酮类成分
黄庆佐1,2,杨晓灵1,赵会贤1,黄丽英1
(1. 福建医科大学 药学院,福建 福州 350108; 2. 福建省泉州市卫生和计划生育委员会,福建 泉州 362000)
HPLC法测定不同施肥模式栽培的金线莲中3种黄酮类成分:槲皮素、山奈酚和异鼠李素. 超声-微波协同提取法提取4种不同施肥模式下金线莲中的黄酮类成分. HPLC-电喷雾离子化法/质谱(HPLC-ESI-MS)对黄酮类化合物进行定性分析. HPLC分析得槲皮素在0.25~20.0 μg/mL(r=0.999 2)、山奈酚在0.25~20.0 μg/mL(r=0.999 5)、异鼠李素在1.0~80.0 μg/mL(r=0.999 0)范围内峰面积与浓度呈良好的线性关系,不同栽培方法的金线莲药材中槲皮素、山奈酚、异鼠李素的质量分数分别在151.8~240.0、47.2~88.2、16.8~29.8 μg/g之间.方法简单、精确,快速,可为科学评价不同培养模式金线莲质量提供依据. 栽培过程施加氮、磷、钾 (NPK) 复合肥及添加腐植素和微量元素,能提高金线莲中3种黄酮类成分的含量. 栽培过程施加硫、磷 (SP) 复合肥,槲皮素、山奈酚和异鼠李素的质量分数分别下降了2.3%、17.2%和18.8%. 结果表明采用不同施肥模式直接影响到药材中的药效物质的含量.
金线莲;高效液相色谱;超声-微波协同提取;黄酮;氮、磷、钾复合肥;硫、磷复合肥
金线莲 (Anoectochilusroxburghii(Wall) Lindl) 为兰科开唇兰,属多年生草本植物,是我国民间传统的珍贵药材,别名包括金线兰、金丝草、树草莲、金钱子草等,主要分布于中国、日本、印度及东南亚各国. 在我国主要分布在福建、广西、广东、云南、贵州、台湾、海南等地区,其中以闽、浙、赣为主产地[1-2]. 金线莲以全草入药,味甘性平,用于治疗癌症、高血压、糖尿病、肺炎和肾炎、毒蛇咬伤等. 因其具有多种药理作用,包括抗炎、保肝、抗疲劳和抗骨质疏松症等,因此民间称之为 “药中之王”[3-4].
黄酮类化合物是自然界中存在的酚类化合物,属植物次级代谢产物,数量之多列天然酚性化合物之首. 目前,研究发现黄酮类化合物除具有清除自由基[5]、抗氧化[6]和抗炎[7-8]等作用之外,还具有保肝[9-10]、抗肿瘤[11-13]、降血脂[14]和抗抑郁[15]等作用. 金线莲中黄酮类成分的分析方法主要有荧光光度法[16]、HPLC法[17-18]以及HPLC-MS法[19]. 目前研究较多的是不同产地和品种[20-22]、不同月龄[23]金线莲中黄酮类成分分析. 曹扬远[18]利用RP-HPLC法测定了不同产地野生金线莲和中槲皮素、山奈酚和异鼠李素的含量,但是不同施肥模式栽培的金线莲中黄酮类成分的分析尚未见报道.
由于金线莲成分比较复杂,本试验同时采用高效液相色谱/电喷雾离子源-质谱法(HPLC-ESI-MS),对不同施肥模式栽培的干燥金线莲药材中的槲皮素、山奈酚、异鼠李素3种黄酮类化合物进行了定性比较.
1 试验部分
1.1 仪器与试剂
HPLC-ESI-MS-8040三重四级杆液质联用仪(日本岛津公司);LC-20Atvp 高效液相色谱仪(日本岛津公司);SPD-20Atvp紫外检测器(日本岛津公司);RE-52AA型旋转蒸发仪(上海亚荣生化仪器厂);DJ-10A型倾倒式粉碎机(上海淀久中药机械制造有限公司);CW-2000型超声-微波协同萃取仪(中山大学、上海新拓联合研制);电子天平(北京赛多利斯仪器系统有限公司).
对照品:槲皮素、山奈酚、异鼠李素(阿拉丁试剂公司);甲醇(色谱纯,德国默克试剂);乙醇(分析纯,国药集团化学试剂有限公司);磷酸(分析纯,国药集团化学试剂有限公司);水为实验室自制双蒸水;金线莲药材来自福建永安林下金线莲培养基地,培养模式如表1所列,药材经福建医科大学药学院天然药物化学系张永红教授鉴定.
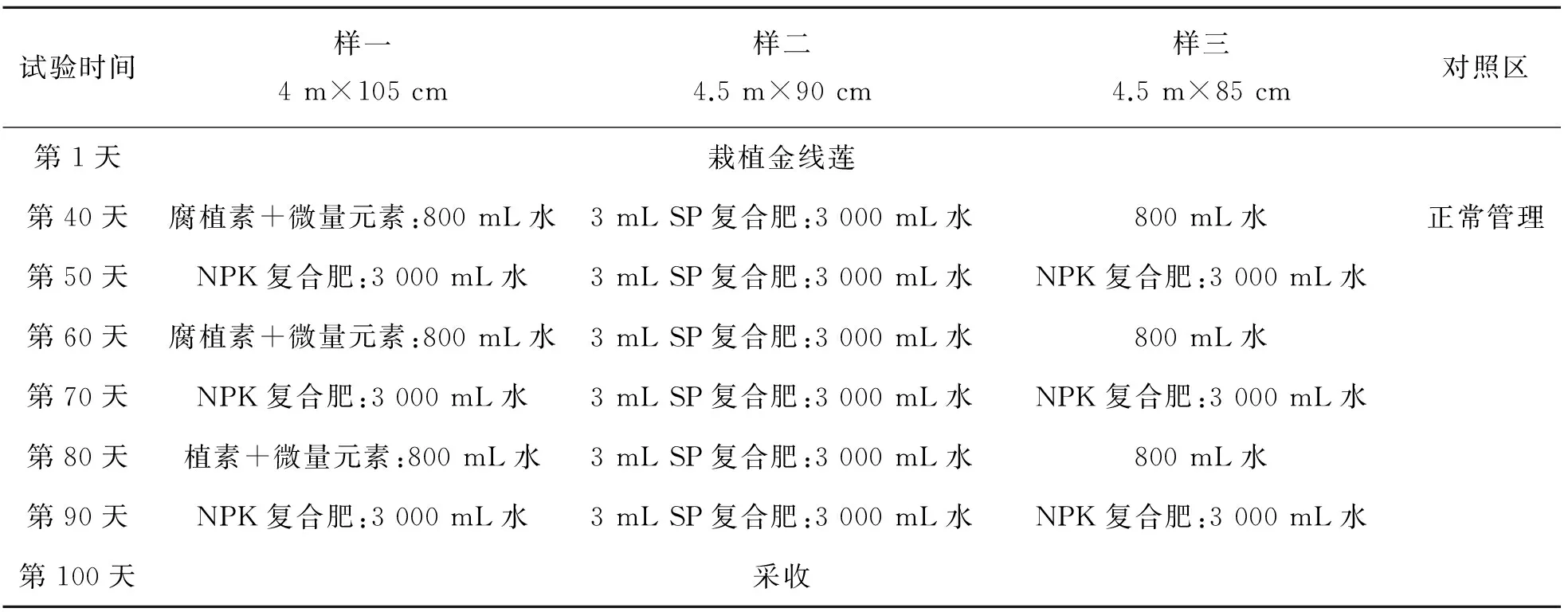
表1 金线莲施肥试验方案Table 1 Fertiliztion experiment program for Anoectochilus roxburghii
氮、磷、钾 (NPK)复合肥15-15-15:氮肥(尿素)、磷肥(过磷酸钙)和钾肥(氯化钾)通过转鼓造粒工艺自制而得;硫、磷 (SP) 复合肥15-15:硫肥(硫酸钠)和磷肥(过磷酸钙)通过转鼓造粒工艺自制而得.
1.2 试验方法
1.2.1 施肥试验
金线莲幼苗经人工瓶培4个月后,移栽至试验田. 试验地分为4个区(即样一、样二、样三、对照区),每区约为4 m2左右. 每个区均施10次肥料,每隔10天施一次肥(阴雨天顺延),每次施2.5 g肥料,对照区只施相应数量的清水. 具体方案如表1所列.
1.2.2 检测条件
1.2.2.1 色谱条件
Welch Materials C18柱(250 mm×4.6 mm,5 μm);流动相为甲醇-0.04%磷酸水溶液(体积比为55∶45);检测波长为360 nm;流速1.0 mL/min;柱温30 ℃;进样量20 μL.
1.2.2.2 质谱条件
电喷雾离子源(负离子扫描模式),质量扫描范围:m/z100~700;毛细管电压:6 KV;离子源温度:250 ℃;雾化气:180 L/h;除溶剂温度:400 ℃;干燥气:900 L/h氮气;碰撞气体:氩气.
1.2.3 对照品溶液的制备
分别取槲皮素、山奈酚、异鼠李素对照品10 mg,精密称定,用甲醇溶解并稀释至50 mL容量瓶中,摇匀,制得200.0 μg/mL的各对照品储备液. 分别精密移取上述对照品储备液4.0、1.0、1.0 mL置同一个10 mL容量瓶中,用甲醇稀释至刻度,摇匀,制成含有槲皮素、山奈酚和异鼠李素,质量浓度分别为80.0、20.0、20.0 μg/mL的混合对照品溶液,备用.
1.2.4 供试品溶液的制备
金线莲全草干燥粉碎(过425 μm筛),精密称取2.0 g,置于超声-微波协同萃取仪的玻璃萃取容器中,加入50 mL 80%乙醇溶液浸泡2 h,然后在微波功率80 W、温度 55 ℃的超声-微波协同萃取仪中萃取30 min,取出放冷后过滤,残渣用甲醇洗涤,重复上述步骤两次,合并滤液. 减压回收溶剂,残渣加甲醇溶解,定容于25 mL容量瓶中,摇匀,0.45 μm微孔滤膜滤过,即得待测液.
2 结果与讨论
2.1 提取方法的选择
根据参考文献[18],金线莲样品提取条件为:80%乙醇溶液浸泡2 h,微波功率80 W,温度 55 ℃,超声-微波协同萃取仪中萃取时间30 min,提取次数为2次.
2.2 流动相系统选择
确定以甲醇-0.04%磷酸水溶液(体积比为55∶45)最好,色谱图基线平稳,3种成分得到很好的分离.
2.3 对照品溶液和供试品溶液的HPLC-UV分析
图1(a)和(b)显示了在上述色谱条件下,采用HPLC-UV检测方法得到的3种混合标准品及供试品的色谱图.图1(a)中的槲皮素、山奈酚和异鼠李素的保留时间分别为11.64、19.16和21.06 min. 根据色谱峰的保留时间对比,图1(b)中1、2、3色谱峰初步鉴定,分别为槲皮素、山奈酚及异鼠李素.
2.4 HPLC-ESI-MS鉴定金线莲中的槲皮素、山奈酚和异鼠李素
采用1.2.2.1和1.2.2.2项下的条件,对槲皮素、山奈酚和异鼠李素的对照品和供试品溶液,在保留时间分别为11.64、19.16和21.06 min的流出峰进行质谱分析,从全扫描质谱图中分别获得槲皮素、山奈酚和异鼠李素的准分子离子峰[M+H]-,分别为m/z301 、285和315,且3个准分子离子峰的相对强度最大. 通过m/z值、色谱峰保留时间比较,保留时间为11.64、19.16和21.06 min的色谱峰对应的物质依次鉴定为槲皮素、山奈酚和异鼠李素,即该样品中存在槲皮素、山奈酚和异鼠李素.
2.5 线性关系的考察
精密移取上述混合对照品溶液适量,依次稀释成系列不同浓度的对照品溶液. 按照1.2.2.1项下色谱条件下进样分析,重复5次. 以对照品质量浓度X(μg/mL)为横坐标,峰面积平均值Y为纵坐标,绘制标准曲线并进行线性回归计算,得槲皮素、山奈酚和异鼠李素标准曲线回归方程和线性范围,结果如表2所列. 由表2可见,线性关系良好.

表2 3种组分的回归方程、相关系数和线性范围(n=5)Table 2 Regression equations, correlation coefficients and linear ranges of three constituents(n=5)
2.6 精密度试验
取同一质量浓度的混合对照品溶液,按照1.2.2.1项下色谱条件下进样分析,重复进样6次,测定峰面积,计算槲皮素、山奈酚和异鼠李素峰面积的RSD分别为 0.9%、1.9%、2.3 %. 表明精密度良好.
2.7 重复性试验
精密称取金线莲药材(样三)样品6份,依1.2.4项下方法制备供试品溶液,按照1.2.2.1项下色谱条件下进样分析,测得槲皮素平均质量分数为216.3 μg/g,RSD为3.5%;山奈酚平均质量分数为87.4 μg/g,RSD为1.4%;异鼠李素平均质量分数为30.8 μg/g,RSD为2.8%.
2.8 稳定性试验
取金线莲供试品溶液(样一),于室温下放置,分别于0、2、4、8、12、24 h进样,按照1.2.2.1项下色谱条件下进样分析,测定槲皮素、山奈酚和异鼠李素的峰面积,计算RSD分别为2.9%,2.6%和2.3%.
2.9 加样回收率试验
称取已知含量(槲皮素、山奈酚、异鼠李素的质量分数分别为217.2、88.2、29.8 μg/g)的金线莲药材粉末(样三)9份,每份约1.0 g,精密称定,按低、中、高分别精密加入相当于样品中含有量的80%、80%、80%、100%、100%、100%、120%、120%和120%的混合对照品溶液,按1.2.4项下的方法操作. 按照1.2.2.1项下色谱条件下进样分析,计算各成分的回收率以及各组分9组回收率的RSD%,结果如表3所列.
2.10 样品含量测定
分别取4个样品金线莲药材粉末(过425 μm筛)约2.0 g,每区设计3个样品(n=3),精密称定,按1.2.4项下的方法操作,在上述色谱条件下进样测定并计算样品中槲皮素、山奈酚和异鼠李素的含量,结果如表4所列. 从测定结果可知,4种不同栽培模式下,金线莲药材中槲皮素质量分数为151.8~240.0 μg/g,山奈酚质量分数为47.2~88.2 μg/g,异鼠李素质量分数为16.8~29.8 μg/g,3种成分含量均有差异. 栽培过程施加NPK复合肥及添加腐植素和微量元素的样一与对照品(浇水)相比,药材中槲皮素、山奈酚含量分别提高了54.5%和50.4%,异鼠李素含量与对照品相当. 样三栽培过程仅施加NPK复合肥,与对照品(浇水)相比,药材中槲皮素、山奈酚和鼠李素含量分别提高了39.8%、54.7%和44.0%. 样品一栽培过程施肥方式与样三比较,除了施加NPK复合肥,还有添加腐植素和微量元素,前者槲皮素含量高于后者约15%,山奈酚和鼠李素含量二者之间没有显著性差异. 以上结果说明栽培过程施加NPK复合肥及添加腐植素和微量元素,能有效提高金线线莲药材中黄酮类物质中重要活性成分含量. 而样二与对照品(浇水)比,药材中槲皮素、山奈酚和异鼠李素含量反而分别下降了2.3%、17.2%和18.8%,即栽培过程施加SP复合肥对金线线莲药材中山奈酚和异鼠李素含量有较大影响,二种成分含量下降近二成.

表3 加样回收率试验结果(n=9)Table 3 Results of recovery test(n=9)
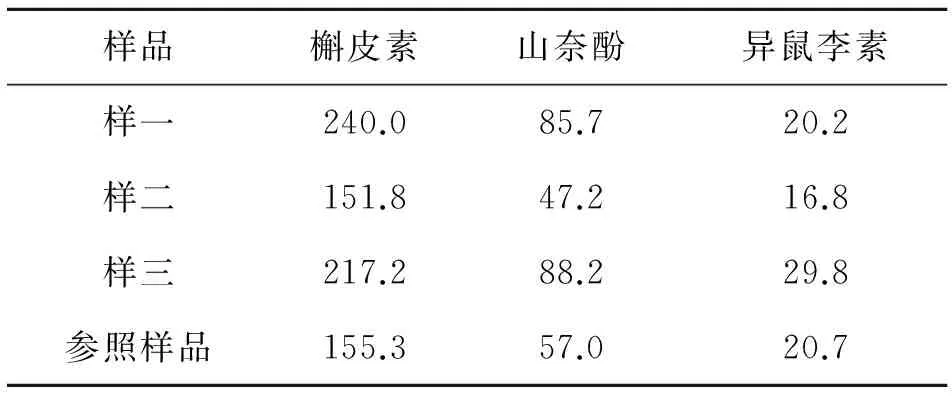
表4 不同培养模式金线莲中槲皮素、山奈酚和异鼠李素的含量 Table 4 Contents of queretin,kaempferol and isorhamnetin in Anoectochilus roxburghii cultivated by different modes (μg/g, n=3)
3 结论
本试验首次采用HPLC/ESI-MS对4种不同施肥模式栽培的金线莲药材中的黄酮类化合物槲皮素、山奈酚和异鼠李素进行了定性定量分析. 试验结果表明:栽培过程施加NPK复合肥及添加腐植素和微量元素,能有效提高金线莲中3种黄酮类物质的含量. 施加SP复合肥,药材中槲皮素、山奈酚和异鼠李素含量反而分别下降了2.3%、17.2%和18.8%,说明不同施肥模式下,金线莲药材中3种黄酮类成分含量存在显著差异. 金线莲适生于山涧常绿阔叶林和竹林下的枯枝落叶层、植被覆盖较好、郁闭度大、土壤腐殖质层厚而肥沃疏松及相对湿度大的环境[20],其对生态环境要求严格. 所以人工栽培时施加腐植素,有利于其生长及活性成分的累积.
本论文为金线莲药材中其他活性成分与栽培模式的研究提供思路. 证明金线莲栽培环境能够影响金线莲药材中的黄酮类化合物含量,可以为今后金线莲的种植提供科学指导,以适应市场的需求和质量控制.
[1] 张以忠,邓琳琼,黄丽华,等.金线莲研究的现状与展望[J].贵州科学,2007(2):81-84.
[2] 黄以平.金线莲研究进展[J]. 海峡药学,2013(9):19-21.
[3] Tseng C C, Shang H F, Wang L F,etal. Antitumor and immunostimulating effects ofAnoectochilusformosanusHayata[J]. J Phytomedicine, 2006, 13:366-370.
[4] Hsieh W T, Tsai C T, Wu J B,etal. Kinsenoside, a high yielding constituent fromAnoectochilusformosanus, inhibits carbon tetrachloride induced Kupffer cells mediated liver damage[J]. J Ethnopharmacology, 2011, 135: 440-449.
[5] Hyung-Kyoon Choi, Yong-Suk Lima, Young-Suk Kim,etal. Free-radical-scavenging and tyrosinase-inhibition activities of Cheonggukjang samples fermented for various times[J]. J Food Chemistry, 2008,106:564-568.
[6] Leong Cheng, Ning Abrahama, Tako Masakuni,etal. Antioxidant flavonoid glycosides from the leaves of Ficus pumila L[J]. J Food Chemistry, 2008, 109: 415-420.
[7] WANG T Y, LI J, GE J F,etal. Effect of total flavonoids from Litsea coreana Leve. on adjuvant-induced arthritis and its mechanism[J]. J Chinese Pharmacological Bulletin, 2007, 23(12):1618-1623.
[8] Aquila S, Rosa M, Ginera Mar C,etal. Anti-inflammatory activity of flavonoids from Cayaponia tayuya roots[J]. J Journal of Ethnopharmacology, 2009, 121:333-337.
[9] 杨晓灵,廖小英,黄媛,等.SFOD-LPME-HPLC测定金线莲中对羟基苯乙酮和香草乙酮[J].中国医院药学,2016,36(24):2156-2161.
[10] 林守二,黄丽英,俞晓玲.柱前衍生化HPLC法分析人工栽培金线莲中多糖的单糖组成[J].福建医科大学学报,2016,50(3):148-152.
[11] John A Manthey, Najla Guthrie. Antiproliferative activities of citrus flavonoids against six human cancer cell lines[J]. J Food Chemistry, 2002, 50: 5837-5843.
[12] Ko C H, Shen S C, Lee T J F,etal. Myricetin inhibits matrixmetallop roteinase 2 protein expression and enzyme activity in colorectal carcinoma cells[J]. J Mol Cancer Ther, 2005, 4(2): 281-290.
[13] Erhart L M, Lankat-Buttgereit B, Schmidt H. Flavone initiates a hierarchical activation of the caspase-cascade in colon cancer cells[J]. J Apoptosis, 2005, 10(3):611-617.
[14] 韩敏.黄酮类化合物降血脂作用研究进展[J].西安文理学院学报(自然科学版),2013,16(4):11-15.
[15] 龚金炎,吴晓琴,毛建卫,等.黄酮类化合物抗抑郁作用的研究进展[J].中草药,2011,42(1):195-200.
[16] 罗明可,吴水华,柯伙钊.荧光光度法测定福建组培金线莲中总黄酮含量[J].中国医药科学,2012(2):121-123.
[17] 关璟,王春兰,郭顺星,等. 高效液相色谱法测定金线莲中黄酮含量[J].药物分析,2008(1):9-11.
[18] 曹扬远,朱壁洁,王勇,等. RP-HPLC测定金线莲超声-微波协同萃取物中3种活性成分的含量[J].中国现代药物应用,2007(5):1-3.
[19] 郑成凤,潘裕添,蔡文燕,等. HPLC-UV-MS/MS法对金线莲中黄酮类组分的鉴定和测定[J].天然产物研究与开发,2013(10):1381-1386.
[20] 黄丽萍,黄丽英,林守二,等.液-质联用分析金线莲中4种黄酮类化合物[J].福建医科大学学报,2015(2):72-77.
[21] 张赛男. 不同种源金线莲黄酮含量对比研究[J]. 北京农业,2014(30):126-127.
[22] 李丹丹,彭金年,张付远.不同来源金线莲中总黄酮含量的比较[J].安徽农业科学,2013(14):6213-6214.
[23] 黄瑞平,黄颖桢,陈菁瑛,等.不同月龄金线莲多糖和总黄酮含量的比较.热带生物学报[J].2012(2):174-176.
Determination of Flavonoids inAnoectochilusRoxburghii(wall) Lindl Cultivated with Different Modes by HPLC
HUANG Qing-zuo1,2,YANG Xiao-ling1,ZHAO Hui-xian1,HUANG Li-ying1
(1. School of Pharmacy, Fujian Medical University, Fuzhou 350108,Fujian China;2. Quanzhou City Health and Family Planning Commission of Fujian, Quanzhou 362000,Fujian China)
Three flavonoid compounds(quercetin, kaempferol and isorhamnetin )inAnoectochilusroxburghiicultivated with four different modes were determined by HPLC. The above metioned compounds were extracted by ultrasonic-microwave synergistic extraction method and the quantitative and qualitative analysis were separately analyzed by HPLC and HPLC-ESI-MS. Quercetin, kaempferol and isorhamnetin had good linear relationship in the range of 0.25~20.0(r=0.999 2), 0.25~20.0(r=0.999 5), and 1.0~80.0(r=0.999 0), respectively. The contents were within 151.8~240.0、47.2~88.2、16.8~29.8 μg/g, respectively. The method is a simple, accurate and fast method for the quality evaluation ofA.roxburghiicultivated with different modes. The contents of three flavonoid compounds increased effectively inA.roxburghiiwith the addition of nitrogen, phosphorus, potassium(NPK) compound fertilizer in cultivation and decreased 2.3%, 17.2% and 18.8% respectively inA.roxburghiiwith the addition sulfur-phosphorus(SP) compound fertilizer, this finding provides scientific guidance for plantingA.roxburghii.
A.roxburghii;HPLC;ultrasonic-microwave synergistic extraction;flavonoid;NPK;SP
2017-05-10;
2017-06-12.
福建省卫生教育联合攻关计划项目(wkj-FJ-33);福建省财政厅专项科研项目( 2016B007);福州市科技局资助项目 (No.2015-G-72);福建省教育厅科研项目(NO.JA13125)
黄庆佐(1987-),男,研究生,研究方向:天然药物分析, Tel:13405927646,E-mail:huangqingzuo@126.com
黄丽英,女,教授,博导,研究方向:药物色谱分析,E-mail:fjmuhly88@sina.com.
O657.32
A
1006-3757(2017)02-0114-06
10.16495/j.1006-3757.2017.02.008

