多巴胺受体在大鼠结肠黏膜下神经丛的表达和细胞分布
张 悦 李 蕴 朱进霞 赵文明
(1.首都医科大学基础医学院免疫学系,北京 100069;2. 首都医科大学基础医学院生理学与病理生理学系,北京 100069)
· 基础研究 ·
多巴胺受体在大鼠结肠黏膜下神经丛的表达和细胞分布
张 悦1, 2李 蕴1*朱进霞2赵文明1*
(1.首都医科大学基础医学院免疫学系,北京 100069;2. 首都医科大学基础医学院生理学与病理生理学系,北京 100069)
目的 多巴胺(dopamine, DA)与其受体结合调节肠道动力、黏膜分泌及屏障等,黏膜下神经元参与DA对黏膜的生理调节,但其受体的具体分布尚不明了。通过检测DA受体在大鼠结肠黏膜下层的蛋白和mRNA表达及细胞分布,为DA调节大鼠结肠病理生理机制提供依据。方法 用RT-PCR和Western blotting方法定性测定DA受体在大鼠结肠黏膜下层的mRNA和蛋白的表达;免疫荧光双染色后在激光共聚焦显微镜下观察DA受体在黏膜下血管活性肠肽(vasoactive intestinal peptide,VIP)能和胆碱能神经元上的分布。结果 在大鼠结肠黏膜下层,DA受体D1、D2、D5的mRNA及蛋白均有表达;在黏膜下神经丛VIP能阳性的神经元中有大量分布,其中D1阳性的神经元占58.94%±2.245%,D2阳性神经元占52.03%±9.384%,D5阳性神经元占86.21%±2.902%,且D5阳性神经元数量显著高于D1和D2;在黏膜下神经丛胆碱能阳性的神经元广泛表达DA受体,其中D1阳性神经元占87.75%±7.307%,D2阳性神经元占88.50%±8.761%,D5阳性神经元占89.25%±10.75%。结论 DA受体在大鼠结肠黏膜下层有D1、D2及D5的表达,且在VIP能及胆碱能神经元上均有分布,其中D5受体在VIP能神经元上的分布显著高于D1及D2受体。本研究可为深入探讨DA调节结肠黏膜生理及病理机制提供形态学依据。
多巴胺;多巴胺受体;黏膜下神经丛;血管活性肠肽;乙酰胆碱
多巴胺(dopamine, DA)作为儿茶酚胺类神经递质,在中枢及外周均有广泛分布,其中肠道DA的主要来源为黏膜上皮细胞和肠神经系统[1]。DA受体分有5个亚型D1~D5,均为G蛋白偶联受体,可分为2类,分别为D1类受体(D1和D5)及D2类受体(D2、D3和D4)。D1类受体主要通过升高胞内的cAMP发挥相应的生理调节作用;D2类受体则通过降低胞内的cAMP来发挥作用。DA与相应受体的结合不仅对胃肠动力具有重要的调节作用[2-3],还对黏膜的分泌及屏障功能发挥重要作用[4]。但因研究方法、肠道节段生理差异及神经因素参与与否等原因,DA发挥功能的受体机制并不一致[5-6],且DA受体在消化道具体分布[7-8]也尚不完全明确。肠神经系统是由上亿神经元所形成的肠道神经网络系统[9],可合成、释放乙酰胆碱和多种神经肽对胃肠功能发挥重要的独立整合作用。肠神经系统分为黏膜下神经丛和肌间神经丛,其中黏膜下神经丛主要调节黏膜功能,其中血管活性肠肽(vasoactive intestinal peptide,VIP)和乙酰胆碱(acetylcholine,ACh)是黏膜下促分泌性神经元分泌的主要神经递质,在黏膜分泌、血供及黏膜免疫等方面发挥重要调节作用[10];肌间神经丛则主要负责调节胃肠动力。研究[11]证明DA可直接作用于肠道肌层或肌间神经元上的相应受体对结肠动力发挥直接或间接的调节作用,但DA对黏膜生理的调节作用及相关受体分布数据相对缺乏。有研究显示DA对结肠单纯黏膜层跨膜离子转运的调节主要经由肾上腺素能β受体[12],而对结肠黏膜-黏膜下组织的跨膜离子转运则主要经由D2受体[6],提示黏膜下神经丛可能参与了DA对结肠生理的调节机制,但DA受体在大鼠结肠黏膜下神经丛的分布及具体类型还不明确。本研究旨在探讨DA受体在黏膜下神经丛上的表达及细胞定位,为深入探讨DA调节黏膜生理功能的机制提供形态学数据。
1 材料与方法
1.1 实验动物
选取雄性SD大鼠8只(首都医科大学实验动物中心提供),动物许可证号:SCXK(京)2012-0001。体质量为200~250 g,经实验动物福利委员会许可,动物在室温条件,正常更替光照,24 h食水供应。安乐处死后取结肠组织,其中4只大鼠的结肠用解剖镊剥离出黏膜下层并冻存于液氮中,另外4只大鼠的结肠肠管于OCT中包埋后经液氮固化后保存于-80 ℃冰箱中。
1.2 RT-PCR检测DA受体在大鼠结肠黏膜下层mRNA的表达
1.2.1 RNA的提取
取4只适量大鼠远端结肠黏膜下层组织置于研钵中,加入液氮,用捣锤研磨碾碎组织,加至放有1 mL Trizol(美国Invitrogen公司)的1.5 mL EP管内,轻轻上下颠倒混匀,冰上静置5 min。加入氯仿0.2 mL,剧烈震荡15 s,冰上静置2~3 min,4 ℃低温、12 000 r/min 高速离心15 min。离心后将EP管倾斜45°取出,将上层水相移入干净的离心管中,加入异丙醇沉淀RNA(每1 mL Trizol对应0.5 mL异丙醇)。将混合物在室温条件下孵育10 min,之后4 ℃ 12 000转高速冷冻离心10 min。移去上层悬液,用75%(体积分数)的乙醇洗涤RNA 沉淀一次(每1 mL的Trizol至少加1 mL的75%乙醇),4 ℃下 7 500 r/min低速冷冻离心5 min,弃上清,简单干燥RNA沉淀。加入10~20 μL 无酶水溶解RNA样品,经检测合格后,进行RNA的反转录。
1.2.2 反转录
取0.1 ng~5 μg的总RNA,根据RNA溶液的浓度计算出加样体积,并依次加入1 μL(50 μmol/L)Oligo (dT)和无RNA酶水混合至12 μL,65 ℃加热5 min后置于冰上,再分别加入如下成分:4 μL 缓冲溶液,2 μL 10 mmol/L dNTP Mix,1 μL RiboLock RNase抑制剂(20 U/μL),1 μL反转录酶。将混合物在 42 ℃环境下孵育60 min,以70 ℃孵育5 min终止反应。试剂盒购于美国Thermo公司。
1.2.3 扩增
RT-PCR用于测定大鼠远端结肠黏膜下层的D1、D2、D3、D4和D55种DA受体mRNA的表达情况。DA受体D1正向引物序列为5′-GGA TGA CAA CTG TGA CAC AAG GTT G-3′,反向引物序列为5′- AAG CTG ATG AGG GAC GAT GAA-3′;DA受体D2正向引物序列为5′- CAC CAC GGC CTA CAT AGC AA-3′,反向引物序列为5′-GGC GTG CCC ATT CTT CTC T-3′;DA受体D3正向引物序列为:5′-AGG TGA CAG GTG GAG TCT GG-3′,反向引物序列为5′-CCG TGC TGA TAG TGA ACT GG-3′;DA受体D4正向引物序列为:5′-ATG GTG TTG GCA GGG AAC T-3′,反向引物序列为5′-CCA CCC TCG GAG TAG ACA AA-3′;DA受体D5正向引物序列为5′-CTA GTG TGT GCT GCC ATC GT-3′,反向引物序列为5′-ACC CAG ATG TCG CAG AAT G-3′。GAPDH引物购于生工生物工程(上海)股份有限公司。反应体系根据北京TransGen Biotech公司的试剂盒说明操作。扩增程序如下:94 ℃变性5 s,59 ℃退火15 s,72 ℃延伸10 s,40个循环后4 ℃保存。
1.3 免疫蛋白印迹分析DA受体在大鼠结肠黏膜下层蛋白的表达
分别称取4只大鼠结肠黏膜下层组织20 mg左右,加入200 μL蛋白裂解液,将组织剪碎匀浆,低温超声至半透明,冰浴中轻摇30 min,以12 000 r/min、4 ℃离心5 min。取上清液,用BCA法蛋白定量,调节蛋白上样浓度,在95 ℃水浴中煮5 min变性,以每道80 μg蛋白上样。
80 V电压约40 min,待蛋白跑齐更换至120 V电压约1 h,直至溴酚蓝到达分离胶底端。取出凝胶,与滤纸泡在冷湿转液中10 min左右,PVDF膜在甲醇中短时浸泡后按如下顺序叠放:阴极-滤纸-凝胶-硝酸纤维素膜-滤纸-阳极,恒流295 mA转膜90 min。TBS浸泡纤维素膜10 min后用5%(质量分数)脱脂奶粉(TBS配制)封闭1 h。分别用DA受体D1、D2、D5(1∶200,兔抗大鼠,购自美国Alomone Labs公司)及内参GAPDH(1∶10 000,兔抗大鼠,购自美国Sigma公司),室温孵育1 h,4 ℃过夜孵育,次日取出后室温轻摇30 min,TBST洗膜,孵育绿色荧光二抗 (1∶10 000,山羊抗兔,购自美国Rockrand 公司)2 h,TBST洗膜后TBS浸泡10 min,放入Odyssey系统扫描成像(美国LI-COR公司)。
1.4 免疫荧光组织化学法检测多巴胺受体(dopamine receptors, DAR)在黏膜下层VIP或胆碱乙酰转移酶(choline acetyltransferase,ChAT)免疫阳性神经元上的表达分析
分别取4只大鼠结肠管状包埋的组织块,用冰冻切片机进行6 μm切片,贴片于多聚赖氨酸处理的载玻片上,丙酮固定10 min后晾干并于-20 ℃保存。
PBST洗片后用5%(体积分数)驴血清封闭30 min,选用一抗分别为DA受体D1、D2、D5、血管活性肠肽及胆碱乙酰转移酶(胆碱能神经元标志物),室温孵育1 h,4 ℃过夜孵育。15~16 h后取出组织切片室温放置1 h,PBST洗3次。滴加二抗,孵育2 h后滴加DAPI,5 min后PBST洗片,甘油封片。荧光显微镜下观察,照相。抗体信息详见表1,2。
来自4只大鼠结肠组织的切片进行相应的免疫荧光双标后,每只大鼠的切片选取4~6个视野,分别统计每个视野内VIP、ChAT及DAR免疫阳性神经元的数量;并计算DAR在ChAT或VIP免疫阳性神经元上的表达率。
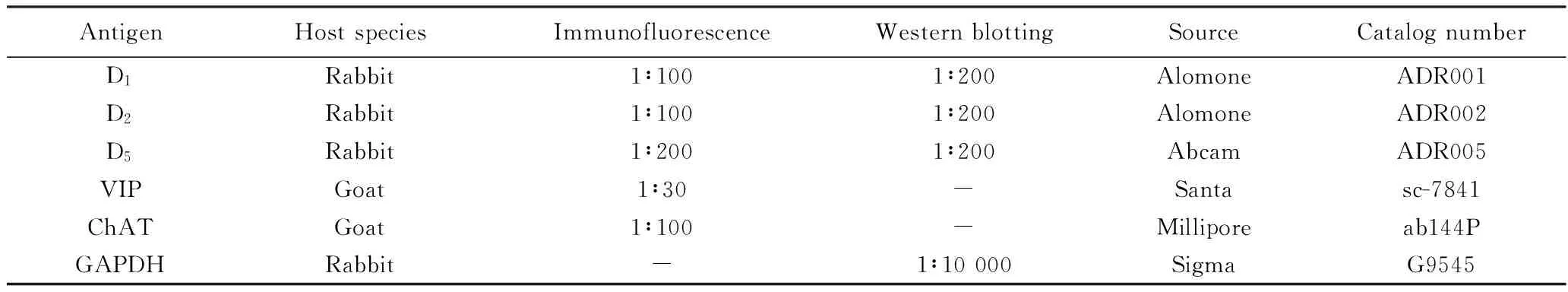
表1 实验所用一抗信息Tab.1 Primary antibodies information in these experiments
VIP:vasoactive intestinal peptide;ChAT:choline acetyltransferase.

表2 实验所用二抗信息Tab.2 Secondary antibodies information in these experiments
1.5 统计学方法
2 结果
2.1 多巴胺受体在大鼠结肠的mRNA及蛋白表达
用PCR技术检测了DA受体在大鼠结肠的mRNA,如图1A显示:DA受体D1、D2、D5的mRNA有明显表达,但未检测到DA受体D3及D4的表达。进一步用Western blotting 方法检测了相应蛋白的表达,结果如图1B所示:D1在120 000处、D2在55 000处、D5在100 000和50 000处均有明显且特异的条带,提示DA受体在大鼠结肠黏膜下组织中有D1、D2及D5的表达。
2.2 多巴胺受体在大鼠结肠胆碱能神经元上的分布
ChAT是ACh的合成酶,在神经元内合成,可作为胆碱能神经元的标志。因此在本研究中,以ChAT为胆碱能神经元标记进行免疫荧光染色,在激光共聚焦显微镜下分别观察ChAT免疫阳性神经元在黏膜下神经丛的分布及DA受体D1、D2、D5在大鼠远端结肠黏膜下神经丛内ChAT免疫反应阳性神经元上的表达情况,并进行统计。结果如图2所示,黏膜下分布有大量ChAT免疫反应阳性的神经元,其中D1、D2及D5免疫反应阳性的ChAT能神经元分别占总ChAT免疫反应阳性神经元数量的87.75%±7.307%、88.50%±8.761%及89.25%±10.75%,差异无统计学意义。

图1 多巴胺受体mRNA及蛋白在大鼠结肠黏膜下层的表达Fig.1 mRNA and protein expression of DA receptors in rat colonic submucosa
A: mRNA expression of DA receptors in rat colonic submucosa;n=4; B: protein expression of DA receptors in rat colonic submucosa;n=4; DA:dopamine; DAR:dopamine receptors.

图2 多巴胺受体在大鼠结肠黏膜下胆碱能神经元上的表达及共存率比较Fig.2 The distribution of dopamine receptors on ChAT-IR neurons in submucosal plexus of rat colon, and comparison of their co-existence
A:green fluorescence staining for dopamine receptors immunoreactivity, red fluorescence staining for ChAT immunoreactivity; B: co-expression rate of D1, D2or D5in ChAT-IR neurons,n=4; ChAT-IR:choline acetyltransferase immunoreactivity; DAR:dopamine receptors.
2.3 多巴胺受体在大鼠结肠的VIP能神经元上的分布
以VIP为VIP能神经元标记,采用免疫荧光双重染色方法并在激光共聚焦显微镜下分别观察DA受体D1、D2、D5在大鼠远端结肠黏膜下神经丛内VIP免疫反应阳性神经元上的表达情况。如图3所示,黏膜下VIP神经元中58.94%±2.245%为D1阳性,52.02%±9.384%为D2阳性,86.21%±2.902%为D5阳性。VIP能神经元上的DA受体D5的表达率显著高于D1及D2,差异有统计学意义。
A: green fluorescence staining for dopamine receptors immunoreactivity, red fluorescence staining for VIP immunoreactivity; B: co-expression rate of D1, D2or D5in VIP-IR neurons;n=3, *P<0.05;#P<0.05;DAR:dopaminereceptors;VIP-IR:vasoactiveintestinalpeptideimmunoreactivity.
3 讨论
研究显示DA及其受体在结肠肌层、肌间神经丛、黏膜上皮细胞及固有层免疫细胞上均有分布[11],但在大鼠黏膜下神经丛中的分布并不明确。其中肌层及肌间神经丛上的DA受体D1、D5和D2介导DA对结肠动力的抑制作用[12],黏膜层DA受体可在结肠黏膜免疫应答中发挥重要的调节作用[13-14]。本实验室前期研究[11]显示DA受体在大鼠结肠黏膜层有D1及D5的表达,本研究显示大鼠结肠组织的黏膜下层有DA受体D1、D2、D5的表达,且在黏膜下胆碱能神经元及VIP能神经元上均有分布,其中VIP能神经元上D5受体的表达数量显著高于其他类型。
结肠黏膜下神经丛中分布着大量的神经元,大致分为胆碱能神经元及非胆碱能神经元,在肠道黏液分泌、跨膜离子转运及免疫调节方面发挥着广泛的直接或间接的影响作用。其中非胆碱能神经元中,VIP能神经元约占大鼠结肠黏膜下神经元数量的60%[15],VIP与多种神经递质如NO共存,除参与调节肠道分泌、血流之外,也可通过调节树突状细胞功能、抑制巨噬细胞活化以及修复黏膜屏障等作用抑制肠道炎性反应,从而发挥黏膜保护作用[13]。由胆碱能神经元所释放的ACh同样具有类似的调节作用,且二者在黏膜分泌功能的调节中还存在协同作用[10,16-17]。
近年来多项研究表明DA及其受体参与炎性肠病的发病机制,但研究结果并不统一:有文献[18]显示DA可通过作用于树突状细胞上的D5受体促进Th17细胞的分化,促进炎性肠病进程;也有文献[19]显示DA可通过作用于D2受体发挥结肠黏膜保护作用。分析可能主要与不同DA受体的细胞分布差异、亲和力差异及不同情况下DA浓度改变有关。DA与其受体的亲和力各有不同:D3>D5>D4>D2>D1,DA在低浓度时优先结合亲和力较高的受体,高浓度时结合较低亲和力的受体,进而发挥不同的调节作用[1]。研究[20]显示炎性肠病时肠道DA浓度显著降低,因此DA有可能优先与黏膜层免疫细胞表面上的D5受体结合,促进炎性反应进程。而根据本研究结果可推断,DA还可能与黏膜下神经元上D5受体高亲和力结合促进VIP及ACh的释放,同时发挥抑炎的负反馈调节作用。而D2受体可能在较高浓度时发挥抑制动力及溃疡生成等作用,具体机制还需深入探讨。
综上,本研究完善了DA受体在大鼠结肠黏膜的形态学分布数据,为深入探讨DA对结肠黏膜功能调节机制提供实验室依据。
[1]PachecoR,ContrerasF,ZoualiM.Thedopaminergicsysteminautoimmunediseases[J].FrontImmunol, 2014, 5:117.
[2] Tolstanova G, Deng X, Ahluwalia A, et al. Role of dopamine and D2 dopamine receptor in the pathogenesis of inflammatory bowel disease[J]. Dig Dis Sci, 2015,60(10):2963-2975.
[3] Zheng L F, Song J, Fan R F, et al. The role of vagal pathway and gastric dopamine in the gastroparesis of rats after 6-hydroxydopamine microinjection in the substantia nigra[J].Acta Physiol (Oxf),2014, 211(2): 434-446.
[4] Feng X Y, Li Y, Li L S, et al. Dopamine D1 receptors mediate dopamine-induced duodenal epithelial ion transport in rats[J].Transl Res,2013,161(6):486-494.
[5] Zhang G H, Zhu J X, Xue H, et al. Dopamine stimulates Cl-absorption coupled with HCO3 -secretion in rat late distal colon[J]. Eur J Pharmacol, 2007,570(1-3):188-195.
[6] Al-Jahmany A A, Schultheiss G, Diener M. Effects of dopamine on ion transport across the rat distal colon[J].Pflugers Arch, 2004,448(6):605-612.
[7] Li Z S, Pham T D, Tamir H, et al. Enteric dopaminergic neurons: definition, developmental lineage, and effects of extrinsic denervation[J]. J Neurosci, 2004, 24(6):1330 -1339.
[8] Li Z S, Schmauss C, Cuenca A, et al. Physiological modulation of intestinal motility by enteric dopaminergic neurons and the D2 receptor: analysis of dopamine receptor expression, location, development, and function in wild-type and lnock-out mice[J]. J Neurosci, 2006,26(10):2798 -2807.
[9] Burns, A J, Hofstra R M. The enteric nervous system: From embryology to therapy[J]. Dev Biol, 2016,417(2):127-128.
[10]Foong J P, Tough I R, Cox H M, et al. Properties of cholinergic and non-cholinergic submucosal neurons along the mouse colon[J]. J Physiol, 2014,592(4):777-793.
[11]Zhang X, Li Y, Liu C, et al. Alteration of enteric monoamines with monoamine receptors and colonic dysmotility in 6-OHDA-induced Parkinson’s disease rats[J].Transl Res,2015, 166(2):152-162.
[12]ZhangX H, Zhang X F, Zhang J Q, et al. β-adrenoceptors, but not dopamine receptors, mediate dopamine-induced ion transport in late distal colon of rats[J].Cell Tissue Res,2008,334(1):25-35.
[13]Chino Y, Fujimura M, Kitahama K, et al. Colocalization of NO and VIP in neurons of the submucous plexus in the rat intestine[J]. Peptides,2002, 23 (12): 2245-2250.
[14]Gonzalez-Rey E, Delgado M. Therapeutic treatment of experimental colitis with regulatory dendritic cells generated with vasoactive intestinal peptide[J]. Gastroenterology, 2006, 131(6): 1799-1811.
[15]Gonzalez-Rey E, Delgado M. Role of vasoactive intestinal peptide in inflammation and autoimmunity[J].Curr Opin Investig Drugs, 2005, 6(11): 1116-1123.
[16]Reddix R, Kuhawara A, Wallace L, et al. Vasoactive intestinal polypeptide: a transmitter in submucous neurons mediating secretion in guinea pig distal colon[J]. J Pharmacol Exp Ther, 1994, 269(3):1124-1129.
[17]Ratcliffe E M, deSa D J, Dixon M F, et al. Intestines choline acetyltransferase (ChAT) immunoreactivity in paraffin sections of normal and diseased intestines[J].J Histochem Cytochem,1998, 46(11): 1223-1231.
[18]Kawano M, Takagi R, Kaneko A, et al. Berberine is a dopamine D1- and D2-like receptor antagonist and ameliorates experimentally induced colitis by suppressing innate and adaptive immune responses[J]. J Neuroimmunol, 2015, 289: 43-55.
[19]Tolstanova G, Deng X, Ahluwalia A, et al. Role of dopamine and D2 dopamine receptor in the pathogenesis of inflammatory bowel disease[J]. Dig Dis Sci, 2015, 60(10): 2963-2975.
[20]Magro F, Vieira-Coelho M A, Fraga S, et al. Impaired synthesis or cellular storage of norepinephrine, dopamine, and 5-hydroxytryptamine in human inflammatory bowel disease[J]. Dig Dis Sci, 2002, 47(1): 216-224.
编辑 孙超渊
Expression and cellular distribution of dopamine receptors in the rat colonic submucosal plexus
Zhang Yue1, 2, Li Yun1*, Zhu Jinxia2, Zhao Wenming1*
(1.DepartmentofImmunology,SchoolofBasicMedicalSciences,CapitalMedicalUniversity,Beijing100069,China; 2.DepartmentofPhysiologyandPathophysiology,SchoolofBasicMedicalSciences,CapitalMedicalUniversity,Beijing100069,China)
Objective Dopamine (DA) plays an important role in the regulation of intestinal motility, secretion and mucosal barrier by binding to its receptors. It has been shown that submucosal neurons are involved in the regulation effect of DA on the mucosa function. However the expressions of DA receptors in submucosal neurons are not clear. The aim of the present study is to investigate the distribution of DA receptors in vasoactive intestinal peptide (VIP) neurons and cholinergic neurons in the submucosa. Methods The mRNA and protein expression of DA receptors was measured by RT-PCR and Western blotting. Immunofluorescent double labeling of DA receptors with submucosal VIP neurons and cholinergic neurons were observed under confocal laser scanning microscope. Results Both the mRNA and protein of DA receptors D1, D2and D5were expressed in the colonic submucosal layer. In the submucosal plexus, D1positive VIP-positive neurons accounting for 58.94%±2.245%, D2for 52.03%±9.384%, and D5for 86.21%±2.902%. The number of D5positive neurons was significantly higher than that of D1and D2. In the submucosal plexus, D1positive cholinergic neurons accounted for 87.75%±7.307%, D2for 88.50%±8.761%, and D5for 89.25%±10.75%, and the distribution of the three types of DA receptors in the cholinergic neurons had no significant difference. Conclusion DA receptors D1, D2and D5are expressed in the submucosal layer of the rat colon. And they all are distributed in the submucosal VIP and cholinergic neurons, and D5expression was higher than D1and D2in VIP-positive neurons. Our study provides a morphological basis for the regulation of DA on the colonic mucosal function.
dopamine; dopamine receptors; submucosal plexus; vasoactive intestinal peptide; acetylcholine
国家自然科学基金(31300954,81370482)。This study was supported by National Natural Science Foundation of China (31300954, 81370482).
时间:2017-06-09 17∶39 网络出版地址:http://kns.cnki.net/kcms/detail/11.3662.r.20170609.1739.042.html
10.3969/j.issn.1006-7795.2017.03.017]
R392
2016-12-15)
*Corresponding authors, E-mail:liyun666@ccmu.edu.cn; zhao-wenming@163.com

