绝食对九龙牦牛体重、血清激素和生化指标的影响
任建林 王之盛 彭全辉 胡 瑞 邹华围 景小平 蒲启建 曾少玉
(四川农业大学动物营养研究所,牛低碳养殖与安全生产四川省高校重点实验室,雅安625014)
绝食对九龙牦牛体重、血清激素和生化指标的影响
任建林 王之盛*彭全辉 胡 瑞 邹华围 景小平 蒲启建 曾少玉
(四川农业大学动物营养研究所,牛低碳养殖与安全生产四川省高校重点实验室,雅安625014)
本试验旨在研究冷季绝食应激时九龙牦牛体重、血清激素和生化指标的变化。选择8头健康无病、生长发育良好的2岁九龙牦牛8头,体重为(90.75±8.66) kg,按体重相近的原则随机分为对照组和绝食组,每组4个重复,每个重复1头牛。对照组正常饲喂,绝食组牦牛做断料处理。试验期7 d。分别在试验开始后的第1、3、5、7天称重和通过颈静脉采血。结果表明:绝食7 d后牦牛的体重显著降低(P<0.05),血清中葡萄糖、胰岛素含量显著下降(P<0.05),血清非酯化脂肪酸、甘油三酯、脂联素和胰高血糖素含量显著升高(P<0.05),血清中糖异生前体物质丙酸、乳酸的含量显著降低(P<0.05),而血清中来源于体储降解的甘油、β-羟丁酸的含量显著升高(P<0.05),血清中糖异生关键酶丙酮酸羧化酶、果糖1,6二磷酸酶、磷酸烯醇式丙酮酸羧激酶、葡萄糖六磷酸酶的活性均显著升高(P<0.05)。结果提示,绝食7 d后牦牛开始大量动用体储,提高糖异生代谢过程,维持机体代谢的正常需要,保证血清葡萄糖含量的稳定以维持生命。
绝食;牦牛;脂联素;糖异生
我国牦牛约有1 600万头,占世界总牦牛数的90%以上。牦牛主要分布在我国西藏、青海、四川、甘肃等高海拔地区,是青藏高原地区牧民耐以生存的生活资料和生产资料,对当地的社会、经济、文化均有重要影响。牦牛所处的高原地区自然环境极为严酷,现阶段牦牛饲养仍采用“靠天养畜”的传统放牧补饲生产体系,一般按冷季(冬春季)、暖季(夏秋季)进行轮牧放牧生产。据统计,青藏高原地区每公顷产草能力在375 kg以下的草场超过50%,牧草生长期短,一般从4月下旬开始萌发,9月下旬开始枯萎,冷季枯草期长达7个月[1]。在冷季枯草期牦牛长期处于绝食状态,在出现大雪封冻的极端气候下,牦牛甚至处于断料断水的绝食生存状态,经过1个冷季枯草期的牦牛掉膘失重可达其体重的30%,死亡率约15%[1-3]。2010—2012年对牦牛养殖的主要5个省区(西藏、青海、四川、甘肃、云南)60余个地区410户牧户开展的牦牛养殖情况调研发现,牦牛低效养殖的关键问题主要是冷季“温饱”问题,绝食胁迫是影响牦牛是否存活的主要因素,每年因绝食造成的直接经济损失在100亿元以上。
绝食是体内营养不足引起的一种生理不平衡状态,在机体“稳态调节”机制的调控下,葡萄糖是动物体维持生理平衡的首要营养素。对绝食和急性低血糖的研究表明,短期内肝脏可通过增强糖原分解和糖异生作用来维持血糖稳衡[4]。糖异生是反刍动物葡萄糖的重要来源,但在冷季绝食条件下,外源营养素摄入受限,来源于食物降解产生的糖异生前体物质减少,机体动员体脂肪、体蛋白质供能,随着脂肪的大量降解产生了大量生糖前体物质[5]。但目前关于冷季绝食对牦牛脂肪代谢和糖异生的影响及其分子机制未见报道。脂联素(adiponectin,APN)是脂肪组织表达最丰富的蛋白质产物之一,能够调节机体能量平衡和血糖稳态,在调节脂肪代谢、能量平衡和胰岛素敏感性等方面都有着重要作用[6]。
近年来,牦牛冷季补饲一直是牦牛营养研究的重点[7],在前人研究的基础上,本研究以九龙牦牛为研究对象,通过建立牦牛绝食模型,研究绝食状态下牦牛体重、血清生化指标、血清中调节糖异生过程的关键酶、激素及糖异生前体物质的变化,为了解牦牛对恶劣环境的抗逆性积累基础数据。
1 材料与方法
1.1 试验动物
选择健康无病、生长发育良好、体重[(90.75±8.66) kg]相近的2岁九龙牦牛8头作为试验对象,试验在四川农业大学试验场进行。
1.2 试验设计
采用配对设计将体重相似的九龙牦牛两两配对分为试验组和对照组,每组4个重复,每个重复1头牛。对照组牦牛正常饲喂,试验组牦牛断绝饲料,并根据杨凤[8]关于动物对饥饿的耐受性的研究以及参照尉小强[9]、杨炳壮等[10]的研究设计试验组牦牛绝食时间为7 d。各组牦牛均自由饮水。预试期21 d,正试期7 d。
1.3 基础饲粮
参考我国《肉牛饲养标准》(NY/T 815—2004)中体重为150 kg肉牛的营养需要按照日增重0.8 kg/d设计饲粮,精粗比为35∶65,基础饲粮组成及营养水平见表1。
1.4 饲养管理
试验前对试验牛进行统一编号,并进行免疫驱虫。其他消毒免疫程序按牛场饲养管理程序进行。预试期牦牛均圈舍饲养,每天早晚各饲喂1次。
1.5 样品采集
在第1、3、5、7天晨饲前进行颈静脉留置针采血,所采血液在阴凉处静置30 min,离心制备血清,-20 ℃保存待测。
1.6 测定指标及方法
1.6.1 体重
试验第1、3、5、7天对九龙牦牛进行空腹称重。
1.6.2 血清生化指标
测定血清中葡萄糖(GLU)、甘油三酯(TG)、非酯化脂肪酸(NEFA)、白蛋白(ALB)、总蛋白(TP)、胆固醇(CHO)的含量,采用全自动生化分析仪(AU 5800)测定。
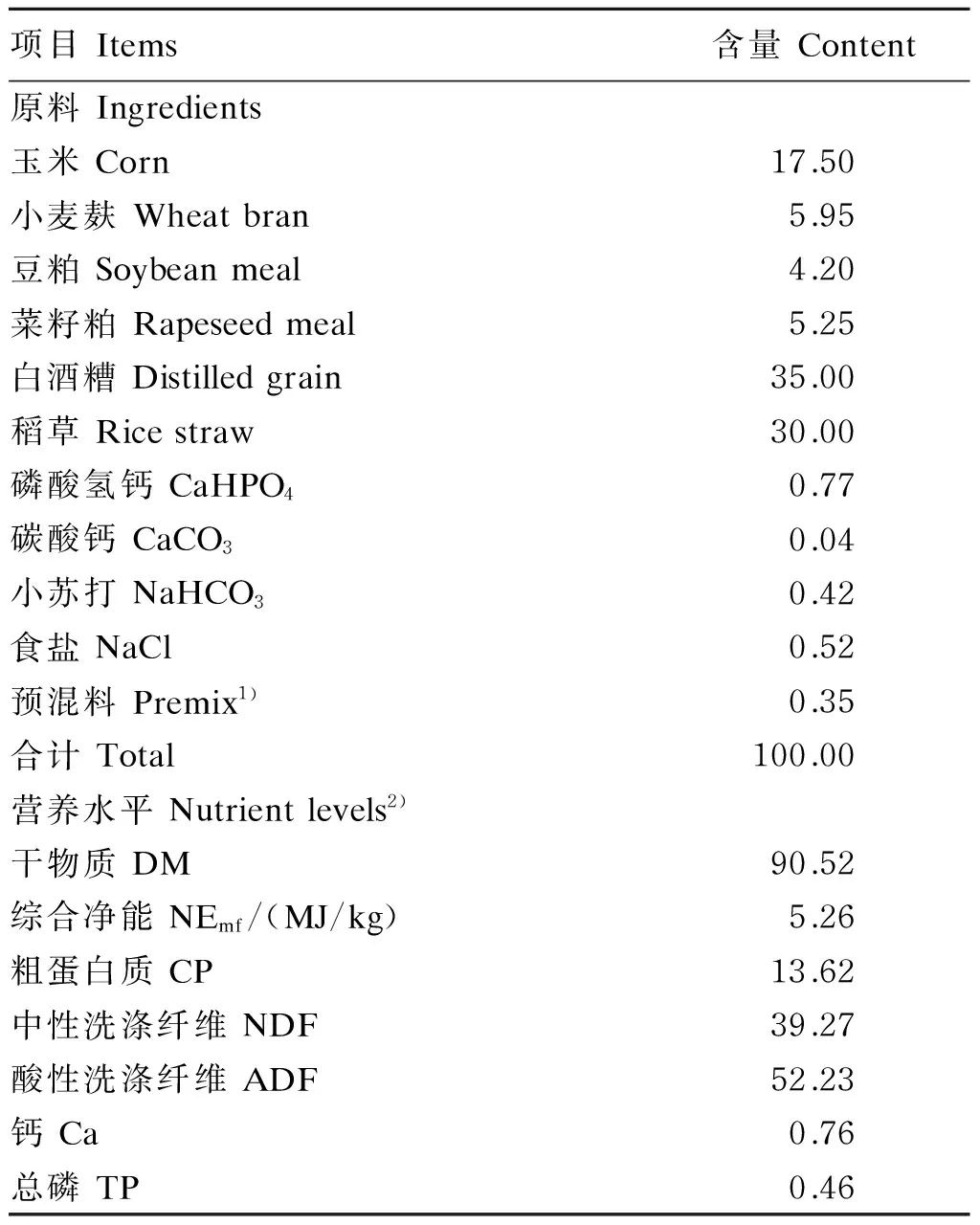
表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet (air-dry basis) %
1)预混料为每千克饲粮提供The premix provided the following per kg of the diet:VA 1 100 000 IU,VD344 000 IU,VE 3 300 IU,Cu 10 mg,Fe 50 mg,Mn 20 mg,Zn 30 mg,I 0.50 mg,Se 0.20 mg,Co 0.10 mg。
2)综合净能为计算值,其余为实测值。NEmfwas a calculated value, while the others were measured values.
1.6.3 血清激素指标
使用酶联免疫吸附试验(ELISA)法测定血清中胰岛素(INS)、胰高血糖素(GN)的含量,具体测定方法参考试剂盒(购自南京建成生物工程研究所)说明。
1.6.4 血清糖异生前体物质含量
采用气相色谱仪测定血清中丙酸、乳酸、甘油、β-羟丁酸含量。以磺基水杨酸为蛋白质沉淀剂,6 000 r/min离心30 min,取上清液用日本L-7型氨基酸自动分析仪测定血清生糖氨基酸丙氨酸含量。
1.6.5 血清中糖异生相关酶活性
使用ELISA试剂盒测定血清中葡萄糖六磷酸酶、磷酸烯醇式丙酮酸酸化酶、丙酮酸羧化酶和果糖1,6二磷酸酶的活性,试剂盒购自南京建成生物工程研究所,具体步骤参照试剂盒说明。
1.7 数据统计与分析
数据用Excel软件进行整理,体重数据分析用SPSS 19.0的配对样本t检验,血清生化指标数据分析用独立样本t检验进行组间分析,用ANOVA过程对组内数据进行单因素方差分析并用Duncan氏法多重比较检验组间差异显著性,结果均用“平均值±标准差”表示,P<0.05为差异显著。
2 结 果
2.1 绝食对牦牛体重的影响
从表2可知,经过7 d的绝食,绝食组牦牛终末体重较初始体重显著降低(P<0.05),降低了12.50%。
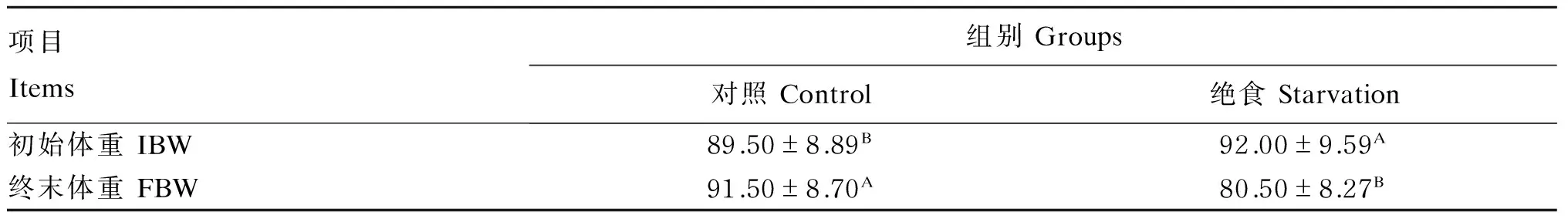
表2 绝食对牦牛体重的影响Table 2 Effects of starvation on body weight of yaks kg
同列数据肩标不同大写字母表示差异显著(P<0.05)。
In the same column, values with different capital letter superscripts mean significant difference (P<0.05).
2.2 绝食对牦牛血清生化指标的影响
从表3可知,绝食组血清中葡萄糖和胆固醇含量在绝食第3天显著降低(P<0.05),之后均保持稳定。绝食组血清非酯化脂肪酸含量在第3天显著升高(P<0.05),第5、7天略有降低,但仍显著高于第1天(P<0.05)。绝食组血清总蛋白和白蛋白的含量分别在第5和7天显著升高(P<0.05)。
绝食组血清甘油三酯的含量在绝食第7天显著升高(P<0.05)。与对照组相比,绝食组血清总蛋白(第5、7天)、白蛋白(第7天)、甘油三酯(第7天)、非酯化脂肪酸含量(第3、5、7天)显著提高(P<0.05),血清葡萄糖(第3、5、7天)、总胆固醇含量(第3、5、7天)显著降低(P<0.05)。

表3 绝食对牦牛血清生化指标的影响Table 3 Effects of starvation on serum biochemical indexes of yaks
同行数据肩标不同小写字母表示差异显著(P<0.05),同一指标、同列数据肩标不同大写字母表示差异显著(P<0.05)。下表同。
In the same row, values with different small letter superscripts mean significant difference (P<0.05), and in the same column, values of the same index with different capital letter superscripts mean significant difference (P<0.05). The same as below.
2.3 绝食对牦牛血清激素指标的影响
从表4可知,血清APN含量随着绝食时间延长逐渐增加,在第7天显著升高了19.46%(P<0.05)。血清胰高血糖素(GN)的含量在绝食第3天显著升高(P<0.05),第5天达最高值,在第7天又有所降低,但仍显著高于第1天(P<0.05)。血清胰岛素(INS)的含量在绝食第3天达最低,之后逐渐上升,但第3、5、7天均显著低于第1天(P<0.05)。血清胰岛素/胰高血糖素在绝食第3、5、7天均显著低于第1天(P<0.05)。与对照组相比,绝食组血清APN(第5、7天)、胰高血糖素含量(第3、5、7天)显著升高(P<0.05),血清胰岛素含量(第3、5、7天)、胰岛素/胰高血糖素(第3、5、7天)显著降低(P<0.05)。

表4 绝食对牦牛血清激素指标的影响Table 4 Effects of starvation on serum hormone indexes of yaks
2.4 绝食对牦牛血清糖异生前体物质含量的影响
从表5可知,血清糖异生前体物质丙酸、乳酸含量均随着绝食时间的延长降低,第3、5、7天均显著低于第1天(P<0.05),血清甘油和β-羟丁酸的含量则随时间的延长含量升高,第3、5、7天均显著高于第1天(P<0.05),而血清丙氨酸含量则表现为在绝食第5天显著升高(P<0.05),第7天降低至与第1天无显著差异(P>0.05)。与对照组相比,绝食组血清丙酸(第3、5、7天)、乳酸含量(第3、5、7天)显著降低(P<0.05),血清甘油(第3、5、7天)、丙氨酸(第5天)、β-羟丁酸含量(第3、5、7天)显著升高(P<0.05)。
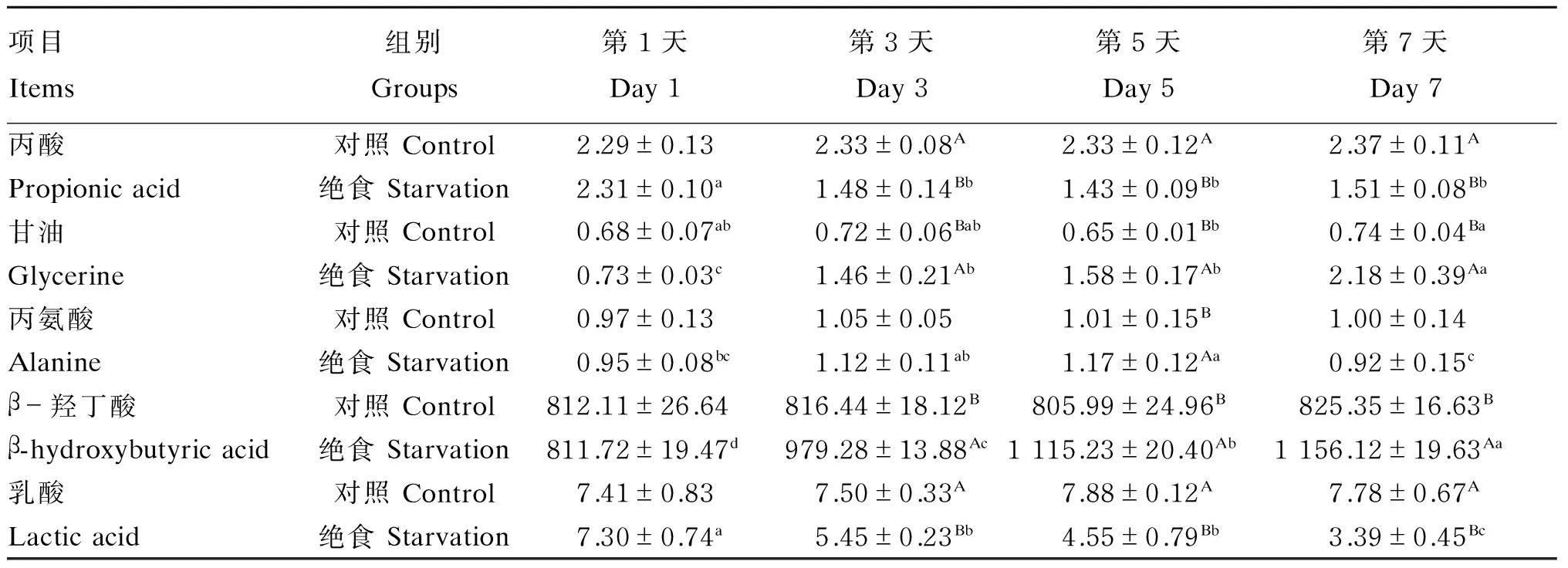
表5 绝食对牦牛血清糖异生前体物质浓含量的影响Table 5 Effects of starvation on serum gluconeogenesis substance contents of yaks mmol/L
2.5 绝食对牦牛血清糖异生关键酶活性的影响
从表6可知,随着绝食时间的延长,绝食组牦牛血清中糖异生关键酶丙酮酸羧化酶、果糖1,6二磷酸酶、磷酸烯醇式丙酮酸羧化酶、葡萄糖六磷酸酶的活性均升高,第3、5、7天均显著高于第1天(P<0.05)。与对照组相比,血清中糖异生关键酶活性在第3、5、7天均显著提高(P<0.05)。
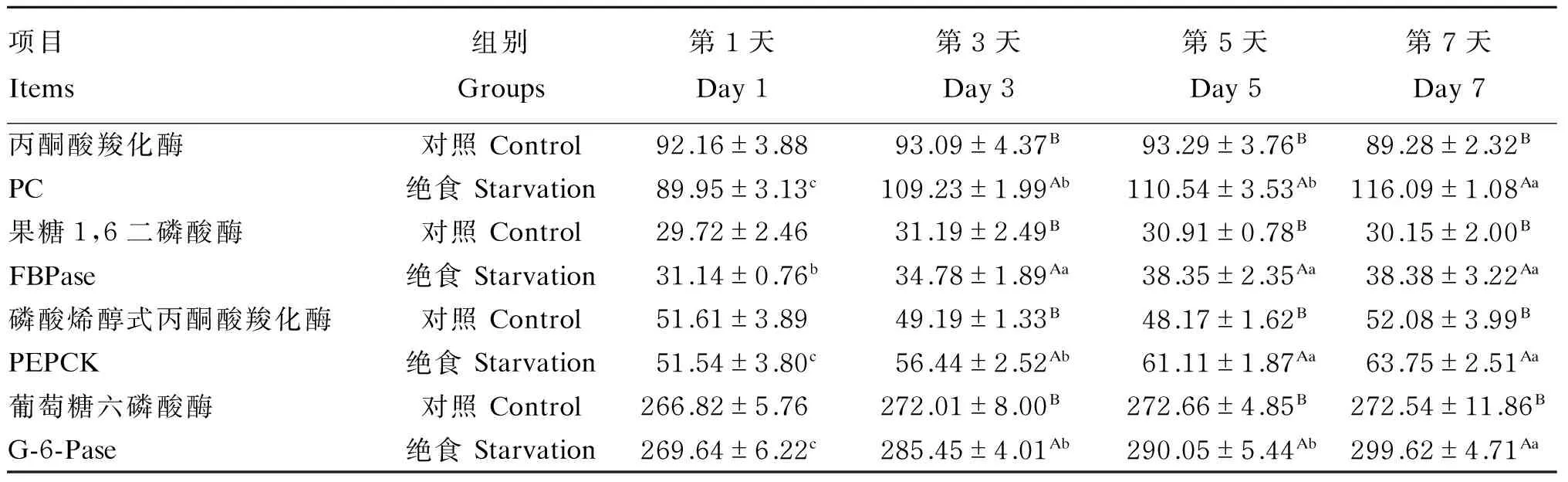
表6 绝食对牦牛血清糖异生关键酶活性的影响Table 6 Effects of starvation on serum gluconeogenesis key enzyme activities of yaks U/L
3 讨 论
3.1 绝食对牦牛体重的影响
体重降低是动物在绝食条件下最明显的现象。研究表明,在受到绝食胁迫时,体重下降超40%时机体将面临生存的危机[11]。一般而言,幼龄动物在绝食状态下的体重损失要大于发育成熟的动物,导致这种差异的原因可能是幼龄动物为了保证机体的生长和发育而存在更高的新陈代谢[12]。动物体重降低的速率也主要取决于2个因素,一是动物因体重、体温及发育状况的不同对能量的需求不同[13-14],二是动物在绝食状态下体内营养物质的分配不同[5]。Chaiyabutr等[15]研究发现经过2 d的绝食,山羊的体重降低了16%。Chwalibog等[16]通过对猪的绝食试验发现,经过4 d的绝食其体重降低了24%。本试验结果表明,经过7 d的绝食,九龙牦牛的体重降低了12.50%,表明了绝食期间牦牛通过消耗机体储备的营养物质,为机体新陈代谢提供能量来源,从而导致其体重的降低,同时还可发现,其体重下降速率要慢于其他动物,推测可能是由于牦牛生活在高原,面对恶劣的环境条件相比较于猪和山羊具有更强的抗逆性。
3.2 绝食对牦牛血清生化指标的影响
当动物受到绝食胁迫时,机体会通过利用体内糖原、脂肪、蛋白质等营养物质分解满足自身能量需要[17]。血清中葡萄糖和甘油三酯的含量能直接反映机体的能量供给状态。在本试验中,牦牛血清葡萄糖含量在绝食第3天显著降低,但在随后4 d血清葡萄糖含量稍有回升但仍稳定在一个较低水平,与以往的研究相似[18]。而另有研究发现在绝食初期,血清葡萄糖含量显著降低,但是随着绝食时间的延长,血清葡萄糖含量变化幅度变小,并维持在一个较恒定的水平[19]。推测以上情况的发生可能由于动物体内稳定的血清葡萄糖含量是动物正常生命活动的前提,绝食条件下血清葡萄糖含量降低使得机体通过糖原分解和糖异生途径来维持血清葡萄糖含量稳定。有研究表明,在绝食状态下,血清葡萄糖和胆固醇含量能够维持在一个较低的水平,可能是机体通过神经-体液调节降低了整个机体的代谢水平来维持的[20]。
血清中甘油三酯水解和脂肪分解可以动态调控甘油三酯的含量,甘油三酯通过脂肪分解产生,而甘油三酯水解酶能将其降解为甘油和脂肪酸。NEFA由中性脂肪水解产生,可以在葡萄糖耗尽时作为其替代品供能。本研究发现,牦牛血清中甘油三酯的含量在绝食第7天显著升高,血清NEFA的含量也随绝食时间的延长出现显著升高。从血清葡萄糖含量在绝食后期趋于稳定的现象来看,随着绝食时间的延长,牦牛体内的能量供应重心逐渐由葡萄糖转变为脂肪。
血清总蛋白由白蛋白和球蛋白组成,白蛋白可以维持血液渗透压和作为运输脂肪酸的载体。本试验中在绝食前期白蛋白和总蛋白的含量并无显著变化,而在绝食后期显著升高。研究发现,鲇血液中的白蛋白、球蛋白、总蛋白含量在绝食21 d后都显著降低[21],与本研究结果存在差异。推测其前期含量保持稳定的原因可能是由于绝食前期脂肪作为第2能源物质首先被机体利用代谢,而到了绝食后期,机体逐渐利用组织蛋白作为能量来源,因此表现为其代谢产物总蛋白和白蛋白含量升高。
3.3 绝食对牦牛血清激素指标的影响
APN是迄今为止发现的唯一与脂肪沉积呈负相关的脂肪细胞因子。Liu等[22]研究发现,绝食24 h可以增加内脏脂肪中的APN基因表达量,而背最长肌中的APN基因表达量没有变化。这与胡戈[23]在小鼠上的研究一致,本研究发现随着绝食时间的延长牦牛血清中APN的含量呈升高趋势,从而能够进一步影响牦牛的糖代谢过程。
胰岛素与胰高血糖素相互拮抗,前者能够降低血液葡萄糖含量,而后者则相反。本研究中绝食后期血清胰岛素含量的升高,可能是因为胰高血糖素的含量升高,促进胰岛素的分泌,通过二者的相互作用,共同维持血清葡萄糖含量。胰岛素和胰高血糖素含量的变化趋势与葡萄糖含量变化趋势相似,表明绝食状态下机体能通过对激素调节血清葡萄糖含量的稳定。胰岛素含量及胰岛素/胰高血糖素均先降低,在绝食后期又升高,最后维持在与绝食前相比较低的水平。De Bruijne等[24]发现,绝食能使血清中的胰岛素含量显著降低;Marliss等[25]在对人的禁食试验中发现,随着禁食时间的延长,血清中胰高血糖素含量先升高后降低,胰岛素含量先下降后升高,与本研究结果一致。
3.4 绝食对牦牛血清糖异生前体物质含量的影响
反刍动物糖异生的主要存在于肝脏和肾脏当中,而且其大部分的葡萄糖是由肝脏中糖异生供给的[26]。正常情况下瘤胃微生物发酵产生的丙酸是反刍动物糖异生主要前体物质,其次,蛋白质降解产生的生糖氨基酸也可经脱氨基作用生成葡萄糖,进入血液供动物利用[27]。推测在本研究中,牦牛在绝食状态下的失重主要是由于外源能量缺乏,机体利用自身脂肪蛋白质分解供能,与此同时也产生了大量生糖前体物质,促进糖异生来共同维持血清葡萄糖平衡。
脂肪分解产生的脂肪酸和甘油可以分别经β-氧化和逆糖酵解途径合成葡萄糖[28];机体蛋白质降解产生的生糖氨基酸可以转变为丙酮酸用于糖异生。Crocker等[29]研究表明,绝食过后海象血清中的β-羟丁酸含量显著升高。另有研究发现丙酸盐能够促进胰岛素分泌[30]。在本研究中,绝食后来源于食物的乳酸、丙酸含量显著降低,而体内脂肪蛋白质分解产生的生糖前体物质甘油、丙氨酸和β-羟丁酸的含量升高。这表明绝食后牦牛糖异生的前体物质由正常状态下的丙酸转变为甘油、生糖氨基酸和酮体,从而保证糖异生作用的持续进行,保证血清葡萄糖含量能够处于稳定状态。
3.5 绝食对牦牛血清糖异生关键酶活性的影响
由于特殊的消化生理特点,糖异生是反刍动物碳水化合物代谢和能量代谢有别于单胃动物的显著特点。除了生糖前体物质的影响之外,糖异生还受糖异生关键酶、激素、葡萄糖转运载体等因素的共同调控。丙酮酸羧化酶、果糖1,6二磷酸酶、磷酸烯醇式丙酮酸羧激酶和葡萄糖六磷酸酶是4个参与调节糖异生的关键酶,其表达量和活性直接影响机体的糖异生情况。其中,葡萄糖六磷酸酶和磷酸烯醇式丙酮酸酸化酶是肝脏糖异生的限速酶,其转录水平决定着糖异生的速度[31]。Vecchi等[32]研究表明,绝食状态下小鼠肝脏中磷酸烯醇式丙酮酸酸化酶基因表达量升高。在本研究中,牦牛血清中4种糖异生关键酶丙酮酸羧化酶、果糖1,6二磷酸酶、磷酸烯醇式丙酮酸酸化酶和葡萄糖六磷酸酶的活性随着绝食时间的延长均显著升高。有研究发现,随着绝食时间的延长,血液糖酵解关键酶活性会显著降低[33];在绝食状态的蒙古育成羯羊的研究中发现,绝食使其肝脏中糖异生关键酶果糖1,6二磷酸酶活性显著升高[34]。以上结果提示,机体为维持血清葡萄糖含量稳定,能够通过提高糖异生相关酶活性促进葡萄糖合成,以维持血清葡萄糖含量的稳态。
4 结 论
① 绝食后牦牛的体重降低,血清葡萄糖含量显著下降,NEFA、胰高血糖素与APN含量显著升高,牦牛大量动用体储来维持机体的代谢需要。
② 绝食后牦牛血清中糖异生前体物质丙酸、乳酸含量显著降低,脂肪和蛋白质动员产物甘油和酮体的含量显著升高。
③ 绝食后牦牛血清中糖异生关键酶活性显著升高,牦牛在绝食状态下能够通过加强糖异生作用以维持血清葡萄糖含量的稳定。
[1] 朱新书,阎萍,梁春年,等.牦牛资源利用现状与提高资源利用效率的途径和方法[C]//第六届中国牛业发展大会论文集.重庆:中国畜牧业协会,2011.
[2] 王威,张建勋,康坤,等.冷季补饲精料对牦牛繁殖性能和生长性能的影响[J].中国畜牧杂志,2013,49(7):78-80.
[3] 郝力壮,王万邦,王迅,等.三江源区嵩草草地枯草期牧草营养价值评定及载畜量研究[J].草地学报,2013,21(1):56-64.
[4] STAEHR P,HOTHER-NIELSEN O,BECK-NIELSEN H.The role of the liver in type 2 diabetes[J].Reviews in Endocrine and Metabolic Disorders,2004,5(2):105-110.
[5] MCCUE M D.Starvation physiology:reviewing the different strategies animals use to survive a common challenge[J].Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology,2010,156(1):1-18.
[6] YAMAUCHI T,KAMON J,ITO Y,et al.Cloning of adiponectin receptors that mediate antidiabetic metabolic effects[J].Nature,2003,423(6941):762-769.
[7] 郝力壮,吴克选,王万邦,等.牦牛妊娠后期补饲对其失重和犊牛生长发育的影响[J].吉林农业科学,2013,38(4):56-58.
[8] 杨凤.动物营养学[M].北京:农业出版社,1993.
[9] 尉小强.饥饿对牦牛糖异生和脂肪代谢的影响研究[D].硕士学位论文.雅安:四川农业大学,2015.
[10] 杨炳壮,文秋燕,梁贤威,等.乳肉兼用水牛不同生长阶段绝食代谢的研究[J].中国畜牧杂志,2006,41(11):46-48.
[11] 郭长江,杨继军.饥饿与生存[J].解放军预防医学杂志,2003,21(2):155-156.
[12] MCNAB B K.On the ecological significance of Bergmann’s rule[J].Ecology,1971,52(5):845-854.
[13] JONES K E,CRUZ-NETO A.Exploring the evolution of the basal metabolic rate in bats[M]//KUNZ T,ZUBAID A,MCCRACKEN G F.Functional and Evolutionary Ecology of Bats.Oxford:Oxford University Press,2006.
[14] GARLAND T Jr,BENNETT A F,REZENDE E L.Phylogenetic approaches in comparative physiology[J].Journal of Experimental Biology,2005,208(16):3015-3035.
[15] CHAIYABUTR N,FAULKNER A,PEAKER M.Effects of starvation on the cardiovascular system,water balance and milk secretion in lactating goats[J].Research in Veterinary Science,1980,28(3):291-295.
[16] CHWALIBOG A,TAUSON A H,THORBEK G.Diurnal rhythm in heat production and oxidation of carbohydrate and fat in pigs during feeding,starvation and re-feeding[J].Journal of Animal Physiology and Animal Nutrition,2004,88(7/8):266-274.
[17] 宋昭彬.饥饿状态下南方鲇仔鱼的形态和行为变化[J].西南师范大学学报:自然科学版,1998,23(4):462-466.
[18] 葛玉凤,侯天德,张建红,等.饥饿对珠颈斑鸠组织糖元、抗氧化酶活性及血液相应指标的影响[J].四川动物,2010,29(2):176-179.
[19] 孙红梅.饥饿对黄颡鱼血液指标及免疫机能的影响[D].硕士学位论文.长春:吉林农业大学,2004.
[20] 卢德勋.动物机体自我营养调控功能及其实践意义[J].内蒙古畜牧科学,1997(增刊):20-29.
[21] 乔志刚,张建平,牛景彦,等.饥饿和再投喂对鲇血液生理生化指标的影响[J].水生生物学报,2008,32(5):631-636.
[22] LIU B H,WANG P H,WANG Y C,et al.Fasting regulates the expression of adiponectin receptors in young growing pigs[J].Journal of Animal Science,2008,86(12):3377-3384.
[23] 胡戈.运动和限食对食源性肥胖大鼠脂联素、脂酶影响的研究[D].硕士学位论文.北京:北京体育大学,2008.
[24] DE BRUIJNE J J,ALTSZULER N,HAMPSHIRE J,et al.Fat mobilization and plasma hormone levels in fasted dogs[J].Metabolism,1981,30(2):190-194.
[25] MARLISS E B,AOKI T T,UNGER R H,et al.Glucagon levels and metabolic effects in fasting man[J].Journal of Clinical Investigation,1970,49(12):2256-2270.
[26] BERGMAN E N.Energy contributions of volatile fatty acids from the gastrointestinal tract in various species[J].Physiological Reviews,1990,70(2):567-590.
[27] ASCHENBACH J R,KRISTENSEN N B,DONKIN S S,et al.Gluconeogenesis in dairy cows:the secret of making sweet milk from sour dough[J].IUBMB Life,2010,62(12):869-877.
[28] LINKE R,SCHROEDER M,HELMBERGER T,et al.Antibody-positive paraneoplastic neurologic syndromes:value of CT and PET for tumor diagnosis[J].Neurology,2004,63(2):282-286.
[29] CROCKER D E,CHAMPAGNE C D,FOWLER M A,et al.Adiposity and fat metabolism in lactating and fasting northern elephant seals[J].Advances in Nutrition:An International Review Journal,2014,5(1):57-64.
[30] SANO H,KAWAHITO Y,WILDER R L,et al.Expression of cyclooxygenase-1 and-2 in human colorectal cancer[J].Cancer Research,1995,55(17):3785-3789.
[31] GOTO M,YOSHIOKA T,BATTELINO T,et al.TNFα decreases gluconeogenesis in hepatocytes isolated from 10-day-old rats[J].Pediatric Research,2001,49(4):552-557.
[32] VECCHI C,MONTOSI G,GARUTI C,et al.Gluconeogenic signals regulate iron homeostasis via hepcidin in mice[J].Gastroenterology,2014,146(4):1060-1069.e3.
[33] 范国燕,李英文.饥饿胁迫对南方鲇幼鱼糖代代谢的影响[J].重庆师范大学学报:自然科学版,2011,28(3):22-27.
[34] 徐永霞,侯先志,王海荣,等.营养限制与补偿对蒙古育成羯羊肝脏关键酶活性的影响[J].动物营养学报,2012,24(7):1236-1245.
*Corresponding author, professor, E-mail: wangzs67@163.com
(责任编辑 王智航)
Effects of Starvation on Body Weight, Serum Hormone and Biochemical Indexes ofJiulongYaks
REN Jianlin WANG Zhisheng*PENG Quanhui HU Rui ZOU Huawei JING Xiaoping PU Qijian ZENG Shaoyu
(KeyLaboratoryofLowCarbonCultureandSafetyProductioninCattleinSichuan,AnimalNutritionInstitute,SichuanAgriculturalUniversity,Ya’an625014,China)
This experiment was conducted to investigate the changes of body weight, serum hormone and biochemical indexes ofJiulongyaks under starvation stress during cold season. Eight 2-year-oldJiulongyaks, which were healthy, in good condition and consistent in body weight [(90.75±8.66) kg], were selected and randomly divided into control group and starvation group, each group had 4 replicates with 1 yak per replicate. Yaks in control group were normally fed, and those in starvation group were suffered from starvation. The experiment lasted for 7 d. On days 1, 3, 5 and 7, body weight was measure, and blood sample was collected through jugular vein. The results showed as follows: after 7 d starvation, body weight of yaks was significantly decreased (P<0.05), serum contents of glucose and insulin were significantly decreased (P<0.05), serum contents of non-esterified fatty acid, triglyceride, adiponectin and glucagon were significantly increased (P<0.05), serum contents of propionic acid and lactic acid as gluconeogenesis substances were significantly decreased (P<0.05), serum contents of glycerine and β-hydroxybutyric acid from body decompose were significantly increased (P<0.05), and serum activities of pyruvate carboxylase, fructose-1,6-bisphosphatase, phosphoenolpyruvate carboxykinase and glucose-6-phosphatase as key enzymes of gluconeogenesis were significantly increased (P<0.05). The results indicate that yaks use the energy stored in the body after starvation, evaluate gluconeogenesis to satisfy normal requirements, and maintain serum glucose content stability and vital activities.[ChineseJournalofAnimalNutrition, 2017, 29(6):2162-2169]
starvation; yak; adiponectin; gluconeogenesis
10.3969/j.issn.1006-267x.2017.06.039
2016-12-01
国家自然科学基金项目(31470121)
任建林(1991—),男,山东潍坊人,硕士研究生,从事反刍动物营养与饲料科学研究。E-mail: renjianlin@qdgenyuan.com
*通信作者:王之盛,教授,博士生导师,E-mail: wangzs67@163.com
S823
A
1006-267X(2017)06-2162-08

