表皮生长因子调控猪肠上皮细胞中钠依赖Ⅱb型磷转运蛋白表达的细胞信号通路研究
邢廷杰 汤小朋 曹满湖 方热军
(湖南农业大学动物科学技术学院,湖南畜禽安全生产协同创新中心,长沙410128)
表皮生长因子调控猪肠上皮细胞中钠依赖Ⅱb型磷转运蛋白表达的细胞信号通路研究
邢廷杰 汤小朋 曹满湖 方热军*
(湖南农业大学动物科学技术学院,湖南畜禽安全生产协同创新中心,长沙410128)
本研究旨在探讨表皮生长因子(EGF)调控猪小肠上皮细胞IPEC-J2中钠依赖Ⅱb型磷转运蛋白(NaPi-Ⅱb)表达的分子机制。试验分别用EGF受体酪氨酸激酶抑制剂(tyrphostin AG 1478)、蛋白激酶A(PKA)抑制剂(H89)、蛋白激酶C(PKC)抑制剂(k4393)、p38抑制剂(SB 203580)、细胞外信号调节激酶(ERK)抑制剂(PD98059)、c-Jun氨基末端激酶(JNK)抑制剂(anisomycin)与EGF共同处理IPEC-J2细胞,利用Western blot检测相关通路蛋白及目的蛋白(NaPi-Ⅱb)的表达水平。结果显示:相较于对照组,EGF处理后NaPi-Ⅱb表达水平显著降低(P<0.05);相较于无抑制剂组,EGF受体、PKA、PKC、丝裂原活化蛋白激酶(MAPK)/p38、MAPK/ERK1/2、MAPK/JNK的特异性抑制剂处理IPEC-J2后,NaPi-Ⅱb表达水平显著提高(P<0.05),其中添加MAPK/ERK1/2特异性抑制剂显著降低了MAPK/ERK1/2在Tyr204位点的磷酸化水平(P<0.05),添加MAPK/JNK的特异性抑制剂显著降低了MAPK/JNK1/2/3在Thr183和Tyr185位点的磷酸化水平(P<0.05),说明该2组抑制剂对该通路的抑制作用是通过降低上述位点的磷酸化水平实现的。本研究结果表明EGF受体、PKA、PKC、p38、ERK和JNK均介导了EGF调控IPEC-J2细胞中NaPi-Ⅱb的表达。
表皮生长因子;磷;NaPi-Ⅱb;信号通路;猪小肠上皮细胞
磷是动物机体必需的矿物元素之一,在动物生长发育、骨骼形成、能量代谢、核酸合成、细胞信号转导以及维持血液酸碱平衡中起着重要作用[1-2]。钠依赖Ⅱb型磷转运蛋白(sodium dependent phosphate cotransporters type Ⅱb,NaPi-Ⅱb)介导的跨上皮细胞磷主动吸收是小肠磷吸收的主要方式[3]。小肠NaPi-Ⅱb的表达受许多因素调控,表皮生长因子(epidermal growth factor,EGF)是调节其表达的重要因素之一[4-6]。EGF是一种由泌乳乳房、下颌腺、肾脏、十二指肠Brunner腺、胰腺和胎盘等分泌的促生长因子,具有促进细胞生长、细胞迁移、细胞增殖、伤口愈合、骨骼愈合及营养物质转运等生物学功能[2,7-8]。EGF调节细胞多种生理功能依赖于与细胞表面的EGF受体结合[8]。EGF能使EGF受体酪氨酸残基自磷酸化,磷酸化的酪氨酸残基为多种信号分子提供了锚定位点,进而可以调节细胞内多种信号分子如蛋白激酶A(protein kinase A,PKA)、蛋白激酶C(protein kinase C,PKC)、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)/p38、MAPK/细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)1/2和MAPK/c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)等介导相应的目的基因的表达[9]。
虽然Xu等[4-5]报道了EGF可通过修饰c-Myb蛋白与NaPi-Ⅱb基因的亲和力,然后通过PKC/PKA和MAPK信号通路实现下游启动子功能的调节,从而抑制人小肠细胞(Caco-2细胞)NaPi-Ⅱb的转录活性而降低其表达水平。本课题组前期研究也表明EGF可抑制猪小肠上皮细胞NaPi-Ⅱb基因的表达,并确定EGF在NaPi-Ⅱb基因的启动子上的反应原件,即c-Myb在NaPi-Ⅱb基因启动子上的结合位点为-1 092~-1 085 bp(5′-TCCAGTTG-3′)[6]。但是,目前尚不清楚EGF主要是通过何种信号通路来调节猪肠上皮细胞中NaPi-Ⅱb表达。因此,本研究拟采用相应的信号分子的特异性抑制剂,包括EGF受体酪氨酸激酶抑制剂(tyrphostin AG 1478)、PKA抑制剂(H89)、PKC抑制剂(k4393)、p38抑制剂(SB 203580)、ERK抑制剂(PD98059)和JNK抑制剂(anisomycin)与EGF共同处理猪小肠上皮细胞IPEC-J2,考察NaPi-Ⅱb在蛋白水平的表达,以期明确EGF调控猪小肠上皮细胞NaPi-Ⅱb表达的确切途径。
1 材料与方法
1.1 主要试剂及抗体
猪EGF(武汉三鹰);DMEM/F12、十二烷基硫酸钠(SDS)(Sigma,美国);0.25%胰蛋白酶-乙二胺四乙酸(EDTA)(Invitregen,美国);30%丙烯酰胺溶液(南京建成);胎牛血清、小牛血清、四甲基乙二胺(TEMED)、显影粉、定影粉、SDS-聚丙烯酰胺凝胶电泳(PAGE)凝胶配制试剂盒(长沙艾佳生物公司);青霉素/链霉素(华中农大兽药厂);脱脂奶粉(伊利);预染Marker(Fermentas,加拿大);蛋白Marker(碧云天生物公司);BAC蛋白浓度检测试剂盒(碧云天生物公司);过硫酸铵(上海生工);硝酸纤维素(NC)膜(Millipore,美国);滤纸(Whatman,美国);胶片(Kodak,美国);增强化学发光(enhanced chemiluminescence,ECL)试剂盒(Pierce,美国)。
EGF受体酪氨酸激酶抑制剂(T4182-5MG,Sigma,美国);PKA抑制剂(S1643,碧云天公司);PKC抑制剂(K4393-10UG,Sigma,美国);p38抑制剂(SML0543-25MG,Sigma,美国);ERK抑制剂(SCP0214,Sigma,美国);JNK抑制剂(S5567-10MG,Sigma,美国)。
NaPi-Ⅱb一抗(21295-1-AP,Proteintech,美国);PKA催化亚基β一抗(ab187515,Abcam,英国);PKA调节亚基Ⅰβ一抗(ab94613,Abcam,英国);PKAα/β/γ一抗(ab211265,Abcam,英国);PKCα一抗(ab32376,Abcam,英国);PKCβ一抗(ab4132,Abcam,英国);PKCγ一抗(ab71558,Abcam,英国);磷酸p38 MAPK(Tyr323)一抗(bs-5477R,Bioss,美国);磷酸p38 MAPK(Thr180)一抗(bs-5476R,Bioss,美国);磷酸ERK1/2(Thr202+Tyr204)一抗(bs-3016R,Bioss,美国);磷酸ERK1(Thr197+Thr202)一抗(bs-3292R,Bioss,美国);JNK1+JNK2+JNK3一抗(bs-2592R,Bioss,美国);磷酸JNK1+JNK2+JNK3(Thr183+Tyr185)一抗(bs-1640R,Bioss,美国);磷酸甘油醛脱氢酶(GAPDH)一抗(ab8245,Abcam,英国);辣根过氧化物酶(HRP)标记二抗(Santa Cruz Biotechnology,美国);抗鼠免疫球蛋白G-HRP(1∶1 000)(北京索莱宝生物公司);抗兔免疫球蛋白G-HRP(1∶500)(北京索莱宝生物公司)。
1.2 试验方法
1.2.1 细胞培养
猪小肠上皮细胞IPEC-J2由中国科学院亚热带农业生态研究所惠赠。IPEC-J2细胞培养于DMEM/F12完全培养基(含10%胎牛血清和1%青霉素/链霉素双抗)中,每24 h换1次液,当细胞80%融合时用0.25%胰蛋白酶-EDTA消化传代。IPEC-J2细胞置于37 ℃、含5% CO2的细胞培养箱中常规培养。
1.2.2 EGF受体抑制剂处理对NaPi-Ⅱb表达的影响
取对数生长期细胞,用0.25%胰蛋白酶-EDTA消化后接种至6孔板中(1×105个/孔),用DMEM/F12完全培养基培养细胞,在显微镜下观察细胞形态,待细胞80%的融合时,换为DMEM/F12不完全培养基(无血清无激素,含青霉素/链霉素)过渡培养16 h,然后试验组加入100 ng/mL EGF[6],并分别加入0、1、2、5、10和20 μmol/L EGF受体抑制剂,对照组加入相同体积的培养基,细胞继续培养8 h。所有处理均为6个重复。培养结束后收集细胞进行Western blot分析。
1.2.3 PKA、PKC、p38、ERK和JNK抑制剂处理对NaPi-Ⅱb表达的影响
取对数生长期细胞,用0.25%胰蛋白酶-EDTA消化后接种至6孔板中(1×105个/孔),用DMEM/F12完全培养基培养细胞,在显微镜下观察细胞形态,待细胞80%的融合时,换为DMEM/F12不完全培养基(无血清无激素,含青霉素/链霉素)过渡培养16 h,然后对照组加入100 ng/mL EGF[6],试验组加入100 ng/mL EGF并分别加入PKA、PKC、p38、ERK和JNK抑制剂,细胞继续培养8 h。所有处理均为6个重复。培养结束后收集细胞进行Western blot分析。
1.3 Western blot分析
1.3.1 细胞蛋白样品制备
细胞培养结束后,弃去培养液,用37 ℃预热的磷酸盐缓冲液(PBS)洗涤细胞2~3遍,加入适量预冷的蛋白裂解液置于冰上10~20 min。用细胞刮刮下细胞,收集在EP管后超声(100~200 W)3 s,然后12 000×g离心5 min。采用BCA蛋白浓度检测试剂盒测定蛋白浓度。将所有蛋白样品调至相等浓度,充分混合沉淀后加加样缓冲液后直接上样,剩余溶液(溶于1×加样缓冲液)-70 ℃保存。
1.3.2 Western blot检测
Western blot程序参照Xiong等[10]介绍的方法。根据目的蛋白分子质量的大小,采用8%、10%、12%与15%的分离胶,5%的浓缩胶将目的蛋白分离。室温恒流转膜90 min,将蛋白转移至聚偏二氟乙烯(PVDF)膜上,随后用含5%脱脂牛奶的对苯二甲酸丁二醇酯(PBST)缓冲液室温封闭1 h,然后与NaPi-Ⅱb一抗(1∶500);PKA催化亚基β一抗(1∶500)、PKA调节亚基Ⅰβ一抗(1∶1 000)、PKAα/β/γ一抗(1∶500)、PKCα一抗(1∶1 000)、PKCβ一抗(1∶1000)、PKCγ一抗(1∶1 000)、磷酸p38 MAPK (Tyr323) 一抗(1∶500)、磷酸p38 MAPK(Thr180)一抗(1∶500)、磷酸ERK1/2(Thr202+Tyr204)一抗(1∶500)、磷酸ERK1(Thr197+Thr202)一抗(1∶500)、JNK1+JNK2+JNK3一抗(1∶500)、磷酸JNK1+JNK2+JNK3(Thr183+Tyr185)一抗(1∶500)、GAPDH一抗(1∶800)4 ℃孵育过夜。经PBST缓冲液清洗3次,用抗鼠免疫球蛋白G-HRP(1∶8 000)或抗兔免疫球蛋白G-HRP(1∶4 000)室温孵育1 h,孵育后弃去二抗,用PBST缓冲液清洗膜3次,使用HRP-ECL法对PVDF膜上的蛋白进行显影。具体的方法是将ECL试剂盒中A液和B液按比例稀释混合,然后涂在PVDF膜上。将PVDF膜放置在Western blot成像仪上进行扫描,然后进行拍照保存。结果用Image J凝胶分析软件进行光密度分析,用GAPDH作为内参。
1.4 统计分析
EGF受体抑制剂试验采用SAS 9.2统计软件ANOVA法进行单因子方差分析,Duncan氏法进行多重比较,PKA、PKC、p38、ERK和JNK抑制剂处理试验采用SAS 9.2统计软件的t检验进行分析比较。试验数据用平均值±标准误表示,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 EGF受体酪氨酸激酶抑制剂干预后NaPi-Ⅱb表达水平
为了证实EGF受体介导了EGF对NaPi-Ⅱb表达水平的调节,我们在用100 ng/mL EGF处理IPEC-J2细胞的同时添加了不同浓度的EGF受体抑制剂(0~20 μmol/L)。用Western blot检测发现随着EGF受体抑制剂浓度不断升高,NaPi-Ⅱb表达水平也逐渐升高(图1)。相较于对照组,未添加EGF受体抑制剂的EGF处理中IPEC-J2细胞NaPi-Ⅱb表达水平显著降低(P<0.05);相较于未添加EGF受体抑制剂的EGF处理,添加5、10或20 μmol/L的EGF受体抑制剂显著提升了IPEC-J2细胞NaPi-Ⅱb表达水平(P<0.05),而添加1或2 μmol/L的EGF受体抑制剂对IPEC-J2细胞NaPi-Ⅱb表达无显著影响(P>0.05)。这表明EGF受体介导了EGF对NaPi-Ⅱb表达水平的调节。
2.2 PKA信号通路对EGF调节NaPi-Ⅱb表达的影响
为了证实信号分子PKA介导EGF对NaPi-Ⅱb表达水平的调节,我们在用100 ng/mL EGF处理IPEC-J2细胞的同时添加了PKA的特异性抑制剂。Western blot检测显示PKA的特异性抑制剂没有改变PKA催化亚基β、PKA调节亚基Ⅰβ和PKAα/β/γ的表达水平(图2),说明PKA的特异性抑制剂抑制PKA活力不是通过影响PKA的表达水平,而是通过其他方式实现的。添加PKA的特异性抑制剂,IPEC-J2细胞NaPi-Ⅱb的表达显著上升(P<0.05),这表明信号分子PKA介导了EGF对IPEC-J2细胞NaPi-Ⅱb表达水平的调节。
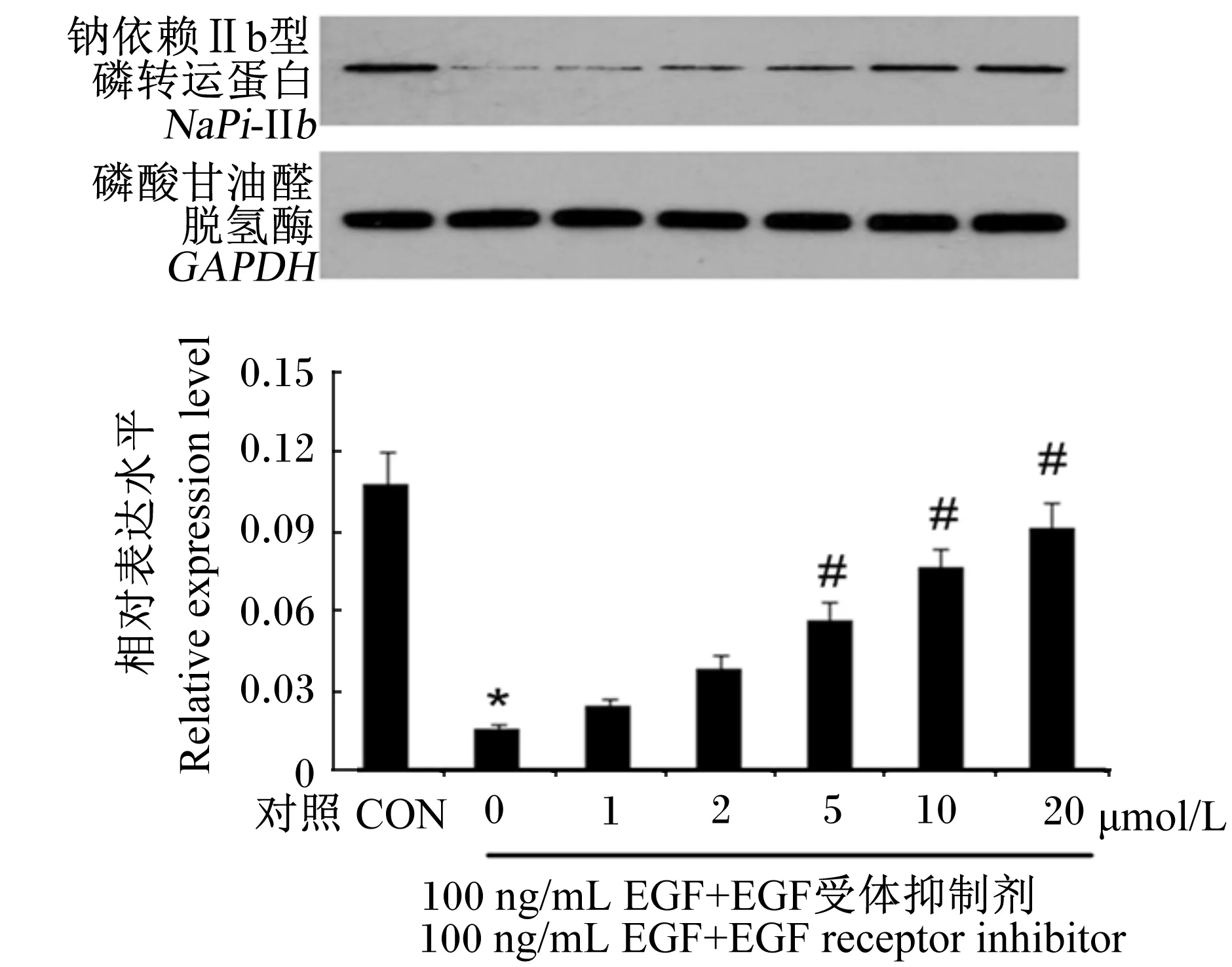
柱形图标记*表示与对照组相比差异显著(P<0.05),标记#表示与EGF处理相比差异显著(P<0.05),标记##表示与EGF处理相比差异极显著(P<0.01)。下图同。
Column diagram with * superscript mean significant different compared with control group (P<0.05), and with # superscript mean significant different compared with EGF treatment (P<0.05), while with ## superscript mean extremely significant different (P<0.01). The same as below.
图1 EGF受体酪氨酸激酶抑制剂干预后NaPi-Ⅱb表达水平
Fig.1NaPi-Ⅱbexpression level after intervention with EGF receptor tyrosine kinase inhibitor

图2 PKA信号通路对EGF调节NaPi-Ⅱb表达的影响Fig.2 Effects of PKA signal path on EGF regulatingNaPi-Ⅱb expression
2.3 PKC信号通路对EGF调节NaPi-Ⅱb表达的影响
由图3可知,PKC的特异性抑制剂并没有改变PKCα、PKCβ和PKCγ的表达水平,说明PKC的特异性抑制剂抑制PKC的活力不是通过影响PKC的表达水平,而是通过其他方式。但是,添加PKC的特异性抑制剂极显著地抑制了EGF下调NaPi-Ⅱb的表达水平(P<0.01)。这表明PKC是EGF调节NaPi-Ⅱb表达水平的关键信号分子。

图3 PKC信号通路对EGF调节NaPi-Ⅱb表达的影响Fig.3 Effects of PKC signal pathway on EGF regulating NaPi-Ⅱb expression
2.4 MAPK/p38信号通路对EGF调节NaPi-Ⅱb表达的影响
由图4可知,MAPK/p38的特异性抑制剂没有改变MAPK/p38在Tyr323和Thr180位点的磷酸化水平,这表明MAPK/p38特异性抑制剂抑制MAPK/p38的活力不是通过影响MAPK/p38的表达水平和磷酸化水平。但是,添加MAPK/p38的特异性抑制剂显著抑制了EGF下调NaPi-Ⅱb的表达水平(P<0.05)。这表明MAPK/p38信号通路参与了EGF对NaPi-Ⅱb表达水平的调节。
2.5 MAPK/ERK1/2信号通路对EGF调节NaPi-Ⅱb表达的影响
由图5可知,MAPK/ERK1/2的特异性抑制剂没有改变ERK1在Thr197和Thr202位点的磷酸化水平,但显著降低了MAPK/ERK1/2在Tyr204位点的磷酸化水平(P<0.05),这表明MAPK/ERK1/2特异性抑制剂抑制MAPK/ERK1/2的活力主要是通过降低MAPK/ERK1/2在Tyr204位点的磷酸化水平。添加MAPK/ERK1/2的特异性抑制剂显著抑制了EGF下调NaPi-Ⅱb的表达水平(P<0.05)。这表明MAPK/ERK1/2信号分子参与了EGF对NaPi-Ⅱb表达水平的调节。

图4 MAPK/p38信号通路对EGF调节NaPi-Ⅱb表达的影响Fig.4 Effects of MAPK/p38 signal pathway on EGF regulating NaPi-Ⅱb expression

图5 MAPK/ERK1/2信号通路对EGF调节NaPi-Ⅱb表达的影响Fig.5 Effects of MAPK/ERK1/2 signal pathway on EGF regulating NaPi-Ⅱb expression
2.6 MAPK/JNK信号通路对EGF调节NaPi-Ⅱb表达的影响
由图6可知,MAPK/JNK的特异性抑制剂没有改变MAPK/JNK1/2/3的表达水平,但是显著降低了MAPK/JNK1/2/3在Thr183和Tyr185位点的磷酸化水平(P<0.05),这表明MAPK/JNK1/2/3特异性抑制剂抑制MAPK/JNK1/2/3的活力主要不是通过下调MAPK/JNK1/2/3的表达水平,而是通过降低MAPK/JNK1/2/3在Thr183和Tyr185位点的磷酸化水平。添加MAPK/JNK1/2/3的特异性抑制剂显著反转了EGF下调NaPi-Ⅱb的表达水平(P< 0.05)。这表明MAPK/JNK1/2/3信号通路参与了EGF对NaPi-Ⅱb表达水平的调节。

图6 MAPK/JNK信号通路对EGF调节NaPi-Ⅱb表达的影响Fig.6 Effects of MAPK/JNK signal pathway on EGF regulating NaPi-Ⅱb expression
3 讨 论
EGF是一种分子质量为6 ku,含有53个氨基酸残基及3个二硫键的小分子肽,具有促进细胞生长、细胞迁移、细胞增殖、伤口愈合、骨骼愈合及营养物质转运等生物学功能[7-8]。大量研究表明EGF通过结合并激活细胞表面的EGF受体而实现其生物学功能[9,11]。EGF受体是一种分子质量为170 ku的跨膜糖蛋白,主要由细胞外区、跨膜区和细胞内区3部分组成[7,9]。当EGF与EGF受体结合后,EGF受体二聚化,启动自身的酪氨酸激酶活性,同时结合细胞内多种重要的信号分子,调节细胞内信号转导,这些细胞信号可以调控多种细胞核内的转录因子,诱导或抑制多种基因的转录进而发挥复杂的生理功能[12-14]。
磷作为一种非再生资源,在动物体内的生物学利用率非常低,如何充分利用磷资源、提高养殖业的经济效益、减少由于过量磷的排泄所造成的环境污染是畜牧业和饲料与动物营养科学有待解决的问题。Xu等[4-5]研究表明EGF可抑制Caco-2细胞中NaPi-Ⅱb基因表达,Xing等[6]研究也表明EGF可抑制IPEC-J2细胞NaPi-Ⅱb基因的表达。本研究结果同样表明EGF处理IPEC-J2细胞后NaPi-Ⅱb表达下降。这些结果表明EGF对肠道磷吸收具有重要的调节作用,探明EGF对猪小肠NaPi-Ⅱb调控的分子机制及其信号通路,对提高磷利用效率,减少磷排泄等具有重要意义。为此,本研究采用EGF受体酪氨酸激酶抑制剂、PKA抑制剂、PKC抑制剂、p38抑制剂、ERK抑制剂和JNK抑制剂等与EGF共同处理IPEC-J2细胞,考察NaPi-Ⅱb在蛋白水平的表达,以期明确EGF调控猪小肠上皮细胞NaPi-Ⅱb表达的确切途径。
通过使用EGF受体抑制剂处理IPEC-J2细胞,发现5、10或20 μmol/L的EGF受体抑制剂处理后IPEC-J2细胞NaPi-Ⅱb表达上升,这说明添加EGF受体抑制剂后EGF不能抑制IPEC-J2细胞NaPi-Ⅱb的表达,表明EGF抑制IPEC-J2细胞NaPi-Ⅱb表达水平的影响依赖与EGF受体的结合。
EGF与EGF受体结合后能激活细胞内多条信号通路,如磷脂酰肌醇3激酶/蛋白激酶B(PI3K/AKT)、腺苷酸活化蛋白激酶(AMPK)、MAPK、PKC和PKA[15-16]。在小鼠肝细胞中发现EGF通过直接或间接的方式激活PKA促进了EGF对ERK2的激活,PKA信号也可以反过来影响EGF/EGF受体信号[17]。EGF激活PKCα可能是通过调节磷脂酶C(PLC)γ,激活后的PKCα可磷酸化Src诱导PI3K磷酸化,随后进一步激活ERK1/2。PKC还能调节EGF前体转化生长因子(TGF)α、神经调节蛋白1β和肝素结合性EGF的剪切和细胞中的释放,此外激活PKC阻碍了EGF受体在Thr654位点的磷酸化[18-19]。这表明EGF能激活PKC,而PKC能反过来调节EGF的分泌和EGF受体的活性。EGF促进小鼠反应性星形胶质细胞中巢蛋白(Nestin)依赖Ras-Raf-ERK信号通路。在EGF受体-ERK信号中Ras是唯一膜锚定组件,它的位置决定了细胞内的下游信号[20-21]。EGF也能调节JNK和p38 MAPK的活性。Cdc42是Ras有关GTP结合蛋白,研究表明,Cdc42绑定衣被蛋白质复合体的γ亚基(γCOP)对Cdc42调节细胞性状转换起到至关重要的作用。进一步的研究发现Cdc42绑定γCOP后诱导EGF受体的累积,使得EGF激活ERK1/2、JNK和PI3K,进而促进细胞分裂[22]。
在人肠道Caco-2细胞中,EGF主要通过调节MAPK、PKC和PKA来调节NaPi-Ⅱb的表达[5]。为了证实MAPK、PKC和PKA是否介导EGF在猪小肠上皮细胞中对NaPi-Ⅱb表达的调节,我们使用了PKA抑制剂、PKC抑制剂、p38抑制剂、ERK抑制剂和JNK抑制剂。结果表明,这些抑制剂均能阻碍EGF下调NaPi-Ⅱb的表达,说明这些信号分子均介导了EGF在这方面的作用,EGF下调NaPi-Ⅱb的表达是通过多条信号通路来实现的。需要指出的是对PKC进行抑制后,NaPi-Ⅱb的表达水平极显著提高,而且提高幅度也明显高于对其他信号分子抑制产生的效果。这说明PKC介导的信号通路在EGF下调NaPi-Ⅱb的表达过程中起主要作用。
不过,虽然本试验证明MAPK(p38、ERK和JNK)、PKC和PKA介导了EGF对猪肠上皮细胞中NaPi-Ⅱb表达水平的调节,但是这3个信号分子介导的信号通路十分复杂,并且这三者之间也存在着紧密联系,它们下游的信号分子最终是如何调节NaPi-Ⅱb表达的还有待进一步研究。
4 结 论
本研究结果表明EGF调控IPEC-J2细胞中NaPi-Ⅱb的表达受EGF受体、PKA、PKC和MAPK(p38、ERK、JNK)等信号通路的调控。
[1] FANG R J,XIANG Z F,CAO M H,et al.Different phosphate transport in the duodenum and jejunum of chicken response to dietary phosphate adaptation[J].Asian-Australasian Journal of Animal Sciences,2012,25(10):1457-1465.
[2] 汤小朋,刘虎,杨淑芬,等.表皮生长因子在动物肠道无机离子及其他营养物质吸收中的作用[J].动物营养学报,2016,28(8):2317-2323.
[3] FENOLLAR-FERRER C,PATTI M,KNÖPFEL T,et al.Structural fold and binding sites of the human Na+-phosphate cotransporter NaPi-Ⅱ[J].Biophysical Journal,2014,106(6):1268-1279.
[4] XU H,COLLINS J F,BAI L Q,et al.Regulation of the human sodium-phosphate cotransporterNaPi-Ⅱbgene promoter by epidermal growth factor[J].American Journal of Physiology:Cell Physiology,2001,280(3):C628-C636.
[5] XU H,INOUYE M,HINES E R,et al.Transcriptional regulation of the human NaPi-Ⅱb cotransporter by EGF in Caco-2 cells involves c-myb[J].American Journal of Physiology:Cell Physiology,2003,284(5):C1262-C1271.
[6] XING T,TAN X,YU Q,et al.Identifying the location of epidermal growth factor-responsive element involved in the regulation of type Ⅱb sodium-phosphate cotransporter expression in porcine intestinal epithelial cells[J].Journal of Animal Physiology and Animal Nutrition,2016,doi:10.1111/jpn.12645.
[7] 汤小朋,方热军.表皮生长因子对早期断奶仔猪生长性能及肠道健康的影响[J].动物营养学报,2015,27(11):3345-3351.
[8] TANG X P,LIU H,YANG S F,et al.Epidermal growth factor and intestinal barrier function[J].Mediators of Inflammation,2016,2016:1927348.
[9] WEE P,SHI H P,JIANG J,et al.EGF stimulates the activation of EGF receptors and the selective activation of major signaling pathways during mitosis[J].Cellular Signalling,2015,27(3):638-651.
[10] XIONG X,YANG H S,TAN B,et al.Differential expression of proteins involved in energy production along the crypt-villus axis in early-weaning pig small intestine[J].American Journal of Physiology:Gastrointestinal and Liver Physiology,2015,309(4):G229-G237.
[11] SEKAR M C,SHAHIWALA K,LELOUP L,et al.Modulation of epidermal growth factor stimulated ERK phosphorylation and cell motility by inositol trisphosphate kinase[J].Journal of Pharmaceutical Sciences and Pharmacology,2014,1(2):160-164.
[12] 刘淑杰,徐子伟,齐珂珂,等.表皮生长因子对肠道功能调控的研究[J].动物营养学报,2014,26(3):565-570.
[13] BRAND T M,LIDA M,LI C R,et al.The nuclear epidermal growth factor receptor signaling network and its role in cancer[J].Discovery Medicine,2011,12(66):419-432.
[14] BEIJE N,ONSTENK W,KRAAN J,et al.Prognostic impact of HER2 and ER status of circulating tumor cells in metastatic breast cancer patients with a HER2-Negative primary tumor[J].Neoplasia,2016,18(11):647-653.
[15] MOTEKI H,KIMURA M,OGIHARA M.Activation of extracellular-signal regulated kinase by epidermal growth factor is potentiated by cAMP-elevating agents in primary cultures of adult rat hepatocytes[J].Biological and Pharmaceutical Bulletin,2011,34(10):1542-1552.
[16] IGUCHI H,MITSUI T,ISHIDA M,et al.cAMP response element-binding protein (CREB) is required for epidermal growth factor (EGF)-induced cell proliferation and serum response element activation in neural stem cells isolated from the forebrain subventricular zone of adult mice[J].Endocrine Journal,2011,58(9):747-759.
[17] BREITBART H,ETKOVITZ N.Role and regulation of EGFR in actin remodeling in sperm capacitation and the acrosome reaction[J].Asian Journal of Andrology,2011,13(1):106-110.
[18] CHEN Y J,TSAI R K,WU W C,et al.Enhanced PKCδ and ERK signaling mediate cell migration of retinal pigment epithelial cells synergistically induced by HGF and EGF[J].PLoS One,2012,7(9):e44937.
[19] DANG M,DUBBIN K,D'AIELLO A,et al.Epidermal growth factor (EGF) ligand release by substrate-specific a disintegrin and metalloproteases (ADAMs) involves different protein kinase C (PKC) isoenzymes depending on the stimulus[J].Journal of Biological Chemistry,2011,286(20):17704-17713.
[20] WANG X Y,GAN M X,LI Y,et al.Cdc42 induces EGF receptor protein accumulation and promotes EGF receptor nuclear transport and cellular transformation[J].FEBS Letters,2015,589(2):255-262.
[21] HONG Z G,CABRERA J A,MAHAPATRA S,et al.Activation of the EGFR/p38/JNK pathway by mitochondrial-derived hydrogen peroxide contributes to oxygen-induced contraction of ductus arteriosus[J].Journal of Molecular Medicine,2014,92(9):995-1007.
[22] KIMURA H,OKUBO N,CHOSA N,et al.EGF positively regulates the proliferation and migration,and negatively regulates the myofibroblast differentiation of periodontal ligament-derived endothelial progenitor cells through MEK/ERK- and JNK-dependent signals[J].Cellular Physiology and Biochemistry,2013,32(4):899-914.
*Corresponding author, professor, E-mail: fangrj63@126.com
(责任编辑 田艳明)
Identifying Cell Signaling Pathway that Mediates Epidermal Growth Factor Regulating Sodium Dependent Phosphate Cotransporters Type Ⅱb Expression in Porcine Intestinal Epithelial Cells
XING Tingjie TANG Xiaopeng CAO Manhu FANG Rejun*
(CollegeofAnimalScienceandTechnology,HunanAgriculturalUniversity,HunanCo-InnovationCenterofAnimalProductionSafety,Changsha410128,China)
The aim of this study was to elucidate the molecular mechanisms of epidermal growth factor (EGF) down-regulated sodium dependent phosphate cotransporters type Ⅱb (NaPi-Ⅱb) expression in porcine intestinal epithelial cells (IPEC-J2). EGF receptor tyrosine kinase inhibitor (tyrphostin AG 1478), protein kinase A (PKA) inhibitor (H89), protein kinase C (PKC) inhibitor (k4393), p38 inhibitor (SB 203580), extracellular signal regulated kinase (ERK) inhibitor (PD98059) and c-Jun n-terminal kinase (JNK) inhibitor (anisomycin) as well as EGF were used to treat IPEC-J2 cells, respectively, and related signal pathways protein and interest protein (NaPi-Ⅱb) expression levels were determined by Western blot. The results showed as follows, compared with control group,NaPi-Ⅱbexpression level was significantly decreased after EGF treatment (P<0.05). Compared with none inhibitor treatments, inhibitors of EGF receptor, PKA, PKC, mitogen activated protein kinase (MAPK)/p38, MAPK/ERK1/2 and MAPK/JNK significantly increasedNaPi-Ⅱbexpression (P<0.05). Especially, MAPK/ERK1/2 inhibitor significantly reduced the phosphorylation level of MAPK/ERK1/2 at Tyr204 site (P<0.05), and MAPK/JNK inhibitor significantly reduced the phosphorylation level of MAPK/JNK1/2/3 at Thr183 and Tyr185 sites (P<0.05). In summary, all EGF receptor, PKA, PKC, p38, ERK and JNK participate in the inhibitory effects of EGF onNaPi-Ⅱbexpression.[ChineseJournalofAnimalNutrition, 2017, 29(6):1988-1995]
epidermal growth factor; phosphate;NaPi-Ⅱb; signal pathway; porcine intestinal epithelial cells
10.3969/j.issn.1006-267x.2017.06.020
2016-12-20
国家自然科学基金面上项目(31572419);长沙市科技计划项目(kh1601185)
邢廷杰(1981—),男,湖北阳新人,博士研究生,从事动物营养与饲料研究。E-mail: xingtingjie@dbn.com.cn
*通信作者:方热军,教授,博士生导师,E-mail: fangrj63@126.com
S811
A
1006-267X(2017)06-1988-08

