全反式维甲酸抑制大鼠骨髓间充质干细胞成脂分化信号通路中Fosl1直接调控PPARγ2*
李 清, 邹丽影, 曾嘉颖, 陈 洁, 李廷玉, 刘友学
(重庆医科大学附属儿童医院营养研究室, 儿童发育疾病研究教育部重点实验室,儿童发育重大疾病国家国际科技合作基地, 重庆400014)
全反式维甲酸抑制大鼠骨髓间充质干细胞成脂分化信号通路中Fosl1直接调控PPARγ2*
李 清, 邹丽影, 曾嘉颖, 陈 洁, 李廷玉, 刘友学△
(重庆医科大学附属儿童医院营养研究室, 儿童发育疾病研究教育部重点实验室,儿童发育重大疾病国家国际科技合作基地, 重庆400014)
目的: 研究激活蛋白1(AP-1)在全反式维甲酸(ATRA)抑制大鼠骨髓间充质干细胞(BMSCs)成脂分化信号通路中的调控机制。方法: 采用SD大鼠原代BMSCs,体外分离、培养和成脂诱导。油红O染色鉴定细胞脂滴形成情况。应用实时荧光定量PCR(RT-qPCR)检测脂肪细胞形成相关蛋白脂肪酸结合蛋白(FABP)、脂蛋白脂肪酶(LPL)、脂肪酸转运蛋白(CD36)、脂滴包被蛋白(perilipin)、过氧化物酶体增殖物激活受体γ2(PPARγ2)以及AP-1家族各成员(Fosl1、 Fosl2、 c-Fos、 c-Jun、 JunB、 JunD和FosB)的mRNA表达水平。Western blot检测相关蛋白的表达水平。染色质免疫共沉淀(ChIP)检测相关蛋白(RARγ和Fosl1)与PPARγ2基因是否存在相互作用。结果: 油红O染色显示 ATRA处理组中细胞脂滴数量明显减少。 BMSCs成脂诱导12 d后,与对照组相比,1 μmol/L ATRA处理组FABP、LPL、CD36、perilipin和PPARγ2的mRNA表达均显著降低。RT-qPCR检测AP-1家族各转录因子表达结果显示Fosl1在ATRA处理组成脂诱导第2天、第6天和第10天表达均显著升高。Westren blot结果表明ATRA处理组Fosl1蛋白表达水平显著升高,而PPARγ2蛋白表达降低。ChIP-qPCR实验发现Fosl1蛋白可结合在PPARγ2基因启动子区域,而RARγ蛋白未直接结合在PPARγ2基因启动子区域。结论: ATRA可抑制BMSCs成脂分化及脂质代谢相关蛋白的表达,可能与其通过上调Fosl1直接结合PPARγ2基因启动子区域、下调PPARγ2表达有关。
全反式维甲酸; 骨髓间充质干细胞; 成脂分化; 激活蛋白1; 过氧化物酶体增殖物激活受体γ2
肥胖的流行趋势以惊人的速度增长,导致的一系列严重的健康问题已引起全世界的热切关注。据世界卫生组织统计,2014年已超过19亿人处于超重亚健康状态,其中600万人是肥胖患者(http://www.who.int/topics/obesity/en/)。脂肪细胞的数量增多及体积增大是肥胖最重要的病理生理机制,作为脂肪组织最重要的组成成分,不仅具有储存能量的功能,同时也是强大的内分泌器官,分泌的多种细胞因子如脂联素、瘦素、抵抗素等对组织能量代谢,胰岛素敏感性及心血管功能都有深远的影响[1]。因此,了解脂肪细胞形成的分子调控机制,对于临床预防肥胖及治疗其相关的慢性疾病具有重要的指导意义。
间充质干细胞(mesenchymal stem cells,MSCs)广泛存在于人体各组织中,具备强大的多向分化潜能,可以向脂肪细胞、神经细胞、心肌细胞、软骨细胞等分化[2-3]。大量学者研究表明间充质干细胞向脂肪细胞分化是由复杂而精细的转录因子调控。其中最关键的分子相互作用发生在CCAAT/增强子结合蛋白(CCAAT/enhancer-binding protein,C/EBP)和过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptors,PPARs)家族的成员中[4-5]。大量研究表明,视黄酸(retinoic acid,RA)对饮食导致的肥胖起保护作用。本课题组曾发现,全反式维甲酸(all-transretinoic acid,ATRA)通过介导其受体RARγ可降低PPARγ2的表达,抑制骨髓间充质干细胞成脂分化,且RARγ蛋白直接与PPARγ2蛋白相互作用[6]而影响该转录因子的功能,进而阻碍成脂信号通路的进程。
激活蛋白1(activator protein-1,AP-1)是调控细胞增殖分化的重要转录因子家族,由Fos蛋白(Fosl1、Fosl2和c-Fos)和Jun蛋白(c-Jun、JunB、JunD和FosB)组成[7]。近年来,一些学者发现AP-1在调控脂肪细胞形成和成骨细胞功能中也扮演重要的角色。Hasenfuss等[8]发现,AP-1各家族成员通过形成同源及异源二聚体而调控PPARγ2,进而影响肝细胞中脂质代谢。过表达FosB的转基因小鼠,其脂肪细胞形成和脂肪水平显着降低[9]。而Wang等[10]用染色质免疫共沉淀技术(chromatin immunoprecipitation,ChIP)发现,ATRA通过激活RARγ下调c-Fos在PPARγ2启动子区域的结合能力,从而抑制3T3-L1前脂肪细胞系的成脂分化。但目前关于AP-1在ATRA抑制原代骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)成脂分化通路中的作用,国内外尚未见相关报道。基于本课题组的前期发现,本研究将继续采用原代BMSCs,进行体外成脂定向分化,进一步研究ATRA抑制BMSCs成脂分化的分子机制,初探AP-1在ATRA抑制脂肪细胞分化信号通路中的调控机制。
材 料 和 方 法
1 动物
SD大鼠购自重庆医科大学实验动物中心[动物生产许可证号为SYXK(渝) 2012-0015],饲养于重庆医科大学附属儿童医院SPF级实验动物中心。
2 主要试剂
DMEM/F12、胎牛血清和胰酶均购自Gibco;成脂诱导液和油红O染料均购自赛业公司;ChIP级别抗Fosl1抗体和抗RARγ抗体购自Santa Cruz;总mRNA提取试剂盒、RIPA裂解液和BCA法蛋白浓度测定试剂盒购自百泰克公司;逆转录试剂盒和转录试剂盒均购自TaKaRa;全反式维甲酸购自Sigma;染色质免疫共沉淀试剂盒为Millipore产品。所有引物由中国生工生物工程有限公司合成,见表1。
3 主要方法
3.1 骨髓间充质干细胞原代培养 采用2周龄SD大鼠,超净工作台中相对无菌条件下操作,分离出股骨和胫骨,用10 mL注射器吸取培养基冲洗出骨髓,吹打均匀并接种于培养皿,培养基的组成分为基础培养基加10%胎牛血清,置于5% CO2、37 ℃的细胞孵箱培养。采用全骨髓差速贴壁法获得单细胞BMSCs,前24 h,48 h,72 h全量换液,弃去未贴壁细胞,此后每3 d全量换液1次,当细胞融合度达95%时,用胰酶消化细胞2 min, 1 000 r/min离心5 min,弃去上清,按1×104/cm2密度接种于培养皿,40 min后更换培养基,弃掉未贴壁细胞。
3.2 原代骨髓间充质干细胞成脂诱导分化 取第3代BMSCs,按1×104/cm2密度接种于6 cm直径培养皿。成脂诱导液分为诱导A液(成分包括基础培养基、10%胎牛血清、链霉素、谷氨酰胺、胰岛素、地塞米松和异丁基-甲基黄嘌呤)和维持B液(成分包括基础培养基、10%胎牛血清、链霉素、谷氨酰胺和胰岛素)。待细胞融合度达95%以上开始进行成脂诱导。实验组分成脂分化培养基(adipogenic differen-tiation medium,ADM)对照组和1 μmol/L ATRA处理成脂分化培养基组(ADM+ATRA组)。第1天将普通培养基更换为成脂诱导液A液,第4天将A液更换成B液,24 h后重新将B液更换成A液。如此A液72 h,B液24 h,循环诱导直至脂滴形成。ATRA处理组在每次更换成脂诱导时均重新添加,余处理同对照组。
F: forward; R: reverse.
3.3 油红O染色 取成脂诱导14 d细胞,PBS洗2遍,加入4%中性甲醛溶液,室温下固定细胞30 min。用蒸馏水按3∶2比例稀释油红O染料,过滤器去除杂质备用。弃去甲醛溶液后,PBS洗2遍,加入油红O工作液,室温下染色30 min。弃掉油红O,PBS洗3遍,之后于倒置显微镜下观察脂滴染色情况,并拍照。加入异丙醇500 μL溶解脂滴中染料,置于室温下5 min,吸出200 μL至96孔板,酶标仪测量油红O吸光度。
3.4 总mRNA提取和实时荧光定量PCR 采用高纯度总mRNA提取试剂盒,按说明书逐步提取总mRNA。测量mRNA浓度,采用PrimeScript Buffer逆转录试剂盒进行逆转录,获取cDNA。采用real-time PCR试剂盒进行转录,反应条件为: 95 ℃ 30 s; 95℃ 5 s, 60 ℃ 30 s,共40个循环; 65 ℃ 30 s。GAPDH为目的基因作为参考进行标准化再进行比较,循环阈值(Ct)为参数,基因改变倍数为2-ΔΔCt,其中ΔCt=CtTarget-CtGAPDH。所用引物由生工生物有限公司合成。
3.5 蛋白提取和Wersten blot实验 采用RIPA裂解液提取总蛋白。用BCA蛋白浓度测量法在酶标仪上测定蛋白浓度。10% SDS-PAGE胶电泳分离蛋白,上样量为每孔20~25 μg。选用0.45 μm PVDF膜在低温下进行转膜。含5%胎牛血清的PBST常温下封闭1 h。加入PBST稀释的目的蛋白 I 抗(Fosl1和PPARγ2),稀释比例均为1∶1 000,内参照为β-actin,I 抗稀释比例为1∶5 000,置于4 ℃冰箱摇床孵育过夜。次日,加入 II 抗(稀释比例为1∶5 000)常温下孵育1 h,放于蛋白成像系统内,将ECL发光液均匀滴加并覆盖在PVDF膜上,曝光并拍照, ImageJ软件进行灰度分析。
3.6 染色质免疫共沉淀 采用EZ-ChIP试剂盒。取成脂诱导的原代骨髓间充质干细胞,加137.5 mL 37%甲醛至含5 mL成脂诱导液的培养皿中,室温下固定10 min。收集细胞,分装成300 μL每管,超声仪中裂解DNA后行普通PCR凝胶电泳,紫外灯下显影并拍照确认DNA片段集中在200~1 000 bp范围。取10 μL DNA裂解液作为Input组,其它IP管加入目的蛋白 I 抗及蛋白G琼脂糖珠进行交联,放置4 ℃冰箱摇床孵育过夜。次日,取出Input管及IP管,置于65 ℃水浴解交联,每管中加入4 μL 0.5 mol/L EDTA、8 μL 1 mol/L Tris-HCl和1 μL的蛋白酶K,并于45 ℃孵育1~2 h。每200 μL的DNA样品管(Input管和IP管)加入1 mL的binding reagent “A”,将其中的600 μL混合液转移到带过滤管的收集管中,(10 000~15 000)×g离心30 s,弃掉滤过的液体,将剩余600 μL液体重复此步骤。加500 μL的binding reagent “B”收集管中,(10 000~15 000)×g离心30 s后弃去滤过液。加入50 μL的洗脱缓冲液“C”到白色滤膜的中心,(10 000~15 000)×g离心30 s,收集管中的洗脱液即纯化的DNA。对纯化的DNA进行扩增,采用实时荧光定量PCR,具体方法同上述。PPARγ2启动子引物:上游引物序列为5’-CACTGGGAAGTTGGAGAAGGAA-3’,下游引物序列为5’-TCTGGGGATTTGTGATGTTGAA-3’。
3.7 启动子序列查找和转录因子结合位点预测 采用NCBI网站的基因数据库,查找大鼠PPARγ2基因(Chromosome 4-NC_005103.4)原始序列。找出该基因的转录起始密码子ATG,以ATG为起点,取范围内2 000个碱基序列作为启动子区域序列。利用Jaspar软件和PROMO软件预测转录因子Fosl1及RARγ在PPARγ2基因启动子区域的结合位点。参考预测结合位点并采用Primer Premier 5.0软件设计启动子引物序列。
4 统计学处理
统计分析采用GraphPad Prism 5.0软件。图中数据以均数±标准误(mean±SEM)表示,两组间均数的比较独立样本t检验,以P<0.05为差异有统计学意义。
结 果
1 ATRA抑制BMSCs向脂肪细胞分化
BMSCs成脂诱导14 d后,通过倒置显微镜观察发现, 1 μmol/L ATRA处理组细胞中脂滴数量明显少于对照组。油红O染色对BMSCs成脂情况进行鉴定发现,未给与ATRA处理的对照组细胞形成的脂滴形态更加圆润,且数量明显增多。用异丙醇溶解脂滴中的油红染料,并在酶标仪上测定两组油红O染料的吸光度, ATRA处理组较对照组明显减低(P<0.01)。这表明ATRA能显著抑制BMSCs向脂肪细胞分化,见图1。
Figure 1.The effect of ATRA on adipogenic differentiation of primarily cultured BMSCs (oil red O staining, ×200). Mean±SEM.n=6.**P<0.01vsADM group.
图1 油红O染色鉴定ATRA对BMSCs成脂分化的影响
2 ATRA对成脂分化中脂质代谢相关基因mRNA及蛋白表达的影响
成脂诱导12 d后,收集对照组及1 μmol/L ATRA处理组细胞样本。RT-qPCR及Western blot检测BMSCs成脂分化中脂肪细胞形成及脂质代谢相关蛋白的表达。与对照组相比,核心转录因子PPARγ2的mRNA表达水平显著降低 (P<0.01),其蛋白表达水平也较对照组显著下降。ATRA处理组BMSCs成脂分化中脂质代谢相关蛋白FABP、LPL、CD36和perilipin表达均显著下调 (P<0.05)。这表明ATRA抑制关键转录因子PPARγ2的表达,同时下调了成熟脂肪细胞形成相关标志物的表达,见图2。
3 ATRA抑制BMSCs成脂分化过程中对AP-1 mRNA及蛋白水平的影响
为探讨AP-1在成脂分化中的调控机制,收集对照组及1 μmol/L ATRA处理组成脂诱导第2天、第6天和第10天的细胞样本。RT-qPCR检测AP-1家族各转录因子的mRNA水平。结果表明,与对照组相比,Fosl1的mRNA表达在成脂诱导第2天、第6天和第10天均显著升高(P<0.01)。FosB和JunB表达在第2天上升(P<0.05),其他时点无显著差异。c-Fos、c-Jun和JunD 的mRNA表达在两组间差异均无统计学显著性。结果表明,Fosl1在ATRA处理后mRNA水平显著上升。为进一步证实,用Western blot检测蛋白水平变化,采用ImageJ软件对蛋白条带进行分析,发现ATRA处理后,Fosl1蛋白表达显著升高。RT-qPCR和Western blot结果表明Fosl1在ATRA作用后表达显著上调,提示Fosl1可能是参与BMSCs成脂分化的一个重要的转录因子,见图3。
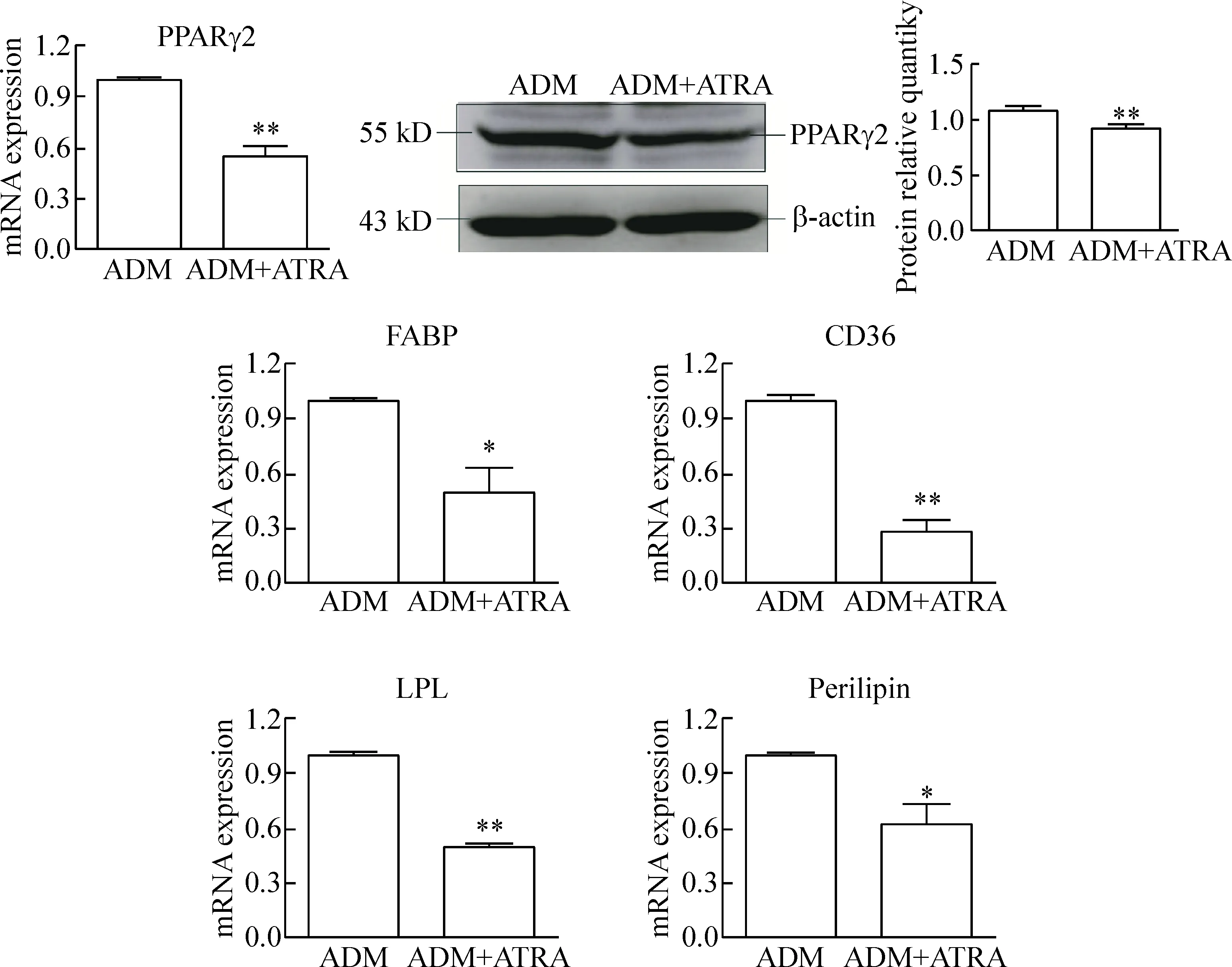
Figure 2.The effects of ATRA on the mRNA expression of adipocyte-associated proteins (FABP, LPL, CD36, perilipin and PPARγ2) and the protein expression of PPARγ2 in late stage of BMSC adipogenic differentiation. Mean±SEM.n=3.*P<0.05,**P<0.01P<0.01vsADM group.
图2 ATRA对BMSCs成脂分化晚期脂质代谢相关蛋白(FABP、LPL、CD36和perilipin)及关键转录因子PPARγ2表达的影响
4 ChIP-qPCR检测RARγ和Fosl1与PPARγ2基因是否存在相互作用
为进一步探讨ATRA介导的RARγ对PPARγ2基因表达的调控机制,我们采用ChIP-qPCR技术。该实验主要是用目的蛋白ChIP级别抗体(RARγ和Fosl1),通过蛋白G琼脂糖珠交联至目的基因(PPARγ2)染色质上,沉淀然后纯化后得到DNA。首先我们用RARγ抗体去交联PPARγ2启动子作为免疫沉淀组(IP组),Input组作为定量对照,IgG组作为阴性对照。ChIP-qPCR结果显示, IP组(ADM组和ADM+ATRA组)与阴性对照组(IgG组)无显著差异,未扩增出PPARγ2启动子区域序列,提示RARγ蛋白并未结合在PPARγ2启动子上直接调控其表达。
ATRA处理组中,Fosl1在mRNA转录水平及蛋白水平均显著上升,而AP-1作为重要的转录因子,对细胞增殖分化起关键作用,为进一步证实Fosl1对成脂分化信号通路的影响,我们采用ChIP-qPCR技术检测Fosl1是否可直接作用于PPARγ2基因并下调其表达。用Fosl1抗体去沉积PPARγ2基因序列作为免疫沉淀组(IP组),Input组作为定量对照,IgG组作为阴性对照。RT-qPCR结果显示,IP组(ADM组和ADM+ATRA组)提取纯化的DNA中扩增出PPARγ2基因启动子区域序列。且与对照组相比,ATRA处理组PPARγ2启动子序列表达增高(P<0.01),提示Fosl1转录因子能够直接结合在PPARγ2基因上调控其表达,见图4。
讨 论
维生素A是最早被发现的脂溶性维生素,其生理功能有维持人体正常视觉功能[11],促进免疫球蛋白合成[12],维护生殖系统上皮细胞稳定性[13]。近年来,维生素A及其活性代谢产物RA新的生物学功能不断被发现,包括调节能量代谢、胰岛素敏感性及脂质代谢[14-15]。流行病学调查显示,低血清视黄醇浓度是肥胖的危险因素[16]。肥胖大鼠模型实验中发现,给与维生素A补充饮食可明显降低其体重,同时校正胰岛素抵抗[17]。此外,维生素A诱导的体重减轻影响脂质代谢。长期喂养富含维生素A饲料的高胆固醇肥胖大鼠,可以纠正其血浆高密度脂蛋白水平和降低的血浆胆固醇水平[18]。ATRA作为维生素A最重要的活性代谢产物,已被证实为脂肪细胞分化的抑制剂。
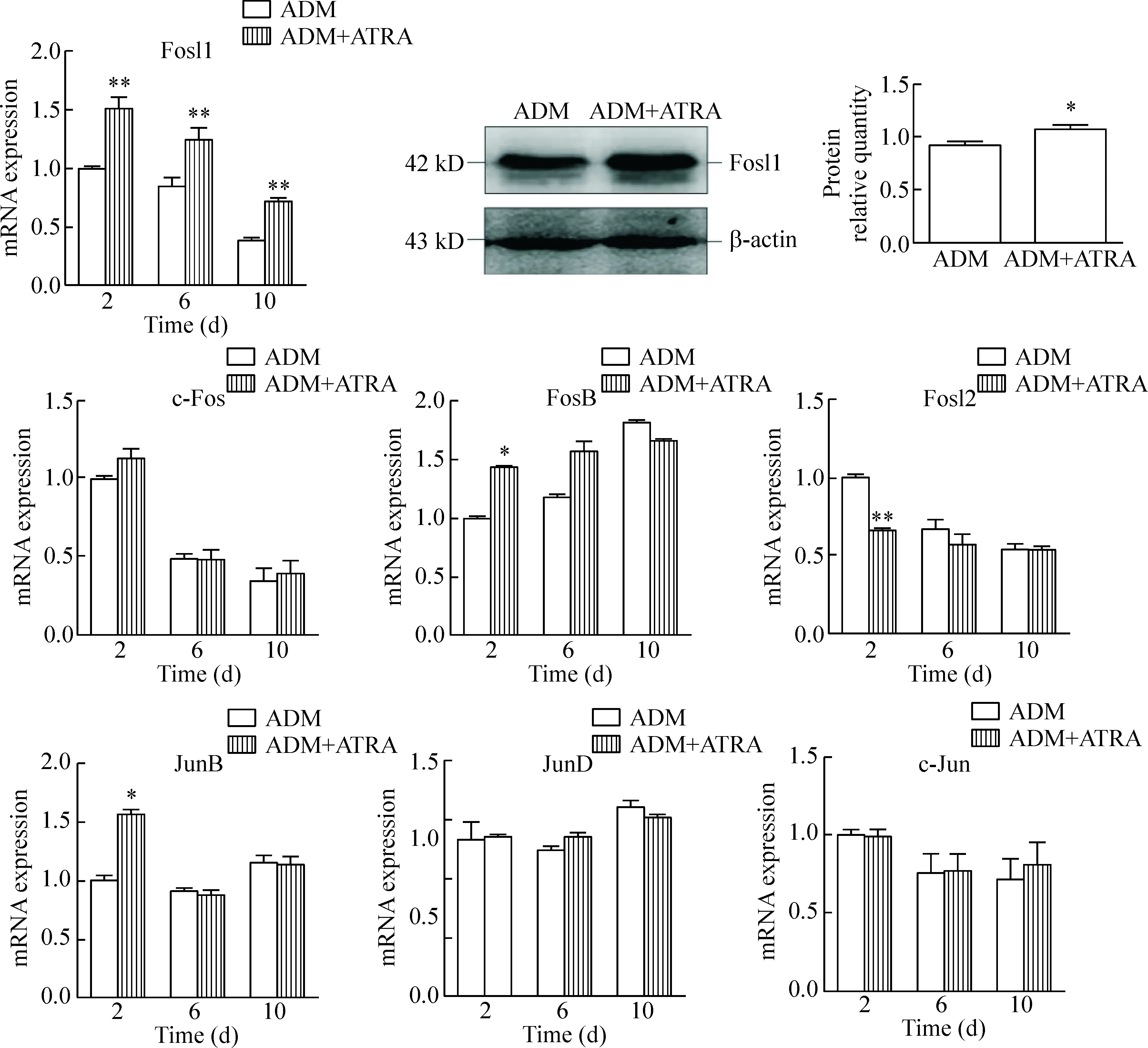
Figure 3.The effects of ATRA on the mRNA and protein expression of AP-1 family members (Fosl1, FosB, Fosl2, JunB, JunD, c-Fos and c-Jun) in BMSC adipogenic differentiation. Mean±SEM.n=3.*P<0.05,**P<0.01vsADM group.
图3 ATRA对BMSCs 成脂分化中AP-1家族成员(Fosl1、FosB、Fosl2、JunB、JunD、c-Fos和c-Jun)表达的影响
将携带绿色荧光蛋白的BMSCs注射到肥胖大鼠体内,在脂肪组织内携带荧光标记的细胞被鉴定为脂肪细胞[19]。本研究及其他研究表明BMSCs在体外诱导能成功向脂肪细胞分化。为了更好地保持BMSC成脂分化的微环境,实验中我们均采用原代BMSC。本课题组前期发现ATRA可显著抑制BMSC向脂肪细胞分化,该过程中RARγ表达上调,而PPARγ2表达下降,Co-IP实验证明RARγ蛋白与PPARγ2蛋白相互作用[5]。这只能表明在细胞生理状态下,RARγ蛋白通过与PPARγ2蛋白结合扰乱了其生物功能,导致该转录因子成脂分化后续靶基因的转录和翻译受到影响,进而阻碍了成脂分化程序的正常进行,但并不能解释PPARγ2表达下调的原因。在本实验中,我们对成脂分化关键转录因子PPARγ2下调原因进行了进一步探究。
ATRA通过其核受体RARs与RXRs通过形成异二聚体结合在靶基因的特定结合原件(RARE)上对靶基因进行调控[20]。在ChIP-qPCR实验进行前,我们通过Jaspar及PROMO软件进行了转录因子结合位点预测。为进一步证实,我们采用RARγ抗体去沉积PPARγ2基因序列,设计PPARγ2启动子区域引物未扩增出目的基因。结果提示,RARγ并没有通过结合在PPARγ2启动子上直接调控其表达。Wang等[10]在ATRA抑制3T3-L1前脂肪细胞成脂分化的研究中,也未发现RARγ受体与PPARγ2基因之间的直接相互作用。有研究表明,ATRA通过激活其核受体可以直接调控靶基因,且存在间接调控的机制,如间接通过AP-1来实现对靶基因的调控[21]。AP-1是细胞核内重要的转录因子,具有RNA聚合酶活性,

Figure 4.ChIP-qPCR for detecting the interactions between relevant proteins (RARγ and Fosl1) andPPARγ2 gene in ATRA-induced inhibition of BMSC adipogennic differentiation. Mean±SEM.n=3.*P<0.05vsIgG1 group;△△P<0.01vsIgG2 group;##P<0.01vsADM group.
图4 ATRA抑制BMSCs 成脂分化中相关蛋白(RARγ和Fosl1)与PPARγ2基因相互作用的检测
可调节下游含有AP-1 DNA 结合位点的靶基因表达,是调节细胞分化和增殖的中枢。近年来研究报道,AP-1在调控脂肪形成和成骨细胞功能中起重要作用[8,10]。有研究表明,视黄酸核受体对靶基因的作用为下调时,可通过介导AP-1来作用[22]。但AP-1在原代BMSCs成脂分化中的研究尚未见报道。本实验采用RT-qPCR检测了AP-1家族各转录因子mRNA表达的变化,结果表明ATRA处理组中Fosl1 mRNA和蛋白水平表达显著升高,提示Fosl1可能是RA抑制成脂分化信号通路中重要的转录因子。Wertern blot进一步证实ATRA处理组Fosl1蛋白水平也显著上调。国外学者Hasenfuss等[8]发现,AP-1参与脂肪性肝病中脂质代谢机制,其中转录因子Fosl1是最为关键的调节蛋白。有研究发现,过表达Fosl1基因小鼠可出现脂质代谢紊乱[23]。为探究Fosl1是否可作用于关键基因PPARγ2,并参与ATRA抑制BMSC成脂分化信号通路中,本实验采用ChIP-qPCR实验,利用Fosl1抗体沉积PPARγ2基因序列,用PPARγ2启动子引物可以扩增出目的启动子区域序列,表明Fosl1可以结合在PPARγ2基因启动子上直接调控其表达。
综上所述,本实验进一步证实在ATRA抑制原代BMSC向脂肪细胞分化中脂质代谢主要基因均显著下调。ChIP实验发现RARγ并没有直接结合在PPARγ2的启动子区域,而ATRA显著上调Fosl1/AP-1 mRNA和蛋白的表达,且Fosl1直接结合在PPARγ2的启动子区域, 提示ATRA可能通过上调Fosl1来调控成脂分化关键转录因子PPARγ2的表达,从而发挥成脂抑制作用。本研究尚存在一些不足,如过表达及沉默Fosl1验证其功能等,需要更长远和深入的研究。
[1] Ali AT, Hochfeld WE, Myburgh R, et al. Adipocyte and adipogenesis[J]. Eur J Cell Biol, 2013, 92(6-7):229-236.
[2] Barry FP, Murphy JM. Mesenchymal stem cells: clinical applications and biological characterization[J]. Int J Biochem Cell Biol, 2004, 36(4):568-584.
[3] 陈文芳, 王连唐. 骨髓基质干细胞和软骨组织工程[J]. 中国病理生理杂志, 2003, 19(2):279-283.
[4] Lane MD, Tang QQ, Jiang MS. Role of the CCAAT enhancer binding proteins (C/EBPs) in adipocyte differen-tiation[J]. Biochem Biophys Res Commun, 1999, 266(3):677-683.
[5] Lowell BB. PPARγ: an essential regulator of adipogenesis and modulator of fat cell function[J]. Cell, 1999, 99(3):239-242.
[6] 刘祖银, 李 清, 陈丽君, 等. 全反式视黄酸通过RARγ蛋白直接调控PPARγ2蛋白抑制骨髓间充质干细胞成脂分化[J]. 上海交通大学学报: 医学版, 2015, 35(5):682-687.
[7] Shaulian E, Karin M. AP-1 as a regulator of cell life and death[J]. Nat Cell Biol, 2002, 4(5):E131-E136.
[8] Hasenfuss SC, Bakiri L, Thomsen MK, et al. Regulation of steatohepatitis and PPARγ signaling by distinct AP-1 dimers[J]. Cell Metab, 2014, 19(1):84-95.
[9] Sabatakos G, Sims NA, Chen J, et al. Overexpression of ΔFosB transcription factor(s) increases bone formation and inhibits adipogenesis[J]. Nat Med, 2000, 6(9):985-990.
[10]Wang X, Yang P, Liu J, et al. RARγ-C-Fos-PPARγ2 signaling rather than ROS generation is critical for all-trans retinoic acid-inhibited adipocyte differentiation[J]. Biochimie, 2014, 106:121-130.
[11]Saari JC. Vitamin A metabolism in rod and cone visual cycles[J]. Annu Rev Nutr, 2012, 32:125-145.
[12]García OP. Effect of vitamin A deficiency on the immune response in obesity[J]. Proc Nutr Soc, 2012, 71(2):290-297.
[13]Boucheron-Houston C, Canterel-Thouennon L, Lee TL, et al. Long-term vitamin A deficiency induces alteration of adult mouse spermatogenesis and spermatogonial differen-tiation: direct effect on spermatogonial gene expression and indirect effects via somatic cells[J]. J Nutr Biochem, 2013, 24(6):1123-1135.
[14]Shabrova E, Hoyos B, Vinogradov V, et al. Retinol as a cofactor for PKCδ-mediated impairment of insulin sensitivity in a mouse model of diet-induced obesity[J]. FASEB J, 2016, 30(3):1339-1355.
[15]Kim SC, Kim CK, Axe D, et al. All-trans-retinoic acid ameliorates hepatic steatosis in mice by a novel transcriptional cascade[J]. Hepatology, 2014, 59(5):1750-1760.
[16]Aasheim ET, Hofsø D, Hjelmesaeth J, et al. Vitamin status in morbidly obese patients: a cross-sectional study[J]. Am J Clin Nutr, 2008, 87(2):362-369.
[17]Jeyakumar SM, Vajreswari A, Giridharan NV. Chronic dietary vitamin A supplementation regulates obesity in an obese mutant WNIN/Ob rat model[J]. Obesity (Silver Spring), 2006, 14(1):52-59.
[18]Prashanth A, Jeyakumar SM, Giridharan NV, et al. Vitamin A-enriched diet modulates reverse cholesterol transport in hypercholesterolemic obese rats of the WNIN/Ob strain[J]. J Atheroscler Thromb, 2014, 21(11):1197-1207.
[19]Tomiyama K, Murase N, Stolz DB, et al. Characterization of transplanted green fluorescent protein+bone marrow cells into adipose tissue[J]. Stem Cells, 2008, 26(2):330-338.
[20]Al TZ, Piskunov A, Rochette-Egly C. Vitamin A and retinoid signaling: genomic and nongenomic effects[J]. J Lipid Res, 2013, 54(7):1761-1775.
[21]Fanjul A, Dawson MI, Hobbs PD, et al. A new class of retinoids with selective inhibition of AP-1 inhibits proliferation[J]. Nature, 1994, 372(6501):107-111.
[22]Zhou XF, Shen XQ, Shemshedini L. Ligand-activated retinoic acid receptor inhibits AP-1 transactivation by disrupting c-Jun/c-Fos dimerization[J]. Mol Endocrinol, 1999, 13(2):276-285.
[23]Luther J, Driessler F, Megges M, et al. Elevated Fra-1 expression causes severe lipodystrophy[J]. J Cell Sci, 2011, 124(Pt 9):1465-1476.
(责任编辑: 陈妙玲, 罗 森)
Fosl1 regulates PPARγ2 in ATRA-induced inhibition of adipogenic differentiation of rat bone marrow mesenchymal stem cells
LI Qing, ZOU Li-ying, ZENG Jia-ying, CHEN Jie, LI Ting-yu, LIU You-xue
(Children’sNutritionResearchCenter,ChildrenHospitalofChongqingMedicalUniversity,KeyLaboratoryofChildDeve-lopmentandDisorders,MinistryofEducation,ChinaInternationalScienceandTechnologyCooperationBaseforChildDeve-lopmentandCriticalDisorders,Chongqing400014,China.E-mail:lyxliu@126.com)
AIM: To investigate the molecular mechanism of activator protein-1 (AP-1) regulating all-transretinoic acid (ATRA)-induced inhibition of adipogenic differentiation of rat primary bone marrow mesenchymal stem cells (BMSCs). METHODS: Primary cultured BMSCs were used for induction of adipogenesisinvitro. The mRNA expression of fatty acid-binding protein (FABP), lipoprotein lipase (LPL), CD36, perilipin, peroxisome proliferator-activated receptor gamma-2 (PPARγ2) and AP-1 family members (Fosl1, Fosl2, c-Fos, c-Jun, JunB, JunD and FosB) was detected by RT-qPCR. The protein expression was determined by Western blot. Chromatin immunoprecipitation (ChIP) assay was performed to detect interactions between relevant proteins (RARγ and Fosl1) andPPARγ2 gene. RESULTS: Oil red O staining showed decreases in fat droplet formation and absorbance of the dye-triglyceride complex in ATRA treatment group. After 12 d adipogenic differentiation, compared with control group, the mRNA expression of FABP, LPL, CD36, perilipin and PPARγ2 was reduced by ATRA. In ATRA treatment group, the mRNA expression of Fosl1 was significantly increased on day 2, 6 and 10. The protein expression of Fosl1 also significantly increased in ATRA treatment group. ChIP-qPCR showed that the Fosl1 protein directly bound to thePPARγ2 promoter, while RARγ did not bind to thePPARγ2 promoter. CONCLUSION: ATRA inhibits BMSC adipogenic differentiation and reduces the expression of fat cell forming-related proteins. The mechanism may be associated with up-regulation of Fosl1 which directly bind toPPARγ2 promoter.
All-transretinoic acid; Bone marrow mesenchymal stem cells; Adipogenic differentiation; Activator protein-1; Peroxisome proliferator-activated receptor γ2
1000- 4718(2017)06- 1104- 08
2017- 02- 20
2017- 05- 09
国家自然科学基金资助项目(No. 30571565)
R58; R363
A
10.3969/j.issn.1000- 4718.2017.06.024
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 023-63632994; E-mail: lyxliu@126.com

