Caveolin-1在TGF-β1诱导人支气管上皮细胞间质化中的作用*
钟长江, 李建华, 岳喜磊, 许继德△, 杨春涛, 邓莉婷
(1广州医科大学生理学教研室,广东 广州 511436; 2广州市花都区人民医院,广东 广州 510800; 3黄石市中心医院,湖北 黄石 435000)
Caveolin-1在TGF-β1诱导人支气管上皮细胞间质化中的作用*
钟长江2, 李建华1, 岳喜磊3, 许继德1△, 杨春涛1, 邓莉婷1
(1广州医科大学生理学教研室,广东 广州 511436;2广州市花都区人民医院,广东 广州 510800;3黄石市中心医院,湖北 黄石 435000)
目的: 探究小窝蛋白1(caveolin-1)在转化生长因子β1(TGF-β1)诱导的人支气管上皮细胞(16HBE细胞)上皮-间充质转化(EMT)中的作用。方法: 以16HBE细胞株为研究对象,免疫荧光、RT-qPCR和Western blot实验检测16HBE细胞EMT过程中caveolin-1的mRNA和蛋白表达;Western blot检测siRNA干扰caveolin-1对16HBE细胞EMT的影响。结果: Caveolin-1广泛存在于16HBE细胞膜上,TGF-β1刺激后,caveolin-1的mRNA和蛋白表达减少(P<0.05)。与TGF-β1组比较,caveolin-1 siRNA和TGF-β1共同作用促进了细胞形态的转化,抑制了E-钙黏蛋白的蛋白表达而促进了α-SMA的蛋白表达(P<0.05)。TGF-β1刺激16HBE细胞后,AKT和Smad3在30 min磷酸化水平最高,与0 min对照组比较显著增加(P<0.05);用siRNA干扰caveolin-1基因后再用TGF-β1刺激16HBE细胞30 min,下游信号蛋白分子AKT和Smad3的磷酸化水平增高,与TGF-β1组比较显著增加(P<0.05)。结论: TGF-β1 能下调 16HBE 细胞的caveolin-1表达水平; caveolin-1可能参与了TGF-β1诱导的16HBE 细胞EMT过程中TGF-β1/Smad通路和PI3K-AKT通路的活化。
转化生长因子β1; 人支气管上皮细胞; 上皮-间充质转化; 小窝蛋白1; 气道重塑
支气管哮喘是由包括支气管上皮细胞等细胞和细胞组份参与的呼吸系统常见慢性多发病。气道上皮细胞脱落、胞间黏附结构丧失和上皮-间充质转化(epithelial-mesenchymal transition,EMT)是哮喘气道重塑的重要特征。EMT主要表现为上皮细胞极性丧失,上皮表型标志物E-钙黏蛋白表达减少,胞间及细胞-基质间的黏附性丧失,并且获得间充质细胞的特性如细胞获得迁移能力和表型标志物α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)的表达增多等。转化生长因子β1(transforming growth factor-β1,TGF-β1)是一种调节细胞生长、存活、分化和转移的转化生长因子,参与组织的纤维化、自身免疫性疾病和肿瘤的形成。研究发现TGF-β1可诱导细胞发生EMT,如使I型肺泡上皮细胞、眼晶状体上皮细胞等多种上皮细胞向间质肌纤维母细胞转分化,促进组织纤维化的发展[1]。TGF-β1调节EMT发生的信号转导通路主要为Smad 通路、非 Smad 通路、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB,即AKT)通路等信号调节通路[2]。小窝是细胞表面大小50~100 nm的向细胞膜内凹陷的微区域,小窝上富含如小窝蛋白1(ca-veolin-1,Cav-1)、TGF-β受体、瞬时受体电位通道和丝裂原激活蛋白激酶激酶1/2(mitogen-activated protein kinase kinase 1/2,MEK1/2)等信号传导分子[3]。Cav-1是小窝的主要组成部分,参与调节许多信号传导和生化过程,并能在许多膜启动信号级联中起着负性调控作用。但在目前未见caveolin-1参与TGF-β1诱导的气道上皮细胞发生EMT过程及其信号转导的报道。本实验研究caveolin-1是否参与TGF-β1诱导的支气管上皮细胞EMT发生和有关机制,为哮喘预防和临床治疗提供新的靶点。
材 料 和 方 法
1 材料
1.1 细胞系 人支气管上皮细胞系16HBE由广州医科大学实验医学研究中心保存和复苏。
1.2 主要试剂 胎牛血清(fetal bovine serum,FBS)和RPMI-1640培养基购自Gibco;rhTGF-β1购自R&D;牛血清白蛋白(bovine serum albumin,BSA)和抗E-钙黏蛋白、p-AKT、AKT、Smad3、p-Smad3、GAPDH多克隆抗体购自CST;兔抗人caveolin-1多克隆抗体购自Bioworld;抗α-SMA多克隆抗体购自Abcam;抗β-actin抗体和ECL试剂盒购自杭州联科生物科技有限公司;PrimeScriptTMRT Master Mix Kit 和 SYBR®Premix Ex TaqTMPerfect Real Time 试剂盒购自 TaKaRa;Cav-1基因的siRNA序列由上海吉玛公司合成,正义链为5’-GCGACCCUAAACCUCAATT-3’,反义链为5’-UUGAGGUGUUUAGGGUCGCTT-3’。
2 方法
2.1 细胞培养 含10% FBS的1640培养基体外培养16HBE细胞,置于 37 ℃、5% CO2培养箱中培养。选择对数生长期细胞进行实验。
2.2 间接免疫荧光法检测caveolin-1在16HBE 细胞上的表达 将各组细胞用 含10% FBS的1640培养基培养 48 h 后,4% 多聚甲醛溶液固定,室温下 0.3% Triton X-100 通透,5% BSA 37 ℃封闭 30 min 后分别加入稀释比例为 1∶100 兔抗人caveolin-1的I 抗100 μL,以 PBS 为对照,4 ℃孵育过夜。次日,于 37 ℃复温 30 min,分别加入稀释比例为 1∶ 100 的 FITC 标记的山羊抗兔Ⅱ抗 100 μL,37 ℃避光孵育 1 h,DAPI 溶液室温孵育 5~10 min,荧光显微镜下观察并拍片。
2.3 Real-time PCR 和Western blot实验检测caveolin-1的mRNA和蛋白表达 实验分组为: FBS(1%) 对照组和10 μg/L TGF-β1组。细胞分组培养 24 h、48 h 和 72 h 后按Trizol 法提取总RNA,按照PrimeScriptTMRT Master Mix (Perfect Real Time)试剂盒说明书操作,合成cDNA。Caveolin-1的上游引物序列为5’-AACCTTGGGGGATGTGCCTAGA-3’, 下游引物序列为5’-CCGCCAAAGGTTTGTTCGC-3’。逆转录反应条件为: 37 ℃ 15 min, 85 ℃ 5 s。然后再按照SYBR® Premix Ex TaqTMⅡPerfect Real Time试剂盒说明书在ABI7500荧光定量PCR仪中进行PCR扩增反应。反应条件为: 95 ℃ 30 s; 95 ℃ 5 s, 60 ℃ 34 s,重复循环40次;熔解曲线分析95 ℃ 15 s; 60 ℃ 1 min, 95 ℃ 15 s。以18S为内参照,以2-ΔΔCt法计算各组caveolin-1的mRNA相对表达量。
相同分组细胞处理24 h、48 h 和 72 h后按细胞裂解液(RIPA) 说明书提取细胞蛋白。提取蛋白定量后加入SDS-PAGE 蛋白上样缓冲液,煮沸变性;选用5% 浓缩胶,12% 分离胶进行电泳,分别用80 V和100 V电压。然后在200 mA恒流、4 ℃条件下电转2 h;5%脱脂奶粉室温封闭1 h;TBST洗膜 10 min×3次;分别孵育1∶3 000的兔抗人caveolin-1的 I 抗及1∶2 000小鼠β-actin单克隆抗体,4 ℃孵育过夜。TBST 洗膜10 min×3次;再室温分别孵育与其Ⅰ抗相对应的HRP标记的羊抗兔IgG及HRP标记的羊抗小鼠IgG 1 h;TBST 洗膜10 min×3次;加入ECL反应,用凝胶成像系统曝光成像,并用ImageJ软件对所得到的条带进行分析。以β-actin为内参照,分析各组caveolin-1的相对含量。
2.4 倒置显微镜和 Western blot实验检测siRNA 转染对 EMT 的影响 第 3 代细胞接种于 6 孔板中,用含10% FBS 的1640培养基培养 12~18 h,细胞密度 30%~50% 时,再分为转染试剂(mock transfection)对照组、mock transfection+caveolin-1 siRNA组、 TGF-β1 (10 μg/L)组、 TGF-β1+mock transfection+caveolin-1 siRNA组、mock transfection+negative siRNA阴性对照组、TGF-β1+mock transfection + negative siRNA组和GAPDH siRNA+mock transfection 阳性对照组。按转染试剂盒说明书操作进行转染 48 h 后,提取细胞总 RNA,RT-qPCR 检测各组细胞中 mRNA 的表达情况,结果提示转染组 mRNA 抑制率达 80% 左右,合成的 siRNA 序列有效。接种第 3 代细胞,实验分为对照(control)组、siRNA-caveolin-1组、TGF-β1 (10 μg/L)组和caveolin-1 siRNA+TGF-β1 组,处理 48 h后在显微镜下观察细胞形态变化,并提取细胞蛋白,Western blot实验分析各组 E-钙黏蛋白以及 α-SMA 蛋白的相对含量。
2.5 Western blot实验检测TGF-β1刺激对16HBE细胞中磷酸化蛋白的水平 实验分组同上,取第3代细胞用TGF-β1 (10 μg/L)作用细胞0 min、15 min、30 min和60 min后立即收集细胞提取蛋白,分别检测AKT和Smad3的磷酸化水平,根据前面实验结果,以TGF-β1刺激以后信号蛋白磷酸化最高的时间点作为观察点,分别检测AKT和Smad3的磷酸化水平,各使用Ⅰ抗比例为1∶1 000孵育,以GAPDH为内参照,分析各组蛋白的相对含量。
3 统计学处理
采用 SPSS 17.0软件进行统计分析。实验均重复3次,数据以均数±标准差(mean±SD)表示,计量资料间的比较在确定方差齐性后采用单因素方差分析(one-way ANOVA),如果方差不齐则采用 Welch 法,组间多重比较采用 Dunnett’s T3 检验。以P<0.05 为差异有统计学意义。
结 果
1 Caveolin-1在16HBE细胞中的表达
免疫荧光检测结果示,caveolin-1主要存在于16HBE细胞膜上,见图1。实时荧光定量PCR检测结果示,TGF-β1 (10 μg/L) 刺激细胞24 h、48 h和72 h后,与对照组比较caveolin-1 mRNA的表达明显减少(P<0.05),且减少的程度具有时间依赖性,见图2。
2 Caveolin-1 蛋白在16HBE细胞中的表达
Western blot法检测结果示,与对照组比较,TGF-β1刺激24 h、48 h和72 h后,caveolin-1蛋白表达量明显减少(P<0.05),且减少程度具呈时间依赖性,见图3。

Figure 1.Immunofluorescence staining for Cav-1 (×200). Cav-1 expression in the 16HBE cells was positive.
图1 Caveolin-1在16HBE细胞的定位

Figure 2.The mRNA expression of Cav-1 in 16HBE cells. 16HBE cells were treated with TGF-β1 for 24 h, 48 h and 72 h. The relative mRNA expression level of Cav-1 was normalized to 18S mRNA in the same sample. Mean±SD.n=4.*P<0.05vscontrol group.
图2 16HBE细胞中caveolin-1的mRNA表达
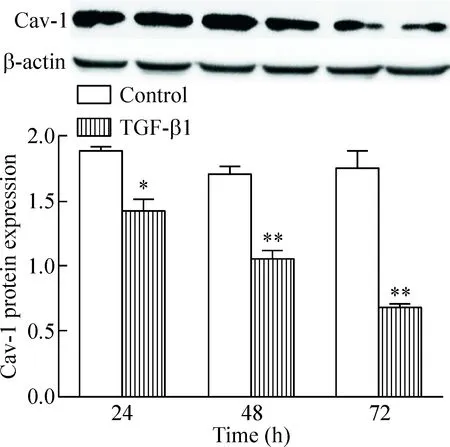
Figure 3.The protein expression of Cav-1 in the 16HBE cells. The 16HBE cells were treated with TGF-β1 for 24 h, 48 h and 72 h. The relative protein expression level of Cav-1 was normalized to β-actin protein in the same sample. Mean±SD.n=4.*P<0.05,**P<0.01vscontrol group.
图3 16HBE细胞中caveolin-1蛋白的表达
3 siRNA沉默Cav-1基因抑制TGF-β1诱导的16HBE细胞的形态改变
倒置显微镜下可见正常16HBE细胞培养48 h后呈贴壁生长,胞间连接紧密,长满后呈铺路石样分布。siRNA沉默Cav-1基因48 h后,部分细胞伸长变细,细胞胞间隙增大。TGF-β1 刺激细胞48 h 后,细胞变细伸长呈梭形,细胞间隙增大,丧失铺路石样特征。用siRNA沉默Cav-1基因24 h再加入TGF-β1刺激细胞48 h,促进了TGF-β1诱导的16HBE细胞形态改变,见图4。
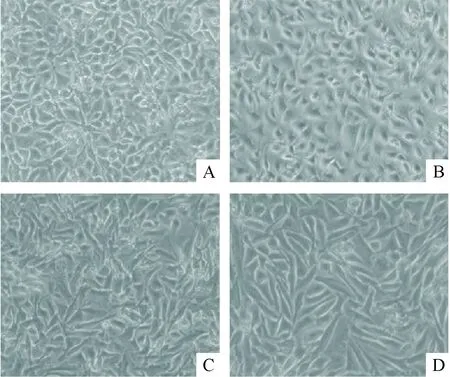
Figure 4.The effect ofCav-1 silencing on the morphologic changes of 16HBE cells induced by TGF-β1 (×100). A: the 16HBE cells cultured for 48 h showed a pebble-like shape and clear cell-cell adhesion; B: the 16HBE cells treated withCav-1 siRNA for 48 h showed a pebble-like shape and loss cell-cell adhesion; C: the 16HBE cells treated with TGF-β1 for 48 h showed a decrease in cell-cell contacts and a morphologic shape; D: the 16HBE cells treated withCav-1 siRNA for 24 h and then TGF-β1 for 48 h showed the morphologic changes of the 16HBE cells induced by TGF-β1 was promoted.
图4 siRNA沉默Cav-1基因促进TGF-β1诱导16HBE细胞的形态改变
4 siRNA沉默Cav-1基因对TGF-β1诱导16HBE细胞E-钙黏蛋白和α-SMA mRNA表达的影响
实时荧光定量PCR检测结果示,用siRNA沉默Cav-1基因24 h再用TGF-β1刺激细胞48 h,与单纯TGF-β1组比较, E-钙黏蛋白的mRNA表达量显著减少(P<0.05),但α-SMA的mRNA表达量显著增加(P< 0.05),见图5、6。
5 siRNA沉默Cav-1基因对TGF-β1诱导16HBE细胞E-钙黏蛋白和α-SMA 蛋白表达的影响
Western blot法检测结果示,与单纯TGF-β1组相比,用siRNA沉默Cav-1基因24 h再用TGF-β1刺激细胞48 h, E-钙黏蛋白表达量显著减少(P<0.05),而α-SMA蛋白的表达量则显著增加(P<0.05),见图7、8。
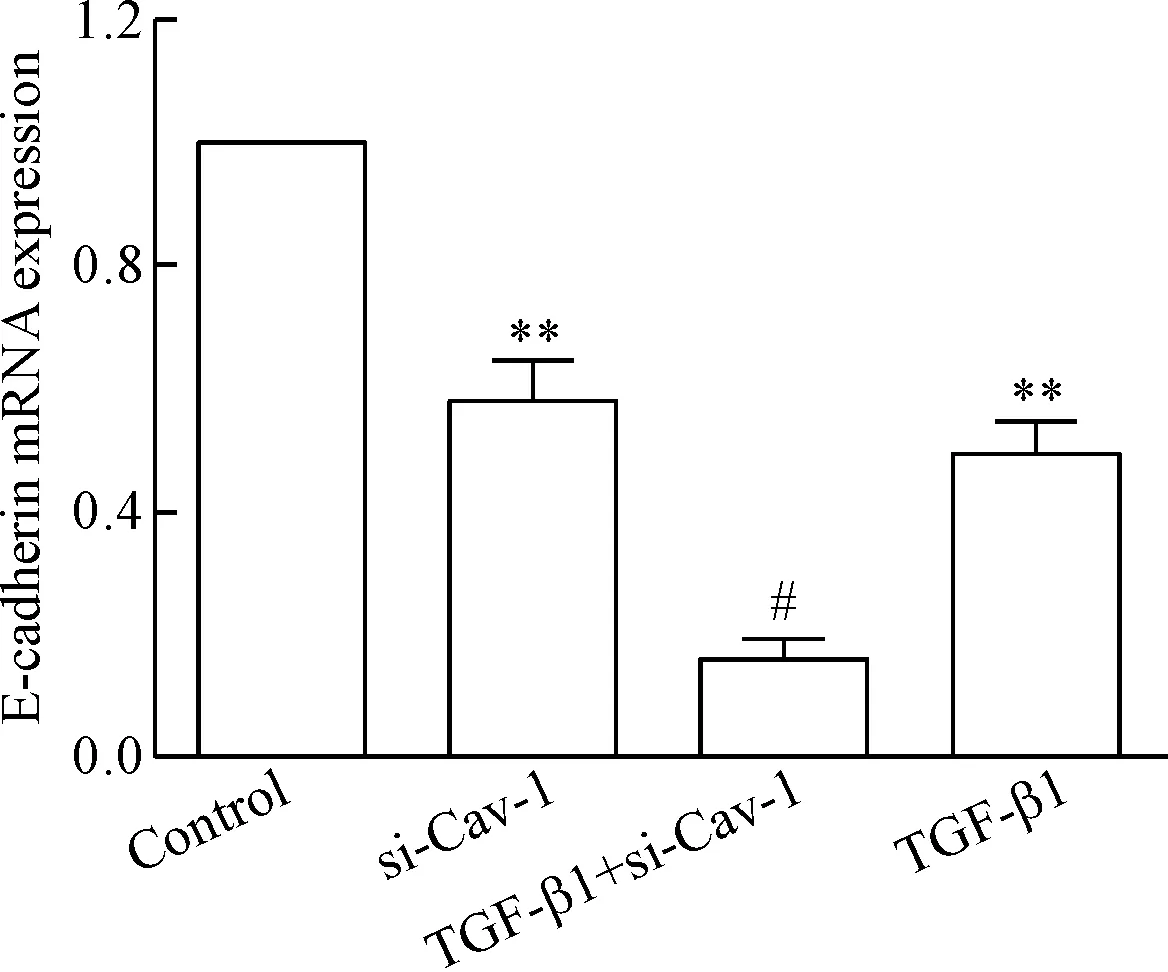
Figure 5.The effectt ofCav-1 silencing on the mRNA expression of E-cadherin induced by TGF-β1. The relative mRNA expression level of E-cadherin was normalized to 18S mRNA in the same sample. Mean±SD.n=4.**P<0.01vscontrol group;#P<0.05vsTGF-β1 group.
图5 siRNA沉默Cav-1基因促进TGF-β1诱导16HBE E-钙黏蛋白mRNA表达的减少
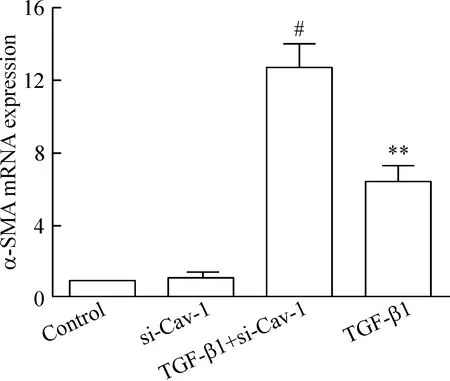
Figure 6.The effect ofCav-1 silencing on the α-SMA mRNA expression induced by TGF-β1. The relative mRNA expression level of α-SMA was normalized to 18S mRNA in the same sample. Mean±SD.n=4.**P<0.01vscontrol group;#P<0.05vsTGF-β1 group.
图6 siRNA沉默Cav-1基因促进TGF-β1诱导16HBE α-SMA mRNA表达的增加
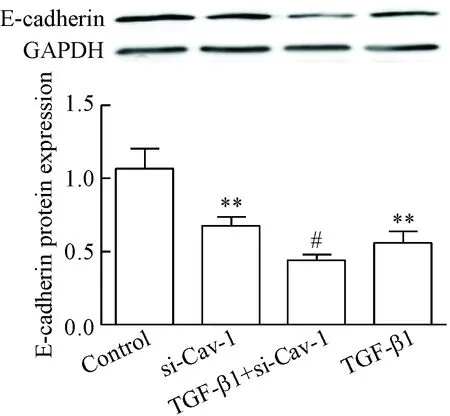
Figure 7.The effect ofCav-1 silencing on the E-cadherin protein expression induced by TGF-β1. The relative protein expression level of E-cadherin was normalized to GAPDH in the same sample. Mean±SD.n=4.**P<0.01vscontrol group;#P<0.05vsTGF-β1 group.
图7 siRNA沉默Cav-1基因促进了TGF-β1诱导16HBE细胞E-钙黏蛋白表达的减少
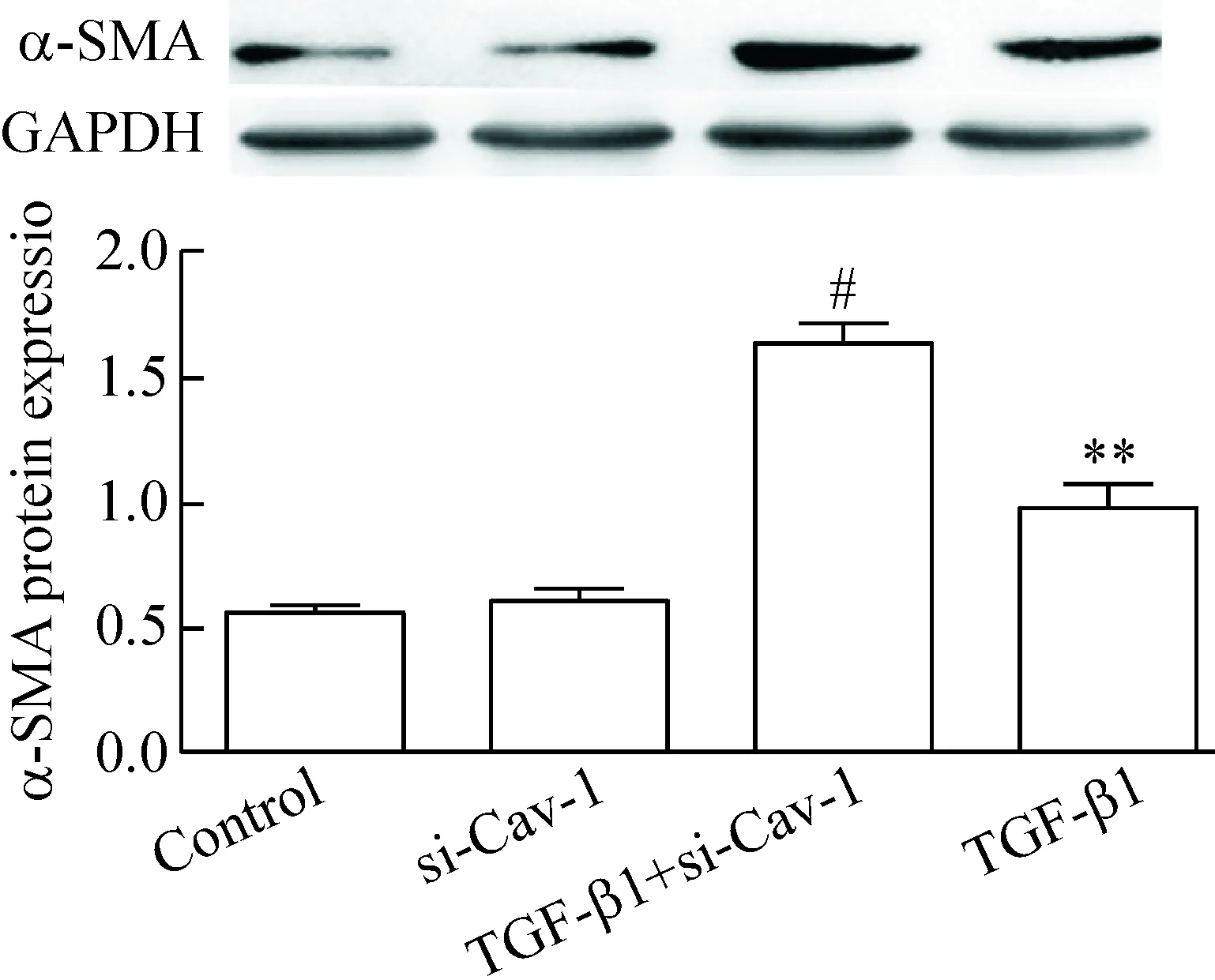
Figure 8.The effect ofCav-1 silencing on the α-SMA protein expression induced by TGF-β1. The relative protein expression level of α-SMA was normalized to GAPDH in the same sample. Mean±SD.n=4.**P<0.01vscontrol group;#P<0.05vsTGF-β1 group.
图8 siRNA沉默Cav-1基因促进TGF-β1诱导16HBE细胞α-SMA蛋白表达的增加
6 siRNA沉默Cav-1基因对TGF-β1诱导的16HBE细胞AKT和Smad3磷酸化水平的影响
Western blot法检测结果显示,在TGF-β1(10 μg/L)刺激16HBE细胞0 min、15 min、30 min和60 min后,下游信号蛋白分子AKT和Smad3在15 min、30 min和60 min均发生磷酸化,以30 min时磷酸化水平最高,与0 min对照组比较显著增加(P<0.05),见图9、10。用siRNA沉默Cav-1基因24 h再用TGF-β1刺激16HBE细胞30 min,下游信号蛋白分子AKT和Smad3的磷酸化水平与TGF-β1组比较显著增加(P<0.05),见图11、12。

Figure 9.The effect of TGF-β1 stimulation on the phosphorylation level of AKT protein in the 16HBE cells at diffe-rent time points. Mean±SD.n=4.**P<0.01vs0 min group.
图9 TGF-β1在不同时点对AKT蛋白磷酸化水平的影响
讨 论
哮喘是当今威胁人类健康与生活最主要的慢性疾病之一,预计到2025年会增至4亿,并且发病率和死亡率逐年升高,给世界各国带来了沉重的社会和经济的负担,对人类健康构成了严重挑战。
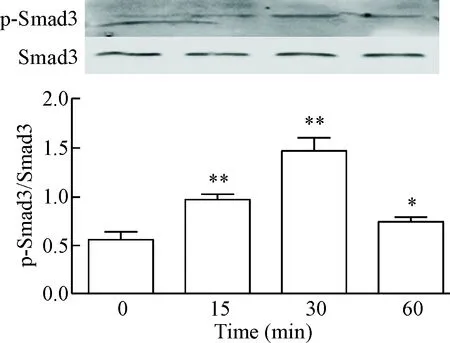
Figure 10.The effect of TGF-β1 stimulation on the phosphorylation level of Smad3 protein in the 16HBE cells at different time points. Mean±SD.n=4.*P<0.05,**P<0.01vs0 min group.
图10 TGF-β1在不同时点对Smad3蛋白磷酸化水平的影响
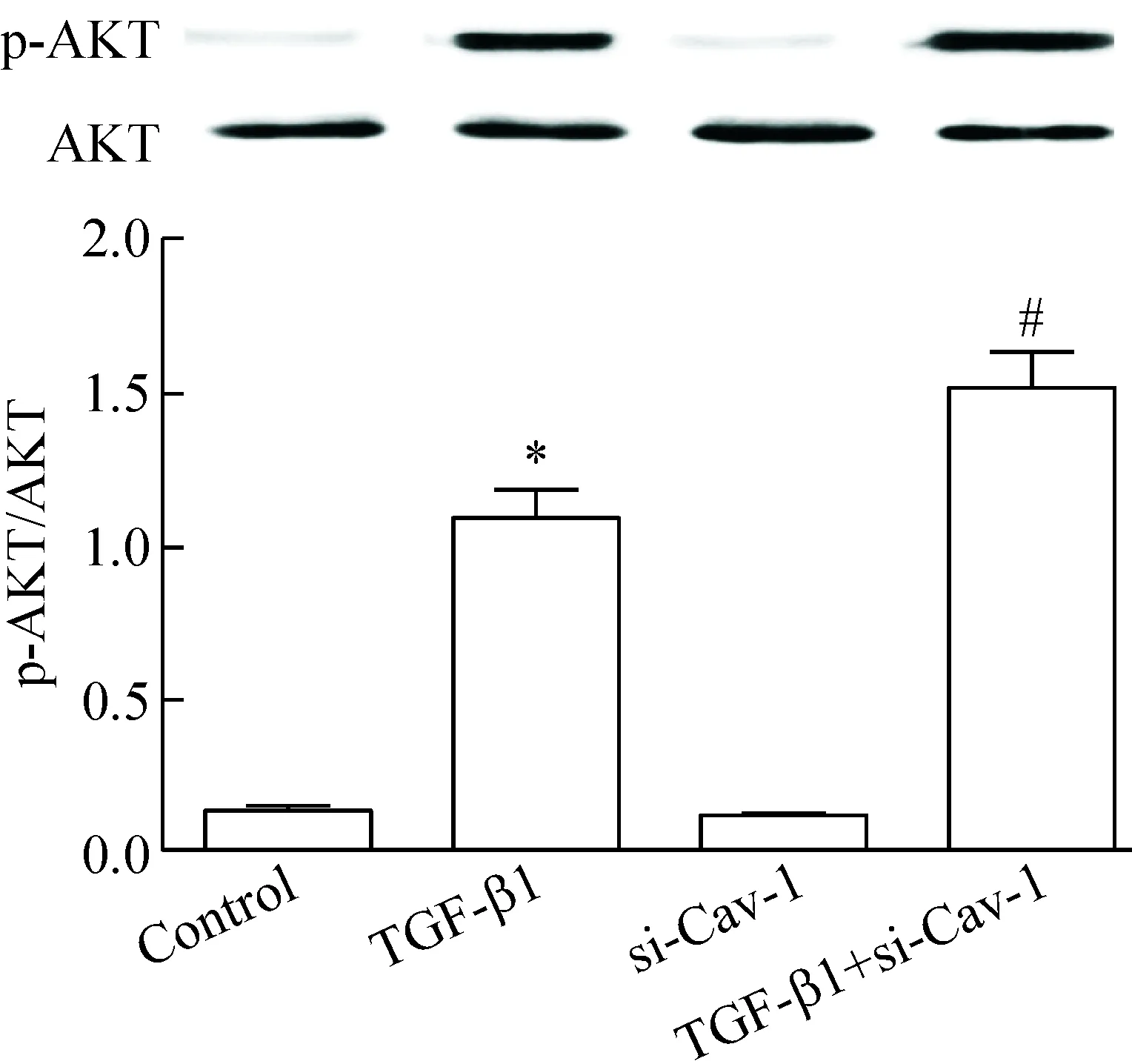
Figure 11.The effect ofCav-1 silencing on the phosphorylation level of AKT protein in the 16HBE cells stimulated with TGF-β1. Mean±SD.n=4.*P<0.05vscontrol group;#P<0.05vsTGF-β1 group.
图11 siRNA沉默Cav-1基因对TGF-β1刺激的16HBE细胞中AKT 蛋白磷酸化的影响
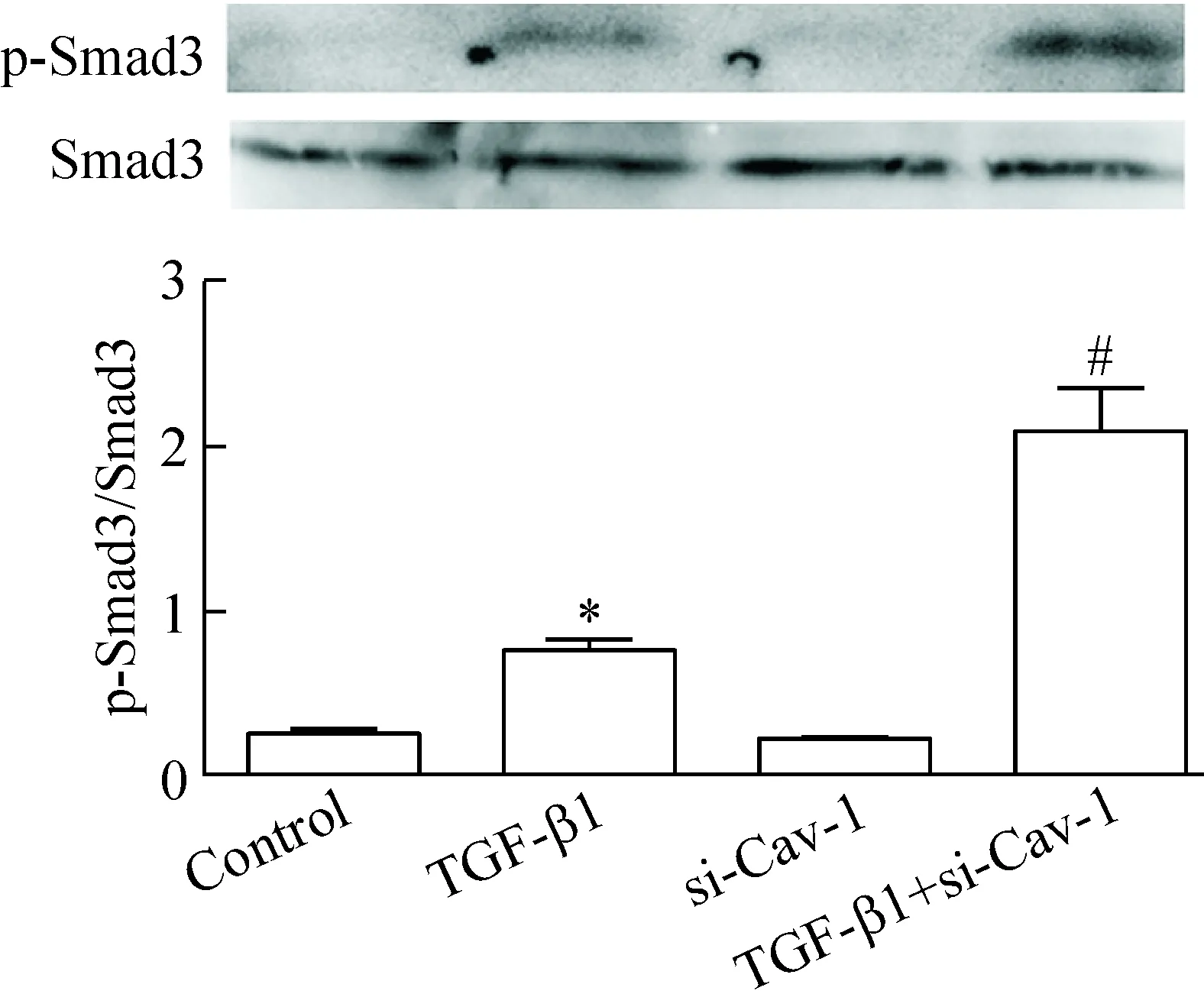
Figure 12.The effect ofCav-1 silencing on the phosphorylation level of Smad3 protein in the 16HBE cells stimulated with TGF-β1. Mean±SD.n=4.*P<0.05vscontrol group;#P<0.05vsTGF-β1 group.
图12 siRNA沉默Caveolin-1基因对TGF-β1刺激的16HBE细胞中Smad3蛋白磷酸化的影响
支气管哮喘包括气道炎症、气道高反应性和气道重构3种主要病理特征性改变。气道重构的主要变化为气道上皮损伤、脱落、上皮下纤维化和气道壁网状基底膜增厚等,从而导致气道顺应性下降和肺功能的降低。近年来,大量研究指出,哮喘患者肺功能下降与气道重塑密切相关[4]。研究表明气道上皮细胞在发生局部损伤或者缺氧或者生长因子等作用下,上皮细胞的黏附分子如E-钙黏蛋白表达减少,间质细胞特征性α-SMA表达增加,即发生了上皮细胞间质转化。EMT是气道重塑的重要特征。
气道上皮受到损伤后,受损的上皮细胞能分泌TGF-β1和EGF等细胞因子,刺激上皮修复和上皮下成纤维细胞及平滑肌细胞的增殖,后2种细胞亦分泌多种细胞因子,它们共同作用最终导致气道重构。TGF-β1是一种已知的具有多重功能的转化生长因子,在多种肿瘤细胞中可以诱导EMT的发生[5]。Ward等[6]在肺移植慢性排斥反应的闭塞性支气管炎中发现EMT发生在支气管气道上皮细胞中,认为气道损伤与气道重构相关。本实验中我们用TGF-β1作用于人支气管上皮细胞,引致16HBE细胞失去典型的上皮细胞铺路石样特征,伸长呈梭形,细胞间隙增大,胞间E-钙黏蛋白表达减少,而α-SMA蛋白表达增加[7]。
小窝是Georgre palade首次从电镜下观察内皮细胞时发现,当时称为“外胞浆囊泡”,小窝蛋白是从小窝中分离的一种分子量为21~25 kD的膜整合蛋白质。它包括3 种小窝蛋白家族成员小窝蛋白1、小窝蛋白2和小窝蛋白3。小窝蛋白1和小窝蛋白2存在哺乳动物大部分细胞中如上皮细胞和内皮细胞等。小窝蛋白2能和小窝蛋白1形成稳定的异源寡聚体复合物,并通过其相互结合,从而作为小窝蛋白1的辅助蛋白而发挥作用。小窝蛋白3特异性的表达于骨骼肌与心肌中,其表达异常可能与一些肌肉营养不良症有关。小窝蛋白1作为小窝的支架蛋白,在许多细胞内高表达,并主要位于这些细胞的胞质膜上。如在肺组织的各种细胞膜上,小窝蛋白1表达约70%[8]。本实验中我们用免疫荧光定位小窝蛋白1,发现在人支气管上皮细胞中小窝蛋白1主要定位于细胞膜上。研究报道氯化镉(CdCl2)和TGF-β1处理肺组织后,肺上皮细胞中小窝蛋白1的表达明显减少[9]。在肺纤维化的肺组织与对照组肺组织相比,发现小窝蛋白1蛋白及mRNA水平较对照组明显降低。本实验证实了TGF-β1作用于16HBE后小窝蛋白1的mRNA和蛋白表达明显减少,并且具有时间依赖性,说明TGF-β1刺激16HBE细胞后,引起了小窝蛋白1的减少。
肺泡上皮细胞和气道上皮细胞在外界刺激因子的刺激下均能发生EMT。E-钙黏蛋白是上皮表型中一种重要的标志物,主要存在于胞间黏附结构中。研究表明E-钙黏蛋白能抑制上皮细胞发生迁移和侵袭[10]。细胞发生癌变后,E-钙黏蛋白的表达明显减少,引起胞间黏附结构的丧失而发生迁移;相反,增强E-钙黏蛋白的表达却能稳定肿瘤细胞间的黏附结构从而抑制细胞的迁移和侵袭。研究显示在转基因小鼠的肿瘤模型和细胞培养模型中可通过敲除掉E-钙黏蛋白基因诱导EMT的发生[11]。可见E-钙黏蛋白表达的下调是EMT的一个重要组成部分,E-钙黏蛋白的缺失也与上皮极性与细胞黏附结构的降解密切相关。本实验中我们用TGF-β1作用于16HBE细胞后E-钙黏蛋白的mRNA和蛋白均明显下降,用siRNA干扰caveolin-1后发现,E-钙黏蛋白也出现了明显的下降;并且我们先用siRNA干扰caveolin-1后再用TGF-β1刺激16HBE细胞后发现,caveolin-1的缺失进一步促进了TGF-β1刺激后E-钙黏蛋白的表达下降,提示caveolin-1可能参与EMT中细胞膜结构稳定的维持和极性改变。
EMT的另一特征是间充质标志物如α-SMA蛋白的表达增加,而α-SMA是肌成纤维细胞的主要标记物。表达α-SMA的肌成纤维细胞是造成细胞外基质异常沉积的主要效应细胞,其合成胶原纤维的能力约是成纤维细胞的4~5倍;成纤维细胞灶越多说明纤维化越严重。本实验结果显示,TGF-β1诱导16HBE细胞后α-SMA表达明显增多,干扰caveolin-1后,TGF-β1刺激后α-SMA的表达量进一步增多,提示caveolin-1的缺失促进了EMT中肺上皮细胞向肌成纤维细胞的转化。
Caveolin-1下调与EMT的发生和发展的机制涉及多条信号转导通路,包括TGF-β1/Smad途径和非依赖Smad的途径如PI3K/AKT。研究发现caveolin-1能阻断TGF-β1/Smad信号通路[12],抑制Smad2的磷酸化,从而使得传导至核的信号减少,影响了EMT相关基因的转录和表达。而caveolin-1的这些功能主要通过其“脚手架”结构域与TGF-β1受体结合而发挥作用。本实验中当16HBE细胞用TGF-β1处理后,发现下游通路中的Smad3蛋白发生磷酸化,且在30 min达到高水平,干扰caveolin-1的表达后,发现TGF-β1处理后的Smad3蛋白磷酸化明显增强,提示caveolin-1参与了EMT信号通路中的TGF-β1-Smad途径。
在经历EMT的上皮细胞中,TGF-β1通过PI3K激活AKT,导致哺乳动物雷帕霉素靶蛋白复合体1(mammalian target of rapamycin complex 1,mTORC1)和mTORC2的活化。PI3K的抑制剂能阻止TGF-β1诱导EMT,表明了PI3K-AKT途径在这一过程中也起着重要的作用。在TGF-β诱导EMT的过程中,mTORC1有助于增加细胞体积,促进蛋白质合成及细胞迁移和侵袭;而mTORC2是上皮到间充质形态转化过渡过程所必需的。AKT的抑制能降低Snail1 的表达水平[13],减弱对E-钙黏蛋白表达的抑制和MMP9表达的激活,抑制mTORC2能阻碍侵袭和转移潜能。Zundel等[14]的研究表明caveolin-1表达下调抑制了PI3K信号,能增强了成纤维细胞抗凋亡的能力。Caveolin-1的脚手架区域能负性调控MAPK信号转导通路中的AKT信号,抑制肌腱蛋白C和胶原蛋白集聚,从而抑制纤维化;而用caveolin-1能治疗博来霉素诱导的肺纤维化反应[15]。我们推测在TGF-β1诱导16HBE细胞发生EMT的过程中亦涉及caveolin-1-PI3K/AKT 途径。本实验结果显示:当16HBE细胞用TGF-β1处理,在30 min时AKT磷酸化水平最强,干扰Cav-1基因后,TGF-β1诱导的磷酸化 AKT蛋白明显增多,说明caveolin-1的缺失促进了AKT信号分子的激活,推测caveolin-1可能对TGF-β1诱导16HBE细胞的EMT有抑制作用,其抑制作用可能涉及到PI3K/AKT信号通路。
综上所述,caveolin-1主要表达于16HBE细胞膜上,TGF-β1诱导16HBE细胞caveolin-1的表达明显降低,并具有时间依赖性;干扰caveolin-1的表达后,更进一步促进了TGF-β1诱导的16HBE细胞EMT的发展;其中caveolin-1参与TGF-β1诱导的EMT可能是通过TGF-β1受体通路中的经典TGF-β1/Smad通路和非Smad通路中PI3K/AKT通路。总之,TGF-β1诱导16HBE 中caveolin-1的表达降低可能是支气管上皮细胞发生EMT的关键环节。作为气道重构、纤维化和炎症的负性调节因子,探讨caveolin-1在EMT的表达及作用机制,对于进一步认识哮喘气道重构具有重要意义,为临床治疗哮喘提供了新的方向。
[1] Fu MM, Chin YT, Fu E, et al. Role of transforming growth factor-β1 in cyclosporine-induced epithelial-to-mesenchymal transition in gingival epithelium[J]. Am J Pathol, 2015, 86(1):1187-1192.
[2] Lamouille S, Xu J, Derynck R. Molecular mechanisms of epithelial-mesenchymal transition[J]. Nat Rev Mol Cell Biol, 2014, 15(3):178-196.
[3] Tamai O, Oka N, Kikuchi T, et al. Caveolae in mesangial cells and caveolin expression in mesangial proliferative glomerulonephritis[J]. Kidney Int, 2001, 59(2):471-480.
[4] Kristiina MM, Pelkonen AS, Makela MJ. Remodeling, inflammation and airway responsiveness in early childhood asthma[J]. Curr Opin Allergy Clin Immunol, 2013, 13(2):203-210.
[5] Laberge RM, Awad P, Campisi J, et al. Epithelial-me-senchymal transition induced by senescent fibroblasts[J]. Cancer Microenviron, 2011, 5(1):39-44.
[6] Ward C, Forrest IA, Murphy DM, et al. Phenotype of airway epithelial cells suggests epithelial to mesenchymal cell transition in clinically stable lung transplant recipients[J]. Thorax, 2005, 60(10):865-871.
[7] 岳喜磊, 成 莹, 许继德, 等. TRPC1在TGF-β1诱导支气管上皮细胞间充质转化中的作用[J]. 中国病理生理杂志, 2015, 31(3):492-498.
[8] Razani B, Woodman SE, Lisanti MP. Caveolae: from cell biology to animal physiology[J]. Pharmacol Rev, 2002, 54(3):431-467.
[9] Reese C, Dyer S, Perry B, et al. Differential regulation of cell functions by CSD peptide subdomains[J]. Respir Res, 2013, 14(1):1-18.
[10] Liang X. EMT: new signals from the invasive front[J]. Oral Oncol, 2011, 47(8):686-687.
[11]Techasen A, Loilome W, Namwat N, et al. Loss of E-cadherin promotes migration and invasion of cholangiocarcinoma cells and serves as a potential marker of metastasis[J]. Tumour Biol, 2014, 35(9):8645-8652.
[12]Lee EK, Lee YS, Han IO, et al. Expression of caveolin-1 reduces cellular responses to TGF-β1 through down-regulating the expression of TGF-β type II receptor gene in NIH3T3 fibroblast cells[J]. Biochem Biophys Res Commun, 2007, 359(2):385-390.
[13]Lamouille S, Connolly E, Smyth JW, et al. TGF-β-induced activation of mTOR complex 2 drives epithelial-mesenchymal transition and cell invasion[J]. J Cell Sci, 2012, 125(Pt 5):1259-1273.
[14]Zundel W, Swiersz LM, Giaccia A. Caveolin 1-mediated regulation of receptor tyrosine kinase-associated phosphatidylinositol 3-kinase activity by ceramide[J]. Mol Cell Biol, 2000,20(5):1507-1514.
[15]Elena T, Mathieu R, Pal GZ, et al. Antifibrotic properties of caveolin-1 scaffolding domaininvitroandinvivo[J]. Am J Physiol Lung Cell Mol Physiol, 2008, 294(5):L843-L861.
(责任编辑: 陈妙玲, 罗 森)
Effect of caveolin-1 on TGF-β1-induced epithelial-mesenchymal transition of human bronchial epithelial cells
ZHONG Chang-jiang2, LI Jian-hua1, YUE Xi-lei3, XU Ji-de1, YANG Chun-tao1, DENG Li-ting1
(1DepartmentofPhysiology,GuangzhouMedicalUniversity,Guangzhou511436,China;2HuaduDistrictPeople’sHospitalofGuangzhou,Guangzhou510800,China;3HuangshiCentralHospital,Huangshi435000,China.E-mail:xujide@163.com)
AIM: To investigate the role of caveolin-1 on epithelial-mesenchymal transition (EMT) in human bronchial epithelial (HBE) cells induced by transforming growth factor beta 1 (TGF-β1). METHODS: Immunofluorescence, real-time PCR and Western blot were applied to detect the mRNA and the protein expression of caveolin-1 in the 16HBE cells during EMT. The influence of siRNA-mediated silencing of caveolin-1 on EMT in the 16HBE cells was detected by Western blot.RESULTS: Caveolin-1 was widely present on the cell membrane of the 16HBE cells. The expression of caveolin-1 at mRNA and protein levels was significantly decreased in a time-dependent manner in the 16HBE cells compared with control group (P<0.05) after stimulation with TGF-β1. The morphologic changes of the 16HBE cells induced by TGF-β1 were promoted by caveolin-1 silencing compared with TGF-β1 group. The protein expression of E-cadherin and α-SMA induced by TGF-β1 was promoted by caveolin-1 silencing compared with TGF-β1 group (P<0.05). The phosphorylation levels of AKT and Smad3 were the highest at 30 min and increased significantly compared with control group (P<0.05) after stimulated with TGF-β1. Treatment of the 16HBE cells with TGF-β1 for 30 min after silencing caveolin-1 gene for 24 h significantly increased the phosphorylation levels of AKT and Smad3 compared with TGF-β1 group (P<0.05). CONCLUSION: TGF-β1 down-regulates the expression of caveolin-1 in the 16HBE cells. Caveolin-1 may participate in TGF-β1/Smad pathway and PI3K-AKT pathway, which are the signal transduction pathways for TGF-β1 inducing EMT.
Transforming growth factor β1; Human bronchial epithelial cells; Epithelial-mesenchymal transition; Caveolin-1; Airway remodeling
1000- 4718(2017)06- 1091- 07
2016- 09- 26
2017- 02- 15
国家自然科学基金资助项目(No. 81470205)
R332; R562.25
A
10.3969/j.issn.1000- 4718.2017.06.022
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 020-37103210; E-mail: xujide@163.com

