达沙替尼对人骨髓间充质干细胞生物学特性的影响*
王 茜, 周 兆, 张 雷, 吕林林, 段锋祺, 刘革修△
(1 广州市番禺区何贤纪念医院药剂科, 广东 广州 511400; 暨南大学 2血液研究所, 3再生医学教育部重点实验室, 4生命科学技术学院生物工程系, 广东 广州 510632; 5广州军区广州总医院血液科, 广东 广州 510010; 6南方医科大学, 广东 广州 510515)
达沙替尼对人骨髓间充质干细胞生物学特性的影响*
王 茜1, 周 兆2, 3, 张 雷2, 4, 吕林林2, 段锋祺5, 6, 刘革修2, 3△
(1广州市番禺区何贤纪念医院药剂科, 广东 广州 511400; 暨南大学2血液研究所,3再生医学教育部重点实验室,4生命科学技术学院生物工程系, 广东 广州 510632;5广州军区广州总医院血液科, 广东 广州 510010;6南方医科大学, 广东 广州 510515)
目的: 在体外探索达沙替尼对人骨髓来源间充质干细胞(hBMSCs)的活力、迁移、细胞周期和凋亡的影响以及潜在的信号通路,以评估达沙替尼在临床应用中对骨髓造血微环境的影响。方法: CCK-8法检测细胞活力;划痕实验检测细胞迁移;流式细胞术检测细胞周期和凋亡;同时采用吖啶橙/溴化乙啶法检测细胞凋亡;酶联免疫吸附实验检测细胞转化生长因子β1(TGF-β1)和肿瘤坏死因子α(TNF-α)的分泌情况;Western blot检测蛋白激酶B(Akt)蛋白的表达和磷酸化以及cleaved caspase-3的蛋白水平。结果: 与对照组相比,达沙替尼(1~10 nmol/L)抑制hBMSCs的活力和迁移;在随后的实验中使用的浓度为7 nmol/L。达沙替尼促进细胞凋亡,并使更多细胞的周期阻滞在G1期。此外,hBMSCs TGF-β1和TNF-α的分泌量显著增加。7 nmol/L达沙替尼组cleaved caspase-3的蛋白水平增加,胞内Akt的蛋白量下调且其磷酸化受到抑制。结论: 达沙替尼以浓度依赖性的方式抑制hBMSCs的活力和迁移,并促进TGF-β1和TNF-α的分泌,诱导细胞G1期阻滞和凋亡;达沙替尼可能通过影响胞内Akt蛋白的表达和磷酸化调控上述细胞学行为。
人骨髓间充质干细胞; 达沙替尼; 细胞增殖; 细胞迁移; 细胞凋亡; 细胞周期; 蛋白激酶B
人骨髓来源的间充质干细胞(human bone marrow mesenchymal stem cells,hBMSCs)是骨髓造血干细胞微环境的主要成员之一,对保持造血干细胞正常的增殖、分化、代谢和功能活动有重要作用[1]。但是目前还没有充分的研究来评价达沙替尼对正常hBMSCs的影响。因此,本文将从细胞与分子生物学水平,研究达沙替尼对正常hBMSCs的活力、迁移、转化生长因子β1(transforming growth factor-β1,TGF-β1)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)的分泌、细胞周期及凋亡的影响,并探索参与这些作用的潜在信号通路,以评估达沙替尼在临床应用时对造血微环境中hBMSCs的影响。
材 料 和 方 法
1 材料与试剂
达沙替尼(ApexBio)溶于DMSO,储存浓度为20 μmol/L;hBMSCs由广州军区陆军总医院医学实验细胞中心友情提供;吖啶橙(acridine orange,AO)和溴化乙啶(ethidium bromide,EB)购自MYM Biological Technology Limited;DMEM/F12完全培养基(HyClone);胎牛血清(Gibco);CCK-8(Dojindo);凋亡试剂盒和细胞周期试剂盒(南京凯基公司);RIPA细胞裂解液(碧云天);ECL化学发光试剂盒(Thermo);TGF-β1 ELISA试剂盒和TNF-α ELISA试剂盒(武汉华美);鼠抗人β-actin单抗(Proteintech);兔抗人Akt抗体、鼠抗人p-Akt抗体以及辣根过氧化物酶标记的羊抗鼠IgG和羊抗兔IgG (CST)。
2 主要方法
2.1 CCK-8法检测细胞活力 将第4~8代的hBMSCs接种于96孔板中(每孔1 500个),在含10%血清的DMEM/F12培养基中过夜后加入达沙替尼(最终浓度为0 nmol/L、1 nmol/L、4 nmol/L、7 nmol/L和10 nmol/L),在37 ℃、5% CO2且饱和湿度的细胞培养箱中培养24 h后,吸弃旧的培养液,每孔加入100 μL新鲜培养液和10 μL CCK-8,在37 ℃、5% CO2且饱和湿度的细胞培养箱中孵育3 h,然后在酶标仪上于452 nm波长处进行检测。
2.2 划痕法检测细胞迁移 将第4~8代的hBMSCs接种于6孔板中(每孔50 000个),待细胞在血清含量为15%的DMEM/F12培养基中贴壁并长至融合时,使用无菌的200 μL枪头在6孔板中均匀地划4条相互垂直的直线并用PBS洗去脱落的细胞,然后加入达沙替尼使其最终浓度为0 nmol/L、1 nmol/L和7 nmol/L,分别在加药后0 h、4 h、8 h和12 h时在带有拍照系统的倒置显微镜(Leica)下观察拍照,然后使用ImageJ软件分析图片,迁移细胞的多少由迁移至划痕中细胞的面积来表示。
总之,针对性护理具有科学、合理、全面性,用于CRRT患者中,能够增加满意度,降低堵管、感染、非计划性下机发生率。
2.3 流式细胞术检测细胞周期和凋亡 将第4~8代的hBMSCs接种于25T培养瓶中,在含15%血清的DMEM/F12培养基中培养,当细胞长至70%~80%融合时加入达沙替尼,终浓度为7 nmol/L,并设置溶剂对照组(0 nmol/L);在37 ℃、5% CO2且饱和湿度的细胞培养箱中培养24 h后,于带有拍照系统的倒置显微镜(Leica)下拍照观察细胞形态;然后收集所有的细胞(包括细胞培养液中的),参考试剂盒上提供的方法分别对其进行周期染色和凋亡染色(PI单染和Annexin V-FITC/PI双染),接着于流式细胞仪(ACEA)上检测分析。
2.4 AO/EB染色检测细胞凋亡 将第4~8代的hBMSCs接种于25T培养瓶中,在含15%血清的DMEM/F12培养基中培养,当细胞长至70%~80%融合时分别加入达沙替尼,终浓度分别为4 nmol/L和7 nmol/L,并设置溶剂对照组(0 nmol/L);在37 ℃、5% CO2且饱和湿度的细胞培养箱中培养24 h后,收集所有细胞(包括细胞培养液中的)进行AO/EB染色,该法由Ribble 等[2]的方法改进而来。简而言之,将收集的细胞用适量的PBS重悬混匀,并吸取50~100 μL的细胞混悬液于载玻片上进行涂片,接着滴加50 μL的AO/EB混合液(浓度均为10 mg/L)并盖上盖玻片,然后立即在正立荧光显微镜(Leica)下拍照观察。AO能透过所有的细胞膜,并将细胞核染成绿色,EB只能被细胞膜不完整的细胞吸收,将核染成红色。因此,活细胞拥有正常的绿色核;早凋的细胞核内有聚缩的染色体片段,拥有更亮的绿色的核;晚凋的细胞展现出聚缩的片段化的橙色的染色体;坏死的细胞则显示出正常的橙色的核。
2.5 酶联免疫吸附实验 将第4~8代的hBMSCs接种到25T细胞培养瓶中,在含15%血清的DMEM/F12培养基中培养,当细胞长至70%~80%融合时加入达沙替尼使其最终浓度为7 nmol/L,并设置溶剂对照组(0 nmol/L);在37 ℃、5% CO2且饱和湿度的细胞培养箱中培养12 h后取细胞培养液,1 500 r/min 离心10 min收集上清,然后根据试剂盒提供的方法检测上清内TGF-β1和TNF-α的量。
2.6 Western blot检测Akt、p-Akt和cleaved caspase-3的蛋白水平 将第4~8代的hBMSCs接种到25T细胞培养瓶中,在含15%血清的DMEM/F12培养基中培养,当细胞长至70%~80%融合时加入达沙替尼,终浓度为7 nmol/L,并设置溶剂对照组(0 nmol/L);在37 ℃、5% CO2且饱和湿度的细胞培养箱中培养12 h后收集所有的细胞(包括细胞培养液中的),RIPA裂解法提取细胞总蛋白,并使用BCA法进行蛋白定量,然后进行常规电泳、转膜、封闭、洗膜、孵 I 抗、洗膜、孵 II 抗和ECL发光,最后在全自动化学发光和荧光凝胶成像系统(Uvitec)中显影拍照观察,并用Gel-Pro Analyzer 6.0 软件对照片进行分析。
3 统计学处理
本研究的所有实验均重复3次,实验数据以均数±标准差(mean±SD)表示。此外,本研究应用SPSS 22.0进行数据的统计学分析,应用GraphPad Prism 7.00进行统计绘图;两组间的比较采用t检验;多组间的比较采用单因素方差分析,均数间的多重比较采用Bonferroni法;以P<0.05为差异有统计学意义。
结 果
1 达沙替尼抑制hBMSCs的细胞活力
从图1可知不同浓度的达沙替尼处理24 h对细胞活力的抑制程度不同。当达沙替尼的浓度为1 nmol/L时,其对hBMSCs已有明显的抑制作用(P<0.01),说明hBMSCs对达沙替尼很敏感;随着药物浓度的增大,hBMSCs的细胞活性逐渐降低;当药物浓度达7 nmol/L时,达沙替尼产生严重的抑制作用,但是此时hBMSCs的细胞活性与药物浓度为10 nmol/L时的细胞活性没有明显的差别。因此,在接下来的实验中,采用的药物浓度为7 nmol/L。
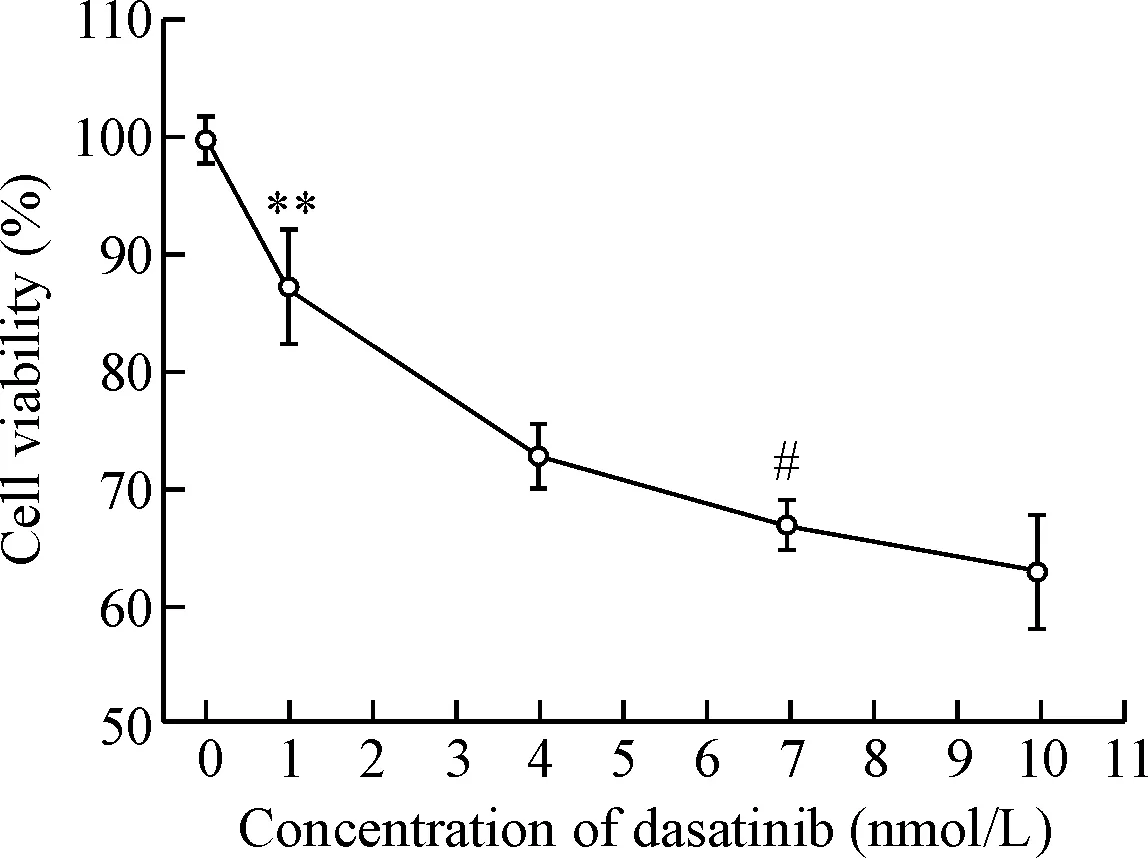
Figure 1.Dasatinib inhibited the viability of hBMSCs in a dose-dependent manner. Mean±SD.n=4.**P<0.01vs0 nmol/L;#P<0.05vs4 nmol/L.
图1 达沙替尼以浓度依赖性的方式抑制hBMSCs的活性
2 达沙替尼抑制hBMSCs迁移
hBMSCs长至融合后,进行划痕实验以检测达沙替尼对hBMSCs迁移能力的影响。从图2可以看出达沙替尼对hBMSCs的迁移有明显的抑制作用,尤其是在7 nmol/L浓度时,hBMSCs的迁移几乎被完全抑制。在观察的12 h内,溶剂对照组的hBMSCs逐渐迁移至划痕中;但是可清楚地看到,在第8~12 h时,迁移细胞的数量陡增;而1 nmol/L组的细胞在观察的时间内迁移的数量有限。在第12 h时,溶剂对照组的划痕已经愈合,但是1 nmol/L组的划痕内还有很大的空间;而7 nmol/L组各个时点细胞划痕面积基本没有变化。
3 达沙替尼阻滞hBMSCs的细胞周期
达沙替尼处理24 h后,与溶剂对照相比,7 nmol/L组有更多的细胞处于G1期,并且两者有显著的差异(P<0.01),见图3。
4 达沙替尼促进hBMSCs凋亡
达沙替尼处理24 h后,进行AO/EB染色,从图4A可以看出溶剂对照组的细胞拥有正常的圆形且绿色的细胞核,1 nmol/L组的细胞显示出许多橙色,而7 nmol/L组的细胞则展现出更多的橙色,且核内染色体发生了聚缩(在图中表现为局部的亮橙色)。进一步地,我们通过流式细胞术的精确检测发现,达沙替尼处理24 h后,hBMSCs的凋亡率明显上升(P<0.01),见图4B。此外,达沙替尼还明显地改变了hBMSCs的细胞形态:hBMSCs不再呈现出典型的长梭形,细胞回缩,细胞与细胞之间更加孤立,见图5。
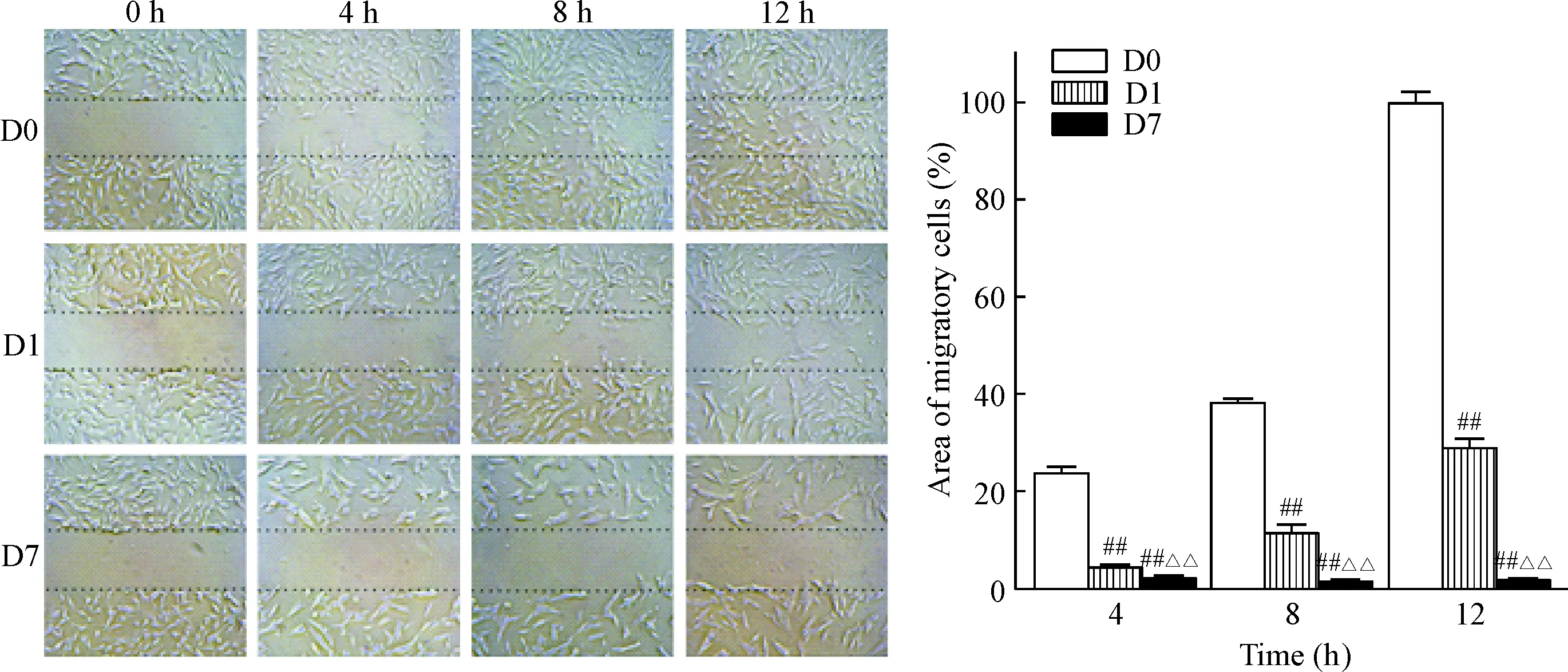
Figure 2.Dasatinib inhibited the migration ability of hBMSCs (×100). The areas of migratory cells were normalized to the value of D0 group at 12 h. D0: concentration of dasatinib was 0 nmol/L; D1: concentration of dasatinib was 1 nmol/L; D7: concentration of dasatinib was 7 nmol/L. Mean±SD.n=4.##P<0.01vsD0;△△P<0.01vsD1.
图2 达沙替尼抑制hBMSCs的迁移

Figure 3.Dasatinib induced cell cycle arrest of the hBMSCs. D0: concentration of dasatinib was 0 nmol/L; D7: concentration of dasatinib was 7 nmol/L. Mean±SD.n=3.**P<0.01vsD0.
图3 达沙替尼阻滞hBMSCs的细胞周期
5 达沙替尼促进hBMSCs炎症因子的分泌
达沙替尼处理12 h后,与溶剂对照组相比,7 nmol/L组上清液中的TGF-β1和TNF-α的量显著增加(P<0.01),见图6。
6 达沙替尼对hBMSCs内Akt总蛋白和磷酸化水平以及凋亡相关蛋白的影响
达沙替尼处理12 h后,7 nmol/L组Akt的蛋白量相对于溶剂对照组显著下降(P<0.01),同时p-Akt的蛋白量也显著下降(P<0.01);但是,cleaved caspase-3的蛋白量明显上升(P<0.01),见图7。
讨 论
在Src家族激酶中有9个成员:c-Src、Yes、Fyn、Fgr、Yrk、Lyn、Blk、Hck和Lck[3];其中Src、Fyn 和Yes广泛地表达于各种细胞中,而其它成员通常表达于造血细胞中;而且Src蛋白在细胞的生命活动中起着重要的作用[4]。达沙替尼为Src家族酪氨酸激酶抑制剂,因此其在临床应用的过程中可能会对正常的组织细胞产生不利的影响。所以,本文探索了达沙替尼对hBMSCs活力、凋亡和迁移等生物学特性及对胞内重要的信号通路——PI3K/Akt信号通路的影响,结果证明达沙替尼可能通过抑制Akt通路抑制hBMSCs的细胞活力和迁移,阻滞hBMSCs的细胞周期,促进其凋亡。hBMSCs是骨髓造血细胞微环境的重要成员,对机体的造血有重要的支持作用。因此达沙替尼的骨髓抑制作用也得到一定的解释。
有很多研究表明达沙替尼抑制肿瘤细胞的异常增殖,并且促进其凋亡[5-7]。本研究发现达沙替尼的浓度为1 nmol/L时,其对hBMSCs已有明显的抑制作用,而临床上达沙替尼的使用浓度可高达300 nmol/L[8],说明hBMSCs对达沙替尼很敏感。此外,本研究还发现处理后细胞的形态发生明显的改变,细胞固缩,细胞核内染色体聚缩,细胞凋亡率明显上升,细胞周期阻滞。这些结果证明达沙替尼在剂量比较低时以浓度依赖性的方式抑制hBMSCs的生长,破坏细胞之间的联系,使hBMSCs的细胞周期阻滞在G1期,并诱导其凋亡。

Figure 4.Dasatinib promoted the apoptosis of hBMSCs. A: AO/EB staining was used to detected apoptosis; B: the apoptosis of hBMSCs was detected by flow cytometry. D0: concentration of dasatinib was 0 nmol/L; D1: concentration of dasatinib was 1 nmol/L; D7: concentration of dasatinib was 7 nmol/L. Mean±SD.n=3.**P<0.01vsD0.
图4 达沙替尼促进hBMSCs的凋亡
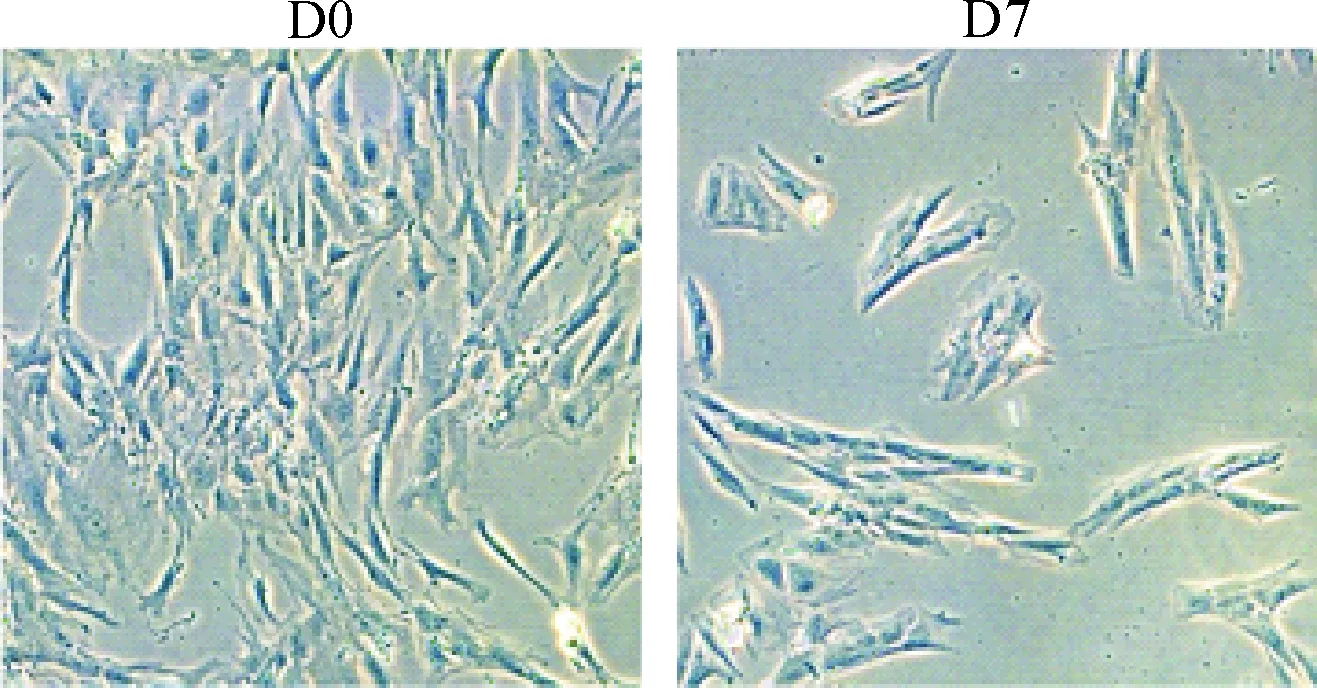
Figure 5.The effect of dasatinib on the morphological changes of hBMSCs (×100). D0: concentration of dasatinib was 0 nmol/L; D7: concentration of dasatinib was 7 nmol/L.
图5 达沙替尼对hBMSCs形态的影响
在癌细胞中,Src激酶的功能异常会促进癌细胞的浸润和扩散[9]。而达沙替尼抗癌的作用机制就包括抑制Src家族激酶以抑制癌细胞的迁移扩散。且有研究表明抑制Src可抑制正常小鼠胚胎纤维原细胞的迁移[10]。因此,达沙替尼可能会影响hBMSCs的迁移。本研究发现达沙替尼浓度为1 nmol/L时,其对hBMSCs迁移能力的抑制很强烈;在观察的第12 h,D0组的划痕已经愈合,而1 nmol/L组的细胞只有很少的一部分发生了迁移。而7 nmol/L组,hBMSCs的迁移基本上完全被抑制。所以本研究结果表明达沙替尼在剂量比较低时可强烈地抑制hBMSCs的迁移。

Figure 6.Dasatinib promoted the secretion of TGF- β1 and TNF-α. D0: concentration of dasatinib was 0 nmol/L; D7: concentration of dasatinib was 7 nmol/L. Mean±SD.n=3.**P<0.01vsD0.
图6 达沙替尼促进hBMSCs分泌更多的炎症因子TGF- β1和TNF-α
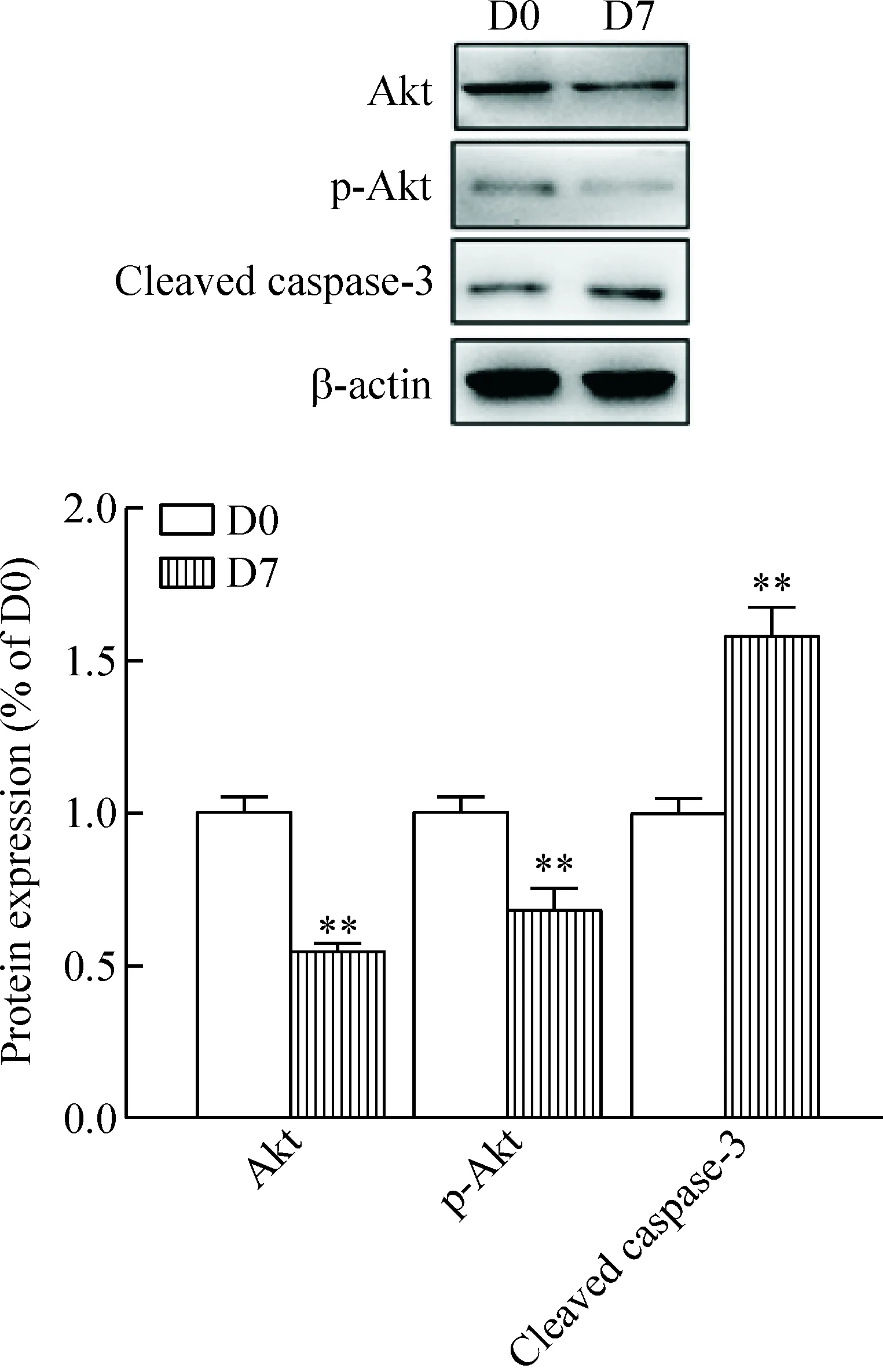
Figure 7.The effect of dasatinib on the protein levels of Akt, p-Akt and cleaved caspase-3 in the hBMSCs. D0: concentration of dasatinib was 0 nmol/L; D7: concentration of dasatinib was 7 nmol/L. Mean±SD.n=3.**P<0.01vsD0.
图7 达沙替尼对Akt、p-Akt蛋及cleaved caspase-3蛋白水平的影响
TGF-β属于一系列具有多种功能的转化生长因子超家族,在多种细胞中参与细胞的增殖、分化以及其它细胞功能的调控。同时它也是一种具有消极作用的自分泌生长因子,其异常的活化可引起细胞的凋亡,Kulkarni 等[11]的研究证实了这一点。此外,还有研究证明TGF-β在细胞周期的调控中起着重要的作用,它阻止细胞通过G1期[12]。本研究的结果显示:与1 nmol/L组相比,7 nmol/L组的细胞分泌更多的TGF-β1。这与达沙替尼处理后细胞表现出明显的凋亡和细胞周期的G1期阻滞是一致的。所以,达沙替尼促进hBMSCs分泌更多的TGF-β1,而自分泌的TGF-β1又促进了hBMSCs的凋亡和细胞周期的阻滞。
肿瘤坏死因子是一种具有多种生物学效应的细胞因子,主要由激活的单核-巨噬细胞分泌,诱导细胞凋亡和诱发炎症反应是其主要的生理效应。其属于死亡配体,通过外源性信号途径诱导细胞的凋亡,即通过caspase-8/caspase-3通路诱导细胞的凋亡。达沙替尼处理后的hBMSCs上清液中TNF-α的量剧增;这与达沙替尼处理后细胞表现出明显的凋亡和凋亡相关蛋白cleaved caspase-3的表达量增加是一致的。这些结果表明达沙替尼促使hBMSCs分泌更多的TNF-α,而TNF-α又促进了hBMSCs的凋亡。
虽然达沙替尼的抗癌作用主要体现为对Bcr-Abl酪氨酸激酶和Src家族酪氨酸激酶的抑制,但胞内的信号通路错综复杂、相互影响。已有研究表明在多种肿瘤细胞中,Akt信号通路也参与了达沙替尼对肿瘤细胞的抑制作用[13-14]。Akt蛋白是一种丝氨酸/苏氨酸蛋白激酶,参与调控细胞的许多生命活动,如细胞存活、细胞周期、细胞凋亡和细胞的代谢等。我们的结果显示达沙替尼处理后Akt蛋白的蛋白量降低,并且其磷酸化受到抑制。与此同时,细胞又表现出凋亡增加,周期阻滞,迁移受阻,增殖抑制,促凋亡细胞因子分泌量增加的现象,结合Akt蛋白在细胞生命活动中的重要作用和多重功能,我们可以得出推论:达沙替尼可能通过下调胞内Akt蛋白的表达,抑制Akt蛋白的磷酸化,激活或者抑制了胞内的一些信号通路,从而对hBMSCs的生命活动产生影响。
综上所述,本研究证明达沙替尼在剂量比较低时促进细胞因子TGF-β1和TNF-α的分泌,阻滞hBMSCs的细胞周期,抑制其生长和迁移,并且促进其凋亡,而Akt信号通路的抑制参与了这些过程的发生。达沙替尼是治疗白血病的良药,但是其治疗过程中的副作用也不能忽视。因为hBMSCs对骨髓内的造血细胞有重要的支持作用,而达沙替尼在临床应用中伴随着一定程度的骨髓抑制。结合本文的研究结果,我们可以大胆地推测,达沙替尼的骨髓抑制作用可能跟其对hBMSCs的抑制有关。所以,本研究的结果可对达沙替尼的临床应用提供支持,以采取必要的方法消除或减轻其对hBMSCs的抑制作用,从而减轻其副作用。由于本研究主要涉及的是体外实验,至于其在体内时对hBMSCs的影响还需要进一步的研究探索。
[1] Scadden DT. Nice neighborhood: emerging concepts of the stem cell niche[J]. Cell, 2014, 157(1):41-50.
[2] Ribble D, Goldstein NB, Norris DA, et al. A simple technique for quantifying apoptosis in 96-well plates[J]. BMC Biotechnol, 2005, 5:12.
[3] Thomas SM, Brugge JS. Cellular functions regulated by Src family kinases [J]. Ann Rev Cell Deve Biol, 1997, 13:513-609.
[4] 谢 捷, 龚兴国, 曾冬云. Src蛋白研究进展 [J]. 中国病理生理杂志, 2003, 19(8):1119-1124.
[5] Montero JC, Seoane S, Ocana A, et al. Inhibition of SRC family kinases and receptor tyrosine kinases by dasatinib: possible combinations in solid tumors [J]. Clin Cancer Res, 2011, 17(17):5546-5552.
[6] Shor AC, Keschman EA, Lee FY, et al. Dasatinib inhibits migration and invasion in diverse human sarcoma cell lines and induces apoptosis in bone sarcoma cells dependent on SRC kinase for survival[J]. Cancer Res, 2007, 67(6):2800-2808.
[7] Song L, Morris M, Bagui T, et al. Dasatinib (BMS-354825) selectively induces apoptosis in lung cancer cells dependent on epidermal growth factor receptor signaling for survival[J]. Cancer Res, 2006, 66(11):5542-5548.
[8] O’hare T, Walters DK, Stoffregen EP, et al. Combined Abl inhibitor therapy for minimizing drug resistance in chronic myeloid leukemia: Src/Abl inhibitors are compatible with imatinib[J]. Clin Cancer Res, 2005, 11(19): 6987-6993.
[9] Summy JM, Gallick GE. Src family kinases in tumor progression and metastasis [J]. Cancer Metastasis Rev, 2003, 22(4):337-358.
[10]何 强, 梁力建, 彭宝岗, 等. ErbB2通过FAK-Src-MAPK信号通路诱导细胞转化和移动侵袭 [J]. 中国病理生理杂志, 2008, 24(12): 2363-2365.
[11]Kulkarni AB, Huh CG, Becker D, et al. Transforming growth factor beta 1 null mutation in mice causes excessive inflammatory response and early death [J]. Proc Natl Acad Sci U S A, 1993, 90(2):770-774.
[12]Hanahan D, Weinberg RA. The hallmarks of cancer[J]. Cell, 2000, 100(1): 57-70.
[13]Chen J, Lan T, Zhang W, et al. Dasatinib enhances cisplatin sensitivity in human esophageal squamous cell carcinoma (ESCC) cells via suppression of PI3K/AKT and Stat3 pathways[J]. Arch Biochem Biophys, 2015, 575:38-45.
[14]Rice L, Lepler S, Pampo C, et al. Impact of the SRC inhibitor dasatinib on the metastatic phenotype of human prostate cancer cells[J]. Clin Exp Metastasis, 2012, 29(2):133-142.
(责任编辑: 林白霜, 罗 森)
Effect of dasatinib on biological properties of human bone marrow mesenchymal stem cells
WANG Qian1, ZHOU Zhao2, 3, ZHANG Lei2, 4, LÜ Lin-lin2, DUAN Feng-qi5, 6, LIU Ge-xiu2, 3
(1DepartmentofPharmacy,PanyuHexianMemorialHospitalofGuangzhou,Guangzhou511400,China;2InstituteofHematology,3KeyLaboratoryforRegenerativeMedicineofMinistryofEducation,4DepartmentofBioengineering,CollegeofLifeScienceandTechnology,JinanUniversity,Guangzhou510632,China;5DepartmentofHematology,GeneralHospitalofGuangzhouMilitaryCommand,Guangzhou510010,China;6SouthernMedicalUniversity,Guangzhou510515,China.E-mail:tliugx@jnu.edu.cn)
AIM: To explore the effect of dasatinib on the viability, migration, cell cycle and apoptosis of human bone marrow mesenchymal stem cells (hBMSCs), as well as the underlying signal pathway to evaluate the influence of dasatinib on hematopoietic microenvironment clinically. METHODS: The cell viability was measured by CCK-8 assay. The migration ability was detected by wound healing assay. The cell cycle and apoptosis were analyzed by flow cytometry. Acridine orange/ethidium bromide staining was also used to detected apoptosis. The secretion of transforming growth factor-β1 (TGF-β1) and tumor necrosis factor-α (TNF-α) were measured by ELISA. The protein levels of cleaved caspase-3, protein kinase B (Akt) and phosphorylated Akt were determined by Western blot. RESULTS: Compared with control group, dasatinib at 1~10 nmol/L suppressed the viability and migration ability of hBMSCs, and dasatinib at concentration of 7 nmol/L was adopted in the following assays. Dasatinib promoted apoptosis, and blocked the cell cycle in G1phase. In addition, the secretion of TGF-β1 and TNF-α was increased markedly. The protein levels of cleaved caspase-3 was increased, but the protein levels of Akt and phosphorylated Akt were decreased. CONCLUSION: Dasatinib inhibits the viability and migration ability of hBMSCs in a dose-dependent manner, promotes the secretion TGF-β1 and TNF-α, and induces cell cycle arrest and apoptosis. Dasatinib might regulate the biological behaviors of hBMSCs observed above by modulating the expression and phosphorylation of Akt.
Human bone marrow mesenchymal stem cells; Dasatinib; Cell proliferation; Cell migration; Apoptosis; Cell cycle; Protein kinase B
1000- 4718(2017)06- 0993- 07
2017- 04- 11
2017- 05- 03
国家自然科学基金资助项目(No. 81270568)
R363.2; R965
A
10.3969/j.issn.1000- 4718.2017.06.006
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 020-85220262; E-mail: tliugx@jnu.edu.cn

