界面扩张流变学性质在食品组分相互作用中的研究进展
朱力杰,张馨心,刘秀英,王 勃,杨立娜,刘 贺,何余堂,马 涛
(渤海大学食品科学与工程学院,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州 121013)
界面扩张流变学性质在食品组分相互作用中的研究进展
朱力杰,张馨心,刘秀英,王 勃,杨立娜,刘 贺,何余堂,马 涛*
(渤海大学食品科学与工程学院,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州 121013)
作为流变学研究中的一个分支,界面扩张流变学性质能够反映不同分子在界面层上的吸附和分散行为,对于研究复合体系中各组分间的相互作用具有重要意义。通过比较界面粘弹特性、弛豫过程、界面张力等特征参数,建立适合于分析不同类型组分的理论模型,界面扩张流变学方法已经成为研究食品组分相互作用机制的有效途径,具有灵敏度高、操作简便、稳定性良好等特点,能够直观地反映出相互作用对加工性能的影响。本文概述了界面扩张流变学性质的理论基础和测量方法,重点介绍了近年来该技术在食品组分相互作用中的研究进展,并就存在的问题及今后的发展方向进行了分析。
界面扩张流变学,食品组分相互作用,悬滴法,Langmuir槽法
界面性质常常会对食品的加工过程产生影响,尤其是在饮料、凝乳等存在气-水或油-水界面的食品当中,往往伴随着碳水化合物、蛋白质、表面活性剂、乳化剂等多种组分间的相互作用,粘度、界面吸附性能均不同于仅存在单一组分时的情况,还会发生正负离子混合后的协同吸附行为,给起泡性和乳化性的研究带来困难,影响稳定胶体体系的建立,因此一直以来都是食品科研工作者重点研究的对象[1-4]。近年来随着界面粘弹测量仪、视频光学接触角测量仪等多种物理化学、石油化工领域检测界面性质的设备逐渐应用于食品分析中,界面流变学性质已经成为阐明食品组分相互作用的一种重要途径,其中以界面扩张流变学性质的研究最受瞩目[5-8]。
界面扩张流变学技术可以在液态食品基质的界面上提供可溶性吸附膜及不溶性膜的粘弹性质信息,弥补传统界面张力研究不能动态表征界面的形成及破坏过程的缺陷,通过考察应力、形变和形变速率的关系,进一步分析溶液中各食品组分间的相互作用[9-10]。与同属界面流变学性质的剪切流变相区别,界面扩张流变主要研究界面张力与界面面积之间的相对变化,对表面活性物质的吸附和脱附动力学更为敏感[11];而剪切流变多采用动态剪切流变仪进行测定,结果主要反映的是界面应力与界面形状之间的相对变化。传统上由于理论模型和实验数据的欠缺,多采用界面剪切流变学性质对起泡性和乳化性开展研究。随着实验设备的普及和相关科研工作的进一步开展,研究人员发现界面扩张流变更适合对复杂体系下的界面行为进行分析,这对于存在于吸附层和分散介质中的食品各组分相互作用研究具有重要意义[12]。
1 界面扩张流变学方法的理论基础
在传统吸附模型的基础上,Ravera等从界面膜上吸附分子的重新分布可能会影响界面动态性质的角度出发,推导出了界面扩张流变参数对频率的依赖方程[13]。通常认为可以采用界面形变大小、速率与张力之间的二维函数关系来考察体系的界面扩张流变学性质。当小幅谐波扰动界面时,界面扩张模量(E)定义为表面压(π)与面积变化(ΔA)之间的比值[14]:

式(1)
界面扩张模量(E)则是一个与界面扩张频率(ω)有关的复数量,即:
E=Eexp(iωt)=Er+iEi=Ed+iωηd
式(2)
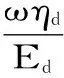
式(3)
式中:Er及Ei分别为E的实数和虚数部分,Ed为界面扩张弹性模量(储能模量),ηd为界面扩张粘度,ωηd为粘性模量(损耗模量);θ为相角。
这些变量当中,界面扩张弹性模量主要来源于扰动后偏离平衡状态导致的界面分子能量改变,其数值与界面上各分子间的相互作用密切相关;而粘性模量则与各分子发生界面与体相间的交换以及排布方式改变等弛豫过程具有紧密联系[15]。相角可以表征界面膜的粘弹特性,其数值等于粘性模量和弹性模量的比值,界面膜弹性越强,相角数值越小。界面扩张频率作为影响界面扩张粘弹特性的主要因素之一,通常在两种极限频率之间发生变化:一是扩张频率很低,在被搅动的界面上单层膜有足够恢复平衡的时间,当频率低至0 Hz时,界面张力变化也为0 mN/m,因此扩张模量等于0 mN/m;二是扩张频率较大,吸附膜没有充足的时间通过扩散等弛豫过程重新恢复平衡,扩张模量的值便较大,同时体系粘度、相角也随之降低。如假设扩张频率能达到无穷大,则此时可以忽略体相与界面之间的扩散作用,形成类似于不溶性单层膜的界面弹性模,扩张模量的值等于Gibbs弹性(EG),故在两种极限频率之间,扩张模量随着频率的提升而逐渐增大,直至达到趋于恒定的平台值[16]。
近年来随着界面扩张流变学性质成为界面性质领域研究的一大热点,对其在理论层面的探索也不断深入。Ivanov等在考虑了分子间界面相互作用以及表面活性分子体相-界面的扩散这两种弛豫过程后,给出了界面膜弹性、反应弛豫时间以及界面扩张模量的表达式;针对表面活性剂的多种反应过程,进一步对界面面积形变以及周期性小幅振荡下的扩张流变方程进行了分析[17]。Miller等建立了溶液振荡过程中界面吸附层的二维弛豫理论模型,即在振荡频率足够高的前提下,可以忽略体相与界面之间分子扩散,并发现表面活性分子界面行为的改变可能会对界面膜扩张流变学性质产生影响,进而导致体系的界面扩张粘弹特性、吸附等温线的变化趋势不同于过往经典理论[18]。Fainerman等从热力学、表面压等温线和扩张流变三个方面综述了近年来适用于阐明蛋白质与离子/非离子型表面活性剂之间静电/疏水相互作用机制的方法,认为现有描述蛋白质及其与表面活性剂混合物界面行为的吸附平衡模型已经达到了相当高的水平,这些模型同样适用于分析吸附层在高频率下不易表征的扩张粘弹特性,进而用于说明各组分间的相互作用性质[19]。随着二维压缩参数等新理论的不断提出,界面扩张流变学性质的理论体系还在进一步得到深入和完善。
2 界面扩张流变学性质的测量方法
2.1 悬滴法
随着德国Dataphysics等公司研发的界面粘弹测量仪的普及,悬滴(振荡)法已经成为表征界面扩张流变学性质的最主要方法之一。图1显示了该方法的原理及设备组成情况,在对传统的接触角测量仪进行改进后,以压电传感器为基础,采用气源(频率范围0~50 Hz)或机械(频率范围0~2 Hz)式振荡发生器,使待测溶液的液滴在一定频率及振幅下形成振荡,在液滴体积或面积发生周期性变化的条件下,通过高速摄像机直接观察、记录并对其外形进行分析,测量液滴表面张力的周期性变化,进而得到总模量、弹性模量、粘性模量、相角等数据,以此研究界面扩张流变学性质[20-21]。Drusch等在研究乳蛋白及其水解产物的喷雾干燥过程中,发现气-水界面会出现的表面堆积作用,随即采用悬滴法对界面活性蛋白在液滴中的扩张流变学性质进行了分析,并同时测量了该体系下的动态界面张力;作者认为这是一种适合于快速分析食品加工中基质变化的方法,结果表明乳蛋白在水解后表现出更强的表面活性[21]。Song等采用悬滴法比较了吐温60和80这两种典型非离子型表面活性剂在吸附膜上界面张力和扩张性质的异同,并阐述了扩张频率、体积浓度以及温度对界面性能的影响[22]。结果表明与吐温60相比,吐温80具有更高的扩张模量和更小的相角;还发现低温会降低表面活性剂不饱和疏水基的灵活性,并减少饱和疏水基之间相互作用带来的影响。Li等在研究草甘膦异丙胺盐同其聚合物相互作用的过程中,采用悬滴法分析了气-水界面下的表面特性,发现随着聚合物浓度的增加,扩张模量、弹性模量、粘性模量会达到一个最大值,并在这期间伴随着相角的持续增大,作者将这一现象归因于溶液和界面之间的分散-交换过程[23]。

图1 悬滴法分析界面扩张流变学性质的原理图[21]Fig.1 Analysis principle of interfacial dilational rheology properties through pendant drop method[21]注:1.数据处理,2.高速摄像机,3.温度控制系统, 4.注射器,5.定量进样单元,6.光源。
2.2 Langmuir槽法
作为测量界面粘弹特性的另一种经典方法,转矩流变仪多采用Langmuir槽法,以频率为0.001~1 Hz范围内进行正弦运动的方式,通过水平滑障发生周期性界面压缩或扩张作用,经由应力测量装置检测界面张力及扩张流变学变化[24]。同悬滴法相比,该方法适用频率范围相对较窄,同时不能检测界面张力及扩张流变学性质的动态变化,故使用及分析范围受到一定限制,但由于其仪器价格相对较低、操作简便,因此依然被科研工作者广泛采用。Gong等在研究两种普兰尼克嵌段聚醚共聚物(L64和17R4)与十六烷基三甲基溴化铵(CTAB)的相互作用时,采用Langmuir槽法研究了混合溶液扩张模量的变化情况,发现17R4与CTAB的相互作用较L64更强[25]。Tong等采用Langmuir槽法分析了自组装聚电解质和表面活性剂复合体系下的界面行为,认为表面压力与时间变化的依赖关系与纳米粒子在界面上发生不稳定的拆卸作用有关,而弹性模量和粘性模量随频率发生的相应变化进一步验证了纳米粒子在界面上的微动态过程[26]。

图2 Langmuir槽法分析界面扩张流变学性质的原理图[12]Fig.2 Analysis principle of interfacial dilational rheology properties through Langmuir trough method[12]注:1.水平运动的滑障,2.界面上的两性分子,3.应力的测量装置,4.下相,5.表面或界面,6.Langmuir槽。
3 界面扩张流变学方法在食品组分相互作用研究中的应用
食品的组成成分复杂,既包括碳水化合物、脂肪和蛋白质三大营养素,同时还存在矿物质、维生素以及各种因需加入的食品添加剂,因此在加工、贮藏的各个阶段,各组分间时刻发生着相互作用,这对食品品质控制、风味形成等都起着重要影响,一直以来都是食品科研工作者重点关注的核心问题之一。然而由于食品基质的状态不同,目前还没有统一的标准方法来判明食品组分的相互作用情况,往往围绕组分的类别开展研究,如蛋白质-表面活性剂相互作用、蛋白质-多糖相互作用等;并适当考虑不同加工或贮藏条件,如pH、温度等对相互作用带来的影响,借助紫外、荧光、红外光谱、圆二色谱、核磁共振等仪器分析作用位点和方式,通过计算机分子模拟对结合力、结合常数等进行研究。界面扩张流变学方法在研究食品组分的相互作用中具有天然优势,即能够通过粘弹模量、界面张力等数据的趋势,直观地反映出食品组分间由于相互作用而带来的界面行为和吸附性质改变,进而根据理论模型进行有效分析,判断相互作用机制,操作简便,重现性良好。
3.1 蛋白质-表面活性剂相互作用体系
蛋白质是最早纳入界面扩张流变学性质领域研究的食品组分,通过其在界面吸附层上的行为变化来研究溶液中的分散作用。蛋白质和常用小分子表面活性剂都能通过吸附作用降低界面张力,但二者之间在吸附时间和成膜性质上又存在一定的区别,小分子表面活性剂能够迅速地达到平衡状态,蛋白质则往往需要经过数小时来完成这一过程,所以在实际应用中无法对泡沫或乳液的形成起到决定性作用;另一方面,蛋白质对界面起到稳定作用的首要前提是处于相对较高的浓度水平,因此两类组分在混合后实现互补,进而影响各界面的吸附性质,在食品加工的不同阶段维持泡沫或乳液的稳定性[27-28]。
蛋白质与小分子表面活性剂一经混合,会基于自身的化学结构特点发生相互作用,进而在某些条件下发生协同或拮抗效应[19]。相互作用的类型分为氢键、疏水相互作用等弱相互作用以及强静电相互作用,在同小分子表面活性剂相互作用后,蛋白质的分子构象会发生改变,同时使前者的聚集行为发生变化[29];由于二者在不同界面上的活性存在显著差异,导致发生络合作用后,形成具有不同吸附性质的复合物,并对泡沫或乳液的形成产生影响[19]。随着小分子表面活性剂在界面通过竞争性吸附作用逐步取代蛋白质,当小分子表面活性剂的浓度达到一定程度以后,蛋白质对于界面性质的影响会出现显著下降[10],不利于发挥蛋白质对泡沫或乳液的稳定作用。因此,只有在充分认识小分子表面活性剂同蛋白质的相互作用机制这一前提下,对复合体系中二者的组成比例进行优化,才能够形成稳定的界面和分散介质。
天然糖苷类化合物普遍具有一定的表面活性,因此其与食品中蛋白质的相互作用引发了多位学者的关注。Wan等在研究大豆球蛋白与甜菊糖苷的相互作用时,采用悬滴法连续考察了气-水界面和油-水界面下两种组分在吸附层上的界面行为,通过界面张力和弹性模量的变化趋势观察到了二者弱相互作用;扩张流变学结果显示尽管大豆球蛋白主导了界面性质,但甜菊糖苷的加入明显起到了稳定乳液的协同作用[10,30]。Böttcher将界面扩张流变学方法应用于研究皂树皂苷与β-乳球蛋白在气-水界面下的相互作用,发现虽然β-乳球蛋白会降低界面的粘弹特性,但是皂苷-蛋白复合体系依然能够形成足以维持泡沫稳定性的界面膜,同时结合荧光猝灭作用对二者的结合位点进行了分析[31]。此外,采用界面扩张流变学方法分析蛋白质同十二烷基磺酸钠、吐温20等常用于食品、化妆品中的人工合成表面活性剂的相互作用均有较多报道[32-33],显示该方法具有较强的可行性,逐渐得到越来越多研究学者的认可。
3.2 蛋白质-多糖相互作用体系
多糖同样是食品基质当中经常存在的一类大分子化合物,近年来许多学者发现其具有调节免疫力、抗肿瘤等多种活性,并兼具调节食品乳液体系稳定性的作用,往往在食品中配合蛋白质或其他表面活性成分一同添加,已经成为天然产物和食品添加剂领域研究的热点。多糖能够明显增加水相的粘度,减缓体系的失稳过程[34],但由于其单糖组成多样、空间结构复杂,因此研究其与各组分的相互作用存在一定困难。当多糖与蛋白质复合于乳液中以后,稳定体系的形成主要取决于蛋白质的结构、表面电离情况,并与多糖的浓度密切相关[35]。
Bouyer等将β-乳球蛋白和阿拉伯胶复配用于制备稳定剂,比较了单独添加蛋白或多糖以及将二者复配时弹性模量和粘性模量变化趋势的区别,认为复配后的体系明显降低了环境因素改变对稳定性的影响,界面扩张流变学性质很好的表明了多糖和蛋白质在稳定界面性质过程中的作用机制[36]。Tamm等也采用扩张流变学方法,分析了乳清蛋白与不同水解程度果胶多糖在油-水界面上的相互作用[37]。此外,基于动态表面张力及界面扩张粘弹特性表征酪蛋白酸钠分别与黄原胶、羧甲基纤维素钠相互作用的研究亦有报道[38-39]。由于多糖与蛋白质同属于食品大分子范畴,存在多种三、四级结构变化,对相互作用的分析不能仅从基团键合的角度考虑,更需要明确孔穴对接等空间构型上的结合作用,因此互作研究过程远比小分子表面活性剂-蛋白质体系复杂。相对于传统流变学方法,界面扩张流变可以直观地表征多糖和蛋白质在界面吸附层上的动态变化过程,为深入分析相互作用方式提供了界面性质基础。
3.3 其他食品组分相互作用体系
食品组分多样、基质组成复杂,随着科研人员对分析模型的进一步优化和完善,界面扩张流变学方法适用研究的相互作用组分类型也得到了拓展。
Garofalakis等研究了4种酸化蔗糖的起泡性和扩张流变学性质,发现在添加β-乳球蛋白后可以帮助泡沫的形成,并且即使在较低的浓度下也会对膜的膨胀特性产生影响[40]。在β-酪蛋白与β-乳球蛋白混合吸附的界面上,Seta等发现两种蛋白质均存在粘弹模量与振荡频率相关联的变化趋势,酪蛋白对体系界面吸附行为的干预作用要强于乳球蛋白,这可能与前者能够更快地形成网络结构,进而影响界面流变性质有关[41]。Wojciechowski等采用Langmuir槽法研究了磷脂、胆固醇在三萜皂苷存在条件下发生络合作用后,形成复合体系下的界面性质[42],其中α-常春藤皂苷在研究涉及到的皂苷-磷脂复合物形成过程中具有最强的关联作用。Rossetti等将界面扩张流变学性质的研究对象拓展到茶多酚与唾液蛋白的相互作用中,结果显示互作强度与酚类化合物的化学结构复杂性,尤其是酚环的数量有关,为揭示食品在口腔中苦涩、收敛风味的形成机制提供了重要参考,但同时也发现传统模型并不完全适用于多酚-蛋白质复合体系的分析[43]。此外,近年来还涌现出了界面扩张流变学方法分析疏水蛋白与单宁酸、疏水蛋白与β-酪蛋白、类固醇与三萜皂苷等多种食品组分间相互作用的研究[44-46],显示了该方法在食品领域中应用的良好前景。
4 存在问题
尽管近年来基于界面扩张流变学方法分析食品组分的相互作用的研究得到了越来越多学者的关注,发展势头较快,但目前而言该技术还存在一定的问题:
在技术层面上,受制于该分析方法的原理,必须提供一个可供食品组分发生吸附或扩散作用的界面层,即存在互不相容的两相界面,在这个前提下目前主要围绕气-水或油-水界面进行分析。但食品基质的复杂性决定了并不是每种组分都会在这两个界面上表现出吸附行为,溶解度、络合性质的差异很大,因此该方法并不完全适用于分析所有的组分,现有研究主要还是围绕界面活性较强,具有两性分子结构的蛋白质、表面活性剂等化合物开展,有一定的局限性。
在理论层面上,该方法在分析相互作用的过程中,主要针对粘弹模量、界面张力的变化,通过建立或套用相关分析模型,辅助光谱、色谱或核磁共振方法探讨作用位点,最终明晰组分间的相互作用关系。但由于模型不具备通用性,往往不同类型化合物之间的作用模型需要重新进行设计,因此在开展某些模型较少的组分互作研究时需要进行较大规模的数据分析,对研究人员的理论功底和分析能力有较高要求。此外,部分经典模型已经难以适应近年来一些新资源食品组分的分析,亟需进一步优化和重建。
在应用层面上,该方法所涉及仪器中,以悬滴法为原理的界面粘弹测量仪价格普遍较贵;而采用Langmuir槽法的仪器尽管价格相对较低,但由于在动态数据的收集上存在欠缺,使用范围受到一定程度的限制。随着国产厂商逐渐认识到该方法的优势以及国内外研究人员需求的不断增加,更多的仪器生产企业将精力投入到同类设备的国产化中,界面扩张流变学方法的普及程度还会得到提高。
5 结论与展望
同其他研究食品组分相互作用的方法相比,界面扩张流变学方法具有变化趋势直观、不同化合物间差异明显、能够直接与食品的加工特性建立联系等优点,适合于研究较为复杂的基质体系,在食品加工和分析领域具有不可比拟的优势和广阔的应用前景。但该技术也受目标组分的化合物类型制约,存在理论模型不够完善、仪器设备较贵等问题,需要相关科研工作者和仪器生产企业进一步解决。因此,不断拓展和丰富适用研究的化合物范围,优化和改良现有的理论数据模型,统合更多检测结果进行深层次分析,进而建立分类对应的食品组分相互作用模型数据库,是该技术今后发展的一个重要方向。总之,应用界面扩张流变学性质对食品组分相互作用进行分析这一方法还处于起步阶段,仍需不断完善与改进,但该技术所展现的特色优势,为食品加工性能的研究提供了新的思路。
[1]Thaiphanit S,Anprung P. Physicochemical and emulsion properties of edible protein concentrate from coconut(Cocos nucifera L.)processing by-products and the influence of heat treatment[J]. Food Hydrocolloids,2016,52:756-765.
[2]Fischer P,Windhab E J. Rheology of food materials[J]. Current Opinion in Colloid & Interface Science,2011,16(1):36-40.
[3]Narchi I,Vial C,Djelveh G. Influence of bulk and interfacial properties and operating conditions on continuous foaming operation applied to model media[J]. Food Research International,2007,40(8):1069-1079.
[4]Wang C,Cao X L,Guo L L,et al. Effect of molecular structure of catanionic surfactant mixtures on their interfacial properties[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects,2016,509:601-612.
[5]Chojnicka-Paszun A,de Jongh H H J. Friction properties of oral surface analogs and their interaction with polysaccharide/MCC particle dispersions[J]. Food Research International,2014,62:1020-1028.
[6]Zhao Q,Liu D,Long Z,et al. Effect of sucrose ester concentration on the interfacial characteristics and physical properties of sodium caseinate-stabilized oil-in-water emulsions[J]. Food Chemistry,2014,151:506-513.
[7]Schmidt U S,Schütz L,Schuchmann H P. Interfacial and emulsifying properties of citrus pectin:Interaction of pH,ionic strength and degree of esterification[J]. Food Hydrocolloids,2017,62:288-298.
[8]Sadahira M S,Lopes F C R,Rodrigues M I,et al. Effect of pH and interaction between egg white protein and hydroxypropymethylcellulose in bulk aqueous medium on foaming properties[J]. Carbohydrate Polymers,2015,125:26-34.
[9]Dopierala K,Javadi A,Krägel J,et al. Dynamic interfacial tensions of dietary oils[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects,2011,382(1):261-265.
[10]Wan Z L,Wang L Y,Wang J M,et al. Synergistic foaming and surface properties of a weakly interacting mixture of soy glycinin and biosurfactant stevioside[J]. Journal of Agricultural and Food Chemistry,2014,62(28):6834-6843.
[11]朱艳艳,徐桂英. 界面扩张流变方法研究大分子与表面活性剂的相互作用[J]. 物理化学学报,2009,25(1):191-200.
[12]曹冲. 界面扩张流变方法研究几种表面活性剂和大分子的相互作用[D]. 北京:中国农业大学,2015.
[13]Ravera F,Ferrari M,Miller R,et al. Dynamic elasticity of adsorption layers in the presence of internal reorientation processes[J]. The Journal of Physical Chemistry B,2001,105(1):195-203.
[14]Li J B,Kretzschmar G,Miller R,et al. Viscoelasticity of phospholipid layers at different fluid interfaces[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects,1999,149(1):491-497.
[15]张春荣,李振泉,罗澜,等. 氧乙烯数对辛基苯酚聚氧乙烯醚表面扩张粘弹性质的影响[J]. 物理化学学报,2007,23(2):247-252.
[16]Tadros T F. Colloid stability:the role of surface forces[M]. Wiley-Vch,2007:295.
[17]Ivanov I B,Danov K D,Ananthapadmanabhan K P,et al. Interfacial rheology of adsorbed layers with surface reaction:on the origin of the dilatational surface viscosity[J]. Advances in Colloid and Interface Science,2005,114:61-92.
[18]Miller R,Aksenenko E V,Fainerman V B. The elasticity of adsorption layers of reorientable surfactants[J]. Journal of Colloid and Interface Science,2001,236(1):35-40.
[19]Fainerman V B,Aksenenko E V,Krägel J,et al. Thermodynamics,interfacial pressure isotherms and dilational rheology of mixed protein-surfactant adsorption layers[J]. Advances in Colloid and Interface Science,2015,233:200-222.
[20]Tamm F,Sauer G,Scampicchio M,et al. Pendant drop tensiometry for the evaluation of the foaming properties of milk-derived proteins[J]. Food Hydrocolloids,2012,27(2):371-377.
[21]Drusch S,Hamann S,Berger A,et al. Surface accumulation of milk proteins and milk protein hydrolysates at the air-water interface on a time-scale relevant for spray-drying[J]. Food Research International,2012,47(2):140-145.
[22]Song W,Tao B. Dilational Rheological Properties of Non-Ionic Surfactants at the Water-Decane Interface:Effect of Unsaturated Hydrophobic Group[J]. Journal of Dispersion Science and Technology,2016,37(12):1683-1691.
[23]Li M,Du F,Cao C,et al. Effect of Glyphosate Isopropylamine on the Surface Tension and Surface Dilational Rheology Properties of Polyoxyethylene Tallow Amine Surfactant[J]. Journal of Dispersion Science and Technology,2016,37(2):213-221.
[24]Guzmán E,Liggieri L,Santini E,et al. Influence of silica nanoparticles on dilational rheology of DPPC-palmitic acid Langmuir monolayers[J]. Soft Matter,2012,8(14):3938-3948.
[25]Gong H,Xu L,Zhu T,et al. Interactions between pluronic block polyether and CTAB at air/water interface:interfacial dilational rheology study[J]. Colloid and Polymer Science,2016,294(10):1577-1584.
[26]Tong L J,Bao M T,Li Y M,et al. Interfacial dynamic and dilational rheology of polyelectrolyte/surfactant two-component nanoparticle systems at air-water interface[J]. Applied Surface Science,2014,316:147-154.
[27]Bos M A,van Vliet T. Interfacial rheological properties of adsorbed protein layers and surfactants:a review[J]. Advances in Colloid and Interface Science,2001,91(3):437-471.
[28]Maldonado-Valderrama J,Patino J M R. Interfacial rheology of protein-surfactant mixtures[J]. Current Opinion in Colloid & Interface Science,2010,15(4):271-282.
[29]Kotsmar C,Pradines V,Alahverdjieva V S,et al. Thermodynamics,adsorption kinetics and rheology of mixed protein-surfactant interfacial layers[J]. Advances in Colloid and Interface Science,2009,150(1):41-54.
[30]Wan Z L,Wang L Y,Wang J M,et al. Synergistic interfacial properties of soy protein-stevioside mixtures:relationship to emulsion stability[J]. Food Hydrocolloids,2014,39:127-135.
[31]Böttcher S,Scampicchio M,Drusch S. Mixtures of saponins and beta-lactoglobulin differ from classical protein/surfactant-systems at the air-water interface[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects,2016,506:765-773.
[32]Dan A,Gochev G,Miller R. Tensiometry and dilational rheology of mixedβ-lactoglobulin/ionic surfactant adsorption layers at water/air and water/hexane interfaces[J]. Journal of Colloid and Interface Science,2015,449:383-391.
[33]Noskov B A. Dilational surface rheology of polymer and polymer/surfactant solutions[J]. Current Opinion in Colloid & Interface Science,2010,15(4):229-236.
[34]Sun C,Gunasekaran S,Richards M P. Effect of xanthan gum on physicochemical properties of whey protein isolate stabilized oil-in-water emulsions[J]. Food Hydrocolloids,2007,21(4):555-564.
[35]Gu Y S,Decker E A,McClements D J. Influence of pH and ι-carrageenan concentration on physicochemical properties and stability ofβ-lactoglobulin-stabilized oil-in-water emulsions[J]. Journal of Agricultural and Food Chemistry,2004,52(11):3626-3632.
[36]Bouyer E,Mekhloufi G,Le Potier I,et al. Stabilization mechanism of oil-in-water emulsions byβ-lactoglobulin and gum arabic[J]. Journal of Colloid and Interface Science,2011,354(2):467-477.
[37]Tamm F,Drusch S. Impact of enzymatic hydrolysis on the interfacial rheology of whey protein/pectin interfacial layers at the oil/water-interface[J]. Food Hydrocolloids,2017,63:8-18.
[38]Liu L,Zhao Q,Liu T,et al. Dynamic surface pressure and dilatational viscoelasticity of sodium caseinate/xanthan gum mixtures at the oil-water interface[J]. Food Hydrocolloids,2011,25(5):921-927.
[39]Liu L,Zhao Q,Zhou S,et al. Modulating interfacial dilatational properties by electrostatic sodium caseinate and carboxymethylcellulose interactions[J]. Food Hydrocolloids,2016,56:303-310.
[40]Garofalakis G,Murray B S. Dilatational rheology and foaming properties of sucrose monoesters in the presence ofβ-lactoglobulin[J]. Colloids and Surfaces B:Biointerfaces,2001,21(1):3-17.
[41]Seta L,Baldino N,Gabriele D,et al. Rheology and adsorption behaviour ofβ-casein andβ-lactoglobulin mixed layers at the sunflower oil/water interface[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects,2014,441:669-677.
[42]Wojciechowski K,Orczyk M,Gutberlet T,et al. Complexation of phospholipids and cholesterol by triterpenic saponins in bulk and in monolayers[J]. Biochimica et Biophysica Acta(BBA)-Biomembranes,2016,1858(2):363-373.
[43]Rossetti D,Ravera F,Liggieri L. Effect of tea polyphenols on the dilational rheology of human whole saliva(HWS):Part 2,polyphenols-HWS interaction[J]. Colloids and Surfaces B:Biointerfaces,2013,110:474-479.
[44]Zou Y,Wan Z,Guo J,et al. Tunable assembly of hydrophobic protein nanoparticle at fluid interfaces with tannic acid[J]. Food Hydrocolloids,2017,63:364-371.Zou Y,Wan Z,Guo J,et al. Tunable assembly of hydrophobic protein nanoparticle at fluid interfaces with tannic acid[J]. Food Hydrocolloids,2017,63:364-371.
[45]Burke J,Cox A,Petkov J,et al. Interfacial rheology and stability of air bubbles stabilized by mixtures of hydrophobin andβ-casein[J]. Food Hydrocolloids,2014,34:119-127.
[46]Pagureva N,Tcholakova S,Golemanov K,et al. Surface properties of adsorption layers formed from triterpenoid and steroid saponins[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects,2016,491:18-28.
Research progress in interfacial dilational rheology properties in food component interactions
ZHU Li-jie,ZHANG Xin-xin,LIU Xiu-ying,WANG Bo,YANG Li-na,LIU He,HE Yu-tang,MA Tao*
(College of Food Science and Technology,Bohai University,National & Local Joint Engineering Research Center of Storage,Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products,Jinzhou 121013,China)
As a branch of rheology,interfacial dilational rheology properties could reflect the adsorption and dispersion behaviors of different molecules on the interface layer. These properties contribute significantly to the research of interactions between components in the composite system. By comparing the characteristics of viscoelastic properties,relaxation process,interfacial tension and other parameters,theoretical models were established for analyzing different types of components. In recent years,method of interfacial dilational rheology has been considered as an effective way to study the interaction mechanism of food components for its advantage of high sensitivity,simple operation,well stability,and directly reflects the influence of interaction on processing performance. In this review,the theoretical basis and measurement methods of interfacial dilational rheology properties are summed up. Then the research progress in this technology in food component interactions is emphatically introduced. Finally,the existing problems and the future development direction are analyzed.
interfacial dilational rheology;food component interactions;pendant drop method;Langmuir trough
2016-10-28
朱力杰(1986-),男,博士,讲师,研究方向:农产品深加工与功能性食品添加剂,E-mail:lijiezhu325@126.com。
*通讯作者:马涛(1962-),男,博士,教授,研究方向:粮油与植物蛋白工程,E-mail:matao-09@163.com。
国家自然科学基金项目(31601510);辽宁省农业领域青年科技创新人才培养计划(2015001)。
TS201.7
A
1002-0306(2017)11-0363-06
10.13386/j.issn1002-0306.2017.11.062

