马铃薯淀粉汁水中Patatin的纯化及结构研究
孙 莹,魏冬旭,姚春艳,江连洲
(1.哈尔滨商业大学旅游与烹饪学院,黑龙江哈尔滨 150000;2.黑龙江出入境检验检疫局技术中心,黑龙江哈尔滨 150001;3.哈尔滨商业大学经济学院,黑龙江哈尔滨 150000;4.东北农业大学食品学院,黑龙江哈尔滨 150030)
马铃薯淀粉汁水中Patatin的纯化及结构研究
孙 莹1,魏冬旭2,姚春艳3,江连洲4
(1.哈尔滨商业大学旅游与烹饪学院,黑龙江哈尔滨 150000;2.黑龙江出入境检验检疫局技术中心,黑龙江哈尔滨 150001;3.哈尔滨商业大学经济学院,黑龙江哈尔滨 150000;4.东北农业大学食品学院,黑龙江哈尔滨 150030)
马铃薯淀粉汁水经分离与纯化后得到马铃薯糖蛋白Patatin。通过对Patatin纯度、结构的测定与分析表明:Patatin纯度在90%以上,分子量为40.6 kDa。Patatin是糖和蛋白质的复合物。单糖组成为:鼠李糖、甘露糖、葡萄糖和半乳糖。Patatin中含有α-糖苷键,糖苷类型为吡喃型;糖链和肽链之间由O-型糖肽键连接。Patatin的热变性温度为75 ℃。
马铃薯淀粉汁水,Patatin,纯化,结构
马铃薯汁水是马铃薯淀粉加工过程中产生的一种副产物,主要成分是马铃薯蛋白。马铃薯蛋白是一种全蛋白,其赖氨酸和色氨酸均高于谷类作物,营养价值可与鸡蛋蛋白相媲美。如果将马铃薯汁水直接排放,不仅造成环境污染,而且还会造成优质蛋白质资源的浪费[1]。
Patatin占马铃薯块茎中可溶性蛋白的40%左右[2]。Patatin是马铃薯块茎中主要的贮藏蛋白,与其他贮藏蛋白不同的是Patatin具有酶活性[3-5]。正是由于Patatin在马铃薯块茎中含量较高并且具有酶活性,所以引起了研究者的广泛兴趣。
本研究以马铃薯汁水为原料,通过超滤膜分离技术对汁水进行预处理得到马铃薯浓缩蛋白质,再利用色谱分离技术对浓缩蛋白进行纯化,最终得到糖蛋白Patatin。分析了Patatin的纯度、单糖组成和热稳定性以及多糖的糖链构型,以期为进一步研究马铃薯糖蛋白Patatin结构与活性功能的关系提供实验依据。
1 材料与方法
1.1 材料与仪器
马铃薯汁水 内蒙古华欧淀粉厂;Con A-Sepharose 4B和Q-Sepharose Fast Flow 美国GE Healthcare公司;三氟乙酸(TFA)、十二烷基硫酸钠(SDS)和考马斯亮蓝G-250 美国Sigma公司;其他试剂为分析纯。
PYRIS-1差示扫描量热仪 英国Perkin Elmer公司;F-4500型荧光分光光度计 日本日立公司;Bruker核磁共振仪 德国Bruker公司;Nexus 470傅立叶变换红外光谱仪和LCQ Decaxp电喷雾质谱 美国Thermo electron公司;Mini Protein Ⅱ电泳仪 美国Bio-Rad公司;GC-2010气相色谱质谱联用仪 日本岛津公司;Agilent 1100高效液相色谱仪 美国Agilent公司;AKTA层析系统 美国GE公司;Autoflex Ⅲ飞行时间质谱 德国Bruker公司。
1.2 实验方法
1.2.1 马铃薯浓缩蛋白粉的制备 将收集新鲜的马铃薯汁水静置沉淀,撇去表面的泡沫后用300目和5 μm的滤袋过滤两次,得到的液体用MWCO 200 kDa超滤膜进行过滤,收集膜分离后所得截留液,最后将截留液进行干燥得马铃薯浓缩蛋白粉,备用[11]。
1.2.2 离子交换柱层析 将超滤截留液干燥后得到的马铃薯浓缩蛋白粉进行色谱分离。称取三份200 mg超滤浓缩蛋白粉分别用pH7的5 mL 20 mmol/L磷酸盐缓冲液溶解,然后在10000 r/min转速下离心30 min,取上清液上离子交换Q-Sepharose Fast Flow(1.6 cm×25 cm)柱,用20 mmol/L磷酸盐缓冲液(溶解样品时的pH)平衡,收集离子交换穿透峰,再用平衡液冲洗5个柱体积,然后用含1 mol/L NaCl 20 mmol/L磷酸盐缓冲液(pH7)B液洗脱。100% B液直接洗脱。收集离子交换洗脱液。流速为1.5 mL/min。在280 nm下检测吸光度。
1.2.3 亲和层析 将离子交换洗脱液浓缩后,上Con A-Sepharose 4B(2.6 cm×20 cm)柱。用含1 mol/L NaCl 20 mmol/L磷酸盐缓冲液(pH7)平衡,少量未吸附蛋白穿透,然后用1 mol/L NaCl 20 mmol/L磷酸盐缓冲液(pH7)平衡5个柱体积后,改用含0~100 mmol/Lα-甲基-D-葡萄糖苷和1 mol/L NaCl 20 mmol/L磷酸盐缓冲液(pH7)C液洗脱。流速为1.5 mL/min。在280 nm下检测吸光度。收集亲和层析洗脱液,5000 Da超滤离心管离心10 min,干燥后存于-20 ℃冰箱中,备用。
1.2.4 电泳(SDS-PAGE) 用样品溶解液(内含4% SDS、10%β-巯基乙醇、20%甘油、0.02%溴酚蓝、0.125 mol/L Tris-HCl缓冲液,pH6.8)配制浓度为1 mg/mL蛋白质溶液,振荡混合1 min,100 ℃水浴3 min,备用。参照Park[12]的SDS不连续电泳方法,分离胶浓度15%,浓缩胶浓度5%,电极缓冲液含0.05 mol/L Tris、0.384 mol/L甘氨酸、0.1% SDS(pH8.3)。电泳采用1.00 mm凝胶板;上样量为12 μL;开始电泳时电压为90 V,待样品进入分离胶后改为130 V;电泳结束后,取出胶片先用固定液固定30 min,再用考马斯亮蓝R250染色30 min(染色液含有50%的甲醇、6.8%的冰醋酸和1 mg/mL的考马斯亮蓝),然后用甲醇/冰醋酸脱色液脱至透明(脱色液中含有5%的甲醇和7.5%的冰醋酸)。
1.2.5 凝胶过滤色谱 采用凝胶过滤色谱法分析Patatin的纯度。色谱柱:Sephadex G-75(30 cm×1.6 cm);流动相:磷酸缓冲液(0.02 mol/L,pH7.0);流速:0.5 mL/min;检测波长:280 nm;进样量:2 μL。
1.2.6 液质联用(HPLC-MS)技术对纯化组分进行定性 参照张贵锋[13]和高建萍[14]等人的方法。将收集的离子交换洗脱液和亲和层析洗脱液经过3000 Da和5000 Da的超滤离心管10000 r/min离心10 min。在100 ℃加热处理10 min后进行真空干燥,将干燥粉溶解在200 μL 0.05 mol/L NH4HCO3溶液中(pH8.0),再加入50 μL 1 μg/μL胰蛋白酶溶液(胰蛋白酶溶解在0.05 mol/L NH4HCO3,pH8.0),涡旋混合均匀,37 ℃加热8 h得到酶解后的产物再用液质联用(HPLC-MS)分析。液质联用分析条件:选用的色谱柱为Zorbax SB C18(150 mm×2.1 mm);流动相 D液含 0.1% TFA的水溶液;流动性E液含0.1% TFA的乙腈;进样量50 μL。梯度设置0~10 min,10% E;10~70 min,10%~90% E;80~90 min,100% E。通过Turbosequest软件进行质谱数据检索,从Swiss-Prot网站上下载包括马铃薯蛋白中已发现的全部蛋白质氨基酸序列数据库。检索参数设置为:多肽质荷比范围设为m/z=300~2000;多肽的信号强度为1×105;多肽的分子量计算方式为单一同位素分子量;FASTA数据搜索格式;±1.5多肽质量准确度;±1.0碎片离子的质量准确度。阳性结果:当多肽带电荷数1时,Xcorr≥1.5,带电荷数为2时,Xcorr≥2.0,带电荷数为3时,Xcorr≥2.5,DeltaCn≥0.1。综合考虑目标离子色谱峰的信噪比以及二级质谱图b、y离子之间的匹配性和连续性。
1.2.7 纯化样品分子量测定 取1 μL样品点靶,室内自然风吹干后取1 μLα-氰基-4-羟基肉桂酸(CHCA)基质溶液点靶,自然风干。质谱质量数利用外标法,并用标准蛋白混合物校正。以337 nm脉冲氮激光离子解析电离源,100 次/s激光脉冲次数,20 kV离子加速电压,m/z 600~4000范围内扫描[14]。
1.2.8 蛋白质和碳水化合物含量测定 蛋白质含量测定依照Bradford法[15],标准蛋白采用牛血清白蛋白;碳水化合物含量测定依照苯酚-硫酸法测定,标准单糖采用葡萄糖。
1.2.9 气相色谱分析Patatin单糖组成 取10 mg Patatin置于安培管中,加入2 mL 2 mol/L三氟乙酸,封管后120 ℃水解6 h。冷却至室温,减压蒸干。加入约10 mg盐酸羟胺及1 mL无水吡啶,90 ℃反应30 min,冷至室温,加入1 mL无水醋酸酐,90 ℃下反应30 min,冷至室温,再用氯仿萃取3次,每次1 mL,合并氯仿层,减压抽干,置真空干燥箱减压干燥24 h[16-17]。各种标准单糖的糖腈乙酰酯衍生物制备方法同上,分别进行气相色谱分析。采用日本岛津GC-2010气相色谱仪,氢火焰离子化检测器,载气N2流速为20 mL/min,氢气流速为40 mL/min,空气流速为450 mL/min,色谱柱为Rtx-WAX(30 m×0.25 mm×0.25 μm),程序升温,柱初温180 ℃,恒温3 min,升温速率为5 ℃/min,终温240 ℃,恒温3 min,进样口温度为280 ℃,检测器温度为250 ℃。
1.2.10 Patatin热性能 通过示差扫描热量计(DSC)测定蛋白热稳定性。精确称量15 mg样品放入样品池,放置DSC仪器的样品支持器上,调整好仪器,用空盒做对照。实验采用的测定温度范围为0~200 ℃,加热速度为10 ℃/min[18-19]。
1.2.11 红外光谱 称取干燥的Patatin 1 mg和100 mg KBr固体粉末在玛瑙研钵中均匀研磨,用压片机压成薄片,用红外分光光度计在4000~400 cm-1范围进行扫描[20]。
1.2.12 核磁共振 将10 mg Patatin溶解在1 mL D2O中,冷冻干燥交换3次。用0.5 mL D2O溶解后置于核磁管,于250 ℃核磁共振波谱仪测定其1H NMR和13C NMR[21-22]。
1.3 统计分析
采用SPSS 12.0数据统计软件对实验数据进行单因素方差分析;采用Origin8.0作图,每个实验重复三次,结果用平均数±SD表示。
2 结果与分析
2.1 色谱层析
马铃薯浓缩蛋白经过Q-Sepharose Fast Flow离子交换色谱柱后得到两个峰(见图1)。收集的离子交换洗脱液(图1中的洗脱峰),经过浓缩后,直接上Con A-Sepharose 4B亲和色谱柱,上样后用缓冲液B平衡,收集穿透液。然后用含1 mol/L NaCl和1 mol/L葡萄糖酸酐20 mmol/L磷酸盐缓冲液(pH7)C洗脱吸附在介质上的组分,收集洗脱液。

图1 马铃薯浓缩蛋白离子交换色谱Fig.1 Ion exchange chromatography of potato concentrated protein
2.2 Patatin纯度鉴定
收集的亲和层析洗脱液经过SDS-PAGE和Sephadex G-75凝胶过滤检测,以判断样品的纯度。通过SDS-PAGE分析可知,亲和层析洗脱峰组分为单一组分,电泳显示单一条带,达到电泳纯(图2A)。
纯品纯度检测一般要用两种以上的方法检测,因此选用凝胶过滤进行验证。通过Sephadex G-75凝胶过滤分析发现谱图上出现一个细而尖的峰,通过峰面积估算,该组分的纯度在90%以上(图2B)。

图2 Patatin的纯度Fig.2 Homogeneity assays of purified patatin
2.3 纯化样品的组分鉴定
利用超滤和色谱分离相结合的方法对马铃薯汁水中的蛋白质组分进行分离,通过SDS-PAGE初步判断出亲和层析洗脱峰蛋白质主要集中在40 kDa左右。在此基础上采用HPLC/MS与酶解技术相结合的方法对亲和层析洗脱峰中的蛋白质进行识别。
图3为亲和层析洗脱峰中样品经过酶解、HPLC/MS分析的总离子流图,质谱数据利用Turbosequest软件进行数据库检索以识别洗脱峰中的组分。

图3 洗脱峰的紫外色谱(A)和总离子流(B)Fig.3 Total ion chromatograms(TIC)of digested unbound fraction
表1结果表明,洗脱峰中蛋白质主要为Patatin,并且含有多种亚基,分别为Patatin-01、Patatin-04/09、Patatin-3-Kuras 1、Patatin-03和Patatin-2-Kuras 3。Pots等[23]分离出的Patatin 具有两种亚基,分子量分别为40.5 kDa和41.8 kDa。不同亚基类型的Patatin在氨基酸组成及排列顺序方面有轻微差异,但却具有相同的免疫和色谱性质,因此,通常将不同亚基类型的Patatin作为均一蛋白来进行研究[24]。这一结果与SDS-PAGE和Sephadex G-75凝胶过滤检测结果一致,表明该组分是均一物质,可进一步结构分析。

表1 亲和层析洗脱峰组分识别结果Table 1 Identification of unbound fraction of affinity chromatography
2.4 马铃薯糖蛋白Patatin的分子量
通过MALDI-TOF-MS分析马铃薯糖蛋白Patatin的精确分子量,结果如图4所示。由图4可知,通过亲和层析色谱纯化得到的Patatin分子量为40.6 kDa,其多电荷亚基分子量分别为10.1、13.6、20.3 kDa。这个结果与HPLC-MS分析结果存在差异。Jorgensen等[25]通过MALDI-TOF-MS检测纯化出的Patatin分子量为41~42 kDa,通过肽指纹图谱分析发现Patatin中含有三种亚基,分别为Pat2-K1、Pat3-K1和Pat1-K2,分子量约为40 kDa。同样,与本文结果也存在差异。这可能与仪器的精密度有关系。另外,MALDI-TOF-MS图中的峰分子量是通过标尺手动标上,所以存在一定的误差。

图4 马铃薯糖蛋白Patatin的分子量Fig.4 Molecular weight of potato glycoprotein Patatin
Liu等[26]从马铃薯块茎中提取出的Patatin(45 kDa)分子量与本文报道的Patatin分子量(40.6 kDa)差异很大。这两种Patatin可能是不同的亚基类型,马铃薯的品种以及提取方式不同可以引起亚基组成不同[23]。
2.5 马铃薯糖蛋白Patatin的理化性质
2.5.1 马铃薯糖蛋白Patatin糖、蛋白质含量、单糖组成分析 用苯酚-硫酸法测定糖蛋白Patatin中糖的含量约为32%,用Bradford法测定其蛋白质含量约为64%,说明Patatin是糖和蛋白的复合物。
通过气相色谱法分析Patatin的单糖组成。图5为标准混合单糖和Patatin气相色谱图。在标准混合单糖中,1、2、3、4、5、6分别为鼠李糖、阿拉伯糖、木糖、甘露糖、半乳糖、葡萄糖;在Patatin样品中1、2、3、4 分别为鼠李糖、甘露糖、半乳糖、葡萄糖。由图5A可知,采用糖腈乙酰酯衍生化方法可以使一种单糖对应一种衍生化产物,在本实验条件下,可以将混合标准单糖较好的分离。图5B是用同样的衍生化方法并在相同的测定条件下得到Patatin水解衍生化产物的气相色谱图,从图5B中可以看出,通过与标准混合单糖的保留时间比较可知,Patatin中可能含有四种单糖,分别为鼠李糖、甘露糖、葡萄糖和半乳糖。对于Patatin的单糖组成,国内没有相关报道,国外仅有Racusen等人[2]通过纸层析法测得45 kDa Patatin主要单糖为甘露糖,正是由于甘露糖的出现,使Patatin对甘露糖具有高度的亲和力,使Patatin能够吸附到Con A-Sepharose 介质上。Tsukagoshi等[27]报道了从Coriolus versicolor中提取的PSK糖蛋白具有抗肿瘤活性,原因可能是它的结构中包括的葡萄糖、甘露糖、果糖、木糖和半乳糖发挥作用。研究Patatin中含有的单糖组分可为研究Patatin的生理活性提供理论依据。
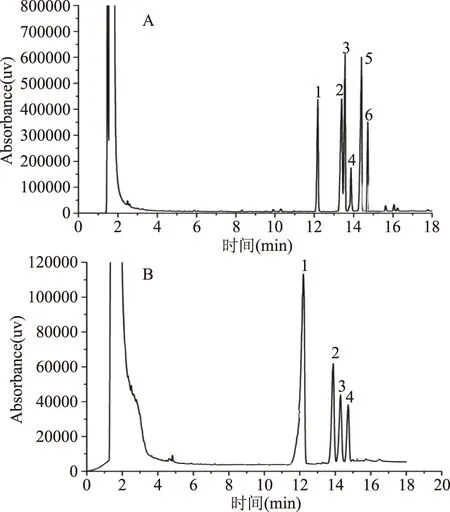
图5 标准混合单糖(A)和Patatin(B)气相色谱Fig.5 Gas chromatography spectrum of standard mixed monosaccharides(A)and patatin(B)
2.5.2 马铃薯糖蛋白Patatin的糖肽键特征 单糖与蛋白质中某一肽段的连接是糖蛋白的重要结构特征。目前已经发现多种连接方式,其中主要有两类:一类是糖链与天冬酰胺连接,称为N-连接糖肽键,另一类是与苏氨酸和丝氨酸连接,成为O-连接糖肽键。β-消去反应可以区分糖蛋白中的O-糖肽键和N-糖肽键。O-糖肽键在碱作用下易发生断裂,而N-糖肽键相对比较稳定。糖蛋白经过碱处理后,与O-糖肽键连接的苏氨酸生成α-氨基丁烯酸,丝氨酸生成α-氨基丙烯酸,形成的不饱和氨基酸在240 nm波长处的紫外吸收明显增强,在反应体系中迅速加入硼氢化钠还原剂,α-氨基丙烯酸会被还原成丙氨酸。因此,在β-消去反应中,丝氨酸和苏氨酸的含量减少,而丙氨酸和α-氨基丁酸的含量,减少和增加之间有一定的联系[17-18]。
图6为Patatin经过NaOH溶液处理前后的紫外吸收光谱。Patatin经过β-消去反应后,糖链被消去,235 nm处吸光度明显增加。说明马铃薯糖蛋白Patatin糖肽键为O-连接糖肽键。

图6 β-消去反应前后Patatin的紫外光谱Fig.6 UV spectra of patatin before and after β-eliminate reaction
2.5.3 马铃薯糖蛋白Patatin的热稳定性 蛋白质在加热过程中,内部氢键断裂,导致蛋白质分子伸展,在分子伸展过程中需要吸收热能,这种现象被称为热变性。蛋白质的热变性和可能影响蛋白质生理活性的空间构象的变化有紧密的关系。DSC可以反映蛋白质的空间构象变化,热稳定性与生理功能之间的关系及热变性原因等信息,被广泛用于蛋白质的热变性研究中[28]。因此,通过测定β-消去反应前后糖蛋白Patatin的DSC,可以确定糖链对其抗热变性功能的影响强弱。
糖蛋白Patatin的热变性最高温度为74.97 ℃,经过β-消去反应后,其热变性最高温度降低为66.98 ℃(表2)。β-消去反应使糖链释放,导致热变性温度明显降低,说明糖链对Patatin稳定性起到重要作用,并且糖链的存在可以提高Patatin的抗变性能力。

表2 Patatin(A)和β-消去反应后Patatin(B)的DSC结果Table 2 The result of DSC on patatin(A) and Patatin treatmented by β-elimination(B)
2.5.4 马铃薯糖蛋白Patatin的核磁共振(NMR)分析 Patatin的13C NMR和1H NMR如图7所示。呋喃型醛糖的C-4和呋喃型酮糖C-5在δ 82.00~84.00 ppm 范围内有信号,这个原则用于区别呋喃糖和吡喃糖构型。在图7A中,δ 82.00~84.00 ppm内没有信号,说明Patatin为吡喃构型。一般来说,吡喃糖的α构型在δ 90.00~102.00 ppm有信号,β构型在δ 102.00~112.00 ppm有信号,Patatin在101.29 ppm出现信号峰,表明其糖苷键构型为α-型,进一步证明了Patatin糖苷键主要类型为α-型吡喃糖[29-30],与红外图谱分析结果一致。
在图7B中,质子信号对应不同的糖残基。δ 5.18、δ 5.09、δ 4.98、δ 4.53 ppm分别对应H-1的α-(1→3)甘露糖,α-(1→4)半乳糖,β-(1→4)葡萄糖和α-(1→2)鼠李糖。许多文献已经报道[31],单糖组成和糖苷键类型可能与糖蛋白的抗肿瘤活性相关。

图7 马铃薯糖蛋白Patatin的13C NMR谱(A)和1H NMR谱(B)Fig.7 13C NMR spectra of Patatin(A) and1H NMR spectra of Patatin(B)
3 结论
通过离子交换和亲和层析分离技术相结合的工艺技术对马铃薯浓缩蛋白进行纯化,得到马铃薯糖蛋白Patatin。经过SDS-PAGE和Sephadex G-75凝胶过滤检测,亲和层析洗脱峰组分的纯度在90%以上。MALDI-TOF-MS鉴定该组分是分子量为40.6 kDa的Patatin。Patatin为糖和蛋白质的复合物,其单糖组成为:鼠李糖、甘露糖、葡萄糖和半乳糖;Patatin中含有α-糖苷键,糖苷类型为吡喃型;Patatin经过β-消去反应前后的紫外光谱测定表明:糖链和肽链之间由O-型糖肽键连接。Patatin的热变性温度为74.97 ℃,经过β-消去反应后,热变性温度为66.98 ℃。
[1]陈钰,潘晓琴,钟振声,等. 马铃薯淀粉加工废水中超滤回收马铃薯蛋白质[J]. 食品研究与开发,2010,31(9):37-41.
[2]潘牧,彭慧元,雷尊国,等. 马陵山蛋白的研究进展[J]. 贵州农业科学,2012,40(10):22-26.
[3]Gambuti A,Rinaaldi A,Molo L. Use of patatin,a protein extracted from potato,as alternative to animal proteins in fining of red wine[J]. European Food Research and Technology,2012,235(4):753-765.
[4]谢从华.马铃薯产业的现状与发展[J].华中农业大学学报,2012,97:1-4.
[5]张笃芹,木泰华,孙红男. 马铃薯块茎特异蛋白 Patatin 的研究进展[J]. 中国农业科学,2016,49(9):1746-1756.
[6]Stratkvern K O,Schwarz J G. Recovery of native potato protein comparing expanded bed adsorption and ultrafiltration[J]. Food and Bioprocess Technology,2011,5(5):1939-1949.
[7]Pouvreau L,Gruppen H,Piersma S,et al. Relative abundance and inhibitory distribution of protease inhibitors in potato juice from cv. Elkana[J]. Journal of Agricultural and Food Chemistry,2001,49(6):2864-2874.
[8]Jorgensen M B,G,Welinder K. Molecular properties and activities of tuber proteins from starch potato cv. Kuras[J]. Journal of Agricultural and Food Chemistry,2006,54(25):9389-9397.
[9]Liu Y,Han C,Lee M,et al. Patatin,the tuber storage protein of potato(SolanumtuberosumL.),exhibits antioxidant activityinvitro[J]. Journal of Agricultural and Food Chemistry,2003,51(15):4389-4393.
[10]Waglay A,Karboun E S,Alli I. Potato protein isolates:Recovery and characterization of their properties[J]. Food Chemistry,2014,142:373-382.
[11]Sun Y,Jiang L,Wei D. Partial characterization,invitroantioxidant and antiproliferative activities of Patatin purified from potato fruit juice[J]. Food and Function,2013,4(10):1502-1511.
[12]Park D,Xiong Y L,Alderton A L. Concentration effects of hydroxyl radical oxidizing systems on biochemical properties of porcine muscle myofibrillar protein[J]. Food Chemistry,2007,101(3):1239-1246.
[13]张贵锋,刘涛,王前,等. 高效液相色谱/质谱法识别不同明胶酶解产物中特征多肽[J]. 分析化学,2008,36(11):1499-1504.
[14]高建萍,刘琳,张贵锋,等. 多级逆流固液提取技术提取大豆分离蛋白[J]. 过程工程学报,2011,11(2):312-317.
[15]Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72(1):248-254.
[16]Dubois M,Gilles K A,Hamilton J K,et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry,1956,28(3):350-356.
[17]阚建全. 甘薯糖蛋白的糖链结构与保健功能研究[D]. 重庆:西南农业大学,2003.
[18]Creusot N,Wierenga PA,Laus MC,Giuseppin ML,Gruppen H. Rheological properties of Patatin gels compared withβ-lactoglobulin,ovalbumin,and glycinin[J]. Journal of the Science of Food and Agriculture,2011,91(2):253-261.
[19]Shahidi F,Janitha P,Wanasundara P. Phenolic antioxidants[J]. Critical Reviews in Food Science & Nutrition,1992,32(1):67-103.
[20]朱科学,周惠明. 麦胚球蛋白的分离制备及理化性质研究[J]. 中国粮油学报,2005,20(6):15-18.
[21]Sun H H,Mao W J,Jiao J Y,et al. Structural characterization of extracellular polysaccharides produced by the marine fungus Epicoccum nigrum JJY-40 and their antioxidant activities[J]. Marine Biotechnology,2011,13(5):1048-1055.
[22]Seo S,Karboune S,Archelas A. Production and characterisation of potato Patatin-galactose,galactooligosaccharides,and galactan conjugates of great potential as functional ingredients[J]. Food Chemistry,2014,158:480-489.
[23]Pots A M,Gruppen H,Hessing M,et al. Isolation and characterization of patatin isoforms[J]. Journal of Agricultural and Food Chemistry,1999,47(11):4587-4592.
[24]Pots A M,Jongh H H,Gruppen H,et al. Heat-induced conformational changes of patatin,the major potato tuber protein[J]. European Journal of Biochemistry,1998,252(1):66-72.
[25]Jorgensen M B,Welinder K. Molecular properties and activities of tuber proteins from starch potato cv. Kuras[J]. Journal of Agricultural and Food Chemistry,2006,54(25):9389-9397.
[26]Liu Y W,Han C H,Lee M H,et al. Patatin,the tuber storage protein of potato(SolanumtuberosumL.),exhibits antioxidant activityinvitro[J]. Journal of Agricultural and Food Chemistry,2003,51(15):4389-4393.
[27]Tsukagoshi S,Hashimoto Y,Fujii G,et al. Krestin(Psk)[J]. Cancer Treatment Reviews,1984,11(2):131-155.
[28]易薇,胡一桥. 差示扫描量热法在蛋白质热变性研究中的应用[J]. 中国药学杂志,2004,39(6):401-403.
[29]Kobayashi H,Matsunaga K,Oguchi Y. Antimetastatic effects of PSK(Krestin),a protein-bound polysaccharide obtained from basidiomycetes:an overview[J]. Cancer Epidemiology Biomarkers and Prevention,1995,4(3):275-281.
[30]Spelbrink REJ,Lensing H,Egmond MR,Giuseppin ML. Potato Patatin generates short-chain fatty acids from milk fat that contribute to flavour development in cheese ripening[J]. Applied Biochemistry and Biotechnology,2015,176(1):231-243.
[31]Zheng R,Jie S,Hanchuan D,et al. Characterization and immunomodulating activities of polysaccharide from Lentinus edodes[J]. International Immunopharmacology,2005,5(5):811-820.
Study on purification and structure of Patatin from potato starch juice
SUN Ying1,WEI Dong-xu2,YAO Chun-yan3,JIANG Lian-zhou4
(1.College of Tourism and Culinary Science,Harbin University of Commerce,Harbin 150000,China;2.Technical Centre of Heilongjiang Entry-exit Inspection and Quarantine Bureau,Harbin 150001,China;3.College of Economics,Harbin University of Commerce,Harbin 150000,China;4.College of food,Northeast Agricultural University,Harbin 150030,China)
Potato glycoprotein(patatin)was obtained by separating and purifying the potato starch juice. The results showed that the purity of patatin was above 90% and the molecular weight was 40.6 kDa. Furthermore,the monosaccharide composition included rhamnose,mannose,glucose and galactose. Moreover,the carbohydrate chain of patatin was connected to protein by O-glycopeptide linkages and denaturation temperature of patatin was 75 ℃.
potato starch juice;Patatin;purification;structure
2016-11-18
孙莹(1982-),女,博士,讲师,研究方向:植物蛋白质的功能性,E-mail:sunying625@163.com。
黑龙江省自然科学基金项目(C2015067);哈尔滨商业大学博士科研启动项目(15RW19);哈尔滨商业大学青年人才支持项目(2016QN060)。
TS255.1
A
1002-0306(2017)11-0122-06
10.13386/j.issn1002-0306.2017.11.015

