低温保护剂添加与去除过程对猪卵母细胞的渗透损伤
杨云周新丽戴建军张德福衣星越滕芸陶乐仁
(1上海理工大学生物热科学研究所 上海 200093;2上海市农业科学院畜牧兽医研究所 上海 201106)
低温保护剂添加与去除过程对猪卵母细胞的渗透损伤
杨云1周新丽1戴建军2张德福2衣星越1滕芸1陶乐仁1
(1上海理工大学生物热科学研究所 上海 200093;2上海市农业科学院畜牧兽医研究所 上海 201106)
在卵母细胞低温保存过程中,低温保护剂的添加与去除是必不可少的步骤,但此过程会对细胞造成致命的渗透损伤和毒性损伤。为了研究保护剂添加和去除联合过程对猪MII期细胞的损伤程度,本文设计并制作了一个适合卵母细胞低温保护剂连续添加与去除的微流体装置,分别采用微流控线性法和传统的分步法加载和去除低温保护剂,分析了两种方法对卵母细胞的体积变化以及存活率与发育潜能的影响。结果表明:微流控线性法加载和去除低温保护剂时,卵母细胞的体积变化明显小于分步法;线性法处理后细胞的存活率、卵裂率、囊胚率分别为95.3%、64.4%、19.4%,都显著高于传统的分步法(79.4%、43.6%、9.7%)(P<0.05)。因此,微流体装置用于卵母细胞低温保护剂添加与去除是有效的,能够显著减小细胞的渗透损伤,为卵母细胞低温保存技术提供了新思路。
低温保存;低温保护剂;渗透损伤;卵母细胞
20世纪末D.C.Whittingham[1]和C.Chen[2]相继成功地冷冻保存了小鼠卵母细胞和人卵母细胞,受精后均获得了后代。之后,卵母细胞的低温保存成为低温生物医学研究的重要内容,一方面能够使一些珍稀濒危物种和优良品种资源得以延续,另一方面可为某些因病理或其他原因而推迟生育的妇女提供生育机会[3-4]。随着研究的深入,多种哺乳动物的卵母细胞已被保存,但保存效果并不理想[5]。目前,学术界普遍认为玻璃化冷冻更适合于卵母细胞的冷冻保存,因为玻璃化避免了胞内外冰晶的生成[6-7]。但是,要想实现细胞的玻璃化保存,除了较高的降温速率外,还需要添加高浓度的低温保护剂[8]。在低温保护剂添加和去除过程中,由于细胞内外渗透压的急剧变化,大量水或保护剂会快速流出或流入细胞,从而引起细胞体积的膨胀或收缩,造成细胞膜结构的损伤[9]。
为了减小保护剂的渗透作用对卵母细胞的损伤,近年来,研究者对低温保护剂的添加或去除过程进行了优化。解政鼎等[10]认为采用等渗透压差、渗透时间间隔逐渐减小的方式添加高浓度低温保护剂,可以最大限度地减轻对细胞的损伤。S.E.Mullen等[11]实验表明分步法添加6.4 mol/L乙二醇至人卵母细胞时,以四步添加最为理想。Y.S.Heo等[12]采用微流体装置向卵母细胞中连续添加1.5 mol/L丙二醇,结果表明:整个保护剂的添加时间小于15 min,细胞体积的改变量小于10%。C.Mata等[13]提出用微流体装置去除脐带血低温保护剂并制作了水平两流的微流体装置,实验验证了微流体装置用于低温保护剂去除的可行性。尽管这些研究明显改善了细胞低温保存的效果,但都是孤立地优化添加过程或者去除过程,而事实上,低温保护剂的添加与去除过程是相关的,解冻液浓度和平衡时间的选择依赖于细胞在冷冻液中的浓度和平衡时间。X.Wang等[14]也指出分步法添加与去除牛卵母细胞低温保护剂时,四步添加结合两步去除的方案处理后细胞发育效果最好。
为了综合评价添加和去除联合过程对细胞的损伤程度,并且填补微流体装置用于卵母细胞低温保护剂连续添加与去除的研究空白,本文设计制作了一个适合卵母细胞低温保护剂连续添加与去除的微流体装置,比较了微流控线性法和传统分步法添加与去除低温保护剂时,猪MII期卵母细胞的体积变化及对卵母细胞存活率与发育率的影响。
1 材料与方法
1.1 主要试剂
组织培养液(tissue culture medium 199,TCM199)、磷酸盐缓冲液(phosphate buffer solution,PBS)、二甲基亚砜(Me2SO)、蔗糖、山梨醇、醋酸钙、醋酸镁,胎牛血清(fetal bovine serum,FBS)购自美国Gibco公司。实验中所用其他试剂除特别说明外,均购自美国Sigma公司。
1.2 玻璃化冷冻/解冻液
实验中所用溶液的浓度均为体积比浓度。基础液:TCM199+20%FBS。分步法玻璃化冷冻液:(VS1)基础液+15%Me2SO;(VS2)基础液 +30% Me2SO。微流体线性法玻璃化冷冻液:基础液+30% Me2SO。分步法解冻液:(WS1)基础液+1 mol/L蔗糖;(WS2)基础液+0.5 mol/L蔗糖;(WS3)基础液。微流体线性法解冻液:基础液+1 mol/L蔗糖。
1.3 猪卵母细胞的采集及MII期卵母细胞的获得
从上海市嘉定区某屠宰场采集新鲜猪卵巢组织,置于37℃含1 000 μg/mL的双抗生理盐水中,1 h内运回实验室。用生理盐水冲洗2~3次,选择卵巢表面直径为2~6 mm的卵泡,用10 mL的一次性注射器将卵母细胞复合体连同卵泡液一起吸出。将抽出的液体置于10 mL离心管中,在39.5℃的恒温水浴中静置15~20 min,移除上清液。取胞质均匀且有3层以上致密卵丘细胞的卵丘卵母细胞复合体,即GV期卵母细胞。将GV期卵母细胞洗涤三次后,置于已平衡4 h以上的成熟培养液中,培养液为TCM199+10%FBS+10%猪卵泡液+0.1% 血清促性腺激素(PMSG)+0.1% 人绒毛膜促性腺激素(hCG),然后再放入 CO2培养箱((39±0.5)℃、5%CO2,BCJ160S,上海博讯实业有限公司,中国)中,成熟培养44~46 h,得到MII期卵母细胞。MII期卵母细胞用0.1%透明质酸酶消化以去除卵丘细胞,再用TCM199洗涤3~5次备用。
1.4 微流体芯片的设计与制作
用于卵母细胞低温保护剂连续添加和去除的微流体芯片主要包括流体混合通道、细胞分析腔、细胞出入通道等,如图1所示。蛇形混合通道的尺寸(长×宽×高)为100 mm×150 μm×150 μm,两股流体在混合通道内层流扩散混合,实现溶液浓度的连续线性变化。细胞分析腔的尺寸(长×宽×高)为1 200 μm×1 000 μm×150 μm,卵母细胞经细胞通道导入细胞分析腔。为防止卵母细胞被流体冲走,在细胞分析腔的内部加工了两排直径为100 μm的柱状障碍物,障碍物之间的间距为50 μm。
采用模塑法制作微流体芯片,首先在硅晶片上利用光刻胶得到微流控芯片结构的光刻模具,然后将PDMS和固化剂混合均匀并浇注在模具上,完全固化后将PDMS材料从模具上剥落下来,得到刻有微通道的微流控芯片基片;将PDMS基片和PDMS盖片对齐复合完成封接,然后置于75℃的烘箱中加热10 min,得到牢固的PDMS芯片;最后在芯片的制定位置处用钻孔器打四个直径为0.6 mm的孔,用塑料管连接注射泵和口吸器,使流体和细胞进出微流体芯片。
1.5 微流控线性法和分步法添加与去除低温保护剂
实验中,微流控线性法和分步法添加与去除低温保护剂的具体程序如图2所示。

图1 微流控线性法添加与去除低温保护剂的示意图Fig.1 The schematic diagram of CPA loading and unloading with the microfluidic linear method

图2 线性法和分步法添加与去除低温保护剂的程序Fig.2 The protocols of CPA loading and unloading with the step⁃wise method and the microfluidic method
微流控线性法:在导入卵母细胞前,先用基础液充满混合通道,然后用口吸器将卵母细胞吹入细胞分析腔并开启注射泵(Pump 11 Plus微量注射泵:Harvard,美国),通过注射泵分别将基础液和高浓度的低温保护剂注入微流体芯片内,保持混合通道内总流量为1.2 μL/min,控制基础液的流量从1.2 μL/min减小到0 μL/min,同时保护剂的流量从0 μL/min减小到1.2 μL/min,使胞外保护剂体积浓度从0线性增加到30%,加载时间为10 min。完成低温保护剂的添加后,不取出卵母细胞,迅速更换注射溶液(基础液和解冻液)进行低温保护剂的去除,保持混合通道内溶液的总流量为5 μL/min,控制基础液的流量从0 μL/min增加到5 μL/min,同时解冻液的流量从5 μL/min减小到0 μL/min,使细胞外解冻液浓度从1 mol/L线性减小到0 mol/L,去除时间为8 min。
分步法:将卵母细胞从基础液中移至体积浓度为15%Me2SO中平衡3 min,然后移至体积浓度为30% Me2SO中平衡30 s,然后快速转移至1 mol/L蔗糖溶液中平衡2 min,然后移至0.5 mol/L蔗糖溶液中平衡3 min,然后转移至基础液中平衡3 min。
1.6 细胞图像采集与数据处理
在低温保护剂添加与去除过程中,用带有图像采集系统的显微镜(TS100倒置荧光显微镜:Nikon,日本)连续记录并获取整个过程中卵母细胞(n=5)的体积变化图片。假设卵母细胞为理想球体,利用图像分析软件测量细胞的二维投影面积,再通过球体体积与投影面积的换算关系式(V=0.752 S3/2),计算得到细胞的体积变化。
1.7 细胞存活率与发育率判断
按照实验中设计的方案添加与去除冷冻保护剂后,将卵母细胞转移至培养液中,放入CO2培养箱孵育1 h,然后将一部分细胞用荧光素双醋酸酯(fluorescein diacetate,FDA)染色5 min,再用TCM199洗3~5遍,在倒置荧光显微镜下观察是否着色。有强荧光反应的为活卵,无荧光反应或弱荧光反应的为死卵。活卵数与细胞总数之比为存活率。将另一部分细胞进行孤雌激活,激活后的细胞转移至胚胎培养液中,然后放入CO2培养箱培养。分别在培养的第二天和第七天观察细胞卵裂率和囊胚率。每组实验重复3次,数据采用数据分析软件SPSS Statistics 13.0进行显著性分析,P <0.05为显著性差异标准。
2 结果与讨论
2.1 微流控线性法与分步法添加与去除低温保护剂时卵母细胞的体积变化
图3所示为微流控线性法与分步法添加与去除低温保护剂时卵母细胞的体积变化。由图3可知,分步法添加与去除低温保护剂时,细胞体积会出现多次的膨胀和收缩,而且去除过程中细胞体积的变化幅度要明显大于添加过程,其中最小收缩归一化体积达到了0.46±0.07,该变化趋势与文献[15]中小鼠卵母细胞体积变化的模拟结果一致,说明低温保护剂去除过程对细胞的渗透损伤要比添加过程大。另外,分步法添加与去除冷冻保护剂也会增加细胞的丢失率,导致实验的重复性差[16]。线性法加载与去除冷冻保护剂时,卵母细胞的体积也会出现先缩小后膨胀的变化趋势,但其变化明显小于分步法,最小收缩归一化体积和最大膨胀归一化体积分别为0.95±0.03、1.07 ±0.03,因而微流控线性法能够显著减小卵母细胞的渗透损伤。
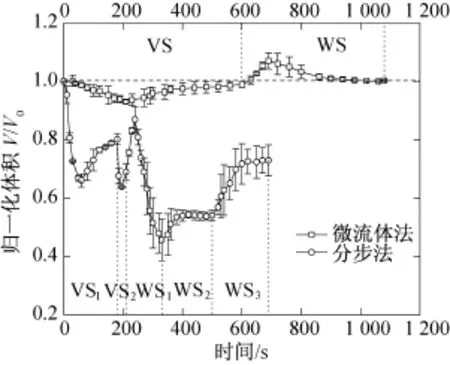
图3 微流控线性法与分步法添加与去除保护剂时猪MII期卵母细胞的体积变化Fig.3 Experimental MII porcine oocyte volumetric responses as CPAs were loaded and unloaded with the step⁃wise method and the microfluidic linear method
2.2 微流控线性法与分步法添加与去除低温保护剂对卵母细胞存活率与发育率的影响
表1所示为微流控线性法和分步法添加与去除低温保护剂后卵母细胞存活率与发育率的结果。由表1可知,分步法处理后细胞的存活率、卵裂率、囊胚率分别为79.4%、43.6%、9.7%。线性法处理后细胞的存活率与发育率都显著高于分步法,其中存活率、卵裂率、囊胚率依次提高了 15.9%、20.8%、9.7%,与对照组之间无显著性差异。这说明微流体装置用于卵母细胞低温保护剂添加与去除是有效的,能够显著减小细胞的渗透损伤,从而进一步提高细胞的存活率与发育潜能。Y.S.Song等[17]将微流体装置用于肝细胞低温保存的保护剂加载与去除过程,处理后细胞的存活率比一步法高25%,比两步法高10%,同时还指出微流体装置更适合应用于一些渗透敏感性的细胞,比如卵母细胞和胚胎干细胞。然而,对于微流体装置也存在不同的结论,N.Guan等[18]采用微流控装置连续加载并去除肝脏切片的冷冻保护剂,结果表明:连续法能够显著减小渗透压的变化速率,但是与分步法相比,其并不能改善肝脏切片的存活率。两者结论差异的原因可能是所用微流控装置结构和操作方法不同,另外,组织和细胞对保护剂的渗透特性也存在较大差异。

表1 微流控线性法和分步法添加与去除保护剂对猪MII期卵母细胞存活率与发育率的影响Tab.1 Effects of loading and unloading CPA with the step⁃wise method and the microfluidic linear method on the survival rate and developmental rate of MII porcine oocytes
注:a,b表示不同字母表示组之间有显著性差异,P <0.05。
3 结论
为了综合评价保护剂添加和去除联合过程对细胞的损伤程度,本文设计制作了一个适合卵母细胞低温保护剂连续添加与去除的微流体装置,研究了微流控线性法添加与去除低温保护剂时,卵母细胞的体积变化及对卵母细胞存活率与发育率的影响,并与传统的分步法进行了比较,主要结论如下:
1)采用微流控线性法加载与去除低温保护剂时,猪MII期卵母细胞的体积变化明显小于分步法,其中最小收缩归一化体积和最大膨胀归一化体积分别为0.95±0.03、1.07±0.03,说明线性法能够显著减小对卵母细胞的渗透损伤。
2)微流控线性法处理后细胞的存活率、卵裂率、囊胚率分别为95.3%、64.4%、19.4%,都显著高于传统的分步法(79.4%、43.6%、9.7%)(P<0.05)。
本文受上海市国家重点实验室(1N15301101)项目资助。(The project was supported by the National Key Laboratory of Shanghai(No.1N15301101).)
[1]Whittingham D G.Fertilization in vitro and development to term of unfertilized mouse oocytes previously stored at-196 degrees[J].Journal of Reproduction and Fertility,1977,49(1):89-94.
[2]Chen C.Pregnancy after human oocyte cryopreservation[J].Lancet(London,England),1986,327(8486):884-886.
[3]Karlsson J M,Szurek E A,Higgins A Z,et al.Optimization of cryoprotectant loading into murine and human oo-cytes[J].Cryobiology,2014,68(1):18-28.
[4]李维杰,周新丽,吕福扣,等.纳米低温保护剂提高卵母细胞玻璃化保存效果的机理初探[J].制冷学报,2014,35(1):114-118.(LI Weijie,ZHOU Xinli,LYU Fukou,et al.Preliminary study on the mechanism of promoting the survival rate of vitrified oocytes with nano-cryoprotectants[J].Journal of Refrigeration,2014,35(1):114-118.)
[5]Kuwayama M.Highly efficient vitrification for cryopreservation of human oocytes and embryos:The Cryotop method[J].Theriogenology,2007,67(1):73-80.
[6]Chian R C,Wang Y,Li Y R.Oocyte vitrification:advances,progress and future goals[J].Journal of Assisted Reproduction and Genetics,2014,31(4):411-420.
[7]李维杰,王利红,刘宝林,等.新型卵母细胞载体降温速率的实验研究[J].制冷学报,2016,37(1):114-118.(LI Weijie,WANG Lihong,LIU Baolin,et al.Experimental study on the cooling rate of a new type of oocyte carriers[J].Journal of Refrigeration.2014,37(1):114-118.)
[8]王欣,华泽钊,刘宝林,等.Me2SO浓度及预处理条件对组织工程化真皮活性的影响[J].上海理工大学学报,2007,29(4):311-314.(WANG Xin,HUA Zezhao,LIU Baolin,et al.Effects of Me2SO and loading conditions on the cell viability of tissue-engineered dermal replacement[J].Journal of University of Shanghai for Science and Technology,2007,29(4):311-314.)
[9]Clark N A,Swain J E.Oocyte cryopreservation:searching for novel improvement strategies[J].Journal of Assisted Reproduction and Genetics,2013,30(7):865-875.
[10]解政鼎,马学虎,艾丹亭,等.低温保护剂对神经干细胞球添加过程的模拟分析[J].化工学报,2013,64(11):3956-3967.(XIE Zhengding,MA Xuehu,AI Danting,et al.Analysis of cryoprotectant addition for neural stem cell sphere[J].Journal of Chemical Industry and Engineering,2013,64(11):3956-3967.)
[11]Mullen S E,Li M,Li Y,et al.Human oocyte vitrification:the permeability of metaphase II oocytes to water and ethylene glycol and the appliance toward vitrification[J]. Fertility and Sterility,2008,89(6):1812-1825.
[12]Heo Y S,Lee H J,Hassell B A,et al.Controlled loading of cryoprotectants(CPAs)to oocyte with linear and complex CPA profiles on a microfluidic platform[J].Lab on a Chip,2011,11(20):3530-3537.
[13]Mata C,Longmire E K,Mckenna D H,et al.Experimental study of diffusion-based extraction from a cell suspension[J].Microfluidics and Nanofluidics,2008,5(4):529-540.
[14]Wang X,Al Naib A,Sun D W,et al.Membrane permeability characteristics of bovine oocytes and development of a step-wise cryoprotectant adding and diluting protocol[J]. Cryobiology,2010,61(1):58-65.
[15]Wang L,Liu J,Zhou G B,et al.Quantitative investigations on the effects of exposure durations to the combined cryoprotective agents on mouse oocyte vitrification procedures[J].Biology of Reproduction,2011,85(5):884-894.
[16]Herrid M,Billah M,Malo C,et al.Optimization of a vitrification protocol for hatched blastocysts from the dromedary camel(Camelus dromedarius)[J].Theriogenology,2016,85(4):585-590.
[17]Song Y S,Moon S,Hulli L,et al.Microfluidics for cryopreservation[J].Lab on a Chip,2009,9(13):1874-1881.
[18]Guan N,Blomsma S A,van Midwoud P M,et al.Effects of cryoprotectant addition and washout methods on the viability of precision-cut liver slices[J].Cryobiology,2012,65(3):179-187.
Osmotic Injury to Porcine Oocytes during Cryoprotective Agents Addition and Removal Processes
Yang Yun1Zhou Xinli1Dai Jianjun2Zhang Defu2Yi Xingyue1Teng Yun1Tao Leren1
(1.Institute of Biothermal Technology,University of Shanghai for Science and Technology,Shanghai,200093,China;2.Animal and Veterinary Research Institute,SAAS,Shanghai,201106,China)
Oocyte cryopreservation has become a practical tool in assisted reproductive technology and fertility preservation.Cryoprotective agents(CPAs)addition and removal are essential steps during oocytes cryopreservation,however,the processes of CPAs addition and removal may cause fatal osmotic and toxic injuries to oocytes.In order to study the injuries of porcine MII-stage oocytes during CPAs addition and removal combined processes and minimize osmotic and toxic injuries to oocytes,primarily,a microfluidic device for continuous loading and unloading of CPAs was designed and fabricated in this study.CPAs were loaded and unloaded with the microfluidic linear method and the conventional step-wise method,respectively.Then,the cell volume changes and the effects on the survival rate and developmental potential of oocytes were investigated.The results showed that the oocyte volume changes with the microfluidic device were obviously less than step-wise method.The survival,cleavage and blastocyst rate of oocytes were 95.3%,64.4%,and 19.4%,respectively,which were significantly higher than the traditional step-wise method(79.4%,43.6%,and 9.7%)(P<0.05).In conclusion,microfluidic device can be used efficiently to load and unload of CPAs,and significantly reduce the osmotic shock to oocytes,which may open up a new path for oocyte cryopreservation.
cryopreservation;cryoprotective agents(CPAs);osmotic injury;oocyte
TB61+1;R318.52;Q27
:A
0253-4339(2017)03-0114-05
10.3969/j.issn.0253-4339.2017.03.114
周新丽,女,副教授,上海理工大学生物热科学研究所,(021)55270218,E-mail:zjulily@163.com。研究方向:生物材料的低温保存。现在进行的项目有:国家自然科学基金项目(51376132)——卵母细胞微流体低温保存过程的理论与实验研究。
国家自然科学基金(51376132)资助项目。(The project was supported by the National Natural Science Foundation of China(No. 51376132).)
2016年7月28日
About the corresponding author
Zhou Xinli,female,associate professor,Institute of Biothermal Technology,University of Shanghai for Science and Technology,+86 21-55270218,E-mail:zjulily@163.com.Research fields:cryopreservation of biomaterials.The author takes on project supported by the National Natural Science Foundation of China(No. 51376132):theoretical and experimental research on oocyte cryopreservation in microfluidic device.

