应用B超技术和激素测定诊断奶牛卵巢囊肿和排卵延迟的研究
高树,陈家发,徐天海,杨永强,吴世强,刘贤侠
(1.新疆天康生物技术股份有限公司,乌鲁木齐 830000; 2.新疆石河子大学动物科技学院,石河子 832003)
应用B超技术和激素测定诊断奶牛卵巢囊肿和排卵延迟的研究
高树1,陈家发1,徐天海1,杨永强1,吴世强1,刘贤侠2
(1.新疆天康生物技术股份有限公司,乌鲁木齐 830000; 2.新疆石河子大学动物科技学院,石河子 832003)
本文结合奶牛生产实践,通过运用B超和激素诊断对常见的两种卵巢疾病(卵巢囊肿和排卵延迟)进行综合诊断,总结出卵巢囊肿和排卵延迟常见的B超影像图及激素数据规律,为今后两种疾病的相关研究提供理论参考依据。
B超技术;激素测定;奶牛;卵巢囊肿;排卵延迟
目前制约奶牛场发展的“瓶颈”因素之一是奶牛的不孕症,该病作为奶牛场的四大疾病之一,卵巢囊肿和排卵延迟是引起不孕症发生的主要因素。据国外报道卵巢囊肿的发病率为6.7%~13.1%,排卵障碍引起的屡配不孕奶牛占整个不孕牛总数的30%~40%[1,2]。罗瑞卿等[3]对新疆857头成年奶牛调查发现,卵泡囊肿发病率为2.68%。卵巢囊肿包括卵泡囊肿和黄体囊肿,前者发病率占卵巢囊肿的75%,后者为25%。卵巢囊肿和排卵延迟主要通过延长产犊间隔以及增加配种的次数最终影响了奶牛正常的繁殖力,给奶牛业造成了严重的经济损失[4]。因此针对这两种卵巢疾病应及早发现,早诊断、早治疗才能降低该病的发病率,降低对奶牛业造成的经济损失。临床上诊断这两种卵巢疾病的常规手段是临床症状结合直肠检查,但应用直肠检查存在两个问题,一是卵泡囊肿和黄体囊肿通过直肠检查准确率只有50%;二是排卵延迟与不排卵诊断错误。B超探头做出的是二维断面图像,应用B超扫查对卵巢囊肿和黄体囊肿的诊断准确率可以达到80%以上,同时也能提高排卵延迟诊断的准确性。另外,通过测定患病牛血清中P4和E2的浓度也是鉴别卵泡囊肿和黄体囊肿的一种有效手段。据报道,运用B超诊断技术结合清中P4和E2的浓度可使卵泡囊肿和黄体囊肿诊断的准确率达到85%左右[5,6]。本试验通过查阅繁殖资料、观察临床症状、应用直肠检查结合B超检查、激素检测的方法对卵巢囊肿和排卵延迟进行综合诊断,建立卵巢囊肿和排卵延迟的B超声像图谱,从而为今后这两种疾病的诊治奠定基础。
1 材料与方法
1.1 试验动物
选自新疆西部牧业股份有限公司牛场、奎屯澳利亚牧业有限公司牧场、克拉玛依绿成农业开发有限责任公司牛场未孕荷斯坦母牛。选取的试验牛无传染病、寄生虫病及其他疾病(子宫炎、蹄病、乳房炎等),统计试验奶牛的耳号、胎次、产犊日期、发情与配种记录、产奶量、体况评分。试验牛场饲养规范,无结核、布病,牛场饲养方式全部为散栏饲养,采用全混合日粮(total mixed ration,TMR)饲喂。
1.2 试验仪器与试剂
1.2.1 试验仪器
50s型Tringa Vet 便携式兽用线阵B超扫描仪,配备3.5/5.0MHz变频凸阵探头和5.0~7.5MHz变频线阵探头,荷兰Piemed ICAL公司生产,配备Ni-MH 12V充电电池各1个,2215型NiCd/NiMH charger各1个,另外有配套的50s Tringa communication software version 1.0图像处理软件ODTCOMM和双向红外传输接口,Power Wave X32 BioTekB酶标仪,美国BioTek公司生产。1.2.2 试验试剂
耦合剂:天津市南开区华科医疗器械厂生产的AB-1型医用超声耦合剂,规格250g;牛雌激素ELISA试剂盒,灵敏度1pg/mL,产品编号E11E0023;牛孕酮ELISA试剂盒,灵敏度0.1ng/mL,产品编号E11P0200;以上产品均购自于上海蓝基生物技术有限公司。
1.3 奶牛卵巢疾病B超诊断的操作方法使用颈夹对奶牛进行普通保定,B超扫查前排除直肠内宿粪,初步判断两侧卵巢的位置,探头上涂抹超声耦合剂后送入直肠,至骨盆入口前后向下呈45°~90°进行扫查;用手指将卵巢略微固定,然后将探头轻靠在一侧卵巢上方,对卵巢进行扫描,观察实时图像,当显示出卵泡或黄体的最大直径切面图像后,按下冻结键。通过B超仪内置电子标尺对卵泡或黄体的纵径、横径等指标进行测量,并保存图像,之后将超声图像保存到电脑上备用。
1.4 血样采集与保存
试验奶牛在B超诊断后,每头颈静脉采血10mL,静置数小时后析出血清并对应牛号进行标注,保存于-20℃冰箱待测,同时选取10头正常发情奶牛作为对照组,颈静脉采血10mL,处理同上。
1.5 奶牛卵巢囊肿血清中雌激素和孕酮测定的方法
先取出试剂盒,于室温(2 0~2 5℃)放置15~30min。试验过程应在室温(20~25℃)内进行。然后取出酶标板,按照标准品的次序分别加入100μL的标准品溶液于空白微孔中。空白微孔中加入100μL的血清,空白对照加入100μL的蒸馏水。在各孔中加入50μL的酶标记溶液(不含空白对照孔)。将酶标板用封口胶密封后,37℃孵育反应1h(在孵育箱中保持稳定的温度与湿度)。充分清洗酶标板5次,保持各孔有充足的水压(浓缩洗涤液以1∶100的比例与蒸馏水稀释)。酶标板洗涤后用吸水纸彻底拍干。各孔加入显色剂A、B液各50μL。20~25℃下避光反应10min。各孔加入50μL终止液,终止反应。
采用优化切削工艺参数A2B3C3和A3B3C3再次进行铣削实验,对本文优化方法进行验证,结果如表9所示。由表9中表面粗糙度测量结果可见,以逆铣区域或顺铣区域作为优化目标可取得更均匀的优化效果。
1.6 奶牛卵巢囊肿和排卵延迟的诊断方法
1.6.1 奶牛卵巢囊肿的诊断
临床症状:表现为频繁或持续发情或者不发情,部分发病时间长的奶牛尾根高抬,尾根与坐骨结节之间出现深的凹陷,阴门排出黏液[7]。
直肠检查:囊肿卵泡壁较薄,呈单个或多个存在于一侧或两侧卵巢上,卵泡有波动感。多次直肠检查发现囊肿交替发育或者大卵泡持续存在,但不排卵,子宫角松软不收缩。
B超探查:在同一卵巢相同部位上持续10d以上,声像图表现为圆形或卵圆形规则的无回声液性暗区,暗区直径明显大于成熟卵泡,存在1个或多个直径超过25mm的大卵泡,囊肿壁厚度小于3mm[8,9]。黄体囊肿壁呈现为高强回声的光环或光带,壁厚大于3mm,并且黄体囊肿组织的边界不如卵泡囊肿的边界规则。
激素诊断:通过测定患病奶牛血清中E2和P4的浓度,根据相关的理论[10,11],当E2/P4>1,血清中P4的浓度<1ng/mL时一般属于卵泡囊肿;当E2/P4<1,血清中P4的浓度>1ng/mL时则属于黄体囊肿。
1.6.2 奶牛排卵延迟的诊断查阅繁殖记录:多次正常发情和人工授精但未妊娠。临床症状[7]:外表发情症状和正常发情一样,但发情的持续期延长。
直肠检查[7]:发情期检查卵巢和子宫无明显的疾患,卵巢上有卵泡存在,大小正常,人工授精后次日检查成熟卵泡未排卵。
B超检查:人工授精后次日在同一卵巢部位成熟卵泡大小和位置基本未发生变化,声像图显示低回声液性暗区。
2 结果与分析
2.1 卵巢囊肿和排卵延迟奶牛的诊断结果
通过运用常规方法结合B超在排除子宫疾病和其他疾病的基础上共诊断出卵巢囊肿奶牛70例,排卵延迟奶牛60例,其中卵泡囊肿54例,黄体囊肿16例,在诊断出卵泡囊肿奶牛中其中1例为双侧单个囊肿卵泡,1例为单侧多个囊肿卵泡,详见表1。
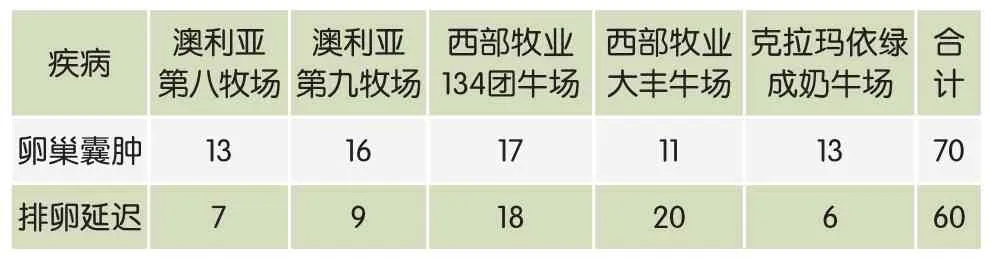
表1 卵巢囊肿和排卵延迟奶牛的诊断结果 单位:头
2.2 奶牛卵巢疾病的典型B超图像
2.2.1 奶牛卵巢囊肿的典型B超图像
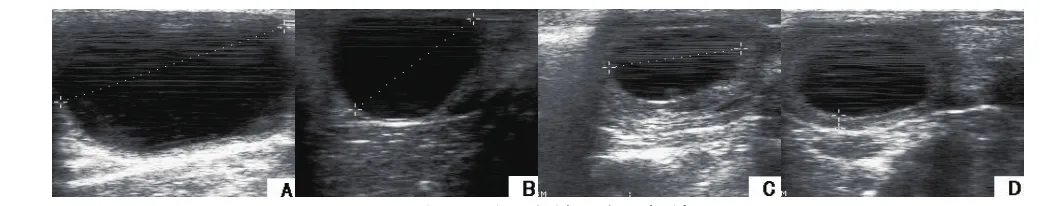
图1 卵巢囊肿的B超声像图A:直径61.1mm的卵泡囊肿声像图; B:直径39mm的卵泡囊肿声像图C、D:直径34.1mm、壁厚3.9mm的黄体囊肿声像图
图1中A、B分别为澳利亚公司第八牧场6217号奶牛和克拉玛依绿城牛场0586号奶牛卵泡囊肿的B超声像图,声像图显示囊肿卵泡为无回声液性暗区,卵泡直径大于正常卵泡直径,卵泡内为一圆形无回声液性暗区,卵泡壁较薄,厚度小于3mm,边界整齐而光滑。
图1中C、D为西部牧业134团牛场8125号奶牛黄体囊肿的B超声像图,声像图显示卵巢表面回声光滑, 囊内出现液体暗区,内部可见棉纱样回声或形态不规则的光团,内壁不光滑,出现低淡光点,外层回声较强,囊肿壁厚度大于3mm。

图2 排卵延迟的B超声像图E~H:直径为18.9 mm、20 mm、20.8 mm、22.7 mm的卵泡声像图
2.2.2 奶牛排卵延迟的典型B超声像图图2中E~H为澳利亚公司第九牧场6002号、1003号奶牛和西部牧业大丰牛场080024号、03207号奶牛排卵延迟的B超声像图,声像图特征显示卵泡壁呈强回声,边界清晰、光滑,卵泡呈低回声液性暗区,本试验中排卵延迟奶牛卵泡的直径范围为15.5~22.7mm。
2.3 奶牛卵巢囊肿血清中雌激素和孕酮测定的结果

表2 激素标准曲线方程的相关系数
图3 P4和E2激素的标准曲线
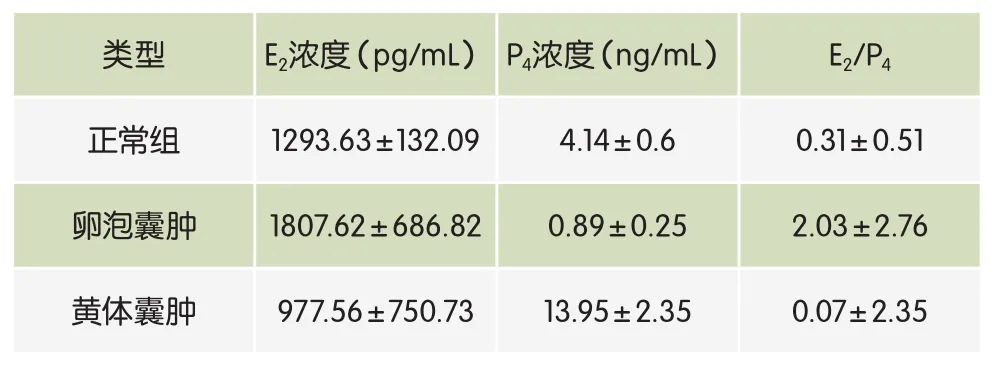
表3 卵泡囊肿和黄体囊肿奶牛血清中E2和P4的浓度
由表3可知,本试验中卵泡囊肿奶牛血清中E2与P4的浓度分别为1807.62±686.82pg/mL、0.89±0.25ng/ mL,E2与P4的浓度之比为2.03±2.76。黄体囊肿奶牛血清中E2与P4的浓度分别为977.56±750.73pg/mL、13.95±2.35ng/mL,E2与P4的浓度之比为0.07±2.35。以上数据均符合激素诊断的相关理论。
3 讨论
3.1 卵巢囊肿奶牛的诊断
卵巢囊肿主要包括卵泡囊肿和黄体囊肿,卵泡囊肿是指卵巢卵泡直径大于25mm,持续存在时间超过10d或更长时间,同时卵巢上无正常黄体结构的一种病理性状态,主要由于卵泡上皮变性、卵泡壁结蹄组织增生变厚,卵母细胞死亡,卵泡液未被吸收或者增多引起,黄体囊肿是由于未排卵的卵泡壁上黄体化而引起[7]。一般情况下卵泡囊肿和黄体囊肿很难通过直肠检查做出准确的判断,研究显示直肠检查的准确率只有50%[12,13]。B超诊断技术是一项诊断卵泡囊肿与黄体囊肿值得信赖的手段,主要根据卵泡囊肿与黄体囊肿的B超声图像进行鉴别诊断:(1)卵泡囊肿腔内液体声像图为均匀的液性暗区,而黄体囊肿腔内部可见棉纱样回声或形态不规则低淡光点。(2)卵泡囊肿壁呈线状或环状中等回声或强回声,卵泡壁薄,厚度小于3mm,黄体囊肿壁呈现为高强回声的光环或光带,壁厚大于3mm,并且黄体囊肿组织的边界不如卵泡囊肿的边界规则[9,14]。(3)黄体囊肿内有特殊的结构——小梁,小梁超声影像为线状强回声,有时是单一的一条白线,有时是交织的网状结构,可以从结构上进行区别卵泡囊肿和黄体囊肿[11]。根据卵泡囊肿和黄体囊肿黄体化的程度不同,本研究测定的病牛血清中E2与P4的浓度之比,和Braw-Tal[10]等报道的E2与P4的浓度之比10.8±2.3存在一定的差距,可能和激素测定的方法、试剂盒的选择有关;黄体囊肿奶牛E2与P4的浓度之比和Braw-Tal[10]等报道的0.07±0.02基本一致。
3.2 排卵延迟奶牛的诊断
排卵延迟属于卵巢机能不全或排卵障碍,指在发情时有外表症状,但不出现排卵,在牛上时有发生。动物的正常排卵是在下丘脑-垂体-卵巢轴的相互调节下进行的[15],排卵前成熟卵泡分泌大量的雌激素通过正反馈诱发排卵前LH峰的出现。所以排卵延迟往往与LH脉冲释放减少或不及时有关,也可能与雌激素合成受阻及某些排卵活性降低有关。本文中的患牛产奶量平均为26.24±3.16kg/d,多数为高产奶牛,泌乳产生大量催乳素,造成脑垂体前叶抑制LH的分泌,同时降低了卵巢LH的正常反应,进而影响卵泡的正常排卵。另外,饲养管理不当、应激和遗传也是导致奶牛排卵延迟的重要原因。该疾病主要通过直肠检查和B超诊断,和其他卵巢疾病相比,排卵延迟奶牛外部发情症状正常,直肠检查卵巢和子宫无异常,但发情持续的时间比正常奶牛要长,通过查阅繁殖记录对发情配种正常但未受孕的奶牛在下次实施人工授精后10~12h进行直肠检查和B超扫查,如卵泡仍然存在并且B超声像图上显示为低回声液性暗区,卵泡直径大小和位置也基本未变,连续跟踪检查最终卵泡会发生排卵,由此可诊断为排卵延迟。但需要与不排卵进行鉴别诊断[7],虽然二者都属于排卵障碍范畴,并且临床症状比较相似,不排卵的奶牛是在卵泡发育到最大体积时不发生排卵[16]。据Bat对排卵延迟的诊断是指奶牛出现发情后,发情卵泡存在的时间超过4d,并且在下一发情周期的中期有成熟的黄体生成,可诊断为排卵延迟。而不排卵是指在奶牛出现发情后,发情的卵泡存在的时间超过4d以上,但在下一发情周期的中期无成熟的黄体生成,即可诊断为不排卵[17]。
[1] Lopezgatius F, Santolaria P, Yaniz J, et al. Risk factors for postpartum ovarian cysts and their spontaneous recovery or persistence in lactating dairy cows[J].Theriogenology, 2002,58:1623-1632.
[2] Nakada K. How to improve reproductive efficacy from now in Japan? Find out the factors of late lactation to predict postpartum reproductive diseases[J]. Reprod and Dev, 2006,52(1):177-183.
[3] 谷新利,罗瑞卿,杨光,等. 奶牛卵泡囊肿与持久黄体发病规律调查[J].新疆农垦科技:2009,5:26-27.
[4] Kinsel ML, Etherington WG. Factors affecting reproductive performance in Ontario dairy herds[J].Theriogenology, 1998,50:1221-1238.
[5] Farin PW,Youngquist RS, Parfet JR, et al. Diagnosis of luteal and follicular ovar-ian cysts by palpation per rectum and lineararray ultrasonography in dairy cows[J]. Am Vet Med Assoc, 1992,200:1085-1089.
[6] Douthwaite R, Dobson H. Comparison of different methods of diagnosis of cystic ovarian disease in cattle and an assessment of its treatment with a proges-terone-releasing intravaginal device[J].Vet Rec, 2000,147:355-359.
[7] 赵兴绪.兽医产科学[M].第4版,北京:中国农业出版社, 2009:403-406.
[8] Garverick HA. Ovarian follicular cysts in dairy cows [J]. Dairy Sci,1997,80:995-1004.
[9] 高树,刘贤侠,王少华,等.奶牛常见卵巢疾病性不孕的B超影像学研究[J].黑龙江畜牧兽医,2011,11:35-38.
[10] R.Braw-Tal,S.Pen,Z.Roth.Ovarian cysts in high-yielding dairy cows [J]. Theriogenology,2009,72:690-698.
[11] Pieterse, M. C. Ultrasonic characteristics of physiological structures on bovine ovaries. In Diagnostic Ultrasound and Animal Reproduction, eds. M.M. Taverne & A.H. Willemse. Kluwer Academic Publisher,1989, 44.
[12] Douthwaite R, Dobson H. Comparison of different methods of diagnosis of cystic ovarian disease in cattle and an assessment of its treatment with a progesterone releasing intravaginal device[J].Veterinary Record,2000,147:355-359.
[13] Farin PW,Youngquist RS, Parfet JR, et al. Diagnosis of luteal and follicular ovarian cysts by palpation per rectum and linear-array ultrasonography in dairy cows[J]. Am Vet Med Assoc,1992,200:1085-1089.
[14] Karin Mueller MVSc DCHP MRCVS.Cyst ovarian and disease in cows diagnosis and treatment decision[J].UK Vet,2007,13(1):46-51.
[15] Brunton P J, Arunachalam S, Russel J A. Control of neurohypophysial hormone secretion, blood osmolality and volume in pregnancy[J]. Physiol Pharmacol, 2008,59(8):27-45.
[16] Aris J,Scott TN .Use of a GnRH agonist to delay the ovulation and injection of hCG to induce ovulation in goats superstimulated with FSH [J].Sain Vet,2003,21(1):1-5.
[17] F.A. Bhat,H.K.Bhattacharyya.Oestrus Duration and Status of Reproductive Organs in Repeat Breeding Cows [J]. Animal Science Applied of Iranian Journal,2012,2(3):295-299.
S823.3
A
1004-4264(2017)05-0020-04
10.19305/j.cnki.11-3009/s.2017.05.006
2017-03-20

