稳定过表达生长分化因子5基因大鼠脂肪干细胞系的建立
王会仁, 曹 露, 江立波, 林 红, 李熙雷, 董 健
复旦大学附属中山医院骨科,上海 200032
·论 著·
稳定过表达生长分化因子5基因大鼠脂肪干细胞系的建立
王会仁, 曹 露, 江立波, 林 红, 李熙雷, 董 健*
复旦大学附属中山医院骨科,上海 200032
目的: 探讨慢病毒介导的稳定过表达生长分化因子5(GDF-5)基因大鼠脂肪干细胞(ASCs)的构建条件和方法。方法: 取大鼠腹股沟脂肪垫组织,采用Ⅰ型胶原酶消化贴壁法分离培养大鼠ASCs。倒置相差显微镜观察细胞形态,CCK-8法测定细胞生长曲线,流式细胞仪鉴定细胞表型。制备带GDF-5/GFP融合基因的慢病毒载体系统,探索不同感染复数(MOI=1、5、10、20、40、60、80、100)的转染效率,选择最佳MOI,采用流式细胞仪检测转染效率。对转染细胞行流式细胞筛选,测定筛选后转染细胞的阳性率。筛选出的细胞行细胞爬片,DAPI染色,形态学上进一步验证细胞阳性率;并采用CCK-8法检测转染后细胞活力。结果: 成功培养大鼠ASCs,流式细胞免疫表型鉴定:间充质干细胞表面抗原(CD90、CD29、CD44、CD105)表达阳性,造血细胞表面抗原(CD45、CD34)和骨髓干细胞表面抗原(CD106)表达阴性。成功构建GDF-5过表达慢病毒载体系统,慢病毒转染大鼠ASCs最佳MOI为40,转染率为65%。采用GFP荧光流式细胞筛选技术筛选后阳性率可提高至96%。CCK-8法显示,转染后细胞活力、生长曲线与未转染细胞无明显差异。结论: 胶原酶消化法可成功培养大鼠ASCs,流式细胞筛选技术可显著提高转染细胞阳性率,且对细胞系活力无显著影响。
脂肪干细胞;慢病毒;生长分化因子5;转染
椎间盘退变重要的原因是椎间盘髓核细胞退变及细胞外基质(extracellular matrix, ECM)成分的改变[1]。补充髓核细胞数目和提高细胞活力是抗椎间盘退变的关键。脂肪来源干细胞(adipose-derived stem cells,ASCs)与髓核细胞同发生于中胚层,具有同源性,与骨髓间充质干细胞(BMSCs)相比,可避免骨髓取材带来的诸多问题[2]。多种细胞因子,如转化生长因子(TGF-β)、骨形态发生蛋白(BMPs)、胰岛素样生长因子(IGF-1)、Sox-9、生长分化因子 5(growth differentiation factor-5,GDF-5)等被证实具有促进蛋白多糖和Ⅱ型胶原合成的作用,其中GDF-5对椎间盘髓核细胞的促进增殖和改善活力最为显著[3]。但GDF-5是水溶性诱导因子,半衰期相对较短,且易扩散。通过基因转染使负责表达诱导因子的基因转入靶细胞中,使其持续表达,产生相应的诱导因子,从而达到持续诱导作用。
慢病毒作为一种高效稳定的转录载体系统,常被用于建立稳定表达特定蛋白因子的细胞系[4]。但目前GDF-5基因慢病毒载体转染ASCs效率和稳定性不高。因此,本研究进一步利用GDF-5与绿色荧光蛋白(green fluorescent protein,GFP)组成嵌合基因,通过流式细胞筛选技术筛选出稳定转染的阳性细胞,建立GDF-5基因高纯度稳定转染细胞系,为后续研究奠定基础。
1 材料与方法
1.1 主要材料、试剂及器材 清洁级2个月龄SD大鼠(复旦大学动物实验部),Ⅰ型胶原酶、L-DMEM、胎牛血清(Gibco,美国),青、链霉素(上海国药集团),CCK-8(日本同仁化学研究所),0.25%胰酶-EDTA消化液(Sigma,美国),过表达GDF-5基因慢病毒载体系统(上海吉凯生物基因公司构建),FITC同型对照抗体、PE同型对照抗体(BioLegend,美国),CD29、CD45、CD90抗体(BioLegend,美国),CD44抗体(eBioscience,美国), CD34抗体(Novus Biologicals,美国),CD105抗体(Bioss Inc.,美国),CD106抗体(Raybiotech,美国),CO2培养箱(NAPCO,Model 5410),DL-5型低速离心机(上海安亭科学仪器厂),倒置相差显微镜(CKX31;Olympus,日本),正置荧光显微镜(BX41;Olympus,日本),流式细胞仪FACSclibur(Becton Dickinson公司,美国)。
1.2 大鼠脂肪来源干细胞(ASCs)的分离与培养 参照文献[5],采用胶原酶消化贴壁培养法培养大鼠ASCs。2个月龄SD大鼠无菌条件下取腹股沟脂肪组织,剔除筋膜和毛细血管,PBS液冲洗,剪碎至糊状,0.1%Ⅰ型胶原酶溶液消化。滤网过滤消化液,收集滤液,离心,弃上清。将细胞接种于L-DMEM培养基(含10%胎牛血清,青霉素100 U/mL,链霉素1 mg/mL)培养瓶(25 cm2)中,置于37℃、5%CO2、95%湿度的培养箱中培养。每2~3 d换液1次,待细胞融合成单层后传代培养。在倒置相差显微镜下观察细胞情况。细胞生长融合至80%~90%时可进行传代。按照说明书方法采用CCK-8法检测细胞生长曲线。
1.3 细胞表型鉴定 取第3代生长接近融合的细胞,用PBS溶液洗涤细胞2次,0.25%胰蛋白酶消化,收集细胞。每个样品收集细胞数量约1×106,离心,PBS洗涤细胞。细胞重悬,在细胞沉淀中(细胞数量约1×106)分别加入PE-CD44荧光抗体、FITC-CD29荧光抗体、FITC-CD105荧光抗体、FITC-CD90荧光抗体、FITC-CD45荧光抗体、FITC-CD34荧光抗体、FITC-CD106荧光抗体及同型对照抗体,各2 μL,37℃温箱中孵育30 min。再离心,PBS缓冲液清洗,重复2遍洗去残存的未与细胞结合的抗体。最后沉淀加入100 μL预冷的PBS,摇匀使细胞重悬。上机测定抗原的阳性率。
1.4 慢病毒转染ASCs的最适感染复数(MOI)的确定 慢病毒转染前24 h,将第2代ASCs以1×105/孔铺到24孔板中。细胞接种后第2天,观察细胞形态,若细胞形态良好,用含有6 μg/mL polybrene的2 mL新鲜不含血清的L-DMEM培养基替换原培养基,加入不同浓度的病毒液(MOI分别为1、5、10、20、40、60、80、100)。置培养箱中继续培养。继续培养24 h后,用新鲜L-DMEM全培养基替换含有病毒的培养基,继续培养。转染后96 h,荧光显微镜下观察细胞荧光情况,选取荧光最佳时的MOI的病毒液在培养瓶中感染ASCs。96 h后流式细胞仪检测转染效率。
1.5 流式细胞仪筛选转染后细胞 按照BD公司流式细胞仪FACSclibur细胞筛选操作说明进行。准备足量的无菌PBS(约3 L)和去离子水(约10 L)。细胞收集区、上样区及管道先行消毒,调整机器参数:Precision Mode设置为purify,Target Events设置为continuous,获取速度为每秒2 000~4 000 events,调节drop delay,使屏幕左边方框中的数值为98%以上。转染后的ASCs胰酶消化、离心、洗涤后,加1 mL PBS重悬,转入无菌流式细胞仪试管,上机进行筛选。装有3 mL L-DMEM完全培养基的无菌离心管作为接受管。筛选完毕后,进行流式细胞检测。筛选后细胞按5×104/mL细胞密度接种。置于37℃、5%CO2、95%湿度的培养箱中培养。8 h后换液去除未贴壁细胞。筛选后细胞爬片,DAPI染色,荧光显微镜下观察细胞荧光情况。
1.6 Real-time PCR检测 GDF-5基因转染后表达效果 细胞分为两组,ASCs-GDF-5组:流式细胞仪筛选后转染GDF-5/GFP嵌合基因的ASCs;ASCs-GFP组:作为空白对照,只转染GFP,不转染GDF-5基因。根据Invitrogen公司的TRIzol操作说明书进行总RNA抽提,RNA反转录获cDNA,置于-80℃保存备用。应用Primer 5.0,设计检测基因引物,内参基因为β-actin。分别检测6个样本,每个样本重复3次,进行结果分析。β-actin引物序列,F:5′-GTA AAG ACC TCT ATG CCA ACA-3′,R:5′-GGA CTC ATC GTA CTC CTG CT-3′;GDF-5引物序列F:5′-GGT CAC AGC GGC AGA TAA-3′,R:5′-CCG AAC ATA CGA TTG GGT-3′。
1.7 统计学处理 采用SPSS 19.0(IBM SPSS公司,USA)统计软件,组间比较采用t检验。检验水准(α)为0.05。
2 结 果
2.1 倒置相差显微镜下观察大鼠ASCs 形态 倒置相差显微镜下见培养的大鼠ASCs细胞传代前已达90%融合,见细胞呈纺锤形或短梭形,有一定极性,细胞排列成螺旋形(图1)。ASCs体外可正常传代至少5代。
2.2 CCK-8法测定ASCs生长曲线 结果(图2)表明:P1、P3、P5ASCs细胞生长曲线相似,均为“S”型,细胞在接种当天处于适应期,接种后1 d进入加速生长期,接种后2 d为对数生长期,3 d为减速生长期,4 d后进入平台期。因此采用细胞数1∶2~1∶3传代时,可在第3天再次传代。

图1 倒置相差显微镜下观察第3代大鼠ASCs
B为A虚线方框内的放大观. Original magnification: ×100(A);×200(B)
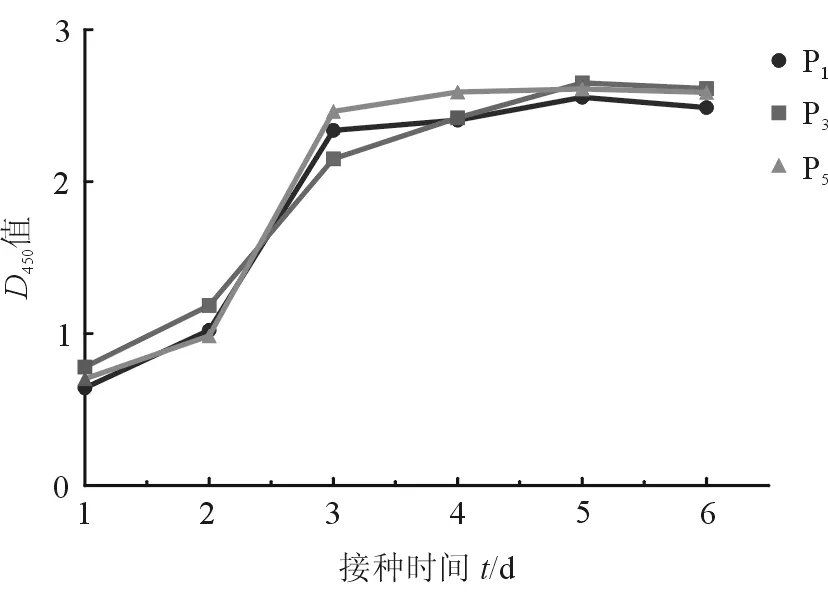
图2 CCK-8法测定细胞生长曲线
2.3 流式细胞仪检测ASCs细胞表型 细胞表型鉴定结果(图3)表明:间充质干细胞标志物CD90、CD29、CD44、CD105表达呈阳性,而造血干细胞标志物CD45、CD34和骨髓干细胞标志物CD106呈阴性。各种标志物表达率分别为:CD90 96.76% 、CD29 95.12% 、CD44 95.67% 、CD105 88.42%、 CD45 4.62% 、CD34 4.86% 、CD106 4.93%。
2.4 不同MOI慢病毒转染96 h后荧光表达情况 倒置荧光显微镜观察结果(图4)表明:当MOI=1时,ASCs几乎无荧光;MOI=5时,少许ASCs表达GDF-5,并且荧光强度较弱;MOI=10时,阳性ASCs数目和荧光强度均增加;当MOI=20时,荧光强度和阳性ASCs数仍在增加;当MOI=40时,荧光强度和阳性细胞数显著增加,并且阳性细胞仍保持了纺锤形或短梭形形态,细胞融合后呈螺旋形排列,细胞活力好;当MOI=60时,荧光强度和阳性细胞数无明显增加;当MOI=80和MOI=100时,转染的ASCs形态发生改变,死亡细胞增多,且阳性细胞数和荧光强度无明显增加。结果提示,MOI=40时,慢病毒转染大鼠ASCs的转染率较高。流式细胞仪测定MOI=40时的转染率,结果(图5)可见,流式细胞图呈双峰,表明流式细胞仪检测有效,但转染率为65.3%,远低于稳定转染阳性率要求。
2.5 流式细胞仪筛选建立稳定转染ASCs 单纯慢病毒转染大鼠ASCs效率仅为65%,达不到后续实验要求,利用转染后ASCs自发绿色荧光,可使用流式细胞仪筛选技术对其筛选(fluorescence activated cells sorting,FACS),提高转染细胞纯度。筛选后传代细胞爬片的DAPI复染后,荧光照片可见转染后表达GFP-5的ASCs比例接近100%,细胞形态形态良好,仍为纺锤形或短梭形,螺旋形排列;流式细胞仪检测示转染率高达96%(图6)。

图3 流式细胞仪检测培养的ASCs细胞表型图

图4 不同MOI慢病毒转染96 h后ASCs GDF-5表达情况
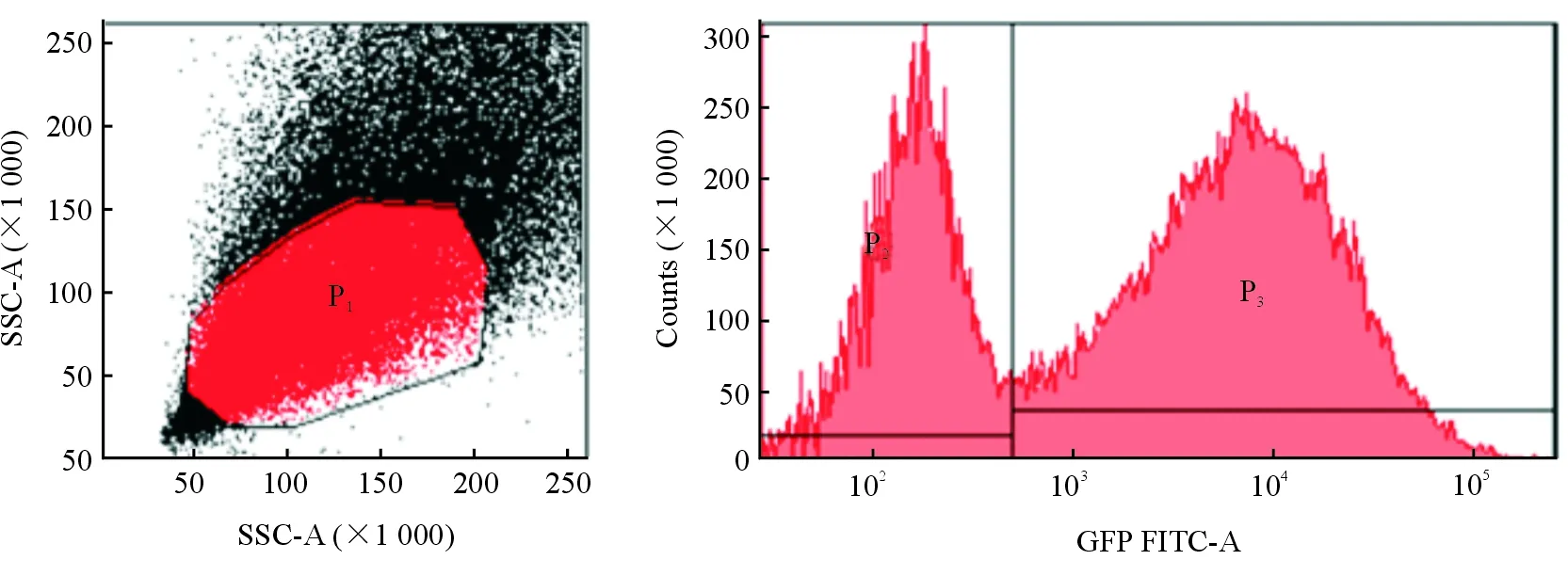
图5 流式细胞仪测定MOI=40时转染率
2.6 流式细胞仪筛选后转基因ASCs的光镜下形态观和细胞生长曲线测定 流式细胞仪筛选转基因ASCs后,于细胞接种第3天在倒置相差显微镜下观察细胞形态,可见细胞形态无明显变化,仍呈纺锤形,有细胞极性,细胞生长状况良好,视野内无明显死细胞或异型细胞(图7A)。CCK-8法测定筛选后细胞生长曲线,并与非转染细胞生长曲线作对比,可见筛选后的细胞(ASCs-GDF-5组)与未转染细胞(ASCs组)生长曲线无明显改变,筛选后细胞生长曲线仍呈“S”型,在接种后第2天进入对数生长期,接种后第3天,进入减速生长期,第4天后进入平台期(图7B)。结果表明经慢病毒转染及流式细胞仪筛选后,细胞活力和生长未造成明显影响。

图6 筛选后传代细胞DAPI复染免疫荧光染色及流式细胞仪鉴定
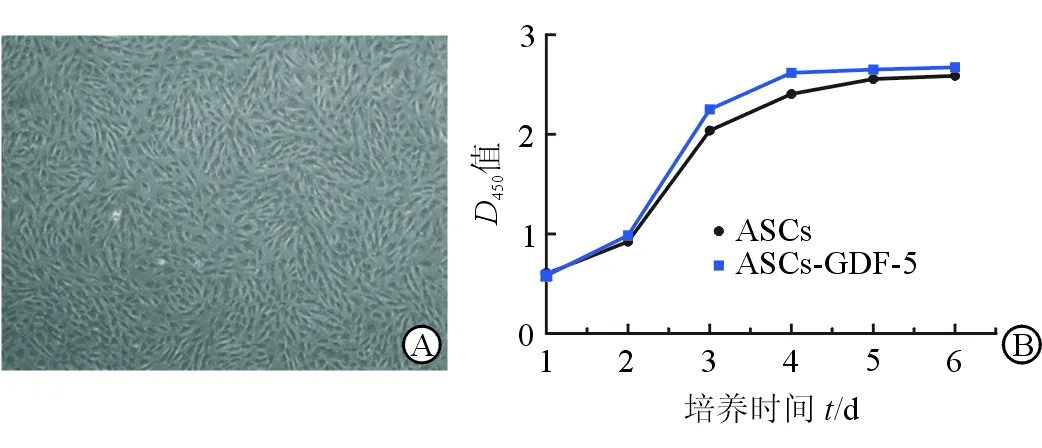
图7 转基因ASCs光镜观察及CCK-8法测定细胞生长曲线
A:转基因ASCs第3天光镜照片;B:CCK-8法测定筛选后转染细胞与非转染细胞生长曲线. Original magnification:×100(A)
2.7 Real-time PCR检测5代后ASCs-GDF-5的GDF-5基因表达 结果(图8)表明:ASCs-GDF-5组的GDF-5基因的转录水平较未转染组升高了约20倍,差异有统计学意义(P<0.001)。结果提示目的转录的GDF-5基因表达有效,成功建立稳定过表达GDF-5基因的ASCs。

图8 Real-time PCR检测结果n=3,
3 讨 论
椎间盘退变的病理生理机制复杂。椎间盘内髓核细胞数目减少、活力降低,引起细胞外基质,如Ⅱ型胶原、蛋白聚糖等合成减少和成分改变,是导致椎间盘退变的病理基础[1]。研究[6]表明,在退变腰椎间盘中,髓核细胞的凋亡率达(61.3±24.5)%,而正常椎间盘中髓核细胞凋亡率仅为(5.6±6.8)%。因此,补充细胞数目,改善细胞活力,是治疗退变性椎间盘疾病的关键。
ASCs是一种极具前景的应用于修复椎间盘退变的种子细胞, 具有取材方便、来源充分、分离容易,扩增速度快的优点[5, 7-10]。与骨髓基质干细胞相比,ASCs在骨科临床应用中有较大优势,可避免骨髓取材带来的诸多问题。而且体外大量实验也证实,脂肪来源干细胞可以转化为髓核样细胞[11-12]。研究还发现,脂肪来源间充质干细胞分化为髓核细胞在细胞表型检测上优于传统的骨髓间充质干细胞[11]。本研究中采用脂肪组织块酶消化贴壁法成功培养了大鼠ASCs,经CCK-8方法测定,培养的ASCs活力好、增殖快,在体外培养5代时细胞形态和细胞活力无明显改变。流式细胞仪鉴定细胞表面抗原标志物也表明,培养的ASCs间充质干细胞表面标志物(CD90、CD29、CD44、CD105)表达呈阳性,而造血干细胞标志物(CD45、CD34)表达阴性,排除了造血干细胞污染的可能,同时骨髓间充质标志物CD106表达阴性,也排除了骨髓来源可能。这与文献[7,12-13]报道类似。通过胶原酶消化脂肪组织贴壁法虽然可获得脂肪多能干细胞,但其实是混合细胞群,主要为ASCs,同时还有极少量的造血细胞、内皮细胞、平滑肌细胞和周围细胞,但随着不断传代,这些混杂的非间充质干细胞类型细胞会消失,尤其是造血细胞和内皮细胞。本研究培养的ASCs经流式细胞仪鉴定表明非间充质干细胞类型较少,可能是以下原因:在取材过程中尽可能减少血液污染脂肪组织标本,PBS液反复冲洗脂肪组织块,显微镜下尽可能将脂肪组织中的血管和筋膜组织剔除干净。
虽然多项研究表明,ASCs具有分化为髓核样细胞的能力,但寻找合适的诱导因子对ASCs定向分化过程极为重要。在多个细胞因子中GDF-5对椎间盘髓核细胞的促进增殖和改善活力最为显著[3,14-15]。此外,GDF-5还可促进蛋白多糖和Ⅱ型胶原的生成,同时提高髓核和纤维环细胞增生活力[14]。Walsh等[15]发现,GDF-5主要作用于内层纤维环细胞,并可使其向髓核细胞方向分化。用GDF-5处理人退变髓核细胞可以增强蛋白聚糖和Ⅱ型胶原的表达[16]。更值得一提的是,GDF-5作用于人间充质干细胞后,不表达成骨细胞表型,因此不必担心成骨问题[17]。因此,相比较其他细胞因子,GDF-5可能会成为临床上应用生物方法抑制或逆转椎间盘退变的一种理想细胞因子。
细胞因子直接注射于椎间盘髓核内进行修复存在一定的弊端,如:直接注射到退变髓核内,在未与退变细胞有机结合之前有些细胞因子已经渗漏出来;这些蛋白有半衰期,不能起到长期作用效果,需要反复注射,会大大增加椎间盘退变的风险。借助载体可在退变椎间盘内持续表达细胞因子,因此转基因技术治疗成为了热点[18]。慢病毒载体近年来在肿瘤治疗研究、转基因动物制作、蛋白生产及疫苗开发中得到了广泛应用。慢病毒载体具有转移基因片段容量大、无毒性且不易诱发宿主免疫反应,安全性较好,不仅能转染分裂细胞,且能转染终末分化细胞和非分裂细胞,可使整合于靶细胞基因组的目的基因长期、稳定表达[19-20]。本研究成功构建了携带GDF-5/GFP嵌合基因的慢病毒载体系统,并发现转染大鼠ASCs最佳MOI为40。但由于大鼠ASCs难以转染,流式细胞仪检测转染效率仅为65%,需要对转染细胞进行筛选和纯化。
本研究未采用传统的药物压力筛选,如G418筛选等,主要是考虑到此方法需要细胞多次传代进行筛选,会造成ASCs的分化功能降低,且药物本身会对细胞活力产生一定影响。本研究通过流式细胞仪荧光细胞筛选技术,对GFP阳性细胞进行筛选,对转染GDF-5基因的细胞进行纯化,发现可大大提高筛选效率,不需多次传代,且对细胞活力影响较小。经流式细胞仪筛选后,GFP阳性细胞率可高达96%,且可稳定传代。本研究体外传代5代后仍能高表达GDF-5,基本建立了稳定转染的ASCs细胞系。因流式筛选后GFP阳性细胞比例已很高,本研究未对筛选后的细胞进行单克隆化,尽量减少对细胞的影响和干扰。通过CCK-8法检测及显微镜下观察,流式细胞仪筛选后的转染GDF-5基因ASCs细胞活力无明显改变。对于转染GDF-5对ASCs分化的影响,我们后续将进一步通过分析过表达GDF-5的ASCs在体外培养过程中细胞形态及髓核细胞相关基因蛋白表达情况来探讨。此外,后续研究会将细胞与温敏性水凝胶支架结合构建仿生髓核,进行体内实验尝试修复大鼠退变椎间盘。
综上所述,通过慢病毒转染结合流式细胞筛选技术可得到高纯度的稳定过表达GDF-5基因的ASCs,且对细胞活力和形态无显著影响,为后续组织工程技术奠定了基础。
[ 1 ] TOKTAS Z O, EKSI M S, YILMAZ B, et al. Association of collagen Ⅰ, Ⅸ and vitamin D receptor gene polymorphisms with radiological severity of intervertebral disc degeneration in Southern European Ancestor[J].Eur Spine J,2015,24(11): 2432-2441.
[ 2 ] SHI J, LIANG J, GUO B, et al. Adipose-derived stem cells cocultured with chondrocytes promote the proliferation of chondrocytes [J]. Stem Cells Int, 2017.
[ 3 ] YANG X, LI X. Nucleus pulposus tissue engineering: a brief review [J].Eur Spine J, 2009, 18(11): 1564-1572.
[ 4 ] 周 磊, 陈 婕, 徐 欣, 等.利用重组慢病毒载体建立稳定表达绿色荧光蛋白细胞系[J].中国临床医学, 2009, 16(2): 305-308.
[ 5 ] ESTES B T, DIEKMAN B O, GIMBLE J M, et al. Isolation of adipose-derived stem cells and their induction to a chondrogenic phenotype [J].Nat Protoc, 2010, 5(7): 1294-1311.
[ 6 ] KOHYAMA K, SAURA R, DOITA M, et al. Intervertebral disc cell apoptosis by nitric oxide: biological understanding of intervertebral disc degeneration [J]. Kobe J Med Sci, 2000, 46(6): 283-295.
[ 7 ] BUEHRER B M, CHEATHAM B. Isolation and Characterization of human adipose-derived stem cells for use in tissue engineering [J]. Methods Mol Biol, 2013, 1001: 1-11.
[ 8 ] WU C H, LEE F K, SURESH KUMAR S, et al. The isolation and differentiation of human adipose-derived stem cells using membrane filtration [J].Biomaterials, 2012, 33(33): 8228-8239.
[ 9 ] SHINGYOCHI Y, ORBAY H, MIZUNO H. Adipose-derived stem cells for wound repair and regeneration [J]. Expert Opin Biol Ther, 2015, 15(9): 1285-1292.
[10] TREMP M, MENZI N, TCHANG L, et al. Adipose-derived stromal cells from lipomas: isolation, characterisation and review of the literature[J].Pathobiology. 2016,83(5): 258-266.
[11] MINOGUE B M, RICHARDSON S M, ZEEF L A, et al. Characterization of the human nucleus pulposus cell phenotype and evaluation of novel marker gene expression to define adult stem cell differentiation [J]. Arthritis Rheum, 2010, 62(12): 3695-3705.
[12] HOOGENDOORN R, DOULABI B Z, HUANG C L, et al. Molecular changes in the degenerated goat intervertebral disc [J]. Spine, 2008, 33(16): 1714-1721.
[13] GAETANI P,TORRE M L,KLINGER M,et al.Adipose-derived stem cell therapy for intervertebral disc regeneration: aninvitroreconstructed tissue in alginate capsules [J].Tissue Eng Part A, 2008, 14(8): 1415-1423.
[14] CHUJO T, AN H S, AKEDA K, et al. Effects of growth differentiation factor-5 on the intervertebral disc--invitrobovine study andinvivorabbit disc degeneration model study [J]. Spine, 2006, 31(25): 2909-2917.
[15] WALSH A J, BRADFORD D S, LOTZ J C.Invivogrowth factor treatment of degenerated intervertebral discs [J]. Spine, 2004, 29(2): 156-163.
[16] LE MAITRE C L, FREEMONT A J, HOYLAND J A. Expression of cartilage-derived morphogenetic protein in human intervertebral discs and its effect on matrix synthesis in degenerate human nucleus pulposus cells [J].Arthritis Res Ther, 2009, 11(5): R137.
[17] KOCH H, JADLOWIEC J A, FU F H, et al.The effect of growth/differentiation factor-5 (GDF-5) on genotype and phenotype in human adult mesenchymal stem cells[J].Z Orthop Ihre Grenzgeb, 2004, 142(2): 248-253.
[18] LIU Y, YU T, MA X X, et al. Lentivirus-mediated TGF-β3, CTGF and TIMP1 gene transduction as a gene therapy for intervertebral disc degeneration in aninvivorabbit model.[J]. Exp Ther Med,2016,11(4): 1399-1404.
[19] CHIRA S, JACKSON C S, OPREA I, et al. Progresses towards safe and efficient gene therapy vectors [J].Oncotarget, 2015, 6(31): 30675-30703.
[20] 杨春杰, 丁志文, 龚 惠, 等. 慢病毒介导2型阿诺碱受体RN A干扰有效靶序列的筛选[J].中国临床医学, 2016, 23(3): 399-401.
[本文编辑] 廖晓瑜, 贾泽军
Establishment of stable GDF-5 gene over-expressed rat adipose stem cells
WANG Hui-ren, CAO Lu, JIANG Li-bo, LIN Hong, LI Xi-lei, DONG Jian*
Department of Orthopaedic Surgery, Zhongshan Hospital, Fudan University, Shanghai 200032, China
Objective: To explore the construction conditions and methods of lentivirus-mediated GDF-5 gene over-expressed rat adipose stem cells (ASCs-GDF-5). Methods: Rat ASCs were isolated and cultured using collagenase digestion method. The cell morphology was observed with the growth curve being tested. Besides, the cell phenotypes were identified. Lentiviral vector system with GDF-5/GFP chimeric gene was prepared and the infection efficiency was explored under series of MOI (1, 5, 10, 20, 40, 60, 80, 100). The optimal MOI was determined and the infection efficiency was tested using FCM. High-purified ASCs-GDF-5 were obtained through fluorescence activated cell sorting with FCM. The positive rate of infected cells was verified further with DAPI staining. The viability of infected cells was evaluated with CCK-8 assay. Results: Rat ASCs were successfully isolated and cultured. The markers (CD90, CD29, CD44, CD105) expressed in mesenchymal stem cell were positive in cultured cells. In contrast, the hematopoietic cell surface antigens (CD45, CD34) and bone marrow stem cell surface antigen (CD106) were negative. GDF-5 gene over-expressed lentiviral vector system was successfully constructed. The optimal MOI was 40, with the infection rate of 65%. The positive rate of infected cells was increased to 96% through fluorescence activated cell sorting using FCM. There was no significant difference in the viability and growth curve between infected and non-infected cells with CCK-8 assay. Conclusions: Rat ASCs can be cultured using collagenase digestion method. Without significant effect on cell viability, the positive rate of infected cells can be significantly increased through fluorescence activated cell sorting using FCM.
adipose-derived stem cells; lentivirus; growth and differentiation factor-5; transfection
2017-02-06 [接受日期] 2017-02-22
国家自然科学基金(31170925),国家重点基础研究发展计划子课题(2009CB930002). Supported by National Natural Science Foundation of China (31170925) and National Basic Research Program of China (973 Program,2009CB930002).
王会仁,博士,住院医师. E-mail: wanghuiren340@163.com
*通信作者(Corresponding author). Tel: 021-64041990, E-mail: dong.jian@zs-hospital.sh.cn
10.12025/j.issn.1008-6358.2017.20170084
R -33
A

