黄蜀葵花中5种黄酮类化合物对肠道L细胞AGEs/RAGE/p38MAPK/NF-κB信号通路的调节作用
蔡红蝶,宿树兰,陶伟伟,2,朱 悦,郭建明,钱大玮,段金廒,3
(南京中医药大学 1.江苏省中药资源产业化过程协同创新中心中药资源产业化与方剂创新药物国家地方联合工程研究中心国家中医药管理局中药资源循环利用重点研究室, 2.平移系统生物学与神经科学中心/脑疾病综合生物医学实验室,基础医学院,3.中药品质与效能国家重点实验室(培育),江苏 南京 210023)
黄蜀葵花中5种黄酮类化合物对肠道L细胞AGEs/RAGE/p38MAPK/NF-κB信号通路的调节作用
蔡红蝶1,宿树兰1,陶伟伟1,2,朱 悦1,郭建明1,钱大玮1,段金廒1,3
(南京中医药大学 1.江苏省中药资源产业化过程协同创新中心中药资源产业化与方剂创新药物国家地方联合工程研究中心国家中医药管理局中药资源循环利用重点研究室, 2.平移系统生物学与神经科学中心/脑疾病综合生物医学实验室,基础医学院,3.中药品质与效能国家重点实验室(培育),江苏 南京 210023)
锦葵科;黄属葵花;肠道L细胞;AGEs;RAGE;黄酮类化合物
黄蜀葵[Abelmoschusmanihot(L.)Medicus]为锦葵科秋葵属植物黄蜀葵的花,始载于《嘉佑本草》,后收录于《本草纲目》。其味甘、辛;性凉。归心、肾、膀胱经。具有利尿通淋、活血、止血、消肿解毒的功效,主淋证、吐血、衄血、崩漏、胎衣不下、痈肿疮毒、水火烫伤。现代药理研究表明,黄蜀葵花具有各种明显的生物活性,如消炎止痛、抗氧化、抗凝血、抗心肌缺血坏死、保护缺血性脑损伤、延缓肾小管损害和肾纤维化、降低血糖、促进血管生成等[1-5]。临床上主要用来治疗慢性肾脏疾病,如黄葵胶囊。化学成分研究表明,黄蜀葵花中主要含有黄酮类、有机酸类、甾类及挥发性成分,其中黄酮类成分为主要活性成分,主要包括槲皮素、金丝桃苷、异槲皮苷、槲皮素-3-O′-葡萄糖醛酸苷、棉皮素-8-O-葡萄糖醛酸苷。据报道,槲皮素对急性痛风性关节炎大鼠[6]、尿酸性肾病大鼠[7]、高尿酸血症小鼠[8]、神经细胞[9]及癌细胞[10]等具有明显的作用。金丝桃苷与异槲皮苷具有降血脂、保肝、保护心脑血管、抗炎、抗抑郁、保护神经等各种药理作用[11-16]。槲皮素-3-O′-葡萄糖醛酸苷及棉皮素-8-O-葡萄糖醛酸苷被报道具有明显调节胰岛素抵抗的药理活性[17]。本文通过研究以上5种黄酮类化合物对肠道L细胞AGEs/RAGE/p38MAPK/NF-κB信号通路的调节作用,为黄属葵花资源的进一步利用与开发提供一定依据。
1 材料与方法
1.1 材料
1.1.1 实验细胞 肠道L细胞系GLUTag细胞购自于南京凯基生物科技发展有限公司。
1.1.2 主要试剂与耗材 细胞培养瓶(美国 FALCON 353014);Penicillin/streptomycin solution(中国,南京凯基生物科技发展有限公司,KGY002);0.25% Tripsin-EDTA(中国,南京凯基生物科技发展有限公司,KGY001);PBS(中国,南京凯基生物科技发展有限公司,KGB500);DMEM(美国,Gibco,12800-082);F12(美国,Gibco,883684);FBS(美国,ExCell Biology,FBS500);6 wellcell culture plate(美国,Corning Incorporated,3516);Bax、caspase-3、caspase-9、gp22phox、NFKB-P65、p38MAPK、p53、RAGE、p47phox、β-actin等抗体购自于美国剑桥Abcam公司;IL-1β、IL-6、TNF-α试剂盒购自于美国Sigma公司;槲皮素(QT)、异槲皮苷(IQT)、金丝桃苷(HY)、槲皮素-3′-O-葡萄糖苷(QG)、棉皮素-8-O-葡萄糖醛酸苷(GG)由实验室从黄蜀葵花中制备,纯度高于95%。
1.1.3 主要仪器设备 超净工作台(中国,苏州净化,SW-CJ-1FD);CO2培养箱(日本,SANYO,XD-101);生物倒置显微镜(日本,OLYMPUS,IX51);台式低速离心机(中国,上海医疗器械股份有限公司医疗设备厂,80-2);恒温水浴箱(常州国华电器有限公司,HH-4);电热恒温干燥箱(上海润东荣丰科学仪器有限公司,101-AS-3)。
1.2 方法
1.2.1 GLUTag细胞培养 以含10%的FBS、100 kU·L-1青霉素、100 g·L-1链霉素的DMEM 低糖培养基于37 ℃,5% CO2培养箱中培养细胞,每2 d更换1次培养液。待细胞进入对数生长期后,消化传代。
1.2.2 AGEs制备 称量一定量的BSA与葡萄糖溶于pH为7.4的PBS中,混匀,配制浓度为20 g·L-1的BSA与500 mmol·L-1的葡萄糖,并加入终浓度为0.5 mmol·L-1的EDTA,室温放置过夜。0.2 μmol·L-1滤器过滤除菌,封口后放置37 ℃恒温培养箱中避光孵育90 d。对照组BSA不加葡萄糖,其他制备方法与以上步骤相同。荧光光谱扫描检测制备的BSA-AGEs(激发波长350 nm,发射波长440 nm)。
1.2.3 实验分组与给药 用96孔板铺板细胞,用DMEM低糖培养基预处理,37 ℃、5% CO2中培养6 h,使其处于同步化状态,每24 h换液,实验分为7组:空白对照组(NG)、模型组(AGEs)、槲皮素组(QT)、异槲皮苷组(IQT)、金丝桃苷组(HY)、槲皮素-3′-O-葡萄糖苷组(QG)、棉皮素-8-O-葡萄糖醛酸苷组(GG)。NG细胞培养于DMEM低糖培养基中,不添加其它任何干预因素;AGEs细胞培养于含200 mg·L-1AGEs的DMEM低糖培养基中;给药组细胞分别培养于含50 μmol·L-1各黄酮单体及含200 mg·L-1AGEs的DMEM低糖培养基中。各组细胞培养24 h后进行下一步检测。
1.2.4 Western blot检测RAGE、p22Phox、p47Phox、p53、Bax蛋白表达水平 Western blot检测以β-actin为内参。收集各组处理的细胞,用PBS清洗3次,加入细胞裂解液裂解细胞,提取各组细胞总蛋白,用二辛可宁酸(BCA)法对蛋白进行定量。配制10%分离胶和5%浓缩胶,60 mA预电泳15 min,蛋白上样(20 mg),SDS-PAGE转电泳2.5 h后,在含有封闭液的平皿中于室温下封闭1 h。分别加入RAGE、p22Phox、p47Phox、p53、Bax、Phospho-p38MAPK、NF-κB一抗4 ℃过夜,Tris缓冲液清洗3次,接着加入二抗37 ℃孵育1 h,最后Tris缓冲液清洗3次。用 X光片曝光、显影、定影。
1.2.5 ELISA法检测caspase-3、caspase-9的活性 各组细胞经药物干预24 h后,加入胰酶消化细胞,4 ℃, 800 r·min-1离心5 min。弃上清,取细胞沉淀用预冷的PBS洗涤3次,然后将细胞移入无菌1.5 mL EP管,3 000 r·min-1离心5 min。弃去上清,加50 μL细胞裂解液于每管中。冰浴10 min使细胞重悬。4 ℃,10 000 r·min-1离心5 min,将上清移至另一洁净的EP管中。每管加入2×Reaction Buffer/DTTMix 50 μL及DEVD-fmk 1 mL,冰浴30 min。然后分别加入5 μL 1 mmol·L-1Ac-DEVD-pNA, Ac-VDVAD-pNA, Ac-LEHD-pNA于每孔中,室温放置2h后移至96孔培养板。用酶联免疫检测仪测量OD值,波长设置为405 nm。
1.2.6 ELISA法检测TNF-α、IL-1、IL-6的含量 各组细胞经过不同因素干预后孵育24 h,取各组细胞的上清液,详细操作步骤按照TNF-α、IL-1、IL-6的ELISA试剂盒说明书,对各指标进行含量测定,利用酶联免疫检测仪量OD值。

2 结果
2.1 Western blot检测各组GLUTag细胞RAGE蛋白表达水平 各组细胞干预24 h后,Western blot测定各组GLUTag细胞的RAGE蛋白表达水平,结果如Fig 1所示。各组细胞中RAGE蛋白表达水平差异有显著性(P<0.01),200 mg·L-1AGEs作用GLUTag细胞24 h后,RAGE蛋白表达水平明显高于空白对照组(P<0.01),经50 μmol·L-1QT、IQT、HY、QG、GG干预后,RAGE蛋白表达水平明显下调(P<0.01)。其中以HY作用最为明显,结果表明黄属葵花中黄酮类成分可有效抑制RAGE蛋白的过度表达。
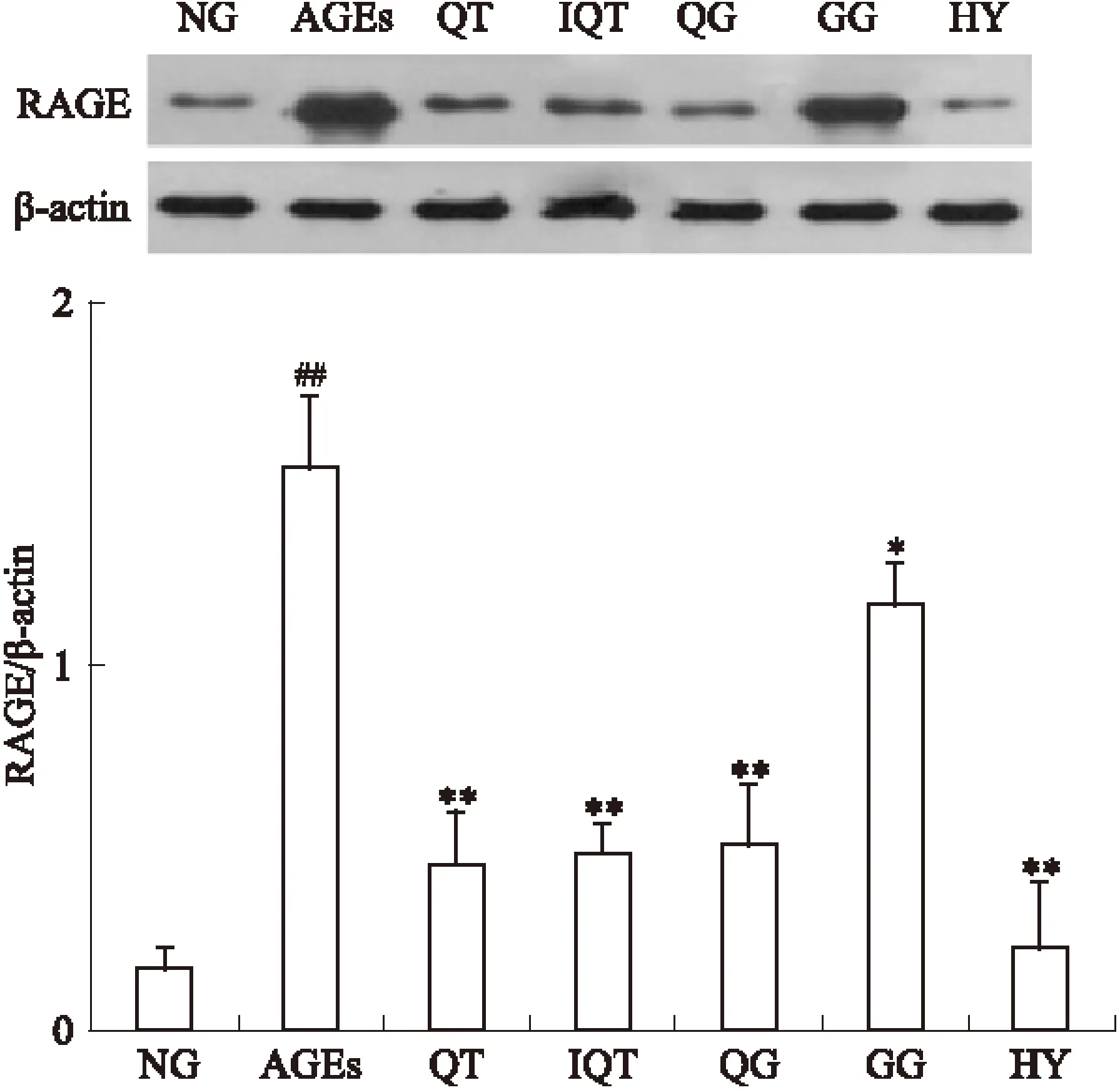
Fig 1 Espression of RAGE in GLUTag cells from different groups tested by Western blot(intervention for 24 h)
*P<0.05,**P<0.01vsAGEs;##P<0.05vsNG
2.2 Western blot检测各组GLUTag细胞中NADPH氧化酶亚单位蛋白表达水平 各组细胞干预24 h后,Western blot测定各组GLUTag细胞的p22Phox、p47Phox蛋白表达水平,结果如Fig 2所示。各组细胞中p22Phox、p47Phox蛋白表达水平差异有显著性(P<0.01),200 mg·L-1AGEs作用GLUTag细胞24 h后,p22Phox、p47Phox蛋白表达水平明显高于空白对照组(P<0.01),经50 μmol·L-1QT、IQT、HY、QG、GG干预后,p22Phox、p47Phox蛋白表达水平明显下调(P<0.01)。其中以金丝桃苷组最接近正常组,结果表明黄属葵花中黄酮类成分可有效抑制NADPH氧化酶亚单位蛋白的过度表达。
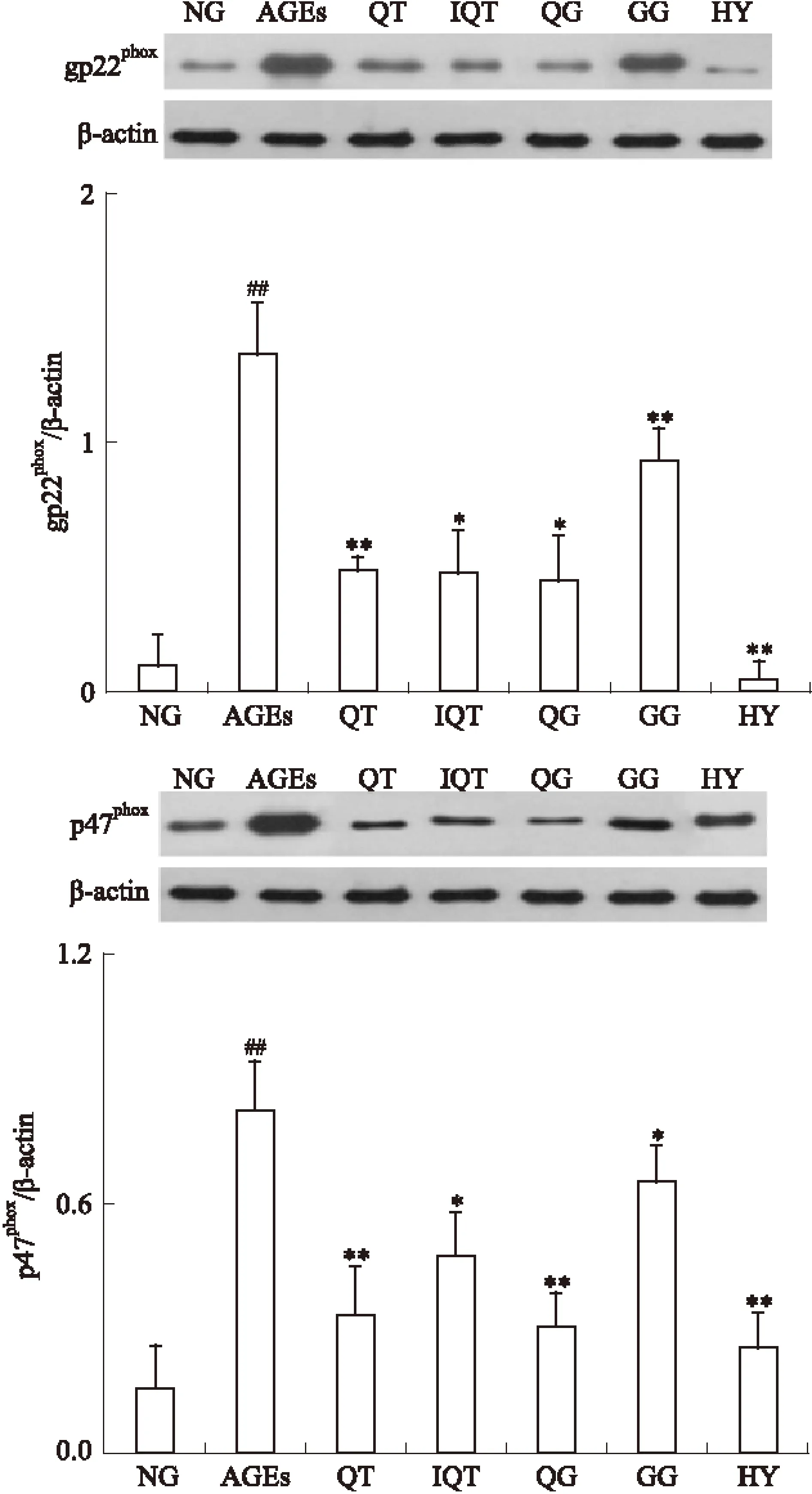
Fig 2 Expressions of p22Phox,p47Phox in GLUTag cells from different groups detected by Western blot(intervention for 24 h)
*P<0.05,**P<0.01vsAGEs;##P<0.05vsNG
2.3 Western blot检测各组GLUTag细胞中p53、Bax蛋白的表达水平 各组细胞干预24 h后,Western blot测定各组GLUTag细胞的p53、Bax蛋白表达水平,结果如Fig 3所示。各组细胞中p53、Bax蛋白表达水平差异有显著性(P<0.01),200 mg·L-1AGEs作用GLUTag细胞24 h后,Bax蛋白表达水平明显高于空白对照组(P<0.01),p53蛋白表达水平明显低于空白对照组(P<0.01),经50 μmol·L-1QT、IQT、HY、QG、GG干预后,p53、Bax蛋白表达水平均向正常组靠近。其中以金丝桃苷组最趋近于正常组,结果表明黄属葵花中黄酮类成分可有效调节GLUTag细胞凋亡相关蛋白p53、Bax的表达。
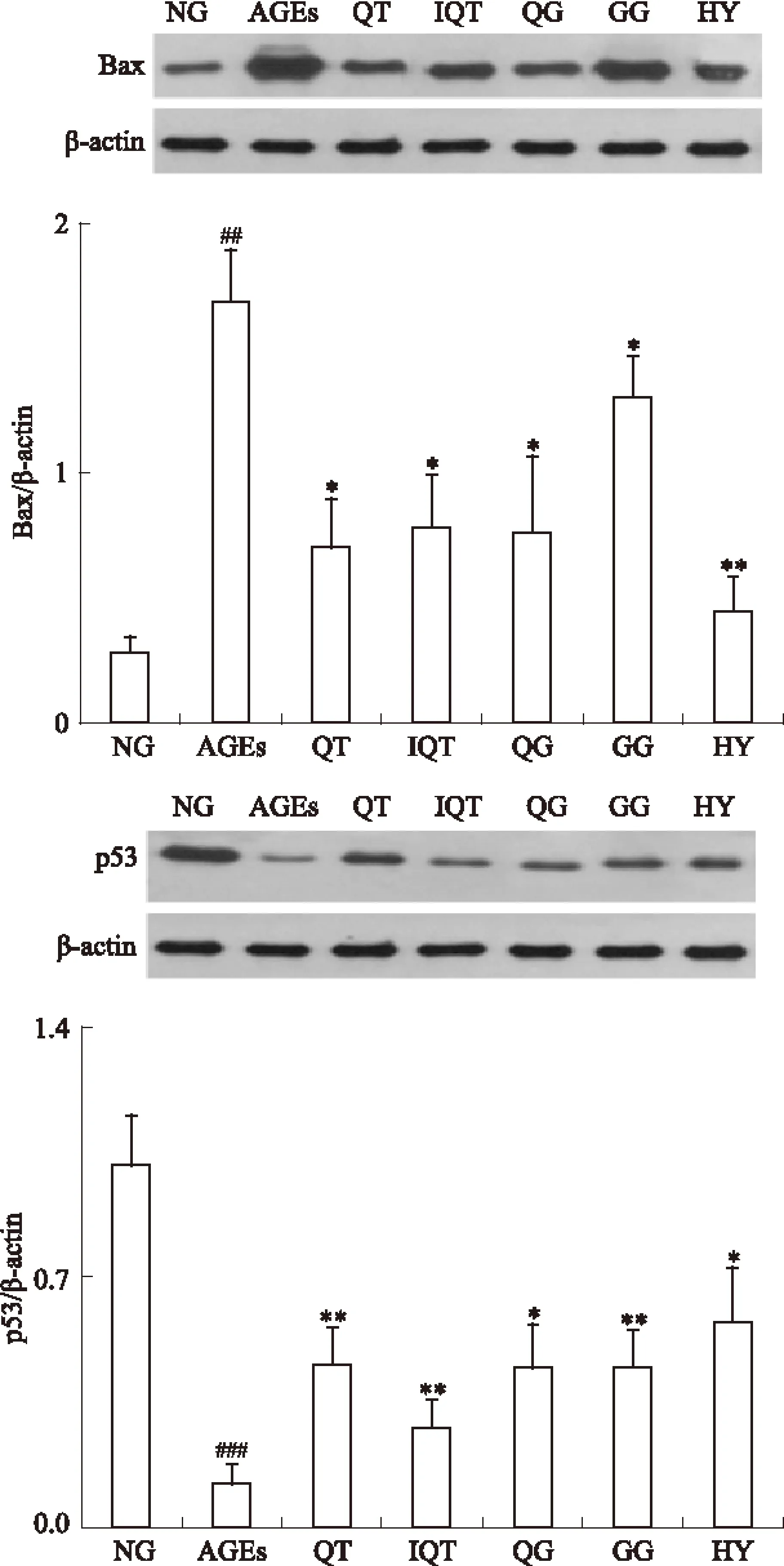
Fig 3 Espressions of p53,Bax in GLUTag cells from different groups detected by western blot(intervention for 24 h)
*P<0.05,**P<0.01vsAGEs;##P<0.05vsNG.
2.4 ELISA检测GLUTag细胞凋亡蛋白酶caspase-3、caspase-9活性 各组细胞干预24 h后,ELISA检测各组GLUTag细胞中caspase-3、caspase-9的活性,结果如Fig 4所示。各组细胞中caspase-3、caspase-9的活性差异有显著性(P<0.01),200 mg·L-1AGEs作用GLUTag细胞24 h后,细胞中caspase-3、caspase-9的活性明显高于空白对照组(P<0.01),经50 μmol·L-1QT、IQT、HY、QG、GG干预后,caspase-3、caspase-9的活性均向正常组回调。其中HY的调节作用最为明显,结果表明黄属葵花中黄酮类成分可有效抑制GLUTag细胞凋亡相关蛋白酶caspase-3、caspase-9的活性。
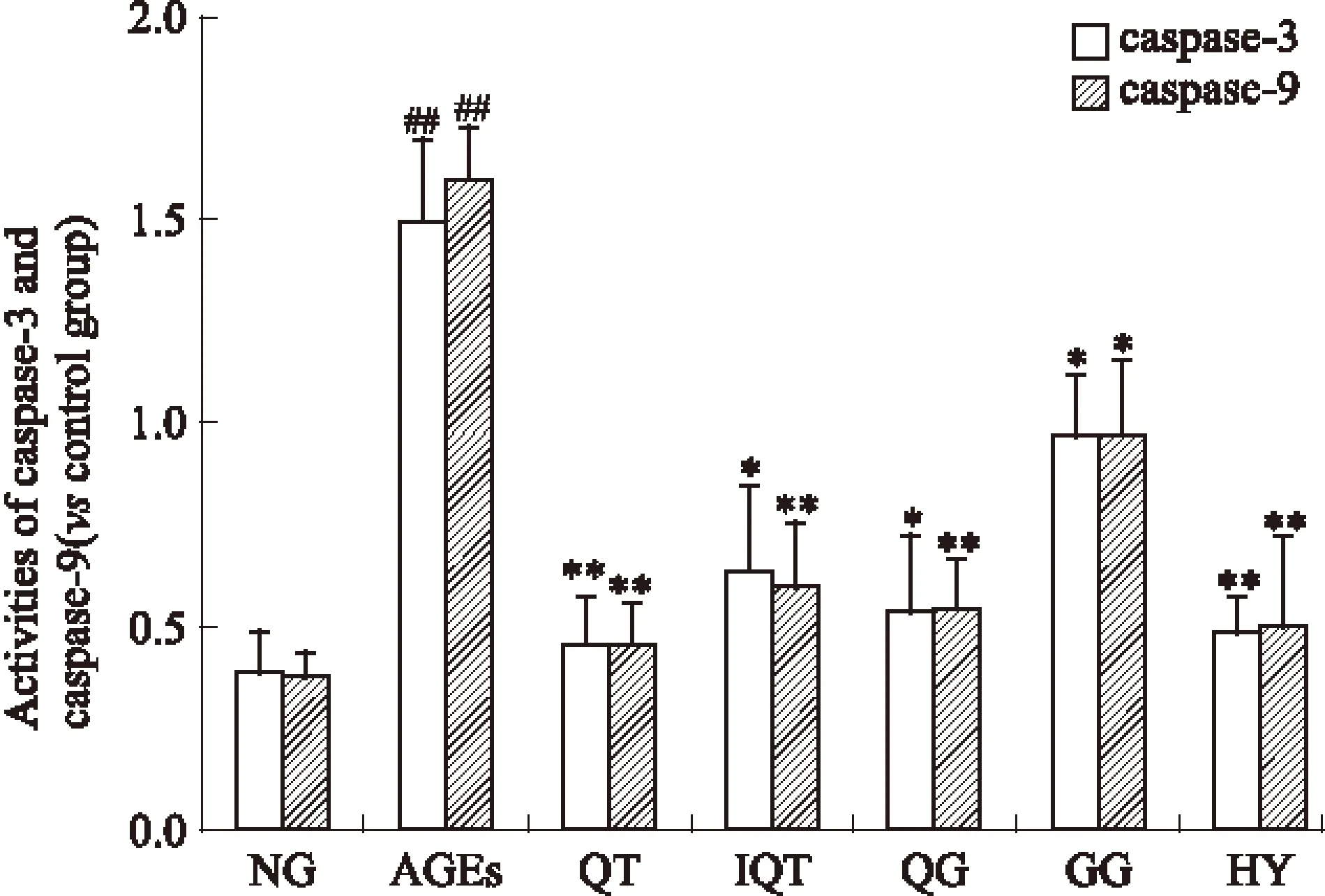
Fig 4 Effect of flavonoids and AGEs on caspase-3 and caspase-9 activity in GLUTag cells
*P<0.05,**P<0.01vsAGEs;##P<0.05vsNG
2.5 Western blot检测各组GLUTag细胞中p38MAPK磷酸化水平、NF-κB的表达水平 各组细胞干预24 h后,Western blot检测各组GLUTag细胞中p38MAPK磷酸化水平、NF-κB的表达水平,结果如Fig 5所示。各组细胞中p38MAPK磷酸化水平及NF-κB的表达水平差异有显著性(P<0.01),200 mg·L-1AGEs作用GLUTag细胞24 h后,细胞中p38MAPK磷酸化水平及NF-κB的表达水平明显高于空白对照组(P<0.01),经50 μmol·L-1QT、IQT、HY、QG、GG干预后,p38MAPK磷酸化水平及NF-κB的表达水平均接近正常组。结果表明黄属葵花中黄酮类成分可有效抑制AGEs刺激的GLUTag细胞中p38MAPK的磷酸化及NF-κB的过表达。
2.6 ELISA检测GLUTag细胞上清液中炎症因子的含量 各组细胞干预24 h后,ELISA试剂盒测定各组GLUTag细胞中TNF-α、IL-1、IL-6的含量,结果如Fig 6所示。200 mg·L-1AGEs作用24 h后,模型组GLUTag细胞上清液中TNF-α、IL-1、IL-6的分泌量明显高于空白对照组(P<0.01),经50 μmol·L-1QT、IQT、HY、QG、GG干预24 h后,TNF-α、IL-1、IL-6的分泌量与模型组比较明显减少,差异具有统计学意义(P<0.01)。其中以QT的调节作用最为明显,结果表明,黄属葵花中黄酮类成分可有效抑制AGEs刺激的GLUTag细胞分泌炎症因子。
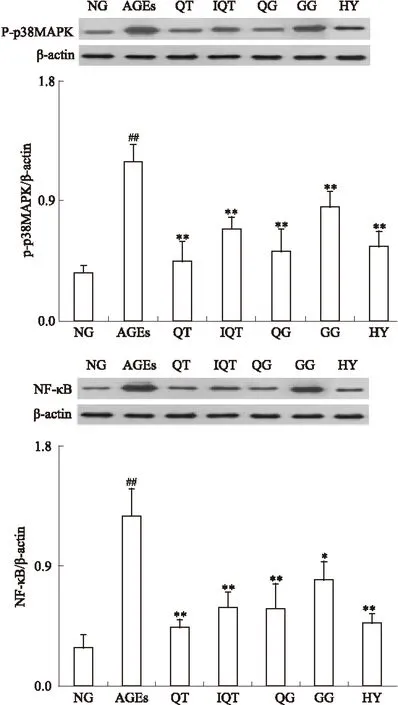
Fig 5 Expressions of p-p38MAPK and NF-κB in GLUTag cells from different groups detected by western blot(intervention for 24 h)
*P<0.05,**P<0.01vsAGEs;##P<0.05vsNG
3 讨论
胰高血糖素样肽-1(GLP-1)是一种含有30个氨基酸的肽类激素,为肠促胰素中的一种,在餐后食物刺激下,由分布在回肠与结肠段粘膜层的肠道L细胞即GLUTag细胞分泌,释放进入血液,与细胞膜上特异性受体结合,促进胰岛素分泌及抑制胰高血糖素分泌,以降低血糖。多项研究表明[18-20],GLP-1分泌减少是2型糖尿病(type 2 diabetes mellitus, T2DM)患者肠促胰素效应受损主要特点,而GLUTag细胞的早期凋亡则是GLP-1分泌减少的主要原因,并参与了T2DM的发生和发展。因此研究GLUTag细胞的早期凋亡机制及其作用药物显得格外重要。糖基化终末产物(AGEs)是长期高血糖与多种蛋白质发生糖基化作用后,形成的具有毒性而不可逆的化合物,大量的不可逆的AGEs的产生和积聚是细胞损伤及DM慢性进展的重要机制。有文献报道[21],AGEs能结合细胞膜上RAGE受体,活化内皮细胞NADPH氧化酶系统,激活细胞内氧化应激水平,促进炎症因子的释放并影响细胞凋亡相关蛋白caspase-3、caspase-9、p53、Bax的表达,导致GLUTag细胞炎症损伤与凋亡。
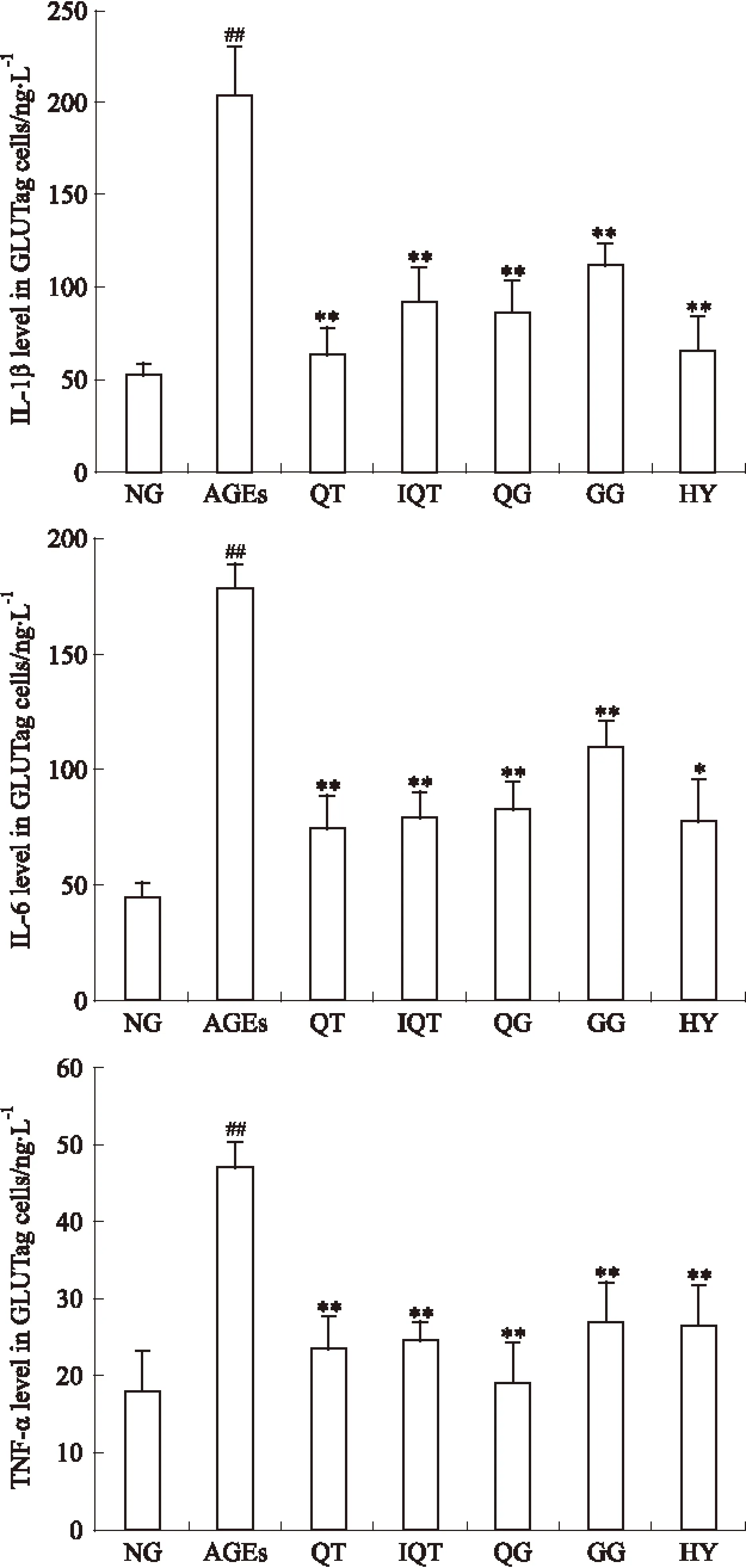
Fig 6 Effect of flavonoids and AGEs on content of TNF-α,IL-1,IL-6 in GLUTag cells
*P<0.05,**P<0.01vsAGEs;##P<0.05vsNG
氧化应激是指机体生成过量活性氧(ROS),超过自身抗氧化能力时,便发挥细胞毒性作用使细胞损伤甚至凋亡。因此细胞内ROS水平可在一定程度上反应细胞氧化损伤状态,而细胞内ROS主要来源于由2个膜亚基gp91Phox、p22Phox及3个胞质亚基p40Phox、p47Phox、p67Phox组成的NADPH氧化酶系统[22-23]。本研究参照文献[21],选择200 mg·L-1AGEs刺激GLUTag细胞24 h后,采用Western blot检测其受体RAGE的表达水平及细胞内的氧化应激水平,结果发现,AGEs处理后的GLUTag细胞中RAGE、p22Phox和p47Phox的表达水平明显升高,而各黄酮单体给药组的细胞内RAGE、p22Phox和p47Phox的表达水平较AGEs模型组明显下降,说明AGEs可通过与RGEs结合后,引起GLUTag细胞中一系列氧化应激反应,而黄属葵花中的黄酮类成分可有效抑制此过程的发生与发展。
p38MAPK是MAPK家族中重要成员,是介导细胞反应的重要信号系统。它在炎症、应激反应过程中发挥重要作用,参与细胞的存活、分化和凋亡等过程[24-25]。NF-κB是一种转录刺激因子,其信号转导通路是炎症反应的关键环节。p38MAPK是NF-κB的重要上游激酶,ROS可通过直接激活p38MAPK[26]使其进一步诱导NF-κB活化,从而增强炎症介质TNF-α、IL-1、IL-6的表达,最终导致多细胞炎症损伤[27-29]。本实验结果显示,AGEs处理GLUTag细胞后,p38MAPK磷酸化水平升高,激活NF-κB因子表达,释放TNF-α、IL-1、IL-6,从而使肠道L细胞产生炎症损伤。黄属葵花中黄酮类成分干预后,细胞中各指标均向正常回调,从而改善GLUTag细胞炎症损伤。
细胞凋亡的主要细胞信号通路有caspase依赖的通路和非caspase依赖的通路。Caspase是一族结构相似的特异性裂解天冬氨酸残基的半胱氨酸蛋白酶,可通过死亡受体和线粒体通路的激活调控细胞的凋亡,在细胞凋亡的执行期发挥关键作用[30]。在应激信号诱导凋亡通路中,p53表达下调诱导Bax蛋白表达上调,从而介导细胞凋亡是一条常见通路[31-32]。GLUTag细胞的生长和凋亡可能是通过Bcl-2家族调节的,该家族包括凋亡分子如Bax和抗凋亡分子如Bcl-2,而这些分子是caspase的调节因子,另外caspase是多种类型凋亡的终端效应分子[33]。本部分实验的结果显示,与正常组细胞相比,AGEs刺激的GLUTag细胞中p53的表达明显下调,Bax的表达及caspase-3、caspase-9的活性明显上调,黄属葵花中黄酮类成分干预后,细胞中各指标均向正常回调。
综上所述,本部分实验结果提示AGEs作用于GLUTag细胞,可上调细胞RAGE受体表达,激活NADPH氧化酶,升高p38MAPK磷酸化水平,促使NF-κB因子表达,释放炎症因子TNF-α、IL-1、IL-6,并调节细胞凋亡相关蛋白caspase-3、caspase-9、p53、Bax的表达,从而导致GLUTag细胞炎症损伤与凋亡,黄属葵花中黄酮类成分能显著调节GLUTag细胞中AGEs/RAGE/p38MAPK/NF-κB信号通路。
(致谢:本实验在江苏省中药资源产业化过程协同创新中心实验室完成,衷心感谢各位实验人员的付出。)
[1] 李庆林, 王成永, 彭代银, 等. 黄蜀葵花总黄酮对心肌缺血再灌注损伤的保护作用研究[J].中国实验方剂学杂志, 2006, 12(2): 39-42.
[1] Li Q L, Wang C Y, Peng D Y, et al. Protective effects of total flavone from the flowers of ablemoschl manihot L. Medic on the myocardial ischemia/reperfusion injury[J].ChinJExpTraditMedFormula,2006, 12(2): 39-42.
[2] 文继月, 陈志武. 黄蜀葵花总黄酮预处理对大鼠脑缺血再灌注性损伤的保护作用[J]. 安徽医科大学学报, 2006, 41(6):667-9.
[2] Wen J Y, Chen Z W. Protective effect of pharmacological preconditioning of total flavones of Ablemoschl manihot L. Medic on cerebral ischemic reperfusion injury[J].ActaUnivMedAnhui, 2006, 41(6):667-9.
[3] 陈 萍, 万毅刚, 王朝俊, 等. 黄蜀葵花制剂治疗慢性肾脏病的机制和疗效[J].中国中药杂志,2012, 37(15): 2252-6.
[3] Chen P, Wan Y G, Wang C J, et al. Mechanisms and effects of Abelmoschus manihot preparations in treating chronic kidney disease[J].ChinaJChinMaterMed, 2012, 37(15): 2252-6.
[4] 周晓隆, 陈志武. 黄蜀葵花总黄酮对实验性高血糖大鼠的作用及机制初探[J].中国临床药理学与治疗学,2016,21(6): 618-20.
[4] Zhou X L, Chen Z W. Effect of total flavones of abelmoschl manihot on rats with experimental hyperglycemia[J].ChinJClinPharmacolTher,2016,21(6):618-20.
[5] 潘 武. 黄蜀葵花总黄酮促血管新生作用及机制的实验研究[D]. 南京:南京中医药大学.2010.
[5] Pan W. Experimental study on angiogenic effect and its mechalism of rotal flavone of ablemoschl manihot[D]. Nanjing: Nanjing University of Chinese Medicine. 2010.
[6] 黄敬群, 孙文娟, 王四旺, 等. 槲皮素对大鼠痛风性关节炎抗炎抗氧化活性研究[J]. 中国实验方剂学杂志,2012,18(2):169-71.
[6] Huang J Q,Sun W J,Wang S W, et al.Studies on the anti-inflammatory and antioxidant activity of quercetin in rats with gouty arthritis[J].ChinJExpTraditMedFormul, 2012, 18(2): 169-71.
[7] 胡庆华, 缪明星, 卢 国, 等. 槲皮素对尿酸性肾病大鼠肾脏NLRP3和TLRs表达的影响[J].中草药,2013,44(24):3496-9.
[7] Hu Q H, Miao M X, Lu G, et al.Effects of quercetin on expression of renal NLRP3 and TLRs in rats with uric acid nephtopathy[J].ChinTraditHerbalDrugs,2013,44(24):3496-9.
[8] 黄敬群,朱妙章,王四旺. 染料木素、芹菜素、槲皮素、芦丁和落新妇苷对高尿酸血症小鼠黄嘌呤氧化酶活性及血清尿酸水平的影响[J].中国药理学通报, 2011, 27(4): 561-5.
[8] Huang J Q, Zhu M Z, Wang S W. Effects of Genistein, Apigenin, Quercetin, Rutin and Astibin on xanthine oxidase activities and serum uric acid levels in hyperuricemic mice[J].ChinPharmacolBull, 2011, 27(4): 561-5.
[9] 刘红亮, 胡 磊, 王靖凯, 等. 槲皮素对H2O2损伤PC12细胞的保护效果与机制[J]. 中国药理学通报, 2014, 30(3): 373-7.
[9] Liu H L, Hu L, Wang J K, et al. Protective effects of quercetin on PC12 cells with H2O2-induced oxidative damage[J].ChinPharmacolBull, 2014, 30(3): 373-7.
[10]施剑明, 殷嫦嫦, 孙维君, 等. 槲皮素联合顺铂对人骨肉瘤MG-63 细胞增殖及凋亡的影响[J]. 中国药理学通报,2014,30(10):1361-6.
[10]Shi J M,Yin C C,Sun W J,et al. Effect of quercetin combined with cisplatin on proliferation and apoptosis of human osteosarcoma cell line MG-63[J].ChinPharmacolBull,2014,30(10):1361-6.
[11]Choi J H, Kim D W, Yun N. Protective effects of hyperoside against carbon tetrachloride-induced liver damage in mice[J].JNatProd, 2011, 74(5):1055.
[12]李沛波, 王永刚, 吴钉红, 等. 田基黄中三个黄酮类化合物保肝退黄作用的实验研究[J]. 中山大学学报(医学科学版), 2007, 28(1): 40-2.
[12]Li P B, Wang Y G, Wu D H, et al.Experimental study of three flavonoids isolated from Hypericum japonicum Thunb. on Hepatoprotective and Jaundice-relieving Effects[J].JSunYat-senUniv(MedSci), 2007,28(1): 40-2.
[13]周晓隆, 陈志武. 金丝桃苷对新生大鼠神经细胞缺氧/再给氧损伤的保护作用及其机制[J]. 中国药理学通报, 2010, 26(1):83-6.
[13]Zhou X L, Chen Z W. Action mechanism of hyperin on neonatal rats neuron with anoxia-reoxygenation[J].ChinPharmacolBull, 2010, 26(1): 83-6.
[14]Haas J S, Stolz E D, Betti A H. The anti-immobility effect of hyperoside on the forced swimming test in rats is mediated by the D2-like receptors activation[J].PlantaMed, 2011, 77(4): 334.
[15]Kim S J, Um J Y, Lee J Y. Anti-inflammatory activity of hyperoside through the suppression of nuclear factor-κB activation in mouse peritoneal macrophages[J].AmJChinMed, 2011, 39(1): 171.
[16]张利斌, 张晓庆, 李玉平, 等. 异槲皮苷抗抑郁作用实验研究[J]. 药学实践杂志,2011,29(4): 272-5.
[16]Zhang L B, Zhang X Q, Li Y P. Experimental study on the antidepressant activities of Isoquercitrin[J].JPharmPract, 2011, 29(4): 272-5.
[17]蔡红蝶, 宿树兰, 郭 盛, 等. 黄蜀葵花中黄酮类成分对前脂肪细胞增殖、分化及胰岛素抵抗的影响[J]. 中国中药杂志,2016,41(24): 4634-41.
[17]Cai H D, Su S L, Guo S. Effect of flavonoids from Abelmoschus manihot(L.) Medic on proliferation, differentiation of 3T3-L1 preadipocyte and insulin resistance[J].ChinaJChinMaterMed,2016, 41(24): 4634-41.
[18]Lim G E, Huang G J,Flora N, et al. Insulin regulates glucagon-like peptide-1 secretion from the enteroendocrine L celI[J].Endocrinol,2009,150(2):580-91.
[19]Daoudi M, Hennuyer N,Borland M G,et al. PPARbeta/delta activation induces enteroendocrine L cell GLP-1 production[J].Gastroenterol,2011,140(5): 1564-74.
[20]Hoist J J,Mcgill M A. Potential new approaches to modifying intestinal GLP-1 secretion in patients with type 2 diabetes mellitus: focus on bile acid sequestrants[J].ClinDrugInvestig,2012,32(1):1-14.
[21]李双喜. AGEs-RAGE通路在2型糖尿病肠道L细胞早期损伤及凋亡中的机制研究[D].广州:南方医科大学, 2014.
[21]Li S X. The study on pathogenesis of AGEs-RAGE pathway in the early damageand apoptosis of intestinal L cells from T2DM[D].Guang zhou: Southern Medical University, 2014.
[22]Dworakowski R, Alom-Ruiz S P, Shah A M. NADPH oxidase-derived reactive oxygen species in the regulation of endothelial phenotype[J].PharmacolRep,2008, 60(1):21-8.
[23]Wang H J, Pan Y X, Wang W Z, et al. NADPH oxidase-derived reactive oxygen species in skeletal muscle modulates the exercise pressor reflex[J].JApplPhysiol(1985),2009,107(2): 450-9.
[24]Wuyts W A, Vanaudenaerde B M, Dupont L J, et al. Involvement of p38 MAPK, JNK, p42/p44 ERK and NF-κB in IL-1β-induced chemokine release in human airway smooth muscle cells[J].RespiratoryMed,2003, 97(7): 811-7.
[25]Lee J C, Kumar S, Griswold D E, et al. Inhibition of p38 MAP kinase as a therapeutic strategy[J].Immunopharmacol,2000, 47(2-3): 185-201.
[26]Wang X, Liu J Z, Hu J X, et al. ROS-activated p38 MAPK/ERK-Akt cascade plays a central role in palmitic acid-stimulated hepatocyte proliferation[J].FreeRadicalBiolMed, 2011, 51(2): 539-51.
[27]Newton R, Holden N S. New aspects of p38 mitogen activated protein kinase (MAPK) biology in lung inflammation[J].DrugDiscoveryToday:DiseaseMechanisms,2006,3(1): 53-61.
[28]Stassen M, Klein M, Becker M, et al. p38 MAP kinase drives the expression of mast cell-derived IL-9 via activation of the transcription factor GATA-1[J].MolImmunol,2007,44(5): 926-33.
[29]Guglielmotto M, Aragno M, Tamagno E, et al. AGEs/RAGE complex upregulates BACE1 via NF-κB pathway activation[J].NeurobiolofAging,2012,33(1):196.e13-27.
[30]Kumar S, Vaux D L. Apoptosis. A Cinderella caspase takes center stage[J].Science,2002,297(5585): 1290-1.
[31]Choudhuri T, Pal S,Agwarwal M L, et al. Curcumin induces apoptosis in human breast cancer cells through p53-dependent Bax induction[J].FEBSLett,2002,512(1-3):334-40.
[32]Hoffinann S,Podlich D,Hahnel B, et al. Angiotensin II type 1 receptor overexpression in podocytes induces glomerulosclerosis in transgenic rats[J].JAmSocNephroU,2004,15(6):1475-87.
[33]Ding G, Reddy K, Kapasi A A, et al. Angiotensin II induces apoptosis in rat glomerular epithelial cells[J].AmJPhysiolRenalPhysiol,2002,283(1):F173-F180.
Regulation of flavoniods fromAbelmoschusmanihoton AGEs/RAGE/p38MAPK/NF-κB signal pathway in GLUTag cells
CAI Hong-die1,SU Shu-lan1,TAO Wei-wei1,2,ZHU Yue1,GUO Jian-ming1,QIAN Da-wei1,DUAN Jin-ao1,3
(1.JiangsuCollaborativeInnovationCenterofChineseMedicinalResourcesIndustrialization,andNationalandLocalCollaborativeEngineeringCenterofChineseMedicinalResourcesIndustrializationandFormulaeInnovativeMedicine,andKeyLaboratoryofChiesseMedicinalResourcesRecyclingUtilizationofStateAdministationofTranslationalChineseMedicine; 2.CenterforTranslationalSystemsBiologyandNeuroscience,LaboratoryofIntegrativeBiomedicineofBrainDiseases,SchoolofBasicBiomedicalScience;3.StateKeyLaboratoryCultivationBaseforTCMQualityandEfficacy,NanjingUniversityofChineseMedicine,Nanjing210023,China)
Aim To investigate the regulation of five flavonoids fromAbelmoschlmanihoton the AGEs/RAGE/p38MAPK/NF-κB signaling pathway in GLUTag cells. Methods With GLUTag cells treated with 200 mg·L-1AGEs,Western blot analysis was applied to determine the expression of RAGE, p22Phox, p47Phox, p53 and Bax proteins and ELISA analysis was used to detect the levels of TNF-α, IL-1, IL-6, caspase-3, caspase-9. The cells were divided into seven groups: the normal group(NG), model group(AGEs), quercetin-treated group(QT), isoquercitrin-treated group(IQT), hyperoside-treated group(HY), quercetin-3′-O-glucoside-treated group(QG), gossypetin-8-O-glucuronide-treated group(GG). NG cells were cultured in DMEM low-glucose culture medium without adding any other intervention factors; model group cells were cultured in DMEM low-glucose medium containing 200 mg·L-1AGEs; cells in five treatment groups were cultured in DMEM low-glucose culture medium containing 200 mg·L-1AGEs, which were respectively added 50 μmol·L-1QT, IQT, HY, QG, GG. Western blot analysis was applied to determine the expression of RAGE, p22Phox, p47Phox, p53 and bax proteins and ELISA analysis was used to detect the levels of TNF-α, IL-1, IL-6, caspase-3, caspase-9. Results The contents of RAGE, p22Phox, p47Phox, bax, caspase-3, caspase-9, phospho-p38MAPK, NF-κB and TNF-α, IL-1 and IL-6 significantly increased in model group cells(P<0.01), and the relative expression of p53 was significantly down-regulated(P<0.01) in model group cells. After treated with 50 μmol·L-1quercetin, isoquercitrin, hyperoside, quercetin-3′-O-glucoside, gossypetin-8-O-glucuronide, the content of proteins and inflammatory factors were close to normal group. Conclusion The five flavonoids inAbelmoschusmanihot(L.) Medicus can inhibit AGEs/RAGE/p38MAPK/NF-κB signaling pathway in GLUTag cells.
Malvaceae;Abelmoschusmanihot(L.) Medicus;GLUTag cell; AGEs; RAGE; flavonoids
时间:2017-5-25 17:44 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170525.1744.024.html
2017-02-03,
2017-03-17
国家自然科学基金资助项目(No 81473408,81673533);江苏高等学校中药学优势学科建设项目(No ysxk-2014);教育部新世纪优秀人才计划项目(No NCET-13-0873)
蔡红蝶(1990-),女,硕士生,研究方向:中药功效物质基础,E-mail: caihongdie@foxmail.com; 宿树兰(1974-),女,教授,硕士生导师,研究方向:中药资源化学及方剂功效物质基础,通讯作者,E-mail: sushulan1974@163.com; 段金廒(1956-),男,博士,教授,博士生导师,中国自然资源学会中药及天然药物资源专业委员会主任委员,国家“973”计划首席科学家,E-mail: dja@njucm.edu.cn
10.3969/j.issn.1001-1978.2017.06.012
A
1001-1978(2017)06-0798-08
R282.71;R284.1;R322.45;R329.25;R392.12摘要:目的 探讨黄蜀葵花中5种黄酮类化合物对肠道L细胞AGEs/RAGE/p38MAPK/NF-κB信号通路的调节作用。方法 200 mg·L-1AGEs作用肠道于L细胞株GLUTag细胞,Western blot检测细胞中RAGE、p22Phox、p47Phox、p53、Bax蛋白的相对表达量,ELISA法检测TNF-α、IL-1、IL-6、caspase-3、caspase-9的含量。实验分为7组:空白对照组(NG)、模型组(AGEs)、槲皮素组(QT)、异槲皮苷组(IQT)、金丝桃苷组(HY)、槲皮素-3′-O-葡萄糖苷组(QG)、棉皮素-8-O-葡萄糖醛酸苷组(GG)。NG细胞培养于DMEM低糖培养基中;AGEs细胞培养于含200 mg·L-1AGEs的DMEM低糖培养基中;给药组细胞分别培养于含50 μmol·L-1各黄酮单体及含200 mg·L-1AGEs的DMEM低糖培养基中。各组细胞经药物干预24 h后,Western blot检测细胞中RAGE、p22Phox、p47Phox、p53、Bax、p-p38MAPK、NF-κB蛋白的相对表达量,ELISA法检测TNF-α、IL-1、IL-6的含量及caspase-3、caspase-9的活性。结果 模型组细胞中RAGE、p22Phox、p47Phox、Bax、caspase-3、caspase-9、Phospho-p38MAPK、NF-κB相对表达量及细胞上清液中TNF-α、IL-1、IL-6的分泌量明显上调(P<0.01),p53相对表达量明显下调(P<0.01)。50 μmol·L-1槲皮素、异槲皮苷、金丝桃苷、槲皮素-3′-O-葡萄糖苷、棉皮素-8-O-葡萄糖醛酸苷分别给药后,各蛋白的相对表达量及炎症因子的分泌量接近正常组。结论 黄属葵花中5种黄酮类化合物能明显抑制肠道L细胞AGEs/RAGE/p38MAPK/NF-κB信号通路。