泰安一兔养殖场大肠杆菌耐药性的检测
叶超群 王晓艺 常维山
(①山东农业大学动物科技学院 山东 泰安 271000②山东省烟台市牟平区畜牧兽医工作站)
泰安一兔养殖场大肠杆菌耐药性的检测
叶超群①王晓艺②常维山①
(①山东农业大学动物科技学院 山东 泰安 271000②山东省烟台市牟平区畜牧兽医工作站)
本试验旨在了解泰安宁阳地区兔养殖场大肠杆菌的流行情况与耐药性。在2017年3月份从泰安宁阳一兔养殖场采集20份腹泻兔子的肛门棉拭子。采集后的样品经选择培养基并对其进行革兰氏染色、生化鉴定和16srRNA分离鉴定大肠杆菌后,采用纸片琼脂扩散法(K-B法)检测其对常用14种抗生素的敏感性以表明兔源大肠杆菌分离菌株的耐药性。本试验检测了兔源大肠杆菌分离菌株中24种耐药基因的存在情况,试验检出与编码超广谱β-内酰胺酶有关的blaTEM和blaCTX-M基因,这两个基因的检出率最高,这与头孢类抗生素在兔养殖业里被普遍的使用有关。本试验分析兔养殖场中大肠杆菌的耐药特点,为临床合理选择抗生素提供了可以借鉴的初步依据,对以后在临床工作中能更全面的防治大肠杆菌所引发的感染,从而更有针对性的做出预防对策。
大肠杆菌 耐药基因 检测
大肠埃希氏菌(Escherichiacoli)也称为大肠杆菌,是在1885年由德国细菌学家Escherich分离得到的。大肠杆菌属于革兰氏染色阴性、无芽孢的中等大小直杆菌,它的大小为(0.4~0.7)μm×(2~3)μm,其菌体两端钝圆,多单个散在或者成对排列(Changqingetal.,2001)。从1928年发现青霉素后,各类抗生以及化学合成抗菌药不断的被开发和使用,虽然抗生素在治疗人和畜禽的疾病方面产生了重要的作用,但由于近几十年以来,抗生素被广泛和持续的使用,在加上不科学的使用抗生素,使用时剂量不足或不规范造成抗生素残留等问题,细菌的耐药性开始产生,耐药菌株也相应的迅速出现导致细菌的耐药性传播。尤其是在畜禽养殖业上,一些养殖户和小规模养殖场将某些抗生素作为饲料添加剂加入到日常的饲料或饮水中,在这种特定的抗性选择压力下,病原菌对这些拌料使用的抗生素产生的耐药性越来越严重,这些病菌对抗生素的耐药水平也越来越高。(Threfall et al.,1993)。细菌耐药基因一方面是由其染色体携带,并通过染色体垂直传播。另一方面也可以通过细菌可遗传因子进行传播。耐药基因通过其携带后再进行下一步的融合、转导和转化,在不同种属的遗传物质之间转移或者进行集聚重排由此细菌耐药性开始较为广泛的传播。
1 材料与方法
1.1 材料
试验中所需要用到的革兰染色液、肠杆菌科细菌生化鉴定盒、试验用药敏纸片都购买于杭州滨和微生物试剂有限公司;营养琼脂培养基(Nutrient Agar Medium)、伊红美蓝培养基(EMB)、麦康凯培养基(Maconkey Agar)、SS琼脂培养基都购买青岛高科园海博生物技术有限公司。试验中所用的细菌基因组DNA提取试剂盒购自北京天根生物科技有限公司;PCR反应所需试剂TaqDNA聚合酶、10xPCRBuffer、dNTP和DNAMarker DL 2000等均购自上海生工生物工程公司。
1.2 方法
1.2.1 样品采集及处理 2016年2月到5月,从泰安宁阳地区发病兔养殖场场各采20份发病兔子粪便样品(肛门棉拭子),将采集到的共60份病兔粪便样品装入无菌密封袋中,放置在装有冰袋的实验室专用泡沫盒内。随后将粪便样品在24h内低温送到实验室,再进行对样品中大肠杆菌的分离鉴定。
1.2.2 大肠杆菌的分离纯化及鉴定 增菌:将2g左右的粪便放入灭好菌的LB液体培养基试管内进行摇菌,在37℃摇床内培养12h。划线分离:将接种环在酒精灯外焰下烧至发红,待冷却后蘸取菌液,采用三线法将菌液接种于伊红美兰培养基和麦康凯培养基上,然后放置到37℃恒温培养箱中培养12~24h,可在培养8h左右时先观察一次菌落,继续培养后仔细观察培养基上细菌的形态,接着挑取疑似菌落进行下一步的生化鉴定试验。经生化鉴定后进行革兰氏染色、镜检观察细菌形态,经16srRNA方法鉴定。
1.2.3 药敏实验 采用美国临床和实验室标准协会(Clinical and Laboratory Standards Institute, CLSI)推荐的KB法检测14种常用抗菌药物的敏感性(环丙沙星、氯霉素、萘啶酸、阿莫西林棒酸、妥布霉素、头孢他啶、头孢曲松、庆大霉素、复方新诺明、亚胺培南、四环素、氨苄西林、头孢西叮、阿米卡星)。本试验用大肠埃希菌ATCC25922作为药敏试验质控菌株。
1.2.4 耐药基因的检测 (1)细菌培养:取保存的大肠杆菌菌种,三线法接种于LB琼脂培养基上,37℃培养24h后,挑取生长良好的单个菌落接种到LB培养基中,37℃摇床振荡培养18h。(2)细菌DNA提取:PCR引物的设计:依据已发表的文献设计引物,下列引物的合成都是由上海生工生物工程有限公司完成,引物序列见表1。(3)PCR反应体系:反应体系由以下成分组成:12.5μl PremixTaq酶、模板DNA2μl、上下游引物各1μl、灭菌去离子水8.5μl,反应体系共25μl。反应条件:94℃预变性5min,94℃变性45s,55℃退火45s,72℃延伸90s,循环30次,最后72℃延伸10min,4℃预冷3min。各扩增程序中,退火温度依据扩增用引物的Tm的不同而定异;(4)PCR产物电泳鉴定:将PCR扩增反应产物加入到1%的琼脂糖凝胶的加样孔中,然后再进行电泳(1xTAE为电泳缓冲液,EB染色,3V/cm条件下电泳1h),以DL2000 DNA Marker作为分子量标准,将电泳结果在紫外分析仪上曝光并保存结果;(5)结果统计分析:依据试验的记录结果统计出每个基因的阳性个数,在此基础上进行分析统计。

表1 耐药基因序列(部分)
2 结果
2.1 大肠杆菌的分离鉴定结果
本试验从泰安宁阳地区一兔养殖场采集20份腹泻兔子的肛门棉拭子。经分离鉴定得到20株非重复的大肠杆菌。大肠杆菌接种到营养琼脂培养基上生长18~24h后,在培养基表面能看到不产生色素、形状为圆形、表面有微微凸起、边缘整齐、半透明灰白色的菌落,形状为中等大小。在伊红美蓝培养基上形成黑色带金属闪光的光滑性菌落;在麦康凯培养基上培养,其生长后形成红色菌落。将大肠杆菌接种到液体培养基里面生长培养18~24h后,能见到试管内部的菌液混浊,在试管的底部有黏性沉淀存在并在试管液面的管壁上形成一圈肉眼能看见的菌环个别致病菌株在血琼平板上出现β溶血。根据《伯杰氏手册》上面有关于大肠杆菌鉴定,菌株都符合大肠杆菌的生化特性。经16srRNA鉴定后将测序结果在NCBI数据库中进行比对,均与大肠杆菌属的序列同源性为99%以上。由此判断经过培养基和生化试验筛选出来的是大肠杆菌。
2.2 药敏试验结果
20株兔源大肠杆菌分离菌株对14种抗生素表现出不同程度的耐药,相比较来看,该养殖场大肠杆菌分离菌株对四环素的耐药率最高,对萘啶酸、氨苄西林的耐药率还是比较高的,对复方新诺明、氯霉素这抗菌两种药物的耐药率次之。对头孢他啶、头孢曲松、亚胺培南、阿米卡星这四种药物敏感几乎都不产生耐药。
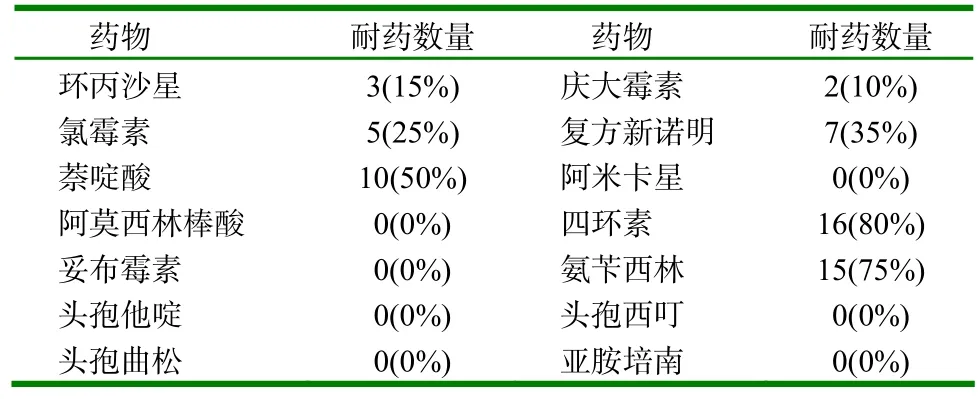
表2 药敏试验结果
2.3 大肠杆菌耐药基因检测结果
2.3.1 大肠杆菌耐药基因的扩增结果
图1 大肠杆菌 blaTEM 基因扩增结果
2.3.2 大肠杆菌耐药基因的统计结果 利用PCR技术检测了20株兔源大肠杆菌分离菌株对24种耐药基因的携带情况。此外blaSHV、blaOXA、blaPSE、qnrA、qnrB、qepA、aac(3′)-I、aph(3′)-IV、ant(2”)、tetA和catB基因的检出率为零。检出率最高的是β内酰胺酶类的两种耐药基因,分别是blaTEM(100%)和blaCTX-M(95%)。qnrS和aac(6′)-Ib-cr耐药基因的检出率分别是5%和10%。aac(3)-Ⅱ耐药基因的检出率为15%。有2株大肠杆菌检测出tetB耐药基因,检出率为10%。磺胺类耐药基因(sul-1、sul-2、sul-3)结果显示:有8株大肠杆菌检测出sul-2耐药基因的,检出率为40%。氯霉素耐药基因cmlA和flor耐药基因的检出率分别是5%和10%。
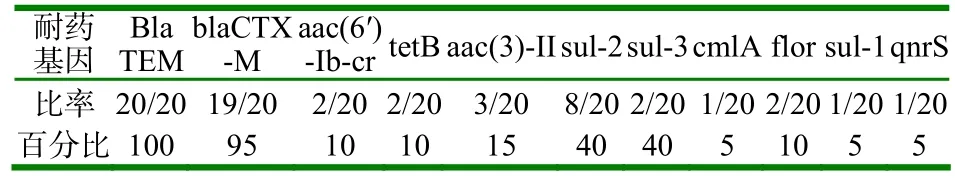
表3 耐药基因的检测结果
3 讨论
本试验从泰安宁阳地区一兔养殖场采集20份腹泻兔子的肛门棉拭子。经分离鉴定得到20株非重复的大肠杆菌。(1)从试验结果可知,从泰安宁阳地区分离的20株兔源大肠杆菌分离菌株对14种抗菌药物表现出不同程度的耐药。20株兔源大肠杆菌分离菌株对阿莫西林棒酸、妥布霉素、头孢他啶、头孢曲松、阿米卡星、头孢西叮、亚胺培南这7种药物表现为敏感,其原因可能是在兽医临床应用方面者四种药物使用较少或者时间上较晚导致。其中头孢他啶对细菌的作用较强但其对钝化酶稳定,所以在一定程度上敏感率是较高的。分离菌株对四环素、氨苄西林、萘啶酸、复方新诺明、氯霉素、环丙沙星等药物耐药性具有耐药性,究其原因可能与在临床用药方面这几种药物使用的时间早且与使用广泛有关,而四环素属于在应用时间上较晚且剂量上面较少的抗菌药物,但细菌对四环素已表现出较高的耐药性。与此同时喹诺酮类药物是在临床用药方面应用比较晚的一种广谱抗菌药物,而它的耐药性也已经开始不断的产生。这表明了动物源大肠杆菌对抗菌药物的适应性较强,也提醒在兽医临床用药方面抗菌要去的选择并不是越新的药物效果就越好。因此,临床用药方面应该根据药敏试验结果科学的选择针对病原菌的抗菌药物。在联合用药方面,最好与没有交叉耐药性的药物进行配合使用,并做到剂量科学。在疗程上时间要充足并尽可能控制和推迟大肠杆菌对抗菌药物产生耐药性,在一定程度上提高药物防治大肠杆菌的效果。(2)在耐药基因的检测中检出与编码超广谱β-内酰胺酶有关的 blaTEM和blaCTX-M基因,这两个基因的检出率最高,这与头孢类抗生素在兔养殖业里被普遍的使用有关,也有相关的报道称(RotimiVO,2008)头孢类的耐药菌株已经出现,并且耐药性率逐年升高,由此说明了该养殖场具有对头孢菌素产生耐药性的潜能,应该要引起注意。在耐药基因的检测中磺胺类的耐药基因sul-2的检测率较高为40%,这说明泰安地区兔源大肠杆菌分离菌株对磺胺类药物不敏感,其耐药性也较高。坤清芳等(冯雯雯,2016)对兔源大肠杆菌喹诺酮基因中qnrS和aac(6′)-Ib-cr 基因的检出率分别为59.8%和80.4%,本试验中对qnrS和aac(6′)-Ib-cr 基因的检出率分别为5%和10%。本次检测出的几种喹诺酮基因检出率均较低,表明该养殖场兔源大肠杆菌中流行的PMQR基因多样性较低,细菌的耐药基因在一定程度上存在很大的差异,究其原因这可能与地域差异性和不同的养殖情况有关。
[1] 蔡宝祥. 家畜传染病学[M]. 北京∶ 中国农业出版社, 2001, 46-52; 103-106.
[2] 姜中其, 陈晓红, 方维焕等. 规模化猪场仔猪断奶腹泻大肠杆菌耐药性监测[J]. 浙江大学学报(农业与生命科学版), 2004, 30(5)∶ 567-571.
[3] 简翠, 叶涛, 张蓓等.. Mohnarin 2006~2007年度报告∶ 中南地区细菌耐药监测[J]. 中国抗生素杂志, 2008, 33(10)∶ 608~616.
[4] 焦显芹, 肖力, 刘河冰等. 氨基糖苷类药物高水平耐药. 16S rRNA甲基化酶的研究进展[J]. 中国畜牧兽医, 2009(6)∶ 128-130.
[5] 耿增强. 兽医微生物学[M]. 北京∶ 中国农业出版社, 1998, 106-107; 176-177.
[6] 甘肃农业大学. 兽医微生物(第2版)[M]. 北京∶ 中国农业出版, 1999, 209-217; 275-278.
[7] 刘梦元, 吴斌, 刘建杰等. 规模化猪场大肠杆菌的耐药性监测及血清流行病学调查[J]. 中国兽医学报, 2004, 24(1)∶ 16-18.
[8] 吕殿红, 曾振灵, 陈杖榴等. 大肠埃希菌多重耐药性的形成机制[J]. 动物医学进展, 2007, 28(7)∶ 76~81.
[9] 李德喜, 刘建华, 张素梅等. 猪源大肠杆菌质粒和染色体介导的喹诺酮类药的耐药机制[J]. 中国兽医学报, 2011, 31(9)∶ 1262-1265.
[10] 雷连成, 陈伟, 韩文瑜. 大肠杆菌对氟喹诺酮类药物的耐药机制研究现状[J]. 中国兽药杂志, 2002, 36(2)∶ 49-53.
[10] 马孟根, 王红宁, 余勇等. 猪源致病性沙门氏菌耐药基因的分析
[J]. 畜牧兽医学报, 2006, 37(1)∶ 65-70.
[11] 马传新, 唐海英. β-内酰胺抗生素的耐药机制及对策[J]. 中国医院药学杂志, 2000, 20(12)∶ 743-745.
[12] 冯雯雯, 杜昕昕, & 曹宾霞. 抗生素抗性分析法在粪便污染源示踪技术中的应用[J]. 环境科学与管理, 2011, 36(5)∶ 147-151.
[13] Brown M G, Mitchell E H, Balkwill D L. Tet 42, a novel tetracycline resistance determinant isolated from deep terrestrial subsurface bacteria. Antimicrobial agentsand chemotherapy M 2008. 52(12)∶ 4518-4521.
[14] Biswas T′, Houghton J L,Garneau T S et al.The structural basis for substrateve--rsatility of chloramphenicol acetyltransferase CATI. Protein Science,2012.
[15] Changqing Q, Xueli Y. Clostridium infection(jisizheng) in yaks in Qinghai, China[J]. Vet Res Commun. 2001, 25(7)∶ 555-63.
[16] Diane GN, Marion K, Linda V et al. Food-borne diseases∶The challenges of 20 years ago still Persist while new ones continue to emerge[J].International Journal of Food Mierobiology, 2010, 59(5)∶ 1-13.
[17] Foley SL, Lynne AM. Food animal-associated salmonella challenges∶Pathogenieity and antimicrobial resistance[J]. Journal of Animal Scienee, 2008, 86(14)∶ 173-187.
[18] Perreten V. Boerlin P. A new sulfonamide resistance gene(sul3) in Escherichia coli is widespread in the pig population of Switzerland. Antimicrobial Agents and Chemotherapy, 2003. 47(3)∶. 1169-1172.
[19] Threfall EJ, Rowe B, Ward LR. A comparison of multiple drug resistance in Salmonellas from humans and food animal in England and Wales, 1981 and 1990. Epidemiol Infect, 1993, 111∶ 189-197
[20] Van Den Hurk J V, Allan B J. Effect of infection with hemorrhagic entertis virus on susceptibility of turkeys to Escherichia coli[J]. Avian Dis, 1994, 38∶ 708-716.
S852.61+2
A
1007-1733(2017)06-0004-03
2017–05–01)

