红霉素分子印迹二维光子晶体水凝胶传感器的研究
高敏君+刘根起+薛亚峰+陈小娟+师维江+范晓东
摘 要 以红霉素为印迹分子,聚苯乙烯二维光子晶体为模板,甲基丙烯酸为功能单体,乙二醇二甲基丙烯酸甲酯为交联剂,2,2二乙氧基苯乙酮为引发剂,紫外光引發聚合,在甲醇乙酸(9∶1, V/V)中洗脱印迹分子,得到能够特异性识别红霉素的分子印迹二维光子晶体水凝胶。通过测试德拜环直径变化,研究了此水凝胶在红霉素溶液中的响应性能。实验结果表明,当红霉素的浓度从0增加到1×106 mol/L时,德拜环直径增加6 mm, 相应的晶格间距减小30 nm。此外,水凝胶在1×106 mol/L红霉素的类似物罗红霉素、琥乙红霉素溶液中,德拜环直径仅分别增加1.5和2.0 mm,表明此光子晶体水凝胶具有良好的选择性,有望用于红霉素低成本的简易检测。
关键词 分子印迹; 二维光子晶体; 水凝胶; 红霉素; 传感器
1 引 言
红霉素(Erythromycin, EM)为大环内酯类抗生素,对革兰阳性菌有较强的抑制作用[1]。因其价格低廉,在医药业和养殖业广泛使用,造成了红霉素滥用问题日益突出。红霉素具有潜在的肝毒性,长期服用红霉素或食用红霉素残留的食品,可引起胆汁淤积、肝酶升高和坏死性肝病,以及精神障碍和关节炎综合症等疾病[2]。为保证食品安全,我国规定动物组织中红霉素的最高残留限量为200 μg/kg[3]。 王丹等[4]研究发现,我国地表水中含有68余种抗生素,部分抗生素在珠江、黄浦江等的取样检出率高达100%,其中包括红霉素。发生在2006年的“多宝鱼事件”,红霉素就是污染源之一。因此, 建立能够准确、专一检测红霉素的方法,有助于保障公众饮水安全,监测控制水污染。
目前,红霉素的检测方法主要有微生物法[5]、免疫法[2]、光度法[6]、高效液相色谱串联质谱法[7]等。微生物法检测成本低、设备简单,但稳定性差,灵敏度低; 免疫法特异性强、灵敏度高,适用于开发试剂盒; 光度法设备简单、灵敏度低。高效液相色谱串联质谱法分离速度快、效率高,但仪器体积大、昂贵,需要专业人员操作。
分子印迹技术(MIT)是制备对特定分子具有专一识别性能的聚合物的技术[8]。光子晶体水凝胶(Photonic crystal hydrogel)[9]则是将光子晶体包埋在智能凝胶中,凝胶在外界环境刺激下产生体积变化,同时引起光子晶体晶格参数变化,光子带隙的位置发生移动,如果带隙位置移动较大,材料的结构色会发生变化。将分子印迹技术与光子晶体水凝胶相结合制得的分子印迹光子晶体水凝胶,能够对目标分子实现专一识别作用,可用于检测牛血清蛋白[10]、双酚A[11]、香草醛[12]、有机磷[13]、氯胺酮[14]、L苯丙氨酸[15]、L色氨酸[16]、辛克宁[17]、2,4,6三氯酚[18]、四环素[19],氯霉素[20],诺氟沙星[21]等, 具有灵敏度高、无需标记、专一性好等特点。
目前,分子印迹光子晶体水凝胶均使用三维光子晶体作为模板,尚未见以二维光子晶体为模板的报道。三维光子晶体模板的制备过程比较繁琐费时,而二维光子晶体制备过程相对简单快速,在光子器件[22]和传感器[23]等领域已得到应用。二维光子晶体具有独特的光学性质,即对入射光有较强的朝前衍射[24],当单色光垂直入射时,在二维光子晶体背面会产生德拜衍射环[25,26],衍射环能够直观地反映凝胶体积变化,简单、快速,无需借助复杂仪器设备,并且德拜衍射检测范围更广。Asher等利用这种原理制备了响应抗生物素蛋白[27]、刀豆蛋白[28]、葡萄糖[29,30]、氨和湿度[26]、pH值[31]及白色念珠菌[32]等多种传感器。目前,尚未见二维光子晶体水凝胶检测抗生素的报道。本研究以红霉素为印迹分子,制备红霉素分子印迹二维光子晶体水凝胶,通过测试德拜环直径,研究了此光子晶体水凝胶在红霉素溶液中的响应性,有望将其用于红霉素的检测。
2 实验部分
2.1 仪器与试剂
UV2550紫外可见光分光光度计(日本岛津公司); JSM6460扫描电镜(日本电子株式会社); 78HW1型恒温加热磁力搅拌器(常州国华电器有限公司); KQ250DE超声波清洗器(昆山市超声仪器有限公司); TG16WS离心机(湘仪离心仪器有限公司); VORTEX5涡旋振荡器(海门市其林贝尔仪器制造有限公司); FA2004N精密电子天平(上海精密科学仪器有限公司); HH1数显恒温水浴锅(余姚长丰仪表厂); 绿色激光笔(波长532 nm,西安市诺青激光有限公司); SZ93自动双重纯水蒸馏器(上海亚荣生化仪器厂)。
红霉素(EM,98.23%,Aladdin公司); 罗红霉素(RM,94%,上海源叶生物科技有限公司); 琥乙红霉素(EEs,76.5%,大连美仑生物技术有限公司); 苯乙烯(分析纯,天津市天力化学试剂有限公司); 甲基丙烯酸(分析纯,天津市福晨化学试剂厂,减压蒸馏去除阻聚剂)、乙二醇二甲基丙烯酸甲酯(EGDMA,分析纯,北京百灵威科技有限公司); 2,2二乙氧基苯乙酮(DEAP,分析纯,国药集团化学试剂有限公司); 其它试剂均为分析纯。 载玻片(25.4 mm×75.6 mm×1 mm)、盖玻片(18 mm×18 mm×0.1 mm)。
2.2 聚苯乙烯微球的制备及二维光子晶体的自组装
采用无皂乳液聚合[33]的方法制备粒径为800 nm的单分散的聚苯乙烯(PS)微球,用去离子水配制成20%(w/w)的PS乳液,将其与正丙醇以2∶1(V/V)比例混合,超声分散均匀。采用针尖注射法[34~36], 用注射泵在去离子水表面制得大面积色彩鲜艳的单层PS光子晶体,注射速度为50 μL/min。注射时,针尖一半在水中,一半在空气中,注射出的PS微球在表面张力的作用下,在水表面自组装得到单层PS二维光子晶体阵列。最后将载玻片倾斜插入液面以下,向上提拉,即可将水面上的二维光子晶体转移至载玻片,在空气中垂直放置,晾干备用。
2.3 红霉素分子印迹二维光子晶体水凝胶(MIPH)的制备
准确称取0.0866 g(0.1173 mmol)红霉素,溶于0.3 mL甲醇中, 再加入0.1 mL(1.173 mmol)甲基丙烯酸(MAA),超聲混合均匀后于阴暗处静置3 h,加入22 μL(0.1173 mmol)交联剂 EGDMA和13 μL引发剂DEAP(20%(w/w)的甲醇溶液),混匀后通氮除氧10 min。
用滴管吸取50 μL前驱液,滴加在四周粘有单层透明胶带的聚苯乙烯二维光子晶体表面,另取一片载玻片,沿着一侧缓慢覆盖在光子晶体模板上面,使光子晶体被前驱液完全浸润变为透明,操作中保证没有气泡产生。用夹子加紧载玻片四周,置于365 nm紫外灯下冰浴光聚合1 h。聚合完成后,轻轻揭开载玻片,将凝胶浸泡在40 mL甲醇乙酸(9∶1, V/V)中洗脱印迹分子,间隔2 h更换一次洗脱液,更换4次, 直到印迹分子被完全除去。最后,将得到的分子印迹光子晶体水凝胶用去离子水冲洗干净, 浸泡在pH 7.6的10 mmol/L磷酸盐缓冲溶液(PBS)中,使其达到溶胀平衡状态,即制得红霉素分子印迹二维光子晶体水凝胶(Molecularly imprinted photonic crystal hydrogel, MIPH),制备过程如图1所示, 作为对照实验,非分子印迹光子晶体水凝胶(Nonmolecularly imprinted photonic crystal hydrogel, NIPH)制备方法同上,只是在前驱液中不加入红霉素。
2.4 MIPH响应行为研究
通过二维光子晶体水凝胶对于激光衍射产生的德拜环直径的变化,研究MIPH对红霉素分子的响应性。在自制实验装置上测量德拜环直径,如图2所示:使用波长为532 nm的绿色激光从垂直方向入射凝胶,在底部水平面上得到衍射产生的德拜环图样,用直尺(最小刻度1 mm)测量出德拜环直径D, 德拜环直径D与晶格间距d的关系为[26~29]:
式中, λ是衍射光波长,h是光子晶体水凝胶与投影平面的距离。
MIPH对印迹分子红霉素的特异性识别会引起凝胶体积变化,进一步导致晶格间距发生变化,在单色光的垂直照射下,可直观表现为德拜环直径的变化。因此,通过测量德拜环直径的变化可以反映水凝胶的响应情况。
3 结果与讨论
3.1 PS二维光子晶体及MIPH的表征
图3A是利用针尖注射法制备的聚苯乙烯二维光子晶体的SEM图和实物图。 由SEM图可见, 制得的二维光子晶体为单层的、规整的六方紧密堆积; 实物图显示此光子晶体具有鲜艳的颜色。图3B是红霉素分子印迹水凝胶的SEM图和实物图。 从SEM图可清楚看到,形成凝胶后PS微球仍然规则地镶嵌在水凝胶的表面,这为后续的德拜环表征奠定了基础。
3.2 MIPH对红霉素溶液的响应性
将上述制备的MIPH和NIPH从低到高分别依次浸泡在EM浓度为0、1×1012 mol/L、 1×1010 mol/L、 1×108 mol/L、 1×106 mol/L、1×104 mol/L的PBS溶液(10 mmol/L, pH 7.6)中,待凝胶溶胀平衡后,进行德拜环测量。
图4和图5分别为MIPH/NIPH在不同浓度红霉素溶液中德拜环直径和晶格间距的变化图,当EM浓度从0 到1×106 mol/L时,德拜环逐渐增大,在EM浓度为1×106 mol/L时,德拜环直径增大6 mm,相应地晶格间距减小30 nm。但EM浓度继续增大,德拜环直径几乎不变,这可能是由于凝胶内部的识别位点的吸附量达到饱和所致。而NIPH在EM度为1×106 mol/L时,德拜环直径仅增大1.5 mm,相应地晶格间距减小8 nm。在1×1010~1×106 mol/L浓度范围内,德拜环直径与红霉素浓度呈线性关系,故检测范围为1×1010~1×106 mol/L。 图4的嵌入图片为在与法线夹角40°的固定平行光线照射下,MIPH在不同浓度红霉素溶液中的颜色变化,随着EM浓度增加,凝胶颜色由黄色变为绿色,再变为蓝色。
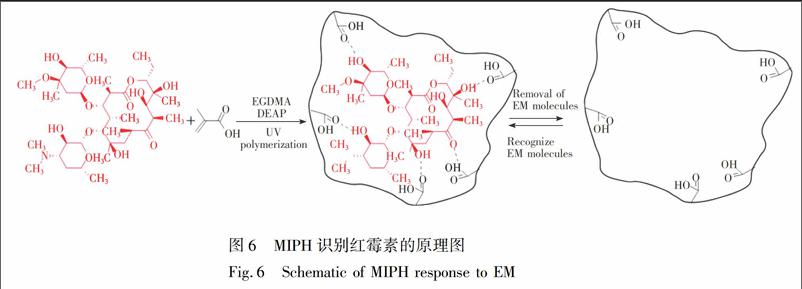
MIPH能够响应EM分子,是因为水凝胶的三维网络中存在大量与EM在形状及作用位点相匹配的孔腔,这些孔腔可EM分子发生特异性结合[17~19](原理如图6),增加了凝胶内部的交联点,使凝胶收缩,德拜环直径增大,晶格间距减小。而NIPH内部不存在类似的识别孔腔,无法与EM分子发生特异性结合,只能进行非特异性吸附,其晶格间距仅发生微小的变化。
3.3 交联剂用量对MIPH响应行为的影响
交联密度是影响水凝胶结构、强度和溶胀率的重要因素之一。实验中通过调节交联剂的用量,分别制备了交联度为5%、 10%、 15%, 20%的MIPH,测定其响应性能,结果表明,随着EM浓度的增加,德拜环直径变化量随交联度的增大而减小,最大变化量分别为0.70、0.60、0.50和0.30 cm。这是因为随着交联度增加,印迹分子与识别位点结合后,凝胶溶胀能力减小,晶格间距变化减小。从这一角度考虑,交联度5%的MIPH响应行为最大,但是在这样低交联度条件下,凝胶的力学强度较低,对于检测操作和使用不利。因此,本实验采用交联度为10%的MIPH。
3.4 印迹分子与功能单体摩尔比对MIPH响应行为的影响
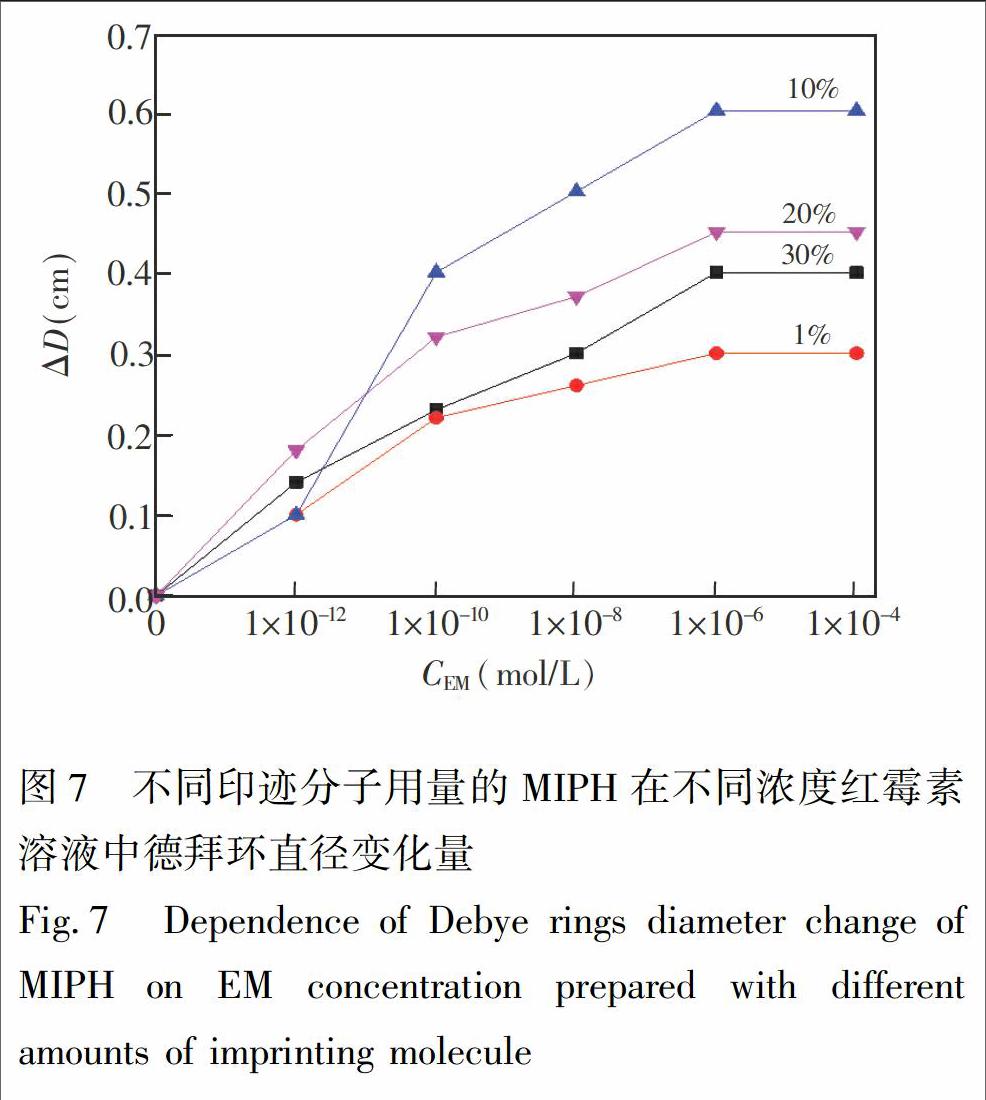
印迹分子用量直接影响印迹孔腔数量,对MIPH的响应行为有很大影响。本实验制备了印迹分子用量为功能单体MAA物质的量的1%、 10%、 20%、 30%的MIPH,研究其在不同浓度红霉素溶液中的响应性,结果如图7所示,不同印迹分子用量的MIPH德拜环直径随测定溶液中EM浓度的增加而增大,即凝胶体积收缩。其中印迹分子用量为10%的MIPH德拜环直径增加0.60 cm,响应变化幅度最大。而印迹分子用量为1%、 20%和30%的MIPH则分别增加0.30、 0.45和0.40 cm。分析产生的原因可能是当印迹分子用量过多时,红霉素除了与MAA形成氢键,也可能同其它红霉素分子以氢键形式复合,而这种红霉素复合物形成的孔腔对于单个红霉素分子不具有特异性识别功能,使得MIPH对红霉素分子的响应性降低。当印迹分子用量过少时,凝胶中形成的有效印迹孔腔数相对较少,对MIPH的响应不利。因此本实验确定印迹分子用量为功能单体物质的量的10%。
3.5 MIPH的响应平衡时间
将MIPH置于1×104 mol/L红霉素溶液中,间隔30 min进行德拜环测定。实验表明,MIPH在红霉素溶液中,德拜环直径不断增大,随着时间延长, 变化速率逐渐趋缓,于4 h后达到吸附平衡。这是由于红霉素分子体积相对较大,扩散进入二维光子晶体水凝胶网络中需要一定时间,随着红霉素分子与识别孔腔特异性结合,凝胶不断收缩,德拜环直径不断增大,当凝胶达到吸附平衡时,德拜环直径则趋于稳定。
3.6 MIPH的重复利用性
本实验制备的光子晶体水凝胶具有良好的物理稳定性和化学稳定性。实验采用同一片MIPH对1×104 mol/L红霉素溶液进行反复测定,每次测定后用甲醇/乙酸(9∶1, V/V)将EM洗脱完全,重复测定5次,其响应特性无明显变化,具有良好的重复利用性。
3.7 MIPH的特异识别性
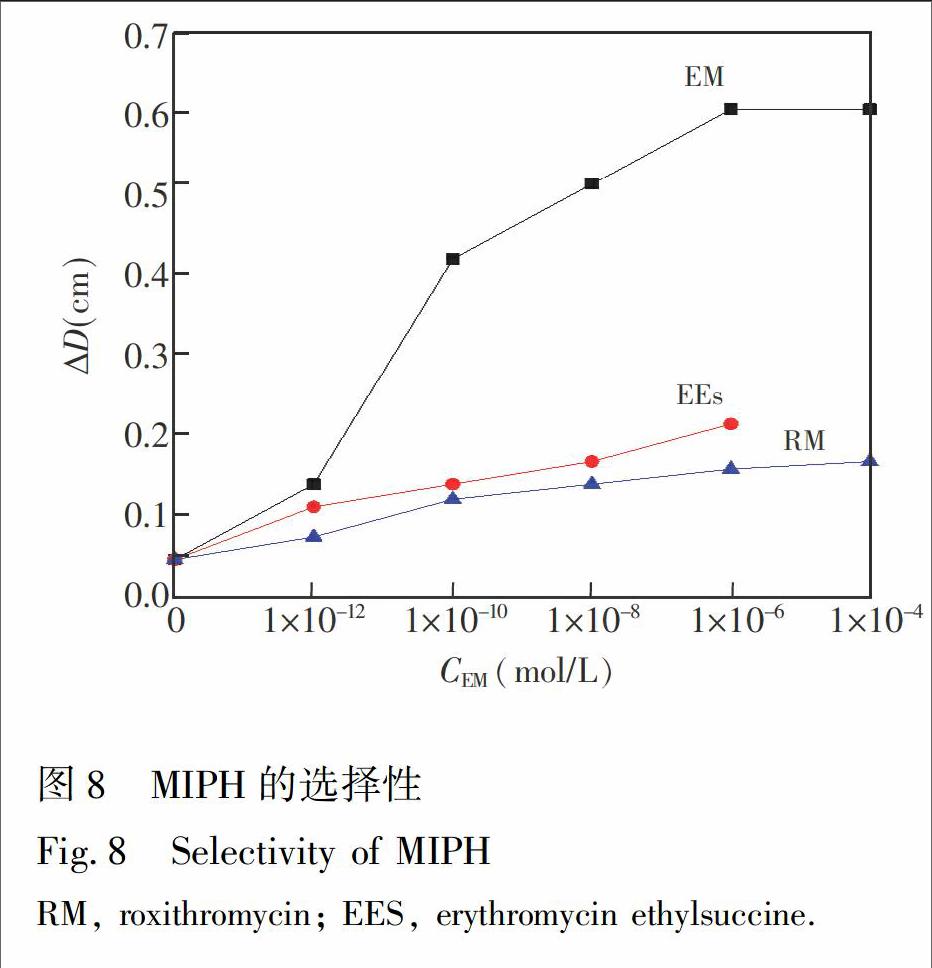
为了进一步研究MIPH的特异识别性,选择了与红霉素结构比较相似罗红霉素(RM)和琥乙红霉素(EEs)进行对比试验,测试MIPH在不同浓度的RM和EEs溶液中, 德拜环直径的变化。结果如图8,
MIPH在浓度均为1×106 mol/L的RM和EEs溶液中德拜环直径仅增加约1.5 和2.0 mm(EEs在PBS中溶解度较低,无法配制更高浓度),明显小于其在EM溶液中德拜环直径的变化量,证明MIPH仅对红霉素具有特异识别性。
3.8 MIPH对模拟水样中红霉素的检测
取西北工业大学自来水作为空白水样(3份),以磷酸为显色剂, 在485 nm处测其吸光度为0, 说明其中不含有红霉素。调节水样pH≈7.6,MIPH置于其中未发生响应; 在水样中加入红霉素,使其浓度为1×108 mol/L,实验发现MIPH德拜环直径增大4.5 mm。此结果表明,MIPH在模拟水样中对EM仍具有较高的选择识别性,有望用于水体中红霉素的检测。
取西北工业大学启真湖水作为空白水样,静置、过滤后同样磷酸作为显色剂,在485 nm处无吸收峰,说明该水样中不含有红霉素。调节水样pH≈7.6,MIPH置于其中, 德拜环直径未发生明显变化; 在水样中加入红霉素,使其浓度为1×108 mol/L,MIPH置于其中, 德拜環直径增大,ΔD平均值为5.3 mm(n=2)。 此结果表明,MIPH在模拟水样中对EM仍具有较高的选择识别性,具有一定的抗干扰能力。
4 结 论
本研究以红霉素为印迹分子,聚苯乙烯二维光子晶体为模板,制备了红霉素分子印迹二维光子晶体水凝胶,它具有高选择性、可重复性和自表达的特点,能够选择性地识别EM,对结构类似的RM和EEs无明显的响应。 此水凝胶制备简单,操作方便,有望用于水体中红霉素的现场检测。
References
1 ZHAO Na, HU XiaoLing, GUAN Ping, SONG RenYuan, TIAN Tian, ZHANG XiangRong. Acta Phys. Chim. Sin., 2014, 30(1): 121-128
赵 娜, 胡小玲, 管 萍, 宋任远, 田 甜, 张向荣. 物理化学学报, 2014, 30(1): 121-128
2 Li X M, Shen J Z, Wang Q, Gao S X, Pei X Y, Jiang H Y, Wen K. Anal. Bianal. Chem., 2015, 407(30): 9125-9133
3 Maximum Residue Limits for Veterinary Drugs in Animal Foods. 235 Notice of Ministry of Agriculture of the Peoples Republic of China
动物性食品中兽药最高残留限量. 中华人民共和国农业部公告第235号
4 WANG Dan, SUI Qian, ZHAO WenTao, LYU ShuGuang, QIU ZhaoFu, YU Gang. Chin. Sci. Bull., 2014, 1(9): 743-751
王 丹, 隋 倩, 赵文涛, 吕树光, 邱兆富, 余 刚. 科学通报, 2014, 1(9): 743-751
5 LIU GongLiang, ZHAO XiaoJuan, CHEN YiQi, CHEN HaiGuang, BAI WeiDong. Journal of Food Safety and Quality, 2014, 5(6): 1751-1756
刘功良, 赵晓娟, 陈艺琦, 陈海光, 白卫东. 食品安全质量检测学报, 2014, 5(6): 1751-1756
6 LI Jun, LI Yan, CHANG FangFang, LI QuanMin. Chem. Res. Appl., 2009, 21(7): 960-963
李 俊, 李 炎, 常方方, 李全民. 化学研究与应用, 2009, 21(7): 960-963
7 ZHOU Ling, WU LiMing, ZHOU JinHui. Journal of Chinese Institute of Food Science and Technology, 2013, 13(6): 198-202
周 玲, 吴黎明, 周金慧. 中国食品学报, 2013, 13(6): 198-202
8 Chen L, Xu S, Li J. Chem. Soc. Rev., 2011, 40(5): 2922-2942
9 Wang H, Zhang K Q. Sensors, 2013, 13(4): 4192-4213
10 Guo M J, Zhao Z, Fan Y G, Wang C H, Shi L Q, Xia J J, Long Y, Mi H F. Biomaterials, 2006, 27(24): 4381-4387
11 Griffete N, Frederich H, Maitre A, Ravaine S, Chehimi M M, Mangeney C. Langmuir, 2012, 28(1): 1005-1012
12 Peng H, Wang S, Zhang Z,Xiong H, Li J, Chen L, Li Y. J. Agric. Food Chem., 2012, 60(8): 1921-1928
13 LIU Feng, HUANG ShuYue, XUE Fei, CHANG Jing, XUE Min, MENG ZiHui. Chinese J. Anal. Chem., 2012, 40(8): 1153-1158
劉 烽, 黄舒悦, 薛 飞, 常 靖, 薛 敏, 孟子晖. 分析化学, 2012, 40(8): 1153-1158
14 Meng L, Meng P, Zhang Q, Wang Y. Anal. Chim. Acta, 2013, 771(7): 86-94
15 Liu X Y, Fang H X, Yu L P. Talanta, 2013, 116: 283-289
16 Yang Z, Shi D, Chen M, Liu S. Anal. Methods, 2015, 7(19): 8352-8359
17 Zhang Y N, Huang S M, Qian C T, Wu Q Z, He J F. J. Appl. Polym. Sci., 2016, 133(11): 43191-43199
18 XUE YaFeng, LIU GenQi, GAO MinJun, CHEN XiaoJuan, FAN XiaoDong. Chinese J. Anal. Chem., 2016, 44(12): 1828-1833
薛亚峰, 刘根起, 高敏君, 陈小娟, 范晓东. 分析化学, 2016, 44(12): 1828-1833
19 Wang L Q, Lin F Y, Yu L P. Analyst, 2012, 137(15): 3502-3509
20 Zhou C, Wang T, Liu J, Guo C, Peng Y, Bai J, Liu M, Dong J, Gao N, Ning B, Gao Z. Analyst, 2012, 137(19): 4467-4474
21 ZHANG Rong, LIU XiaoYan, YU LiPing. Chem. Ind. Eng., 2016, 33(3): 39-44
张 蓉, 刘晓燕, 余莉萍. 化学工业与工程, 2016, 33(3): 39-44
22 Jeon S W, Han J K, Song B S, Nada S. Optics Express, 2010, 18(18): 19361-19366
23 ZANG Wenling, JIANG Lan, ZHANG XiaoHui, WANG JingYu, GUO Ming. Chinese Journal of Luminescence, 2016, 37(5): 603-607
臧文玲, 姜 岚, 张晓辉, 王景宇, 郭 明. 发光学报, 2016, 37(5): 603-607
24 Tikhonov A, Kornienko N, Zhang J T, Wang L, Asher S A. J. Nanophotonics, 2012, 6(1): 3957-3965
25 Cai Z, Smith N L, Zhang J T, Asher S A. Anal. Chem., 2015, 87(10): 5013-5025
26 Smith N L, Hong Z, Asher S A. Analyst, 2014, 139(24): 6379-6386
27 Zhang J T, Chao X, Liu X, Asher S A. Chem. Commun., 2013, 49(56): 6337-6339
28 Zhang J T, Cai Z, Kwak D H, Liu X, Asher S A. Anal. Chem., 2014, 86(18): 9036-9041
29 Cai Z, Luck L A, Punihaole D, Madurac J D, Asher S A. Chem. Sci., 2016, 7: 4557-4562
30 Xue F, Meng Z, Wang F, Wang Q, Xue M, Xu Z. J. Mater. Chem. A, 2014, 2(25): 9559-9565
31 Cai Z, Zhang J T, Xue F, Hong Z, Punihaole D, Asher S A. Anal. Chem., 2014, 86(10): 4840-4847
32 Cai Z, Kwak D H, Punihaole D, Hong Z, Velankar S S, Liu X, Asher S A. Angew. Chem., 2015, 54(44): 13036-13040
33 Reese C E, Asher S A. J. Colloid Interface Sci., 2002, 248(1): 41-46
34 Zhang J T, Wang L, Lamont D N,Velankar S S, Asher S A. Angew. Chem. Int. Ed., 2012, 51(25): 6117-6120
35 Zhang J T, Wang L, Luo J, Tikhonov A,Kornienko N, Asher S A. J. Am. Chem. Soc., 2011, 133(24): 9152-9155
36 Zhang J T, Chao X, Asher S A. J. Am. Chem. Soc., 2013, 135(30): 11397-11401

