河内白曲霉酸性α-淀粉酶高产菌株的诱变选育*
张玉然 张晓云 郭兰英 张海林
(1济宁医学院生物科学学院 山东日照 276826 2山东徐旭酒曲有限公司 山东济宁 272000)
酸性α-淀粉酶属于液化酶(α-淀粉酶)的一种,可在低pH值条件下随机切断淀粉分子内的α-1,4糖苷键,迅速将其降解为糊精、寡糖等小分子[1-2]。 酸性 α-淀粉酶广泛应用于酿酒、制糖、纺织、饲料、造纸等行业,具有良好的社会和经济效益[3]。
在淀粉质原料的水解制糖工艺中,由于α-淀粉酶和糖化酶最适反应pH值的差异,淀粉质原料液化后进入糖化前需加入大量酸试剂调低pH值。开发耐酸性的α-淀粉酶,使其最适反应pH值与糖化酶相近,可节省大量酸试剂的消耗,节约成本[4-5]。
目前,研究者对黑曲霉和枯草芽孢杆菌液态发酵生产酸性α-淀粉酶的研究较多,并通过多种方法选育获得了高产菌株,广泛应用于医药、纺织和环境治理等领域[6-8]。 但在酿酒行业,由于白酒香味和口感的特殊需求,常利用河内白曲霉(Hanoiwhite starter)固态发酵生产酸性α-淀粉酶,并将生产出的含酸性α-淀粉酶的固态白曲直接应用于白酒生产。目前研究者对该菌株的研究较少,固态发酵的酸性α-淀粉酶酶活力普遍较低,筛选具有高产酸性α-淀粉酶能力的河内白曲霉势在必行。
本研究以河内白曲霉为出发菌株,采用不同浓度的DES诱变处理萌发过夜的河内白曲霉孢子,后根据透明圈法筛选高产突变株,进一步摇瓶复筛,以期获得产量高、稳定性好的河内白曲霉突变株。
1 材料与方法
1.1 材料
1)菌种。河内白曲霉为实验室保存。
2)培养基。
①改良的PDA培养基:土豆浸出汁 30%,琼脂 2%,自然pH值。②筛选培养基:玉米淀粉2%,酵母 0.5%,KCl 0.1%,KH2PO40.03%,MgSO4·7H2O 0.05%,FeSO4·7H2O 0.0002%,琼脂 2%,pH 6.5~7.0。③固体发酵培养基:麸皮12.5 g,自来水12.5 mL,置于500 mL三角烧瓶。
1.2 菌株的诱变筛选
1.2.1 孢子悬液的制备 于麦芽汁斜面培养基中刮取孢子,加入含25 mL 2 g/L葡萄糖的三角瓶中,混匀打散,稀释至孢子数为107CFU/mL,于室温下静置萌发过夜。
1.2.2 DES诱变及初筛 取5 mL过夜萌发的孢子悬液,分别加入DES至终浓度为0%、1%、3%、5%、6%、7%、9%、12%,混匀,30℃,220 r/min 振荡处理20 min后,各组分别加入等体积的25%Na2S2O3溶液终止反应。将诱变处理后的孢子悬液适当稀释,涂布于筛选培养基,35℃培养3~4 d,以未经诱变处理的出发菌株为对照,计算致死率。挑选长势良好、透明圈与菌落直径比值(HC)较大的单菌落进行复筛。
1.2.3 摇瓶复筛 挑取2环孢子,接种于固体发酵培养基,35℃培养,分别于第 24 h、36 h、48 h各翻曲一次,测定不同突变株酸性α-淀粉酶的酶活力。
1.2.4 传代培养 将诱变筛选出的突变株连续传代培养,测定各批次酸性α-淀粉酶酶活力。
1.3 酶活力测定 方法参照相关参考文献[9]进行。
2 结果与分析
2.1 不同浓度DES的致死率 诱变育种是获得高产菌株的常用方法[10-11],将诱变致死率控制在75%~85%时诱变效果较佳,易获得高产突变菌。利用不同浓度DES处理河内白曲霉孢子20 min后的致死率曲线如图1所示。由图1可知,使用1%DES诱变处理20 min时,对河内白曲霉的致死率为84.3%。
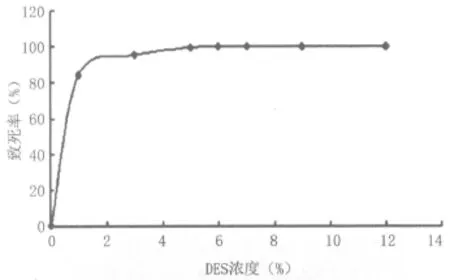
图1 不同浓度DES诱变河内白曲霉的致死率
2.2 高产酸性α-淀粉酶突变株的初筛 将1%DES诱变处理20 min的河内白曲霉孢子悬液适当稀释涂布,培养观察并计算HC比值。从502株突变株中挑选出HC比值较高的突变株列于表1,可知突变株Hanoi white starter 4的HC比值最大,且长势良好。
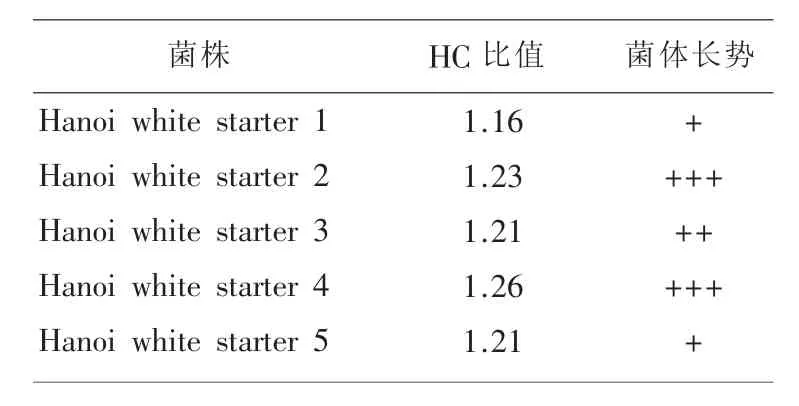
表1 酸性α-淀粉酶高产突变株的初筛
2.3 高产酸性α-淀粉酶突变株的摇瓶复筛 对表1中初筛获得的突变株进行摇瓶复筛,各突变株发酵产酸性α-淀粉酶的能力如表2所示。可知,Hanoiwhite starter 4发酵酶活力最高,达20.8 U/g,较出发菌株提高了61.2%,这也与其HC比值最高相对应。
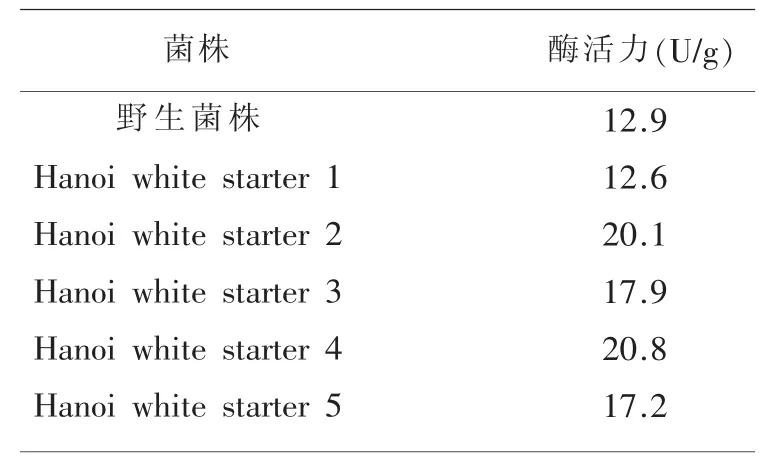
表2 高产酸性α-淀粉酶突变株的复筛
2.4 突变株Hanoi white starter 4的遗传稳定性将高产酸性α-淀粉酶的突变株Hanoi white starter 4于麸皮固体发酵培养基中连续传代培养6次,测定每批次的酸性α-淀粉酶酶活力,结果如图2所示。可知,该菌株产酸性α-淀粉酶的遗传稳定性良好,可用于后续工业放大生产。
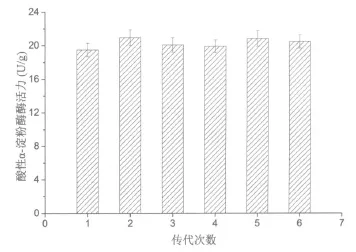
图2 高产酸性α-淀粉酶突变株的遗传稳定性
3 结论
在酿酒行业,鉴于酒品质的高要求,该行业常使用河内白曲霉固态发酵生产酸性α-淀粉酶,为使淀粉质原料水解制糖工艺中α-淀粉酶和糖化酶最适反应pH值相近,节省大量酸试剂的消耗,节约成本,筛选耐酸性的α-淀粉酶十分必要。本研究以河内白曲霉为出发菌株,采用不同浓度DES诱变处理萌发的河内白曲霉孢子,根据透明圈大小初筛、摇瓶复筛高产酸性α-淀粉酶的突变株。研究结果表明,将萌发的孢子于1%DES处理20 min后,对河内白曲霉的致死率为84.3%,后经涂布筛选获得一株高产酸性α-淀粉酶的突变株Hanoi white starter 4,发酵后酶活力达20.8 U/g,较出发菌株提高61.2%。该突变株产酸性α-淀粉酶的遗传稳定性良好,可用于后续工业放大生产。
[1]王建玲,陈志鑫,刘逸寒,等.产耐酸性α-淀粉酶菌株的分离、鉴定、酶学特性研究及发酵培养基的优化.生物技术通报,2014,30(4):159.
[2]Sharma A,Satyanarayana T.Microbial acid-stable α-amylases:characteristics,genetic engineering and applications.Process Biochemistry,2013,48(2):201.
[3]Kalpana B J,Pandian S K.Halotolerant,acid-alkali stable,chelator resistant and raw starch digesting α-amylase from a marine bacterium Bacillus subtilis S8-18.Journal of Basic Microbiology,2014,54(8):802.
[4]Liu JH,Xia W G,Abdullahi A Y,et al.Purification and partial characterization of an acidic α-amylase from a newly isolated Bacillus subtilis ZJ-1 that may be applied to feed enzyme.Preparative Biochemistry and Biotechnology,2015,45(3):259.
[5]张玉然,张晓云,田田,等.酸性α-淀粉酶研究进展.济宁医学 院 学 报,2015,38(5):310.
[6]钱萍.酸性淀粉酶菌株的诱变选育及酶学性质研究.食品工业 科 技,2012,33(11):184.
[7]王发祥,俞健,王建辉,等.1株产酸性α-淀粉酶黑曲霉原生质体制备和再生条件优化.食品科学,2014,35(1):156.
[8]Sharma A,Satyanarayana T.Production of acid-stable and high-maltose-forming α-amylase of Bacillus acidicola by solid-state fermentation and immobilized cells and its applicability in baking.Applied Biochemistry and Biotechnology,2012,168(5):1029.
[9]贺胜英,杨云娟,许波,等.白曲霉Asp-amy1固体发酵生产酸性淀粉酶的初步研究.酿酒科技,2009(8):42.
[10]田丰伟,程传荣,袁维涵,等.原生质体诱变选育ε-聚赖氨酸高产菌株.微生物学通报,2010,37(10):1457.
[11]刘俊梅,王庆,王丹,等.紫外线和硫酸二乙酯复合诱变选育PHB 高产菌株.微生物学通报,2016,43(10):2242.

