催化剂对分解过氧化氢制氧气影响因素的探究
广东省恩平市君堂镇江洲圩江洲中学 刘晓光
一、实验过程
1.实验目的
①通过实验,找出分解过氧化氢的最佳催化剂。
②熟练掌握制取和收集氧气的方法及规范操作。
③实习氧气制取演示实验的方法。
④初步探索制取氧气实验的影响因素。
2.实验原理:
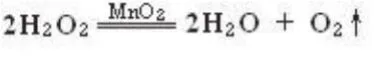
3.实验器材及药品
试管、单孔胶塞的导管、秒表、电子天平、药匙、量筒、铁架台等
实验药品:5%的过氧化氢溶液、二氧化锰、氧化铜、氧化铁、猪肝等。
4.实验步骤
①按实验装置图所示安装好仪器;
②检查装置气密性,往量筒中注满水;
③取3%过氧化氢溶液20ml,分成5等份,每份4ml,分别装人已经准备好的5支试管当中.在5支试管当中分别加人等量的二氧化锰、氧化铜、红砖粉、氧化铁、猪肝。
④分别加热这5支试管,从导管口出现第一个气泡时开始计时,记录当过氧化氢反应完量筒中的水的体积及所用的时间;(保证反应的除催化剂的量外其他条件一致)
⑥分析结果。
5.实验数据记录与分析
数据记录:

二氧化锰氧化铜 氧化铁 红砖粉 猪肝反应程度很快 较慢 很慢 很慢 较快反应时间10min 60min 80min 85min 25min
可见,对H2O2催化分解最快的是MnO2.
为进一步研究MnO2的催化情况,我做了如下实验:
①MnO2催化的制作。
a.取0.2g MnO2粉末。
b.把5gKMnO4分布于试管内壁加热一段时间后把渣倒出,试管内壁上留下一层稳固的棕黑色物质(MnO2),或直接取用KMnO4制取氧气实验留下的试管,用水洗去浮渣后可用。
c.取附有MnO2的灼烧瓷片。
d.用一片有机塑料袋灼烧,然后粘附二氧化锰粉末,让其形成块状。
②把这4种MnO2催化剂连载体分别放入5m15%H2O2溶液中,情况如下:

催化剂(载体)MnO2粉末 MnO2 (试管)MnO2 (瓷片)MnO2 (塑料袋)反应情况 剧烈,使火星复燃剧烈,使火星复燃剧烈,使火星复燃平稳,是火星复燃反应完所需时间(min)3.5 12 18 5
实验结果说明MnO2对过氧化氢的分解有极好的催化作用,但催化剂的制作途径不同,其催化的效率也不同,这主要是接触面大小不同所造成的。对MnO2来说以粉末状态的催化效率最高。但是由于接触面积太大,导致反应速率太剧烈,反而塑料袋粘附的二氧化锰粉末,反应的更平稳。
催化剂的用量对反应有否影响呢?为了探索这个问题,我做了这样一组实验:每次均用10mL30%H2O2溶液配制成10%溶液32mL,采用不同量的MnO2粉末作催化剂,测定各次收集500ml氧气的时间,结果如下:
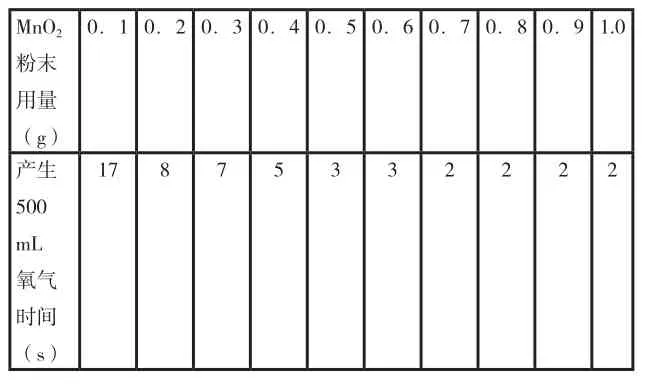
MnO20.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1.0粉末用量(g)产生17 8 7 5 3 3 2 2 2 2 500 mL氧气时间(s)
结果表明:同一种催化剂的不同用量在一定范围内对反应速度是有影响的。
二、溶液浓度、操作情况的影响
为探讨不同浓度H2O2溶液在相同条件下催化分解的时间及反应情况,本人做了如下实验,每次均用5.0mL30%H2O2溶液(配制成不同浓度溶液)及0.2g MnO2粉末,在室温(20℃)下测定在试管中的反应时间,以导管在水中自冒泡至不再冒泡的时间为准,测定结果如下表:

溶液浓度%溶液体积/ml所用试管规格/mm操作情况反应时间反应情况收得气体体积/ml反应完液体温度/℃装置不1 0 m i n反应较动5s慢,后期极慢1 164.5 32×200振荡 1 0 m i n反应较539 24 5s慢,后期极慢装置不3 m i n反应较动40s慢,后期很慢振荡 2 m i n反应前3 54.4 25×20030s期 较543 34快,后期较慢装置不3 m i n反应较动25s慢,后期很慢5 32.5 20×200振荡 1 m i n反应较548 39 14s快,后期很快装置不1 m i n反应较动20s快,后期很快10 16.0 20×200振荡 17s 反应很553 56快,收集的气体有白雾装置不25s 反应很动快,收集的气15 10.5 20×200体有白560 65雾振荡 7s 反应很快,收集的气体有大量白雾装置不9s 反应很动快,收集的气20 7.8 20×200体有大562 67量白雾振荡 6s 反应剧烈,收集的气体有大量白雾反应剧25 6.1 20×200 装置不4s烈,收563 70动集的气体有大量白雾
把结果做成图象。可见在相同条件下,溶液的浓度和操作情况对反应速度影响较大。后者则是在反应过程中振动反应器,由于振动时促使固液体充分混合,增大了接触面,从而使反应速度大大提高。如果收集气体l—2L并以1—2min为适度(在这样的时间段内人们可从容地操作),则从图象分析可知,当装置不动时可选取8.4%—11.4%的溶液,当装置可振动时可选取3.2%—5.8%的溶液。这并非绝对不变的,若出于一些反应的需要可视实际情况选用相应浓度的溶液,通常选用5%—10%溶液即可,在实际过程中用是否需要振荡及振荡次数、幅度大小来调节反应速度,使之符合人们的需要,这样做既简便又见效。
综上所述,常温常压下对H2O2催化分解的影响主要有三大因素:催化剂(包括种类、状态、用量三方面)溶液浓度和溶液与催化剂的接触面。因此在制取氧气过程中可以通过调节这些因素来控制反应速度。

