香糯竹组培技术研究
单 妍
(昆明医科大学海源学院,云南 昆明 651700)
香糯竹组培技术研究
单 妍
(昆明医科大学海源学院,云南 昆明 651700)
研究不同浓度的6-BA、不同激素种类、不同外植体、不同元素和不同土壤基质对组培试验的影响。试验结果表明:2.1mg/L的6-BA的种子发芽率最高;最适合的香糯竹外植体为半年生播种苗枝条;KH2PO4对于黄化苗的处理效果较显著,适合采用;移栽适宜的土壤基质为泥炭+红土+珍珠岩的混合基质。
香糯竹;组织培养;外植体;黄化苗;组培苗;种子发芽率;土壤基质
香糯竹(CephalostachyumpergracileMunro)产自中国云南及东南亚,在西双版纳州和思茅普洱地区栽培较广泛。已经有20多个国家引种该竹种。香糯竹秆丛生,直立,高达15 m,直径5~8 cm,梢端稍下垂,秆箨为光亮的栗褐色,厚革质。节间长30~45 cm,粉绿色。幼时密被白色贴身小刺毛,节下被白色柔毛,秆壁较薄,秆环平[1]。
香糯竹也称摇钱竹,其竹筒盛装大米、糯米,经蒸煮、烘烤熟后,竹腔内膜包裹在大米、糯米外围,既美观,又秀色可口,是上等佳肴。竹秆密集、挺拔、秀丽,是优秀的观赏竹;竹材结构细致,机械性能良好,是优秀的材用竹;竹材纤维含量高,篾性好,是优秀的造纸、竹纤维、编织原料;其竹片煮水,清香可口,为上等饮品;竹笋亦可食用。每年产值达30万元/hm2以上。
竹子虽然常见,但是竹子开花并不多见。大多数竹种开花结实周期较长,且具有十花九不孕的特性,所以其繁殖方式主要为无性繁殖,如母竹分株、竹枝扦插等。但这些方法存在着所需劳动力大,成本高,繁殖系数低等缺点,不能满足规模发展的需求。相较于传统的繁殖技术,组培技术具有繁殖系数大、快速、不受季节限制等特点,有较高的经济效益。研究表明,丛生竹的1个芽通过组织培养1年内至少可以繁殖10 000丛苗,而1株竹子用节育苗繁殖1年内只能繁殖5~10丛苗[2],因此,在竹子繁殖方式上组培技术具极大优势。
1 研究地点
本研究地点为云南珍竹农业科技有限公司,嵩明县竹子科技园。
2 研究材料
2.1 外植体
外植体为香糯竹种子,香糯竹组培苗,实生苗枝条,成年竹枝条。
2.2 实验试剂
实验试剂包括氯化汞(0.05%~0.15%),75%酒精,生长调节物质(GA3、6-BA、NAA、IBA、IAA),KNO3,NH4NO3,KH2PO4,MgSO4。
3 试验方法步骤
3.1 试验材料的选取3.1.1 种子的选取
选取颗粒饱满的无霉、无虫害的优质香糯竹种子作为试验种子[3]。
3.1.2 枝条的选取
采取新鲜的不同的香糯竹枝条(半年生播种苗枝条、1年生播种苗枝条、2年生播种苗枝条、无性繁殖苗枝条、母竹枝条)作为组培材料。要求芽较多、无病虫,在不影响枝条正常生长存活的前提下,尽可能减少枝条的长度,这样可尽量减少污染,有利于提高存活率。
3.2 培养基的制备
竹类植物的组培试验所需的培养基通常为MS培养基。在试验过程中根据具体需要在培养基中添加不同的生长激素,配制不同浓度的培养基[2]。
MS培养基:大量元素(20 mg/L),微量元素(5 mg/L),铁盐(5 mg/L),有机物(2 mg/L),CaCl2(20 mg/L),糖(30 g/L),琼脂(4.5-5)g/L。
3.2.1 配制含有不同生长调节物质的MS培养基
MS培养基:生长调节物质(GA3、6-BA、NAA、IBA、IAA),浓度根据各个培养阶段进行调整。
3.2.2 配制含有不同浓度的6-BA的MS培养基
MS培养基:6-BA(1.5 mg/L,1.8 mg/L,2.1 mg/L,2.4 mg/L)。
3.2.3 配制相同浓度的6-BA的MS培养基
MS培养基:一般采用1.5 mg/L的6-BA进行外植体丛芽诱导;2.0 mg/L的6-BA进行丛芽增值。
3.2.4 配制生根培养基
MS培养基:1.0 mg/L的6-BA和0.3 mg/L的NAA相结合。
3.3 培养基的灭菌
灭菌的仪器为立体式自动高压蒸汽灭菌锅。在温度为121℃的条件下,灭菌29 min[4]。灭菌结束后待培养基冷却凝固后便可使用。灭菌过程不宜过长,否则有机物分解,会失去营养作用,同时也会使培养基变质变色。
3.4 外植体的消毒3.4.1 种子的消毒
将选好的种子剥去外壳(避免损伤胚),放入水中浸泡0.5 h。随后滤去水,将种子置于含量为0.1%的升汞中浸泡2~2.5 h。然后用无菌水冲洗种子3次,每次2~3 min。
3.4.2 枝条的消毒
将枝条置于无菌水中浸泡25~30 min,随后用无菌水冲洗枝条,洗去表面的异物杂质。随后放入0.1% 的升汞中浸泡10 min,最后用无菌水洗涤3次,每次2~3 min。
3.5 接种3.5.1 种子的接种
1)将种子接种在含有水和琼脂的培养基上进行初代培养,5~7 d后,待胚开始萌芽,将萌芽的种子转接入含有不同浓度的6-BA培养基(1.5 mg/L,1.8 mg/L,2.1 mg/L,2.4 mg/L)。
2)在超净工作台上进行接种,将消毒好的种子接种到含有相同浓度1.5 mg/L的不同生长调节物质(GA3、6-BA、NAA、IBA、IAA、对照CK)的培养基上,接种时尽量使种子表面干燥,倒出培养基表面的水,以防种子固定不稳。每个培养基接种5颗种子,过程中尽量避免污染。结束后做好标记和观察记录。
3.5.2 枝条的接种
在超净工作台上,将消毒好的枝条接种到含1.5 mg/L的6-BA的MS培养基上,接种时尽量弄干枝条表面的水。每个培养瓶接种3棵枝条,接种过程中应注意器皿的消毒,减少过程中的污染。结束后做好标记和观察记录。
3.6 培养条件
将接种好的种子、枝条放到培养室中。培养阶段试验室的温度需要控制在25~30℃;每日辅助光照10 h,光照强度约1600 Lx[5]。5~7 d种子、枝条开始萌芽,萌芽期间可初步判断受到污染的种子和枝条,应及时处理。
3.7 幼苗的转接3.7.1 种子幼苗的转接
转接的条件为当幼苗长出第3片叶子时[6]。在超净工作台内进行工作,把根剪去,同时打顶,留下1cm左右的长度,并转接到分化培养基(2.0 mg/L 6-BA)中,每瓶2~3棵。当种子幼苗长出2个或更多丛芽时,去掉种子。将分化的苗分成2~3株,用2.0 mg/L的6-BA继续培养。10~15 d后,由于培养基内的营养物质被消耗,需更换培养基,确保养分充足,植株正常生长[7]。
3.7.2 枝芽的转接
枝条上的芽在长到3~5 cm时打顶,去除顶端优势,保留1 cm左右长度,随后更换为2.0 mg/L的6-BA培养基,有利于丛芽的增值。培养20 d左右开始分化,待丛芽长到2~3 cm,去掉枝条,转接到2.0 mg/L 6-BA的培养基中,使其继续分化。随后10~15 d转接一次。
3.8 幼苗的生根
分化出一定数量的苗后就可以将长势良好、健壮、无污染的苗从培养基中分离出来,转接到生根培养基(1.0 mg/L的6-BA和0.3 mg/L的NAA)。细胞分裂素促进芽的增值,而生长素对根的生长有促进作用,所以结合使用效果较好[8]。每个培养瓶植株数量控制在3株,培养12 d左右,培养苗开始长根,记录根生长情况。
3.9 黄化苗的处理
将刚刚黄化的外植体取出,用无菌水冲洗干净,用0.1%的升汞消毒,随后立即放入含有不同营养元素的培养基中,观察30 d,记录生长情况。
3.10 组培苗的移栽3.10.1 炼苗
由于竹子组培苗适应外界环境的能力较弱,必须进行炼苗以提高移栽成活率。将生根的组培苗从培养室取出,移到覆盖有塑料薄膜和遮荫网的温棚内,敞开瓶口炼苗5~7 d,遮光度为80%~90%。每天中午11∶00—16∶00喷雾状水6次,保持基质和组培苗的湿度。每2 d喷洒一次磷酸二氢钾、尿素和多菌灵(50 g磷酸二氢钾+30 g尿素+520 g多菌灵,用15 kg清水稀释混合液),同时注意保持基质含水量[9]。
3.10.2 移栽
将试管苗从培养瓶取出,洗去培养基,移栽到已消毒的基质(珍珠岩、蛭石、红土、黑土、泥炭土、腐殖土、泥炭+红土+珍珠岩)上,每天观察生长情况并记录。
3.10.3 施肥
在组培苗移栽成活后,采用不同的肥料和施肥方法施肥,观察试管苗的生长情况。采用的肥料有0.1%尿素、0.1%硝酸铵、0.3%NPK复合肥、0.6%过磷酸钙、0.2%磷酸二氢钾等,施肥方法有叶面施肥和地面施肥。
4 研究结果与分析
4.1 同种激素不同浓度对种子发芽率的影响
使用不同浓度的6-BA,探究对种子发芽率的影响,结果见表1。

表1 6-BA对种子发芽率的影响Tab.1 Effect of 6-BA on seed germination rate
表1数据为不同浓度的6-BA的MS培养基培养下种子的生长情况。从表中数据可以看出,在2.1 mg/L的浓度下种子发芽率最高,长势也最好。试验过程中,1.8 mg/L浓度下污染较为严重,导致发芽率降低。
4.2 不同激素对种子发芽率的影响
试验采用5种不同的生长调节物质,在浓度均为2.1 mg/L、培养条件相同的情况下进行组培试验,探究对种子发芽率的影响。记录结果并计算出不同激素情况下的发芽时间、产生病菌时间、发芽率、苗根数和苗高(表2)。
由实验数据得出,在培养条件相同的情况下,BA处理的种子发芽率最高,发芽时间也最短,不易产生病菌,苗长势最好,所以BA最适合促进种子萌芽。其次是GA3和NAA处理。
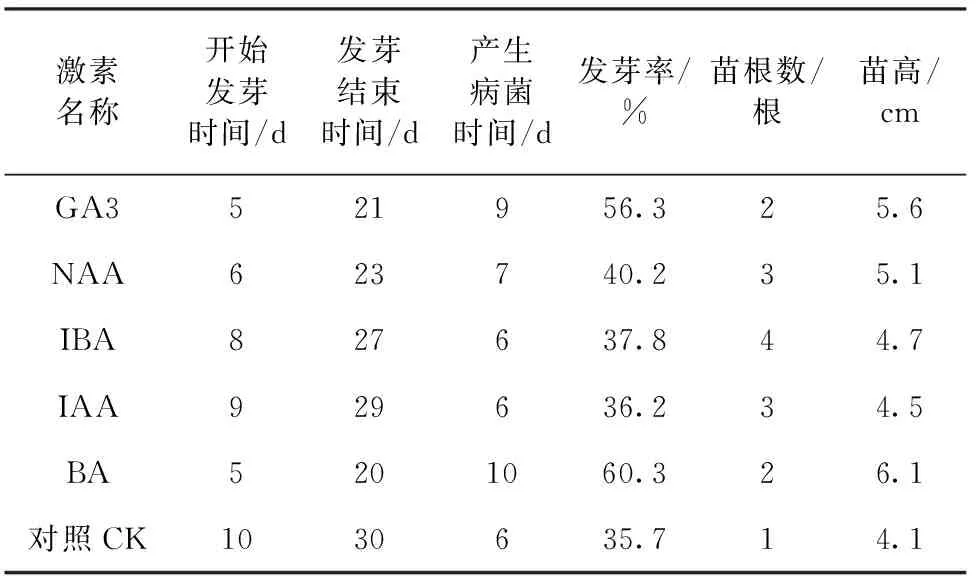
表2 不同激素的种子发芽生长性状Tab.2 Seed germination and growth traits in different hormone
BA为细胞分裂素,主要促进芽和根的形成,GA3为赤霉素,主要促进植物的生长发育,也能促进发芽;NAA是生长素类似物,主要促进植物生根。所以BA对种子的萌芽效果最好。
4.3 不同外植体的组培效果
试验选取了6种不同的外植体,在相同条件下进行组织培养。记录结果并计算出不同外植体的污染率、褐化率和成苗率(表3)。
数据显示,成苗率较高的3个外植体依次为半年生播种苗枝条、1年生播种苗枝条和种子。
种子不会发生褐化,但污染率较其他2种外植体高,也因为种子可能会发生变异,一般不采用。而半年生播种苗褐化率和污染率相对较低,最适合作为组培材料。母竹枝条发芽时间长,易污染,褐化率高,成苗率低,不适合用作组培试验。无性繁殖苗枝条褐化率和污染率也较高,也不适合组培试验。
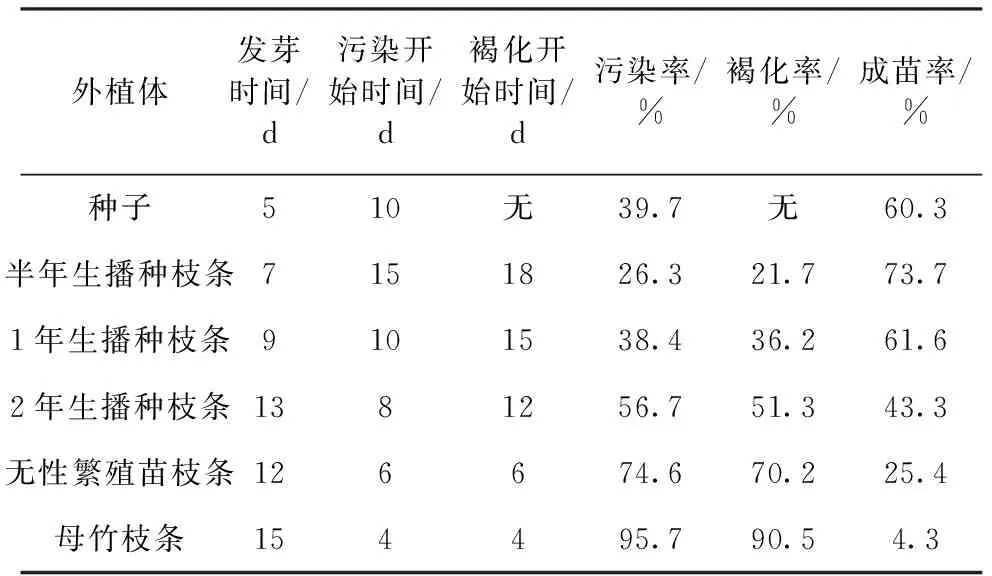
表3 不同外植体的组培效果Tab.3 Effect of tissue culture in different explants
注:试验采用MS培养基(2.0mg/L 6-BA)。
种子、半年生枝条和1年生枝条由于较为幼嫩,全能性较高,较容易分化,且含病菌少,不易被污染,所以成苗率高。而母竹枝条已经多次分化,老年成分较高,继代培养难以继续分化。无性繁殖苗的根系通常不够发达,抗逆性较差,培养过程中容易被污染。
4.4 不同营养元素对黄化苗外植体的处理效果
培养过程中出现了黄化苗,将刚刚黄化的外植体消毒后放入含有不同营养元素的培养基中,观察30 d,其结果见表4。

表4 不同营养元素对黄化苗外植体的处理效果Tab.4 Effect of different nutrient element on etiolated seedling explants
表4中的数据显示,2.3 g /L的KNO3对黄化苗的处理效果最好,还绿率与成活率都达到最高。NH4NO3在浓度为1.9 g/L时,还绿率和成活率达51.3%和45.2%。所以,NH4NO3对于黄化苗的处理效果也较显著,可以采用。
植物中叶绿素含量减少,类胡萝卜素增加,使植物呈现出黄色的现象叫做黄化。培养过程中,由于培养基中含铁量不足,营养耗尽与分布不均匀等原因使得组培苗发生黄化。K元素能够促进植物生长健壮,保障各种代谢活动的顺利进行。N元素是组成植物体内叶绿素的主要成分,使叶生长茂盛,颜色浓绿。所以,KNO3处理下的黄化苗还绿率较高,效果显著。
4.5 不同土壤基质对组培苗的影响
组培苗经过炼苗等处理后,移入到温室大棚中,在不同的土壤基质上种植2个月,结果见表5。

表5 不同土壤基质对组培苗的作用效果Tab.5 Effect of different soil substrates on seedling
注:移栽苗为种子培养分化成的苗。
表5显示不同土壤基质对组培效果的影响,数据显示,基质为泥炭+红土+珍珠岩的移栽苗生长状况最好,成活率最高。珍珠岩基质组培苗的成活率最低。而单有泥炭土,成活率也较高,株高也与混合土的差不多。所以,在有条件的情况下可选择泥炭+红土+珍珠岩的混合土,也可以选择泥炭土。
5 结论
1)MS培养基中添加2.1 mg/L的6-BA,发芽率较高,达66.7%。
2)6-BA处理的种子发芽率最高,发芽时间也最短,不易产生病菌,苗长势最好。其次是GA3和NAA。
3)成苗率较高的3个外植体依次为半年生播种苗枝条、1年生播种苗枝条和种子。半年生播种苗褐化率和污染率相对较低,最适合作为组培材料。
4)KNO3在浓度为2.3 g/L时,还绿率和成活率达64.2%和57.3%,对于黄化苗的处理效果较显著,适合采用。
5)基质为泥炭+红土+珍珠岩的移栽苗生长状况最好,成活率最高。泥炭土成活率也较高,株高也与混合土的差不多。
[1] 史军义,易同培,马丽莎,等.中国观赏竹[M].北京:科学出版社,2011:262.
[2] 单妍.主要经济竹种的微体快繁及苗木培育技术的研究[J].世界竹藤通讯,2017,15(1):16-24.
[3] 张光楚,王裕霞,谭源杰,等.丛生竹的组培快繁技术[J].竹子研究汇刊,2004,23(10):13-20.
[4] 严菊强.培养基对植物组织培养的影响[J],植物学通报,1996,13(1):37-40.
[5] 李蓉,曾炳山,何高峰,等.竹子组织培养的研究进展及趋势[J].安徽农业科学,2008,36(11):4405-4407.
[6] 杨南,李福秀,普晓兰,等.竹类植物育苗技术的研究进展[J].竹子研究汇刊,2008,27(3):37-40.
[7] 郭献煌.竹子的组培繁殖技术[J].林业实用技术,2006(8):27-28.
[8] 张林林.竹子离体快繁的研究[D].广州:中国科学院华南植物园,2008.
[9] NADGI A L,PHADKE C H,GUPTAPK. et a1.Rapidmul-tiplieation of bamboo by tissue Cuhure[J].Silvae Genet-lca,1984,33(6):219-223.
Culture Technology ofCephalostachyumpergracile
SHAN Yan
(Haiyuan College, Kunming Medical University, Kunming 651700, China )
In this paper, the effects of different concentrations of 6-BA and hormones, different explants, different elements and different soil matrixes on the tissue culture experiment were studied. The test results show that 2.1mg/L 6-BA has the highest germination rate; fragrant glutinous bamboo explants was the most suitable for the half year seedlings of branches; the effect of KH2PO4treatment on etiolated seedlings was significantly, suitable soil matrix for transplanting was mixed peat+perlite+clay.
Cephalostachyumpergracile; tissue culture; explants; etiolated seedlings; tissue culture seedlings; seed germination rate; soil matrix
10.3969/j.issn.1671-3168.2017.02.017
2017-02-05.
意大利ONLYMOSO公司(2015002);云南珍竹农业科技有限公司(2015003)资助项目.
单 妍(1981-),女,硕士研究生,讲师.研究方向为生物工程.Email:41513075@qq.com
S795;S723.133
A
1671-3168(2017)02-0071-05

