制动联合脱水建立应激性心肌病大鼠模型*
孙艳荣 富华颖
(天津医科大学第二医院心脏科,天津 300211)
制动联合脱水建立应激性心肌病大鼠模型*
孙艳荣 富华颖
(天津医科大学第二医院心脏科,天津 300211)
目的 通过制动联合脱水建立应激性心肌病大鼠模型。方法 将30只SD大鼠随机分成2组,分别为对照组、实验组,实验组利用制动联合脱水建立应激性心肌病模型。应用超声心动图观察室壁运动情况,以出现左心室心尖部室壁运动减弱呈气球样膨胀而基底部运动增强为造模成功。并通过心电图、心脏解剖和心肌组织病理学观察进行评价。结果 与对照组相比,实验组出现典型应激性心肌病表现大鼠4只,其心率增加、ST段明显偏移,血浆肾上腺素及去甲肾上腺素浓度明显升高,心肌炎性细胞聚集,心尖部心肌水肿、坏死。结论 制动联合脱水可成功建立应激性心肌病大鼠模型。
应激性心肌病;制动;脱水;动物模型
应激性心肌病(stress induced cardiomyopathy,SIC)主要表现为胸痛,同时伴有可逆性左心室功能障碍、心电图异常及心肌损伤标志物的升高[1],其超声心动图表现为短暂的左室心尖—中段气球样改变、左心室心尖部和前壁下段运动减弱或消失、心室基底部运动增强[2]。目前关于SIC病例报告逐年增加,受到临床广泛关注,交感神经高度激活是其重要发病原因和特征。我们观察到临床SIC患者往往进食差或多存在脱水状况,且经大量补液治疗后心脏运动及功能可改善。为此,我们通过建立制动联合脱水方法建立SIC模型,旨在深入探索脱水是否对SIC发生有促进作用。
1 材料与方法
1.1 实验动物 成年健康雄性SD大鼠30只,SPF级,体质量280~300 g,由天津医科大学实验动物中心提供。实验开始前,动物正常饮食饮水,适应饲养环境1周。
1.2 主要试剂与仪器 肾上腺素(epinephrine,EPI)及去甲肾上腺素(norepinephrine,NE)ELISA试剂盒(cusabio,中国武汉),小动物心率监测仪(美国),小动物高分辨率超声成像系统(Visualsonics,加拿大),脱水、包埋及石蜡切片机(莱卡,德国)。
1.3 实验分组及模型制备 将30只SD大鼠随机分成2组,每组15只,分别为对照组、实验组。对照组大鼠正常饮食;实验组大鼠限制饮水(每只大鼠每日给水50 ml)不限饮食,并将大鼠固定于自制大鼠固定器内,6~8 h/d。
1.4 超声心动图及心电图检测 超声检查前使用2%异氟烷气体浅麻醉大鼠,将大鼠四肢用胶布固定于操作台上,胸部备皮,选取胸骨旁长轴切面观察室壁运动情况,并分别对心尖段、心中间段、心基底段行M超检测比较各节段的运动波幅,测量短轴缩短率(FS),超声测量参照美国超声心动图学会制定的标准[3]。连接Ⅱ导心电图并记录,连接大鼠左、右前肢及右后肢导联选取标准肢体导联II,对其心率及ST段进行分析。
1.5 血浆EPI、NE及病理组织学检测 造模完成后两组均给予100 g/L水合氯醛腹腔注射麻醉,处死动物,心脏取血,血液标本离心获取血清后置于-80 ℃保存待测;迅速取出心脏,于4℃ PBS溶液中清洗后吸去水分,称重并记录,取心肌组织制作病理组织切片,经HE染色,观察并比较各组变化情况。

2 结 果
2.1 基本资料 实验前大鼠平均体质量(316.22+16.182)g,心率(309.60±18.89)次/分,经脱水、制动等相应处理3周后,实验组大鼠体质量(271.36±12.95)g,明显下降,心率(425.47±20.31)次/分,明显增快,P<0.05。
2.2 心电图变化 实验组典型应激性心肌病大鼠心电图多表现为ST段抬高,对照组大鼠无明显ST段变化(表1)。实验组大鼠未出现严重心律失常。

表1 心电图指标
注:与对照组比较,*P<0.05。
2.3 超声心动图相关指标改变 实验组出现典型SIC改变大鼠4只,表现为左心室心尖部室壁运动减弱呈气球样膨胀而基底部运动增强,见图1。对实验组中出现室壁运动异常的大鼠分别测量左室心尖段、中间段、基底段的FS值以及EF值,并与对照组比较,差异均有统计学意义(P<0.05),见表2。实验组表现为典型SIC改变的4只大鼠左室心尖段FS值显著低于对照组(P<0.05),中间段、基底段FS 值显著高于对照组(P<0.05),左室EF值小于对照组(P<0.05)。
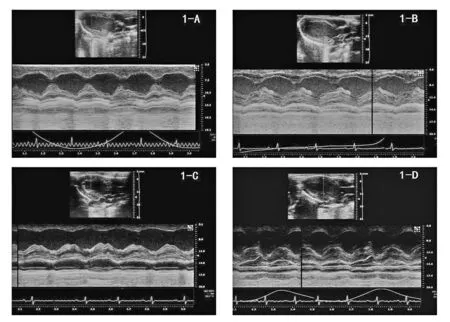
注:l-A为对照组大鼠,收缩期;l-B为对照组大鼠,舒张期;l-C为典型SIC改变大鼠,收缩期;l-D为典型SIC改变大鼠,舒张期。

图1 常规二维超声心动图标准左心室长轴切面表2 脱水联合制动造模致大鼠的心脏指标
注:与对照组比较,*P<0.05。
2.4 血清EPI、NE水平比较 与对照组相比,实验组大鼠血清血清EPI、NE高于对照组,差异有显著性(P<0.05),见表2。
2.5 心脏组织HE染色 实验组大鼠心肌心肌病理组织学改变心肌结构紊乱,并有心肌断裂、心肌间空泡等组织学改变,慢性炎性细胞浸润,见图2。
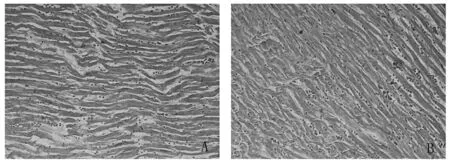
注:A为对照组左室心尖段;B为实验组左室心尖段
3 讨 论
目前SIC的发病率升高,但是其发病机制尚未阐明。Wittstein等[4]研究表明,急性期SIC患者血浆儿茶酚胺浓度较正常成人甚至高20倍。本研究中,出现典型SIC表现大鼠血清EPI、NE确实明显升高。该病发病前有明显的心理或躯体应激史,使交感神经过度激活,最终导致NE和神经元代谢产物的释放,同时肾上腺髓质激素释放引起EPI释放增加[5]。而进一步的研究发现儿茶酚胺过负荷可能通过产生负性肌力作用、直接心肌毒性、影响心肌代谢及冠状动脉血管痉挛等最终导致局部的心肌损伤及心肌顿抑,形成SIC可逆性心室局部功能障碍典型特征[6-7]。
临床中发现多例术后脱水病人合并情绪应激时出现类似SIC心脏超声表现,予以补液治疗后心脏运动及功能恢复正常。因而脱水联合情绪应激是否能造成应激性心肌病,或脱水是否为应激性心肌病形成的促进因素尚不明确。本研究参考前人研究[8-10]基础上,利用束缚制动引起交感神经的持续兴奋,并联合脱水进而诱发SIC形成。本实验组大鼠经相应处理后4只大鼠出现典型SIC心脏超声表现,其血清EPI、NE水平明显增高,心电图ST段抬高,心肌间空泡样改变、心肌断裂,造模成功。
本研究中样本量偏小,在初发造模上,未能全面探讨得出统计学上的最优造模剂量,故尚需进一步研究。本研究对未评估大鼠脱水程度及未与单纯制动所致应激性心肌病作比较,是否脱水对应激性心肌病形成有促进作用,还需进一步研究。
综上,本模型的成功建立脱水联合制动可致典型应激性心肌病,可为今后进一步研究SIC发病机制,明确发病类型,防治该病提供良好的动物模型,但需要进一步改进。
[1] Gianni M,Dentali F.Apical ballooning syndrome or takotsubo cardiomyopanthy:a systematic review [J].European Heart Journal (Oxford University Press),2006,27(13):1523-1529.
[2] Prasad A,Lerman A,Rihal CS:Apical ballooning syndrome Tako-Tsubo orstress cardiomyopathy: a mimic of acute myocardial infarction [J].Am Heart J,2008, 155:408-417.
[3] Sjaastad I,Sejersted OM,Ilebekk A,et al.Echocardiographic criteria for detection of postinfarction congestive heart failure in rats[J].J Appl Physiol(1985),2000,89(4):1445-1454.
[4] Wittstein IS,Thiemann DR,Lima JA,et al.Neurohumoral features of myocardial stunning due to sudden emotional stress[J].N Engl J Med,2005,352( 6) :539-548.
[5] Jols M, Fernandez G, Roozendaal B. Stress and emotional memory: a matter of timing[J]. Trends in cognitive sciences,2011,15(6): 280-288.
[6] Akashi YJ,Goldstein DS,Barbaro G,et al.Takotsubo cardiomyopathy:a new form of acute,reversible heart failure[J].Circulation,2008,118:2754-2762.
[7] Sebastian Szardien, Helge M llmann, Matthias Willmer,et al.Mechanisms of Stress (Takotsubo) Cardiomyopathy[J]. 2013,9(2):197-205.
[8] Kuroda R1, Shintani-Ishida K, Unuma K,et al.Immobilization Stress With α2-Adrenergic Stimulation Induces Regional and Transient Reduction of Cardiac Contraction Through Gi Coupling in Rats[J].Int Heart J,2015,56(5):537-543.
[9] Ueyama T,Kasamatsu K,Hano T,et al,Emotional stress induces transient left ventricular hypocontraction in the rat via activation of cardiac adrenoceptors: a possible animal model of 'tako-tsubo' cardiomyopathy[J].Circ J,2002,66(7):712-713.
[10] Ueyama T,Ishikura F,Matsuda A,et al,Chronic estrogen supplementation following ovariectomy improves the emotional stress-inducedcardiovascular responses by indirect action on the nervous system and by direct action on the heart[J].Circ J,2007,71(4):565-573.
Establishment of rat model of stress induced cardiomyopathy by combination of braking and dehydration
SUN Yan-rong FU Hua-ying
(Second Hospital of Tianjin Medical University,Tianjin 300211,China)
Objective: To establish the rat model of stress induced cardiomyopathy by combination of braking and dehydration. Methods: Thirty male SD rats were randomly divided into the control group and experimental group. In the experimental group, the model of stress cardiomyopathy was established by the combination of immobilization and dehydration. Echocardiography was used to observe the ventricular wall motion, criteria for successful modeling was the occurrence that left ventricular wall motion was reduced and swelled like a balloon while the basal motion was enhanced. The results were evaluated by electrocardiogram, cardiac anatomy and myocardial histopathology. Results: Compared with the control group, 4 rats showed typical stress cardiomyopathy in the experimental group. The heart rate increased significantly, ST segment deviation, plasma epinephrine and norepinephrine concentrations were significantly increased, and inflammatory cell aggregation, apical myocardial edema and necrosis occurred. Conclusion: The model of stress induced cardiomyopathy was successfully established by the combination of braking and dehydration.
stress-induced cardiomyopathy; braking; dehydration; animal model
孙艳荣(1988—),女,硕士在读,主要从事应激性心肌病研究。
富华颖,E-mail:huayingfu@126.com。
R541
A
1004-7115(2017)05-0497-03
10.3969/j.issn.1004-7115.2017.05.006
2016-12-11)

