勒夏特列原理的“三步判断法”及应用条件
姜显光+郑长龙
摘要:总结了勒夏特列原理应用的“三步判断法”。目的:阻碍影响化学平衡移动的条件的改变;方法:化学平衡的移动;结果:阻而不止。勒夏特列原理的应用条件。应用范围:化学热力学平衡体系;应用目的:定性判断化学平衡移动的方向;影响因素:影响化学反应速率的外部因素;因素改变:改变影响化学反应速率的“一个”外部因素。
关键词:勒夏特列原理;化学平衡;三步判断法;应用条件;中学化学教学
文章编号:1005–6629(2017)5–0092–03 中图分类号:G633.8 文献标识码:B
在高中“化学平衡”主题教学中,勒夏特列原理是定性判断化学平衡移动的主要理论依据,是教学的重点和难点,也是学生学习的难点。在实际教学中,往往只停留在“勒夏特列原理”名词本身,只知其名,不知其实;在应用过程中,勒夏特列原理完全被抛在一边,机械性地背了一些经验规律,如浓度、温度、压强改变后,平衡如何移动。几十年来不断有化学家和化学教育工作者提到勒夏特列原理的不足之处[1]。教师和学生如何能轻松、准确地应用该原理呢?在教学和应用过程中必须解决两个主要问题:勒夏特列原理在实践中如何应用?勒夏特列原理的应用条件是什么?
1 如何应用勒夏特列原理——三步判断法
在人教版高中化学选修四中关于勒夏特列原理的描述为:“如果改变影响平衡的因素之一(如温度、压强,以及参加反应的化学物质的浓度),平衡将向着能够减弱这种改变的方向移动,这就是著名的勒夏特列原理。[2]”勒夏特列原理是一条经验性的定律,用来定性地判断化学平衡移动。原理的描述呈现了大量的信息,需要教师和学生能够正确地解读信息。“如果改变影响平衡的因素”说明改变的因素必须是能够影响平衡的因素,“之一”说明在影响化学平衡的诸多因素中,一次只能改变其中的“一个”因素,“如温度、压强,以及参加反应的化学物质的浓度”说明影响化学平衡移动的因素主要有温度、压强、浓度,“减弱这种改变”是原理的目的,“平衡将向着……移动”是达到目的的方法或手段。在认识勒夏特列原理的目的和方法后,学习者要问减弱(阻碍)的结果如何?结果是阻而不止。因此,学习者在应用勒夏特列原理时要正确识别影响因素的改变,通过“三步判断法”完成对勒夏特列原理的应用。“三步判断法”(见图1)就是正确分析原理的目的是什么?采用什么样的方法达到目的?结果如何?第一步,目的:阻碍(减弱)影响化学平衡移动的条件(因素)改变;第二步,方法:通过化学平衡移动;第三步,结果:阻而不止。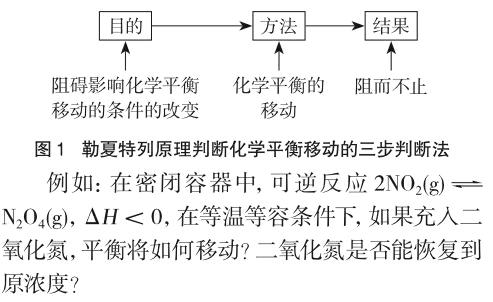
反应物和产物浓度是影响化学平衡移动的因素之一。反应物二氧化氮浓度增大,根据勒夏特列原理三步判断法,目的:阻碍(减弱)二氧化氮浓度的增大,方法:化学平衡向正反应方向移动,结果:阻而不止。也就是,充入二氧化氮,反应物浓度增大,反应向正反应方向移动,使反应物浓度降低,但是,这将增大生成物四氧化二氮的浓度,阻碍反应物浓度的进一步降低,达到新的平衡,结果是二氧化氮的浓度要比第二次充入二氧化氮前的原平衡状态的浓度大。因为在等温等容条件下,二氧化氮浓度恢复到原来的浓度,产物四氧化二氮的浓度将增到最大,反应将向逆反应方向进行,所以,反应必然是使二氧化氮的浓度减低,但不能完全恢复到第二次充入二氧化氮前的原平衡浓度。单独改变温度、压强的分析方法同上。
2 勒夏特列原理的应用条件
任何原理、定理、定律等的应用都是有条件的,满足什么样的条件,将必然得出相对应的结论。勒夏特列原理也不例外,在应用过程中需要明确辨析条件的改变,确定在何种条件下应用勒夏特列原理。
2.1 应用范围:化学热力学平衡体系
化学热力学平衡体系是建立在化学热力学基础上,有化学物质参与达到平衡的体系,既包括可逆的化学过程平衡,也包括一些可逆的物理过程平衡,如:糖类溶解于水达到平衡。因此,不仅包括化学反应平衡,也包括溶解过程平衡、沉淀溶解平衡、弱电解质电离平衡、盐类水解平衡等,其共同特征为:以化学热力学为基础,在一定条件下,平衡体系同时向正、反两个方向进行,当正向速率等于逆向速率时,平衡体系中参加反应的各物质的浓度、质量分数、颜色等不发生变化。
2.2 应用目的:定性判断化学平衡移动的方向
勒夏特列原理只能判断外部因素的改变对正、逆反应速率影响的变化总体趋势,即定性判断,但是不能确定影响程度的大小,也就是无法定量判断。
保持温度不变,增加体系压强。根据勒夏特列原理“三步判断法”,目的:阻碍(减弱)体系压强的增大;方法:平衡向气体系数和减小的方向移动,即正反应方向移动;结果:体系压强降低,但是压强仍比原平衡状态高。因此,上述平衡向正反应方向移动(定性判断)。向正反应方向移動到什么程度,二氧化氮的体积分数改变多少,类似这种需要定量判断的问题,勒夏特列原理无法回答。
2.3 影响因素:影响化学反应速率的外部因素
“正反应速率等于逆反应速率”是化学平衡最本质的特征。根据人教版高中化学选修四勒夏特列原理的描述,勒夏特列原理是改变温度、压强、浓度等影响化学反应速率的外部因素,通过影响正、逆化学反应速率使化学平衡发生移动。所谓外部因素指与化学平衡有关的环境因素或参加反应的物质数量上的改变,外部因素的改变,不会影响化学反应路径或过程,所谓内部因素指与化学反应物质性质有关的因素,内部因素的改变,将改变化学反应的路径或过程。影响化学反应速率的因素有浓度、温度、压强和催化剂等。根据影响化学反应的外部因素和内部因素的划分标准,浓度、温度、压强不会改变化学反应路径,属于外部因素,催化剂参加了化学反应,改变了反应路径,属于内部因素。催化剂对化学反应路径进行了改变,改变了正、逆反应速率,但是对正、逆反应速率的影响效果是相同的。因此,浓度、温度、压强等外界因素对化学平衡的影响是主要的。
2.4 因素改变:改变影响化学反应速率的“一个”外部因素
根据勒夏特列原理的描述,影响化学平衡移动的因素改变必须是“一个”影响化学反应速率的外部因素改变,通过“三步判断法”准确地定性判断出化学平衡的移动,见图1。但是在实际中,可能会出现两个及以上外部因素同时改变,此时,勒夏特列原理将不再适用。
增大体系压强,根据三步判断法,目的:阻碍(减弱)压强的增大,方法:平衡向压强减小的方向,也就是向气体系数和减小的正反应方向移动;升高温度,根据三步判断法,目的:阻碍温度的升高,方法:平衡向吸热反应的方向,也就是逆反应方向移动。这种情况下,根据勒夏特列原理进行判断,平衡可能既向正反应方向移动,也向逆反应方向移动,勒夏特列原理对这样的情形无法作出明确的判断。
勒夏特列原理是学生学习过程中的重点和难点,“三步判断法”意在给出简单易懂的应用方法。分析勒夏特列原理的应用条件,是为了让学习者能准确地应用勒夏特列原理。对于不适用勒夏特列原理的情况,高中教材引入了“浓度商”作为判断依据,而且,随着学习的深入,还会有自由能等判断方法。
参考文献:
[1]廖梁,张嘉培.勒夏特列原理对教师理解化学平衡的负面影响[J].化学教育,2009,(11):21~23.
[1]宋心琦主编.普通高中课程标准实验教科书·化学反应原理(第3版)[M].北京:人民教育出版社,2007.

