12种剧毒鹅膏菌的肽类毒素成分鉴定及其相对含量差异比较研究
魏佳会+吴剑峰+陈佳+吴弼东+陈作红+刘畅+谢剑炜

摘 要 采用高效液相色谱高分辨质谱联用技术对12种剧毒鹅膏菌的肽类毒素成分及其相对含量进行了比较研究。样品经含0.5%甲酸50%甲醇溶液提取, 采用Agilent 300ExtendC18色谱柱, 含0.05% TFA的20 mmol/L NH4Ac溶液甲醇为流动相, 梯度洗脱分离。12种鹅膏菌的高效液相色谱质谱联用分析结果表明, 各鹅膏菌所含毒素种类及相对含量差异较大, 呈现显著的色谱指纹特征信息, 12种鹅膏菌中共检测出19种化合物, 13种属于已知鹅膏肽类毒素, 5种为未知鹅膏肽类毒素, 1种为未知小分子化合物组分。本研究为准确识别鹅膏菌的种类、鹅膏肽类毒素的鉴定、预防和鉴别鹅膏毒肽中毒, 提供了科学依据。
关键词 鹅膏菌; 鹅膏肽类毒素; 质谱; 鉴定; 色谱特征指纹图谱
1 引 言
我国毒蘑菇种类繁多, 已记载有435种[1]。 近年来, 国内频发因误食毒蘑菇的中毒事件[2], 其中90%以上的死亡事件是由鹅膏菌属(Amanita)的蘑菇引起的, 主要有灰花纹鹅膏(Amanita fuliginea)、致命鹅膏(A. exitialis)、裂皮鹅膏(A. rimosa)等[3~6]。鹅膏菌的致死性毒素是鹅膏肽类毒素, 根据其氨基酸组成和结构可分为鹅膏毒肽(Amatoxins)、鬼笔环肽(Phallotoxins)、毒伞肽(Virotoxins)三类, 均属于大环多肽。目前已分离鉴定的天然鹅膏菌毒素有22种, 其中鹅膏毒肽有9种, 属于双环八肽, α鹅膏毒肽和β鹅膏毒肽是导致死亡的主要毒素[7], 鹅膏毒肽非竞争性抑制真核细胞RNA聚合酶II, 阻碍蛋白质的合成, 最终导致肝脏细胞的坏死[8,9]; 鬼笔环肽有8种, 属于双环七肽, 主要毒素是二羟鬼笔环肽和羧基二羟鬼笔环肽; 毒伞肽有6种, 属于单环七肽。目前, 有关毒伞肽的文献报道较少, 研究多集中于鹅膏毒肽和鬼笔环肽, 而鬼笔环肽与毒伞肽可以破坏球状肌动蛋白与丝状肌动蛋白之间的解聚装配平衡, 从而削弱细胞膜的功能[10]。
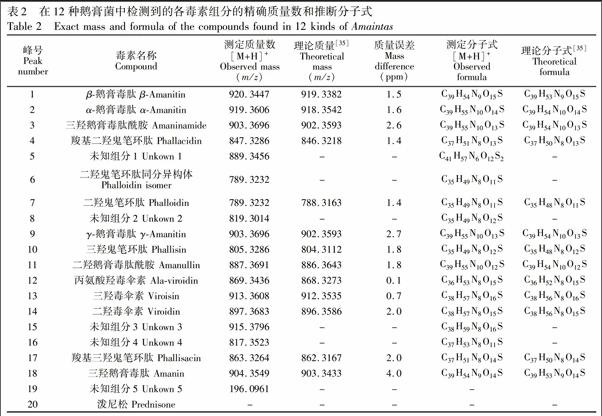
鹅膏肽类毒素检测方法包括显色检测法[11,12]、放射免疫检测法[13~16]、酶联免疫吸附法[17,18]、紫外吸收光谱法[19]、荧光法[20,21]和毛细管区带电泳法[22]等。近年来, 高效液相色谱(HPLC)[23,24]以及液相色谱质谱联用(LCMS/MS)技术[5,19,25~29]逐渐成为鹅膏肽类毒素分析的主流技术,具有所需样品量少、灵敏度高、检测速度快和操作简单等优点, 如LCMS/MS可实现生物样品和食品等复杂基质样品中鹅膏肽类毒素的痕量分析[30,31], LCTOFMS能对样品中化合物进行质谱全信息采集[5,19,29,32]。本研究通过收集国内外12种剧毒鹅膏菌子实体, 通过对其毒素提取方法进行优化, 采用HPLC建立了12种鹅膏菌的特征指纹图谱, 并引入泼尼松为内标, 比较了各子实体中毒素的相对含量差异; 在此基础上, 利用超高效液相色谱电喷雾离子化四极杆飞行时间质谱(UPLCESIQTOF/MS)技术对各毒素进行了鉴定。本方法准确、灵敏度高、特异性好, 可为突发毒蘑菇中毒事件的毒菌及毒素确证分析提供可靠的依据。
2 實验部分
2.1 仪器与试剂
Agilent 1100HPLC仪, 配二元梯度泵、VWD检测器、Agilent Chemstation化学工作站(美国Agilent公司); ACQUITY 超高效液相色谱, G2四极杆飞行时间质谱仪(QTOF/MS)(美国Waters公司); RVC 233 CD离心浓缩仪(德国CHRIST公司); THZD台式恒温振荡器(太仓市实验设备厂); KC04粉碎机(北京开创同和科技发展有限公司); KQ 250E超声仪(昆山市超声仪器厂); R200D电子天平(德国Sartorius公司), 3k30高速冷冻离心机(美国Sigma公司)。
α鹅膏毒肽(αAmanitin)、β鹅膏毒肽(βAmanitin)、二羟鬼笔环肽(Phalloidin)均购于美国Sigma公司, 纯度>90%; 泼尼松(98.50%,中国食品药品检定研究院); 乙酸铵(98%)、三氟醋酸(TFA)购于美国Acros Organics公司; 石油醚、甲酸(分析纯,国药集团化学试剂有限公司); 甲醇(色谱纯,德国Merck公司); 实验用水为MilLQ纯水机(美国Millipore公司)制备的超纯水(18.2 MΩ·cm)。
2.2 鹅膏菌
假淡红鹅膏(自采, 菌种鉴定见文献[33]), 其余11种鹅膏菌均由湖南师范大学陈作红教授鉴定并提供, 所有蘑菇均为干子实体, 其采集地点及时间如表1所示。
2.3 样品前处理
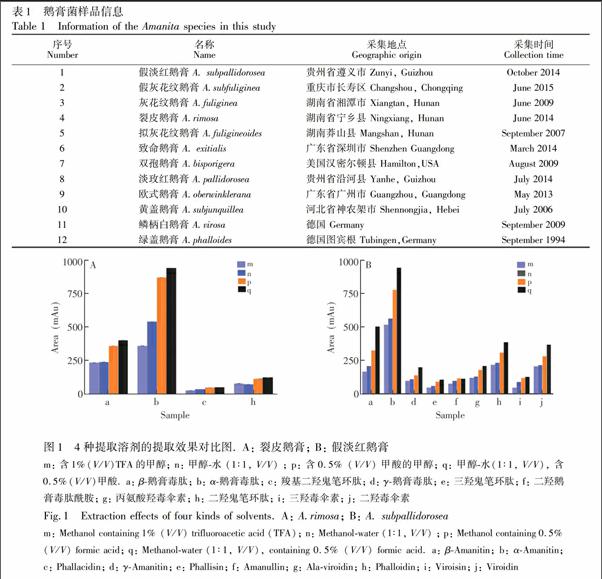
将毒蘑菇干子实体研磨成粉末状, 称取0.1 g, 加2 mL含0.5%(V/V)甲酸的甲醇水(1∶1, V/V)溶液, 室温下240 r/min摇振12 h, 14000 r/min离心10 min; 移取上层清液, 沉淀再加入相同体积的相同溶液超声30 s, 同法离心, 合并两次上清液, 旋干; 以1 mL水复溶, 用等体积石油醚萃取去脂, 再次旋干, 用500 μL甲醇水(1∶1, V/V, 含内标)复溶, 过滤, 得鹅膏菌提取液。
2.4 鹅膏肽类毒素的液相色谱分离条件
色谱柱: ExtendC18(250 mm×4.6 mm, 5 μm); 流动相A为含0.05% TFA的20 mmol/L NH4Ac溶液, 流动相B为甲醇, 采用梯度洗脱(0~40 min, 10%~50%B; 40~45 min, 50%~10% B; 45~60 min, 10% B), 流速1 mL/min; 柱温: 40℃; 进样量: 5 μL; 检测波长: 295 nm。