基于内滤效应的YVO4∶Eu荧光纳米探针测定色氨酸
牛建丽+于永丽+曹艳杰+王猛


1 引 言
色氨酸(Tryptophan,Trp)作为一种生物体必需氨基酸,具有非常重要的生理功能,在蛋白质生物合成过程中起着非常重要的作用,也是机体烟酸、血清素及其它代谢产物的前体。临床上,色氨酸不仅用于营养输液,也用于抑郁症、高血压及疼痛等病症的治疗[1]。适量摄入富含色氨酸的食物可以改善睡眠质量、增强人体的抗氧化水平[2,3]。已报道的色氨酸的测定方法主要有高效液相色谱法[4,5]、电化学法[6,7]、毛细管电泳法[8]和荧光法[9~11]等。其中,高效液相色谱法和电化学法具有较高的灵敏度和准确度,但高效液相色谱分析中样品前处理比较耗时、仪器操作相对复杂,电化学分析法对电极的制备要求较高。荧光分析法具有简单快速、方法重现性好的优点,随着各种新的荧光物质不断涌现,荧光分析法得到越来越广泛的应用。
稀土发光纳米粒子是一类性能优越的发光材料,具有发光强度大、发射谱线窄、发光寿命长和Stokes位移大等特点,已被成功用于物质的定量分析[12]、癌细胞成像[13]和靶向治疗[14]等研究领域。近年来,基于研究体系的内滤效应进行定量分析的研究有很多报道[15~18],内滤效应(Inner filter effect,IFE)是指体系中荧光剂的激发或发射光被吸收剂(猝灭剂)吸收,从而导致荧光剂的荧光强度降低的现象[19]。相比于荧光共振能量转移体系,荧光内滤效应的发生不需要荧光体和吸收体发生化学结合,实验操作更加简单。与紫外分光光度法相比,利用荧光内滤效应将吸收体的吸收变化转换为呈指数变化的荧光体的荧光强度变化,使得待测物的分析具有更高的灵敏度[20]。
本研究采用溶剂热法合成发光性能和水溶性良好的YVO4∶Eu纳米探针(YVO4∶Eu NPs),由于色氨酸的吸收光谱与YVO4∶Eu NPs的激发光谱有很大程度的重叠,二者可以发生内滤效应,即色氨酸吸收YVO4∶Eu NPs的激发光能量,导致YVO4∶Eu NPs的荧光强度显著降低,据此建立了测定色氨酸含量的分析方法。
2 实验部分
2.1 仪器与试剂
Cary Eclipse发光分光光度计(美国瓦里安公司);PHS3E型pH酸度计(上海雷磁精密科学仪器有限公司); UV2100双光束紫外可见分光光度计(北京瑞丽分析仪器有限公司);TG16G台式高速离心机(湖南凯达科学仪器有限公司); TECNAI 20型透射电子显微镜(美国FEI公司)。
Y2O3、Eu2O3(北京有研稀土新材料股份有限公司);原钒酸钠(国药集团化学试剂有限公司);聚乙烯亚胺(PEI10000,合肥博美生物科技有限责任公司); L色氨酸(LTrp,阿拉丁试剂);实验用水为蒸馏水。
2.2 实验方法
2.2.1 YVO4∶Eu NPs的制备 参照文献[21]方法制备YVO4∶Eu纳米粒子,实验中对合成条件进行了优化,具体如下:分别移取浓度均为0.1 mol/L的Y(NO3)3溶液3.75 mL和Eu(NO3)3溶液1.25 mL于锥形瓶中,磁力搅拌下加入4 mL 0.4 g/mL PEI溶液,搅拌均匀,再加入5 mL 0.1 mol/L Na3VO4溶液,然后加入14 mL乙醇,最后调节至pH 9.0。在80 ℃水浴中反应1 h,然后转移到聚四氟乙烯罐中,将聚四氟乙烯罐放入反应釜密封,置于160 ℃烘箱中反应20 h。反应结束后,自然冷却到室温,得到YVO4∶Eu 纳米粒子的胶体溶液。向以上胶体溶液中加入乙醇,离心分离, 沉淀用乙醇和水洗涤沉淀,在超声作用下,用10 mL水分散沉淀,即制得YVO4∶Eu NPs溶液。產物具有良好的水溶性和光学稳定性,可以在室温存放至少6个月,溶液外观和发光性能没有改变。以合成时加入的Y3+和Eu3+的总物质的量计,溶液中YVO4∶Eu NPs的浓度为0.05 mol/L,分析应用时,以水稀释至相应的浓度。若将YVO4∶Eu纳米粒子溶液离心分离,沉淀经干燥后可长期保存,使用时超声分散到水中即可。以罗丹明B为荧光标准物,测得所制备纳米粒子的量子产率为17%。
3 结果与讨论
3.1 YVO4∶Eu NPs的TEM表征
可用于生物分析的稀土发光纳米粒子通常应满足以下要求:粒子的粒径较小且分布均匀、发光强度大且稳定、水溶性和生物相容性好。目前,常用的制备方法主要有水热法[21]、溶剂热法[22]、有机前驱体热分解法[23]和惰性气体保护下的高温加热合成[12]。
其中,热分解法合成所用有机试剂有一定的毒性,惰性气体保护高温加热合成的反应条件相对比较苛刻。溶剂热法反应条件温和、操作简单易行,与水热法相比,所制备产物的结晶度和发光性能更好。因此,本研究采用溶剂热法制备YVO4∶Eu 纳米粒子。
采用透射电子显微镜(TEM)对所制备纳米粒子进行了表征,结果见图1,粒子形状为类球形,粒度比较均匀, 粒径在20 nm左右,分散性较好。
3.2 YVO4∶Eu NPs和色氨酸的荧光内滤效应
由于所制备的YVO4∶Eu 纳米粒子表面修饰了PEI,可直接作为荧光探针使用,YVO4∶Eu NPs具有良好的水溶性和光学稳定性。图2为YVO4∶Eu NPs的激发光谱(a)和色氨酸的紫外吸收光谱(b),YVO4∶Eu NPs的最大激发峰位于280 nm,色氨酸的吸收光谱峰值位于278 nm,与YVO4∶Eu NPs的激发峰和色氨酸的吸收峰有很好的重叠,这表明YVO4∶Eu NPs和色氨酸体系具备发生荧光内滤效应的条件。
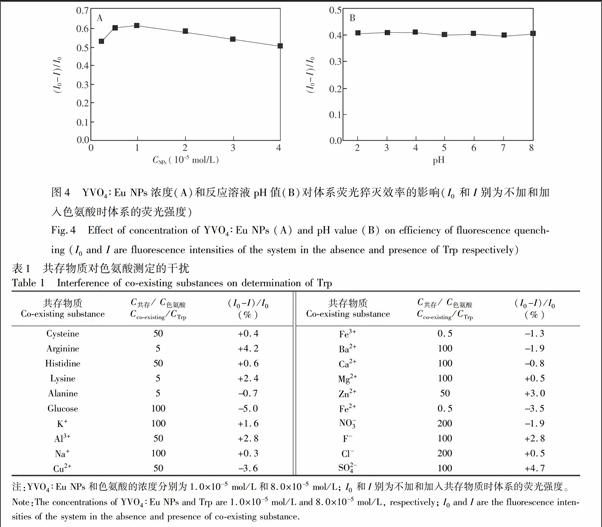
向系列相同浓度的YVO4∶Eu NPs溶液中分别加入不同浓度色氨酸溶液,扫描YVO4∶Eu NPs的发射光谱。由图3表明,随着色氨酸浓度的增加,YVO4∶Eu NPs的荧光强度逐渐降低。这是因为色氨酸和YVO4∶Eu NPs之间发生荧光内滤效应,即色氨酸吸收YVO4∶Eu NPs激发光的能量,导致YVO4∶Eu NPs发射的荧光强度显著降低。这为建立基于YVO4∶Eu NPs测定色氨酸的分析方法奠定了基础。
3.3.3 反应时间的选择 将YVO4∶Eu NPs和色氨酸溶液旋涡混合后,测定放置不同时间时体系的发光强度,结果表明,10 min时体系的荧光强度降低幅度达到最大,且60 min内基本不变。这说明色氨酸和YVO4∶Eu NPs之间的荧光内滤效应可以很快发生,60 min内反应体系都很稳定。
4 结 论
本实验中YVO4∶Eu NPs的制备方法简单易行,所制备纳米探针具有良好的水溶性和光学稳定性。基于YVO4∶Eu NPs和色氨酸的荧光内滤效应,建立了测定色氨酸含量的方法。本方法具有简单快速、灵敏准确的特点。采用本方法对酱油样品中的色氨酸含量进行了测定,回收率良好。本实验拓展了稀土发光纳米粒子的应用范围。
References
1 Sainio E L, Pulkki K, Young S N. Amino Acids, 1996, 10(1): 21-47
2 Bravo R,Matito S, Cubero J, Paredes S D, Franco L, Rivero M, Rodriguez A B, Barriga C. AGE, 2013, 35(4): 1277-1285
3 Silvan J M, van de Lagemaat J, Olano A, Del Castillo M D. J. Pharm. Biomed. Anal., 2006, 41(5): 1543-1551
4 Cevikkalp S A, Loker G B, Yaman M, Amoutzopoulos B. Food Chem., 2016, 193(15): 26-29
5 Zhao J X. Biomed. Chromatogr., 2015, 29(3): 410-415
6 YA Yu, XIE LiPing, JIANG CuiWen, WANG TianShun, MO LeiXing, LI Tao, YAN FeiYan. Chinese J. Anal. Chem. , 2016, 44(9): 1394-1401
牙 禹, 谢丽萍, 蒋翠文, 王天顺, 莫磊兴, 李 焘, 闫飞燕. 分析化学, 2016, 44(9): 1394-1401
7 Haldorai Y, Yeon S H, Huh Y S, Han Y K. Sens. Actuators B, 2017, 239 (2): 1221-1230
8 Forteschi M, Sotgia S, Assaretti S, Arru D, Cambedda D, Sotgiu E, Zinellu A, Carru C. J. Sep. Sci. , 2015, 38(10): 1794-1799
9 Tayade K, Sonawane M, Torawane P, Singh A, Singh N, Kuwar A, Sen. Actuators B, 2017, 246 (7): 563-569
10 Ghosh A, Talukdar S, Ghosh K, Das T, Das D. RSC Adv., 2014, 4 (10): 55286-55289
11 Sutariya P G, Pandya A, Lodha A, Menon S K. Analyst, 2014, 139(19): 4794-4798
12 WANG Yu, REN ShuYue, JIANG HuiCong, BAI JiaLei, PENG Yuan, NING BaoAn, GAO ZhiXian. Chinese J. Anal. Chem. , 2017, 45(1): 35-41
王 瑜, 任舒悅, 姜会聪, 白家磊, 彭 媛, 宁保安, 高志贤. 分析化学, 2017, 45(1): 35-41
13 Duée N, Ambard C, Pereira F, Portehault D, Vinan B, Vallé K, Autissier D, Sanchez C. Chem. Mater., 2015, 27(15): 5198-5205
14 Hu Y L, Wu B Y, Jin Q, Wang X Y, Li Y, Sun Y X, Hou J Z, Zhao X J. Talanta, 2016, 152 (5): 504-512
15 Chen H Y, Fang A J, He L, Zhang Y Y, Yao S Z. Talanta, 2017, 164 (3): 580-587
16 Liu H J, Li M, Jiang L Y,Shen F, Hu Y F, Ren X Q. Spectrochim. Acta, 2017, 173 (2): 105-113
17 Liu Y Y, Li H C, Guo B, Wei L J, Chen B, Zhang Y Y. Biosens. Bioelectron., 2017, 91(5): 734-740
18 Chen C X, Zhao D,Hu T, Sun J, Yang X R. Sens.Actuators B., 2017, 241(3): 779-788
19 YANG ChuanXiao, YU MengWen, SONG DuoDuo, SUN XiangYing. Chemical Journal of Chinese Universities, 2016, 37(5):852-859
杨传孝, 余梦雯, 宋朵朵, 孙向英. 高等学校化学学报, 2016, 37(5): 852-859
20 Zhu L J,Peng X, Li H T, Zhang Y Y, Yao S Z. Sens. Actuators B, 2017, 238(2): 196-203
21 Chen Y C, Wu Y C, Wang D Y, Chen T M. J. Mater. Chem., 2012, 22(16): 7961-7969
22 Zhou J C, Yang Z L, Dong W, Tang R J, Sun L D, Yan C H. Biomaterials, 2011, 32(34): 9059-9067
23 Liu Q, Sun Y, Yang T,Feng W, Li C, Li F. J. Am. Chem. Soc., 2011, 133(43): 17122-17125