基于纳米金Core—satellites等离子体耦合增强效应的汞离子光纤传感器的研究
贾朔+边超+佟建华+孙楫舟+夏善红


摘 要 以DNA杂交双链为联接, 构建纳米金颗粒Coresatellites结构并激发等离子体耦合增强效应,利用Hg2+可与DNA中胸腺嘧啶T形成THg2+T特异性结构,研制了用于检测水中Hg2+的局域等离子体共振(LSPR)光纤传感器。待测溶液中的Hg2+能够引起富含T的DNA单链折叠,抑制DNA杂交反应,降低等离子体耦合强度,改变LSPR谐振波长。通过检测谐振波长红移变化,实现对Hg2+浓度的定量检测。本方法检测Hg2+的线性范围为5~150 nmol/L, 检出限为3.4 nmol/L (3σ)。 Zn2+、Mg2+、Pb2+等重金属离子对Hg2+检测无明显干扰作用。实际水样中Hg2+加样回收率为94.2%~105.4%,相对标准偏差<4.8%。
关键词 局域等离子体共振; 纳米金Coresatellites结构; 脱氧核糖核酸; 汞离子; 光纤传感器
1 引 言
汞离子(Hg2+)具有高毒性和污染性,在水质检测中备受关注[1,2]。Hg2+常规检测方法主要包括冷原子荧光法、电感耦合等离子质谱法、冷原子吸收光谱法等[3~6],这些方法虽然比较准确,但是存在设备昂贵、制样过程复杂、步骤繁琐等缺点。近年来,陆续报道了利用金属纳米颗粒作为传感元件,基于比色法、荧光法和表面增强拉曼光谱法用于Hg2+检测的研究报道[7~10]。其中,比色法检测灵敏度较低,荧光法需要标记,容易受到环境因素的干扰[11,12], 表面增强拉曼光谱法对仪器设备要求高。因此,研发体积小、无标记、易于制备、灵敏度高的传感器具有重要的应用价值。
纳米贵金属颗粒受光激发能够产生局域等离子体共振效应(LSPR),基于LSPR的生化传感器无需标记、检测速度快、传感区域小[13],已被用于Hg2+检测,但目前仍存在检测灵敏度较低的缺点[14~16]。研究表明,受光激发的两个贵金属颗粒接近时,其表面电磁场耦合产生等离子体增强效应[17,18],并随距离存在红移和衰减特性[19],该研究需要暗场显微镜和高精度光学系统,仅适用于实验室检测。Mucic等[20]提出了由一个核心纳米颗粒 (Auc)和多个外围纳米颗粒 (Aus)构成的Coresatellites 纳米结构,多个Aus使得耦合强度大幅提高,并适用于采用光谱仪检测,提高了实际应用能力。随后,其他研究者对该结构的材料组成、粒径尺寸等进行仿真优化[21~23],并初步实现DNA、抗原抗体等的增敏检测[24,25]。
本研究以石英光纤纤芯为传感基底,以富含胸腺嘧啶(T)的互补DNA双链为联接,构建纳米金颗粒Coresatllites结构,并实现等离子体耦合增强效应。利用Hg2+能够形成THg2+T结构使DNA单链折叠[26,27],减弱互补DNA杂交强度,降低等离子体耦合增强效应的特性,研制出一种体积小、结构简单、无标记、特异性、灵敏的检测Hg2+的光纤传感器。
2 实验部分
2.1 仪器与试剂
S4800扫描电子显微镜(日本Hitachi公司); QE65PRO型光纤光谱仪和DTMINI2GS宽带光源(美国Ocean Optics公司); 传感光纤(直径600 μm,数值孔径为0.37,美国Thorlabs公司); HC3018高速离心机(中科中佳公司)。磷酸盐缓冲液(PBS)、牛血清蛋白 (BSA)、聚烯丙基胺鹽酸盐(PAH)、巯基己醇(MCH),三(2羧乙基)膦(TCEP),购于SigmaAldrich公司。不同粒径纳米金溶液(Gold nanoparticles colloids,美国Ted Pella公司)。重金属离子标样购于环保部标准样品研究所; 其它试剂购自北京试剂厂。所用试剂均为分析纯,实验用水为去离子水。DNA序列由上海生物工程有限公司合成,如表1所示。
2.2 光纤传感器的制备
光纤经去除包层、端面抛光和清洗烘干后,浸入Piranha洗液(浓 H2SO4H2O2(30%),7∶3, V/V)中,65℃水浴1 h,使纤芯表面羟基化[28]; 浸入2 mg/mL
阳离子聚电解质PAH(1 mol/L NaCl)溶液中30 min,PAH通过静电作用吸附在纤芯表面; 浸入表面带负电的Auc溶液中1 h,Auc通过静电吸附形成自组装单层; 利用银镜反应在光纤端面形成银反光镜[29]; 将光纤浸入DNAp溶液中12 h,使巯基化DNAp通过AuS键固定在Auc表面; 浸入1 mmol/L MCH溶液中自组装2 h; 将光纤浸入BSA(2 mg/mL,0.01 mol/L PBS,pH 7.4)溶液中,封闭PAH表面吸附位点,减少非特异性吸附。
2.3 DNAT在液相Aus表面的修饰
取粒径20 nm 的Aus溶液,与DNAT以摩尔比1∶200混合,振荡24 h。加入TAE和NaCl老化,继续振荡24 h, 9000 r/min离心15 min,将沉淀物分散到40 mmol/L TrisHCl (pH 6.8, 0.1 mol/L NaCl)溶液中,获得DNAT修饰Aus(DNATAus)溶液。
2.4 Hg2+检测
将Hg2+标样稀释为0~1000 nmol/L待测溶液。按2.2节制备的光纤传感器,浸入Hg2+的TrisHCl溶液中30 min,用TrisHCl 缓冲液和去离子水清洗,吹干,室温下置于DNATAus溶液中1 h,并检测LSPR光谱谐振波长移动量(Δλp),通过加权质心算法(Weighted centroid algorithm)计算λp位置[30]。
3 结果和讨论
3.1 实验原理
如图1所示,光纤光在纤芯中以全反射方式传输,并在纤芯和周围媒介的固液界面产生倏逝波,倏逝波透过纤芯表面进入周围媒介激发Auc单层产生LSPR效应并返回纤芯,经光纤端面银反光镜反射,进入光纤光谱仪获得LSPR光谱。Auc表面DNAp与液相Aus表面DNAT发生杂交反应,使Aus结合在Auc表面,形成Coresatellites结构并激发等离子体耦合效应,导致λp红移。由于Hg2+能与T形成THg2+T结构,Hg2+存在时,DNAp通过THg2+T形成发卡结构,降低杂交反应强度,造成Aus结合量减少,降低Δλp。通过计算Δλp,实现对Hg2+浓度的定量检测。
3.2 Auc粒徑优化
取粒径40、60 和80 nm的金颗粒作为Auc,按2.2节制备由不同Auc修饰的光纤传感器,并在表面固定DNAp,浸入DNATAus溶液检测Δλp变化情况。如图2A所示,80 nm Auc修饰光纤传感器产生的Δλp最大,故选择80 nm作为Auc。图2B和2C分别是80 nm 单层Auc和结合Aus形成Coresatellites结构后的SEM图。
3.3 Auc表面DNAp的密度优化
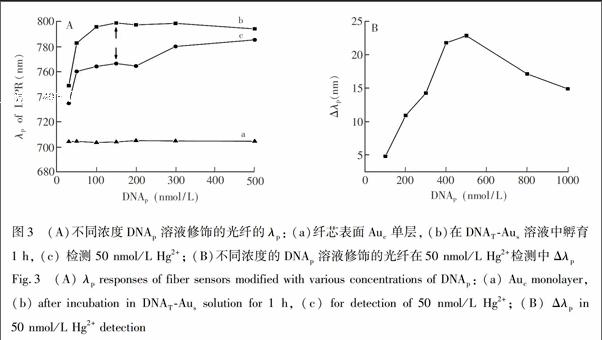
Auc表面DNAp的密度是影响检测灵敏度的重要因素。采用不同浓度DNAp溶液对光纤表面Auc进行修饰,测试了光纤在DNATAus溶液中Δλp及对Hg2+的响应。如图3A所示,曲线a为不同光纤的初始λp位置; 曲线b显示不同浓度DNAp溶液修饰的光纤在DNATAus溶液中的λp随DNAp浓度的增加而增大; 当修饰DNAp浓度大于 150 nmol/L时,λp波长位置趋于稳定,表明此时Auc表面结合Aus已经趋于饱和。不同浓度DNAp溶液修饰的光纤用于检测50 nmol/L Hg2+,由曲线c可见,随DNAp浓度增加,λp逐渐增大; 图3B表明,Δλp先增大后减少; 在DNAp为200 nmol/L时Δλp达最大值,之后随DNAp浓度的增加而减小。这可能是当DNAp密度增加到一定量时,DNAp对Hg2+的结合能力达到最大; 继续增大DNAp浓度,受空间位阻的影响,DNAp对Hg2+结合量下降,降低了Δλp。 因此本研究采用200 nmol/L DNAp进行Auc表面修饰。
3.4 传感器对Hg2+的检测性能
采用本传感器检测不同浓度Hg2+的标准溶液。如图4所示,LSPR光谱的Δλp随着Hg2+浓度增高而降低,当Hg2+浓度高于150 nmol/L时,Δλp趋于稳定,这是因为通过THg2+T作用形成的发卡结构探针DNA开始逐渐趋于饱和。采用本方法检测Hg2+线性范围为5~150 nmol/L,线性方程为y=0.372x+94.143, 检出限为3.4 nmol/L (3σ)。
每次测量后,将本光纤传感器浸入95℃去离子水中10 min,使DNAp和DNAT解链,实现传感器的再生。以再生6次后的传感器检测100 nmol/L Hg2+,响应值的相对标准偏差(RSD)为3.9%,表明本传感器具有良好的可重复使用性,至少可重复使用6次。取6支光纤传感器检测50 nmol/L Hg2+。每支传感器重复测量3次的RSD为1.5%~3.1%; 6支传感器测量平均值的RSD为4.9%,表明此传感器具有良好的制备重现性。
本检测方法与文献报道的Hg2+检测方法,如比色法、荧光法、拉曼光谱法、电化学、石英晶振微天平等方法[31~35]相比,具有无需标记、体积小、易于集成的优点。
3.5 实际水样分析
取清华大学校内荷塘水样,静置过滤后去除悬浮物,利用谱尼公司原子荧光法进行水中Hg2+含量检测,结果表明,水样中未检测出Hg2+。利用标准加入法在实际水样中分别加入不同浓度Hg2+,测定加标回收率。结果如表2所示,回收率为94.2%~105.4%,RSD<4.8%,表明本方法适用于环境水样中Hg2+检测。
4 结 论
基于石英光纤基底,以互补DNA杂交做联接,构建纳米金Coresatellites结构,利用Hg2+对杂交反应的抑制作用构建了一种新型Hg2+检测的光纤传感器,Hg2+检测线性范围5~150 nmol/L,检出限3.4 nmol/L。此传感器微型便携, 具有良好的应用潜力。
References
1 Lin Y, Vogt R, Larssen T. Environ. Toxicol. Chem., 2012, 31(11): 2431-2444
2 Li G H, Feng X B, Li Z G, Qiu G L, Shang L H. Sci. Total Environ., 2010, 408(20): 4607-4612
3 Gil S, Lavilla I, Bendicho C. Anal. Chem., 2006, 78(17): 6260-6264
4 Yu L, Yan X. At. Spectrosc., 2004, 25: 145-153
5 Bloxham M J, Hill S J, Worsfold P J. J. Anal. At. Spectrom., 1996, 11(7): 511-514
6 WANG Shuai, WANG Peng, WANG XiHe, GAO JiHui, ZHANG ZhiGuo, WU ShaoHua. Spectroscopy and Spectral Analysis, 2009, 29(8): 2262-2264
王 帅, 王 鹏, 汪细河, 高继慧, 张治国, 吴少华. 光谱学与光谱分析, 2009, 29(8): 2262-2264
7 Jin L H, Han C S. Sens. Actuators B, 2014, 195(5): 239-245
8 Han A, Liu X, Prestwich G D, Zang L. Sens. Actuators B, 2014, 198(198): 274-277
9 Fu S, Guo X, Wang H, Yang H F. Sens. Actuators B, 2014, 199(4): 108-114
10 Chemnasiri W, Hernandez F E. Sens. Actuators B, 2012, 173(10): 322-328
11 Wang R Y, Zhou X H, Shi H C, Luo Y. Biosens. Bioelectron., 2016, 78: 418-422
12 Long F, Gao C, Shi H C, He M, Zhu A N, Klibanov A M, Gu A Z. Biosens. Bioelectron., 2011, 26(10): 4018-4023
13 Mayer K M, Hafner J H. Chem. Rev., 2011, 111: 3828-3857
14 Heider E C, Trieu K, Moore A F T, Campiglia A D. Talanta, 2012, 99: 180-185
15 Zhao Q, Chen S N, Huang H W, Liu F P, Xie Y T. Anal. Lett., 2014, 47: 295-308
16 RitheshRaj D, Prasanth S, Sudarsanakumar C. Opt. Commun., 2016, 367: 102-107
17 Xu H X, Kall M. Phys. Rev. Lett., 2002, 89: 24802
18 Su K H, Wei Q H, Zhang X. Nano Lett., 2003, 3(8): 1087-1090
19 Sonnichsen C, Reinhard B M, Liphardt J, Alivisatos A P. Nat. Biotechnol., 2005, 23(6): 741-745
20 Mucic R C, Storhoff J J, Mirkin C A, Letsinger R L. J. Am. Chem. Soc., 1998, 120: 12674-12675
21 Sebba D S, Mock J J, Smith D R, LaBean T H, Lazarides A A. Nano Lett., 2008, 8(7): 1803-1808
22 Ruan Q F, Shao L, Shu Y W, Wang J F, Wu H K. Adv. Opt. Mater., 2014, 2: 65-73
23 Ode K, Honjo M, Takashima Y, Tsuruoka T, Akamatsu K. ACS Appl. Mater. Inter., 2016, 8: 20522-20526
24 Zhang T T, Li H, Hou S W, Dong Y Q, Pang G S, Zhang Y W. ACS Appl. Mater. Inter., 2015, 7: 27131-27139
25 Hall W P, Ngatia S N, Van Duyne R P. J. Phys. Chem. C., 2011, 115: 1410-1414
26 Ono A, Togashi H. Angew. Chem. Int. Ed., 2004, 43: 4300-4302
27 Ono A,Torigoe H, Tanaka Y, Okamoto I. Chem. Soc. Rev., 2011, 40: 5855-5866
28 Lin H Y, Huang C H,Chau L K. Biosens. Bioelectron., 2014, 51: 371-378
29 Cao J, Galbraith E K, Sun T, Grattan K T V. IEEE SENS J., 2012, 12: 2355-2361
30 Nenninger G G, Piliarik M, Homola J. Meas. Sci. Technol., 2002, 13: 2038-2046
31 Chen G H, Chen W Y, Chen C F. Anal. Chem., 2014, 86(14): 6843-6849
32 Xu L G, Yin H H, Ma W, Kuang H. Biosens. Bioelectron., 2015, 67: 472-476
33 Zhang J R, Huang W T,Zeng A L, Luo H Q, Li N B. Biosens. Bioelectron., 2015, 64: 597-604
34 Zhang Y, Zhao H, Wu Z J,Xue Y, Zhang X F, He Y J, Li X J, Yuan Z B. Biosens. Bioelectron., 2013, 48: 180-187
35 MO ZhiHong, YANG LinLing, YANG XiaoChao, CHEN ZiFeng. Chinese J. Anal. Chem., 2009, 37(7): 1033-1036
莫志宏, 楊琳玲, 杨小超, 陈自锋. 分析化学, 2009, 37(7): 1033-1036
Abstract Based on the plasmon coupling effect in gold nanoparticles coresatellite nanostructures linked by thymine(T)rich DNA hybridization and the specific Hg2+mediated THg2+T base pair, a novel localized surface plasmon resonance (LSPR) optical fiber sensor was proposed and developed for Hg2+ detection in water. The Hg2+induced conformational change in Trich DNA sequence inhibited the DNA hybridization reaction, weakened the plasmon coupling effect and leaded to the change of LSPR resonance wavelength. The concentration of Hg2+ was quantitatively determined by the resonance wavelength redshift. The linear range of Hg2+ detection was about 5-150 nmol/L with LOD about 3.4 nmol/L. The specificity of the sensor was proved great by evaluating the response to other heavy metal ions such as Zn2+, Mg2+, Pb2+ and so on. This sensor was applied in environmental water detection by standard addition method,with the RSD less than 4.8% and recoveries of 94.2%-105.4%.
Keywords Localized surface plasmon resonance; Gold nanoparticles coresatellites structure; Deoxyribonucleic acid; Mercury ion ; Optical fiber sensor
(Received 25 October 2016; accepted 12 February 2017)
This work was supported by the Major State Basic Research Development Program (No.2015CB352100) and the National Natural Science Foundation of China (No.61501100).