贝伐单抗联合化疗药物胸腔灌注治疗肺癌合并恶性胸腔积液的Meta分析
邓见青 苏清清 张少伟 初向阳
· 论著 ·
贝伐单抗联合化疗药物胸腔灌注治疗肺癌合并恶性胸腔积液的Meta分析
邓见青1苏清清2张少伟1初向阳1
目的 采用Meta分析的方法评价贝伐单抗联合化疗药物胸腔灌注治疗肺癌合并恶性胸腔积液(MPE)的疗效及安全性。方法 检索The Cochrane Library、PubMed、Embase、Web of Science数据库以及中国生物医学文献数据库、中国期刊全文数据库、维普、万方数据库,自2001年1月1日贝伐单抗有文献报道以来至2017年2月30日的文献。纳入贝伐单抗联合化疗药胸腔灌注治疗肺癌合并MPE的随机对照试验(RCT)。以总有效率、主要不良反应为评价指标,采用相对危险度(RR)为效应量,使用Review Manager5.3和Stata12.0软件进行Meta分析。结果 最终纳入8项RCT共510例肺癌合并MPE患者。Meta分析结果显示,联用贝伐单抗与化疗药物胸腔灌注可提高肺癌合并MPE治疗有效率[RR=1.43,95%可信区间(95%CI)=1.27~1.62,P<0.001];两组患者治疗不良反应差异均无统计意义(P>0.05)。结论 贝伐单抗联合化疗药物胸腔灌注治疗肺癌合并MPE比单用化疗药物胸腔灌注治疗效果更好,且该治疗方案没有增加不良反应。
贝伐单抗; 肺癌; 恶性胸腔积液; Meta分析; 随机对照试验
肺癌是最常见的恶性肿瘤,对人类健康造成了巨大威胁[1]。恶性胸腔积液(malignant pleural effusion,MPE)为肺癌晚期常见的并发症之一[2]。约有15%的肺癌患者在诊断时就已经出现了MPE,约有50%的晚期肺癌患者在病情进展中会出现MPE[3]。肺癌出现MPE常提示患者已经失去手术的意义,预后极差。肺癌合并MPE的患者5年生存率仅为2%,中位生存期仅为8个月[4]。MPE增长迅速,常引起胸闷、气短及呼吸困难等症状,大量胸水压迫肺部可引起肺不张,导致肺部感染及肺实变,严重影响患者的生活质量,病程进展甚至可引发限制性通气障碍、纵隔移位,危及患者生命。全身化疗、胸腔穿刺和置管引流、胸腔内局部注药、胸膜固定术、热疗、放疗是目前MPE主要的治疗手段[5]。目前临床上最常用的是方法是胸腔内给药,通过局部直接杀灭癌细胞、刺激浆膜造成间皮细胞纤维化,控制胸腔积液的生成[6]。胸腔内给药的药物种类主要有化疗药、生物反应调节剂、硬化剂、中药等[7]。临床上常采取药物联合进行胸腔内给药用以提高疗效,但总的疗效较差[8]。多项研究[9-16]显示,贝伐单抗联合顺铂或其他化疗药物胸腔灌注治疗肺癌所致MPE能提高患者胸腔积液治疗的有效率,且不增加不良反应发生率。但是由于目前缺乏大样本、多中心临床试验,且大多数研究存在样本量小、质量较低等问题,缺乏统一有力的循证医学证据。因此,本研究采用Meta分析的方法,整合相关文献,旨在为贝伐单抗的临床应用提供循证医学证据支持。
资料与方法
一、 文献纳入标准
1. 研究对象的选择:经病理学或细胞学明确诊断为肺癌、胸部超声或CT等检查提示有胸水,且胸水中找到恶性肿瘤细胞的患者。
(1) 实验组干预措施:患者采用贝伐单抗+顺铂或者其他化疗药胸腔灌注治疗,无论是否同时给予全身化疗。
(2) 对照组措施:仅给予患者顺铂或者其他化疗药胸腔灌注治疗,其余干预措施与实验组相同。
2. 结局指标:主要包括总有效率和不良反应发生率:①总有效率:依据世界卫生组织(WHO)的疗效评价标准来判定胸水治疗效果。完全缓解(complete remission, CR):胸水及相关症状完全消失,并持续4周;部分缓解(partial remission, PR):胸水减少1/2以上,症状明显改善且持续4周。稳定(stable disease, SD):胸水减少小于1/2,无增加趋势,症状较治疗前有所缓解;进展(progressive disease, PD):胸腔积液无增加或减少,需要再次穿刺抽液。视胸水较治疗前减少1/2以上即CR+PR为有效,并依此计算总有效率。②主要不良反应发生率:包括白细胞减少,恶心、呕吐、腹泻等胃肠道反应,以及血压升高、蛋白尿、出血等。
3. 纳入研究:贝伐单抗联合化疗药物治疗肺癌合并胸腔积液患者疗效的随机对照试验(randomized controlled trial, RCT),无论是否采用盲法。
二、 排除标准
排除病例报道、回顾性分析、单臂实验等非RCT研究;排除以实体瘤疗效评价标准(RECIST 1.1) 进行恶性胸水疗效评价(治疗有效定义为治疗后胸水较治疗前减少≥30%,持续时间≥4周)的RCT研究;评价排除非癌性胸水的文章;排除非中、英文文献。
三、 文献检索和资料收集方法
1. 检索词:英文检索词为bevacizumab/avastin、magligant pleural effusion、 lung cancer;中文检索词为贝伐单抗/阿瓦斯汀/安维汀、恶性胸水/恶性胸腔积液、肺癌。
2. 检索数据库:包括中国生物医学文献数据库(CBM)、中国期刊全文数据库(CNKI)、维普数据库(VIP)、万方数据库、The Cochrane Library、PubMed、EMBASE 及Web of Science数据库。检索时间:自贝伐单抗有文献报道以来(2001年1月1日至2017 年2月30日)。
3. 手工及其他检索:用Baidu、Google等搜索引擎在互联网上查找相关的文献。
四、 纳入文献的筛查、质量评价和资料提取
由两名研究者独立筛选文献,根据摘要和关键词初筛文献,阅读初筛文献全文,结合文献纳入和排除标准,意见不统一时找第三者协商确定是否纳入。按Cochrane 协作网偏倚风险评价标准对纳入的RCT进行方法学质量评价。评价指标包括①随机分配方法;②分配方案隐藏;③盲法;④结果数据的完整性;⑤选择性报告研究结果;⑥其他偏倚来源。并按照Cochrane系统评价手册关于质量评价分级标准对纳入文献进行质量分级(文献质量由高到低分为A、B、C)。提取信息主要包括第一作者、发表日期、患者的基本临床特征、具体治疗干预措施以及研究终点指标。
五、 统计学方法
对收集的数据采用Review Manager 5.3和Stata 12.0软件进行Meta分析。客观有效率以及不良反应均采用相对危险度(relative risk,RR)及95%的置信区间(95%CI)为效应指标。采用卡方检验分析各资料的异质性,用I2判断指标统计学异质性:I2<50%,采用固定效应模型合并效应量;I2≥50%,采用随机效应模型合并效应量。采用Stata 12.0软件分析主要指标的发表偏倚(Begg’s检验和Egger’s检验)并进行亚组分析。
结 果
一、 文献筛查
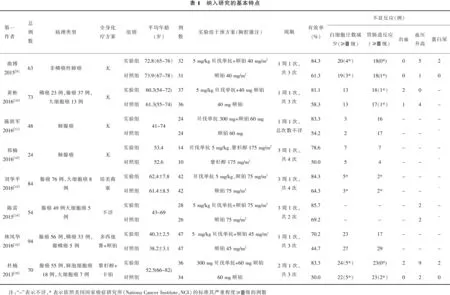
原始文献筛选流程见图1。对初筛的150篇文献,根据纳入、排除标准严格筛选并排除重复文献后,共纳入RCT 8项,共计510例患者,其中实验组260例,对照组250例。所有病例为肺癌患者,且均在胸腔积液中检测到恶性细胞。纳入研究的基本特点见表1。
二、 方法学质量评价
纳入的8篇文献均未提及分配方案隐藏、盲法方面的内容,只有刘华平和林凤华等[13,15]的研究阐述了具体的随机化数字产生方法,分别为计算机随机数法和随机数字表法。8篇文献选择性报告研究结果方面均被评价“不清楚”,7篇文献[9-15]有完整的数据记录,杜楠等[16]的研究中有2例患者失访,作者对原因进行了说明。在其他偏倚方面,杜楠等[16]的研究中实验组和对照组基线不齐。7篇文献[9-15]质量分级为B级,1篇文献[16]质量分级为C级(表2)。
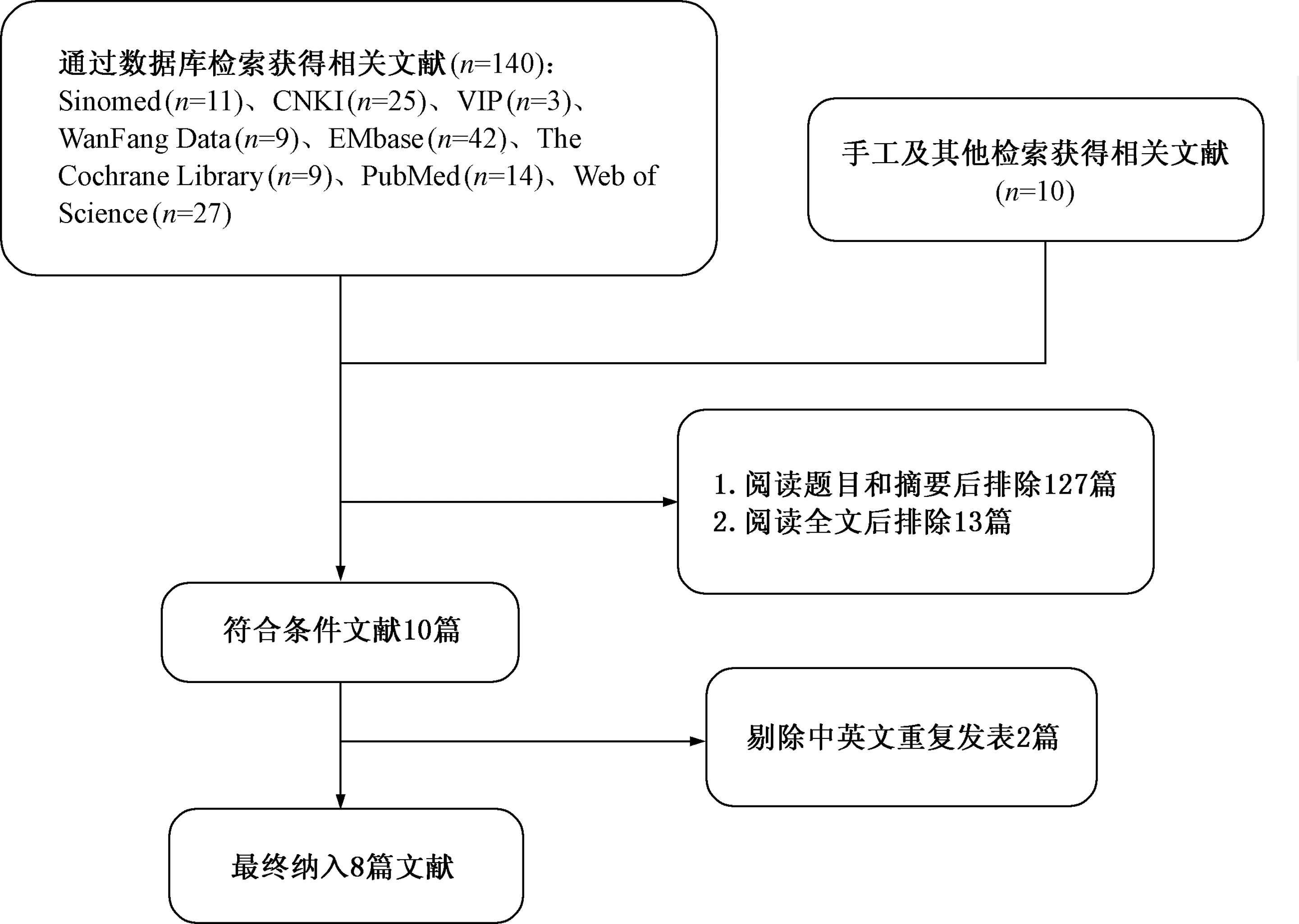
图1 文献筛选流程
三、 异质性检验
分别以总有效率、不良反应发生率进行效应指标的异质性检验,除了不良反应中血压升高I2≥50%,其余所有合并指标均I2<50%,且无异质性(P>0.05),因此采用固定效应模型进行Meta分析,对I2≥50%的血压升高指标进行Meta分析。
四、 Meta分析结果
1. 总有效率:8项研究均报道了实验组和对照组中患者达到CR或PR的人数。Meta分析显示,各个研究间无统计学异质性(P=0.91,I2=0),故选取固定效应模型合并统计量。Meta分析结果显示,与单用化疗药物胸腔灌注治疗方案比较,联合贝伐单抗胸腔灌注可提高肺癌合并MPE治疗有效率[RR=1.43,95%CI为1.27~1.62,P<0.001],提示两组方案治疗有效率的差异有统计学意义(图2)。
Begg's检验和Egger's 检验结果均显示P>0.05,可以认为8项研究合并的总有效率没有发表偏倚。根据是否同时给予受试对象全身化疗分成全身化疗组[9-12]和未全身化疗组[13-16],进行亚组分析结果显示两亚组间合并总有效率一致[RR1=1.44(1.19~1.74),RR2=1.43(1.22~1.68)],可以认为是否同时合并全身化疗不影响贝伐单抗联用化疗药物胸腔灌注治疗肺癌合并MPE的总有效率。敏感性分析表明本研究合并的总有效率稳定性较高。
2. 不良反应:纳入文献报道的不良反应参差不齐,本Meta分析对化疗药和贝伐单抗相关的不良反应进行了合并分析。与化疗药物有关的不良反应指标包括白细胞计数减少、≥Ⅲ级(严重程度)白细胞计数减少、胃肠道反应、≥Ⅲ级(严重程度)胃肠道反应,结果显示白细胞计数减少与胃肠道反应在发生例数上以及严重程度(≥Ⅲ级)上均无统计学差异(P>0.05);与贝伐单抗相关的不良反应主要包括血压升高、出血、蛋白尿[17],这些指标在发生例数上无统计学差异(P>0.05)(表3)。
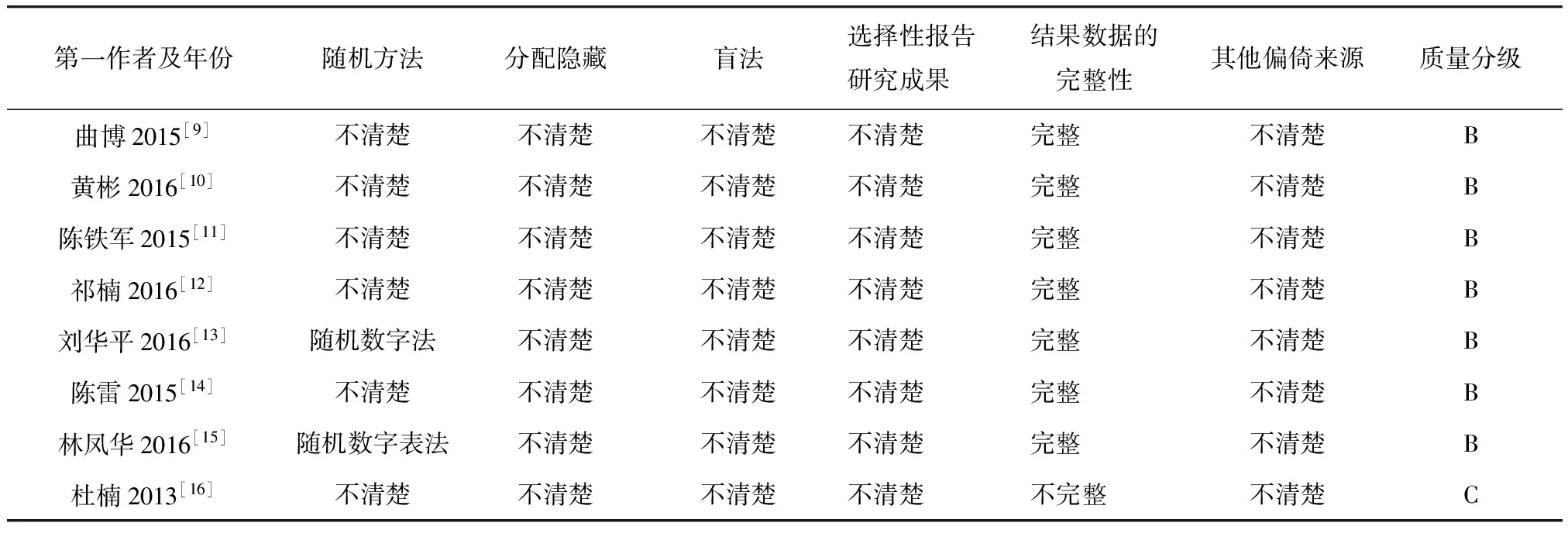
表2 纳入研究的偏倚风险评价
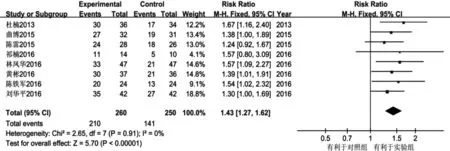
图2 贝伐单抗联合化疗药物局部治疗肺癌合并MPE总有效率比较的Meta分析
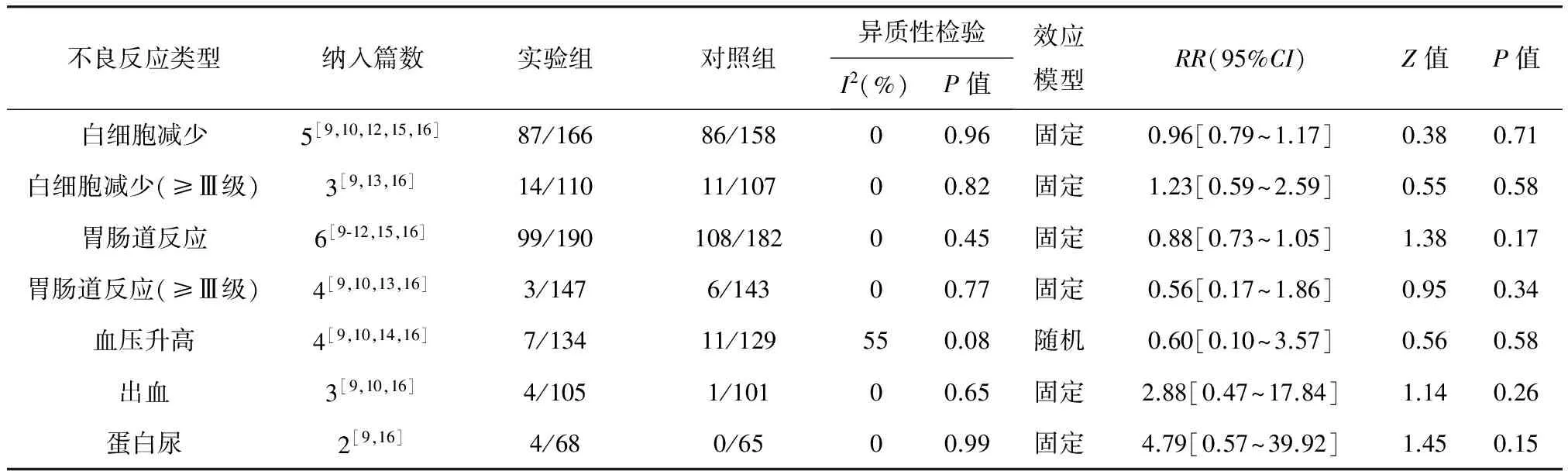
表3 主要不良反应发生率的Meta分析
讨 论
一、 纳入研究的方法学质量评价
本Meta分析充分检索了国内外贝伐单抗联合化疗药物胸腔灌注治疗肺癌合并MPE疗效的原始文章,经过严格筛选最终纳入的8篇文章均为我国学者发表的文献。符合纳入标准的8篇文献仅有6篇报道了具体的基线可比性,大部分文献未给出具体的随机化方法,所有文献均未交代是否使用盲法和分配隐藏。虽然大部分研究未采用盲法,但由于本研究的结局指标:客观有效率为客观测量指标,所以结果仍有一定的可信度。
二、 贝伐单抗联合化疗药物胸腔灌注治疗肺癌合并MPE的治疗效果
1.客观有效率:有研究[18]显示,肺癌患者MPE中血管内皮生长因子(vascular endothelial growth factor,VEGF)高度富集,且VEGF与MPE的产生、肿瘤转移密切相关。动物和体外研究[19]显示VEGF是治疗MPE新的靶点。贝伐单抗是一种重组人源化抗VEGF单克隆抗体,能与人VEGF结合并阻断其生物活性[20]。VEGF通过与VEGFR-2结合,诱导MAPK信号下游,PKC和PI3K/AKT通路,从而发挥生物学效应,主要包括促进血管内皮细胞增殖,诱导新生血管生成、肿瘤细胞生长迁移并且增加血管通透性,其增加血管通透性强度为组胺的5 000倍以上。此外,VEGF亦有可能同时通过与VEGFR-3结合后刺激淋巴管生成,从而促进MPE的形成,但这一猜测有待证实[4,21]。贝伐单抗可以特异性阻断VEGF与其受体结合,进而抑制VEGF诱导的内皮细胞增殖、新血管生成,降低血管的通透性,从而控制MPE。众多临床研究[9-16,22,23]指出贝伐单抗联合化疗药物胸腔灌注对控制肺癌恶性胸水有效。本Meta分析结果亦提示联用贝伐单抗和化疗药物胸腔灌注治疗肺癌合并MPE总有效率优于单用化疗药物胸腔灌注。
2.不良反应:胸腔灌注化疗药物治疗MPE,可延长药物在局部组织的作用时间,低剂量药物浓度即可对肿瘤细胞产生较强杀伤力,且对机体其他组织器官损害小。贝伐单抗因其具有特定的治疗靶点,可作用于对MPE的发生机制,且产生的不良反应小。因此,联用贝伐单抗和铂类等化疗药物胸腔灌注治疗肺癌合并的MPE结合了两者的优势,在提高疗效的同时不增加不良反应发生率。与单用化疗药胸腔灌注治疗MPE相比,联用贝伐单抗并不增加不良反应发生率,本Meta分析结果证实了这一点。以上结果提示贝伐单抗联合化疗药物胸腔灌注是肺癌合并MPE的治疗方法之一。
三、 其他方面
1. 生活质量改善情况:刘华平和陈雷等[13,14]分别报道了治疗后两组的生活质量评分(根据EORTC QLQ-C30评价标准),结果均显示两组生活质量评分差异有统计学意义(P<0.05),实验组生活质量改善情况优于对照组。
2. VEGE浓度与局部用药的关系:纳入的研究几乎报道了同样的结果,即实验组和对照组MPE中VEGF浓度在局部治疗后均明显下降,但联用贝伐单抗组VEGF下降更为明显,表明贝伐单抗对MPE中VEGF控制更为有效。杜楠等[16]报道胸腔积液VEGF阳性者中贝伐单抗治疗有效率比VEGF阴性者高,可否将治疗前MPE中VEGF因子浓度作为贝伐单抗治疗有效率的预测指标有待进一步的临床试验证实。
3. 贝伐单抗治疗的远期效果:曲博等[9]报道了实验组和对照组的中位生存时间(13个月vs12个月),两者差异无统计学意义(P>0.05)。杜楠等[16]报道了类似的结论(10.3个月vs10.1个月),但该研究两组的无进展生存期(5.3个月vs4.5个月)有统计学差异(P<0.05)。祁楠等[12]报道了实验组和对照组1年生存率(45.8%vs20.8%),两组差异有统计学意义(P<0.05)。对原发病关于贝伐单抗的远期疗效结果层次不齐。虽然贝伐单抗通过胸膜到达体循环的量小,对原发病灶治疗作用较小,但其提高了MPE的治疗效果,降低了并发症的风险;此外,由于贝伐单抗阻断了VEGF,从而抑制肿瘤新生血管生成,延缓MPE进展,有延长生存期的可能性。因此,贝伐单抗治疗肺癌合并MPE的远期疗效(无进展生存期、中位生存时间)亟待大样本、多中心的临床试验证实。
四、 局限性分析
本Meta分析最终纳入8篇RCT只涵盖510例患者,样本量仍不够大,且均为国内研究,存在一定局限性。贝伐单抗治疗肺癌合并胸腔积液虽在国外也有报道[ 24,25],但主要为病例报道,或虽为RCT研究,治疗组采用的治疗方法为贝伐单抗(全身给药)联合全身化疗,而非胸腔局部灌注,不符合纳入标准,而且国外较少采用胸腔灌注药物这一治疗方法治疗MPE,以致最终纳入研究均为国内研究。此外,各文献之间还存在治疗方案不统一、疗程及间隔周期不一致、不良反应记录不充分、生活质量评价标准不统一等问题,且对MPE治疗后的复发情况、远期治疗效果报道较少,因此,无法进行更加全面地Meta分析来评价贝伐单抗联合化疗药物局部治疗肺癌合并MPE的治疗效果。
综上所述,贝伐单抗联合化疗药物胸腔灌注治疗肺癌合并MPE比单用化疗药物胸腔灌注治疗效果更好,且该治疗方案未增加不良反应。但是由于纳入的研究文献总体样本量较小,各研究的评价指标不完全统一,文献质量参差不齐,因此本次Meta分析的结果的可靠性有待进一步大样本、多中心的临床试验验证。
1 Siegel RL, Miller KD, Jemal A. Cancer Statistics, 2017 [J]. CA Cancer J Clin, 2017, 67(1): 7-30.
2 徐继平, 周蕾, 杨卫兵. 恩度联合顺铂胸腔灌注治疗非小细胞肺癌合并恶性胸腔积液研究进展[J]. 大连医科大学学报, 2015(1):89-92.
3 Bradshaw M, Mansfield A, Peikert T. The role of vascular endothelial growth factor in the pathogenesis, diagnosis and treatment of malignant pleural effusion[J]. Curr Oncol Rep, 2013, 15(3):207-216.
4 Froudarakis ME. Pleural effusion in lung cancer: more questions than answers[J]. Respiration, 2012, 83(5):367.
5 陈文海. 恶性胸腔积液的治疗进展[J]. 基层医学论坛, 2013,17(4):510-512.
6 汪睿,史清明.76例恶性胸腔积液局部治疗与联合化疗的疗效分析[J]. 安徽医学,2012,33(9):1171-1172.
7 严文跃,钱晓萍,刘宝瑞.恶性胸腔积液的治疗进展[J]. 现代肿瘤医学,2009,17(7):1393-1396.
8 Neragi-Miandoab S. Malignant pleural effusion, current and evolving approaches for its diagnosis and management[J]. Lung Cancer, 2006, 54(1):1-9.
9 曲博,姜威,周志明.贝伐单抗联合顺铂治疗肺癌合并恶性胸腔积液的临床研究[J].中国医科大学学报,2015,44(7):648-652.
10 黄彬.贝伐单抗和顺铂联合治疗肺癌合并恶性胸腔积液的疗效评价[J]. 国际呼吸杂志,2016,36(11):814-817.
11 陈铁军, 李琳琳, 王月,等. 贝伐单抗联合顺铂胸腔灌注治疗肺腺癌恶性胸腔积液的临床研究[J]. 数理医药学杂志, 2016, 29(2):172-173.
12 Qi N, Li F, Li X, et al. Combination use of paclitaxel and avastin enhances treatment effect for the lung cancer patients with malignant pleural effusion[J]. Medicine, 2016, 95(47):e5392.
13 刘华平, 龚传明, 屈磊,等. 贝伐单抗联合培美曲塞/顺铂治疗肺癌合并恶性胸腔积液的疗效[J]. 西南国防医药, 2016(12):1448-1450.
14 陈雷,夏书月.贝伐单抗联合顺铂治疗肺癌合并恶性胸腔积液的效果和安全性[J].上海交通大学学报:医学版,2015,35(8):1194-1198.
15 林凤华,苏伟平,金润女.贝伐单抗联合顺铂治疗肺癌合并恶性胸腔积液临床研究[J].临床军医杂志,2016,44(7):698-700.
16 Du N, Li X, Li F, et al. Intrapleural combination therapy with bevacizumab and cisplatin for non-small cell lung cancermediated malignant pleural effusion[J]. Oncol Rep, 2013, 29(6): 2332.
17 裘雁冰, 陆益, 吴洪斌,等. 贝伐单抗及其联用化疗方案的不良反应[J]. 药物不良反应杂志, 2006, 8(6):431-433.
18 Yanagawa H, Takeuchi E, Suzuki Y, et al. Vascular endothelial growth factor in malignant pleural effusion associated with lung cancer[J]. Cancer Immunol Immunother,1999, 48(7):396-400.
19 Grove CS, Lee YC. Vascular endothelial growth factor: the key mediator in pleural effusion formation[J]. Curr Opin Pulm Med, 2002, 8(4):294-301.
20 Samant RS, Shevde LA. Recent advances in anti-angiogenic therapy of cancer[J]. Oncotarget, 2011, 2(3):122.
21 Brown L F, Detmar M, Claffey K, et al. Vascular permeability factor/vascular endothelial growth factor: a multifunctional angiogenic cytokine[J]. EXS, 1997, 79:233.
22 迟晶,白阳,陈虹.贝伐单抗联合卡铂治疗肺癌合并恶性胸腔积液的临床研究[J].中国临床药理学杂志,2016,32(13):1175-1177.
23 韩娜,张孟贤,于世英,等.贝伐单抗联合顺铂/培美曲塞治疗非鳞癌性肺癌合并恶性胸腔积液的临床研究[J].华中科技大学学报:医学版,2013,42(5):588-591
24 Hama M, Komatsu Y, Hachiya T. A case of lung cancer showing markedreduction of pleural effusion by bevacizumab in combination with carboplatinand paclitaxel. Gan To Kagaku Ryoho. 2011;38:1877-1879.
25 Niho S, Kunitoh H, Nokihara H, et al. Randomized phase II study of first-line carboplatin-paclitaxel with or without bevacizumab in Japanese patients with advanced non-squamous non-small-cell lung cancer.[J]. Lung Cancer, 2012, 76(3):362-367.
(本文编辑:周珠凤)
邓见青,苏清清,张少伟,等. 贝伐单抗联合化疗药物胸腔灌注治疗肺癌合并恶性胸腔积液的Meta分析[J/CD]. 中华胸部外科电子杂志,2017,4(2):112-119.
Efficacy and safety of intrapleural combination therapy with bevacizumab and chemotherapeutic agents for lung cancer-mediated malignant pleural effusion: a meta-analysis
ChuXiangyang,Email:xiangyangchu@163.com
Objective To systematically review the efficacy and safety of intrapleural injection of Bevacizumab combined with chemotherapeutic agents in treatment of lung cancer with malignant pleural effusion. Methods Databases including PubMed, The Cochrane Library, EMbase, Web of Science, CNKI, VIP and WanFang Data were searched to collect randomized controlled trials (RCTs) about Bevacizumab combined with chemotherapeutic agents for lung cancer-mediated malignant pleural effusion from 2000 to February 2017. Overall response rates, main adverse effects incidence, relative risk(RR) were calculated. Then meta-analysis was performed by RevMan 5.3 and stata 12.0 software. Results A total of 8 RCTs involving 510 patients were finally included. The results of Meta analysis showed that: the overall response rate in the Bevacizumab combined with chemotherapeutic agents group were higher than that of the conventional chemotherapeutic agents alone group (RR=1.43, 95%CI1.27 to 1.62,P<0.001;). However, there were no significant differences between two groups in incidence of main adverse effects (P>0.05). Conclusions Compared with chemotheraputic agents, intrapleural injection of Bevacizumab combined with chemotherapeutic agents can improve the overall response rate without increasing incidence of main adverse reaction.
Bevacizumab; Lung cancer; Malignant pleural effusion; Meta-analysis; Randomized controlled trial
10.3877/cma.j.issn.2095-8773.2017.02.09
100853 北京,解放军总医院胸外科1,护理部2
初向阳,Email:xiangyangchu@163.com
2017-03-21)

