尖孢镰刀菌侵染下香蕉幼苗抗病生理响应研究
董鲜+马玉楠+马晓惠+李维蛟+徐福荣
摘 要 香蕉枯萎病由土傳病菌尖孢镰刀菌侵染引起,为探究病原菌侵染过程中香蕉植株的抗病生理响应,本研究利用温室培养植株接种病原菌的方法,测定病原菌侵染之后叶绿素含量、抗病防御酶活性、总酚含量、木质素含量、可溶性糖含量和氨基酸含量。结果表明:(1)随着病原菌的侵染,叶绿素含量显著降低。在侵染第16天时,发病植株叶绿素含量相对于健康植株降低44%;(2)病原菌侵染之后,植株各部位抗病防御酶苯基丙氨酸解氨酶(PAL)、过氧化物酶(POD)和多酚氧化酶(PPO)活性显著提高;(3)随着病情的加剧,酚类物质和木质素逐渐在植株体内累积;(4)病原菌侵染之后,香蕉植株叶片和假茎可溶性糖含量显著增加,但根系可溶性糖含量显著降低。当植株发病等级为I级时,叶片和假茎可溶性糖含量增加至未侵染植株的1.53和1.62倍,根系可溶性糖含量降低至未侵染植株的67%;(5)当植株发病等级为II级时,叶片和假茎氨基酸含量分别增加至未侵染植株的的3.01、5.38和1.99倍。综上所述,病原菌侵染之后,香蕉植株会通过提高抗病防御酶活性,合成抗病物质酚类和木质素,同时,也会主动累积可溶性糖和氨基酸,来缓解由于病原菌侵染之后所造成的渗透胁迫。
关键词 香蕉 ;尖孢镰刀菌 ;抗病防御酶 ;可溶性糖 ;氨基酸
中图分类号 S668.1 ;Q945.8 文献标识码 A Doi:10.12008/j.issn.1009-2196.2017.05.011
Physiological Resistance Response of Banana Seedlings to
Fusarium oxysporum
DONG Xian MA Yunan MA Xiaohui LI Weijiao XU Furong
(College of Chinese Medical Materials, Yunnan University of Chinese Medical Sciences,
Kunming, Yunnan 650500)
Abstract Banana wilt disease was caused by soil-borne pathogen Fusarium oxysporum. Hydroponic experiments with pathogen inoculation were conducted in the greenhouse to observe the resistance response of banana seedlings to F. oxysporum. The banana seedlings infected with F. oxysporum were determined in terms of chlorophyll, total phenolic, lignin, soluble carbohydrate and amino acid and defense enzyme activity. When infected with the pathogen, the banana seedlings reduced their chlorophyll content significantly, and at the day 16 their chlorophyll content was decreased by 44% compared with the healthy plants.After infected with the pathogen, the banana seedlings increased significantly the activities of the defense enzymes like phenylalanine ammonia lyase (PAL), peroxidase (POD) and polyphenol oxidase (PPO). When seriously infected with the pathogen, they increased gradually their contents of total phenolic acid and lignin. After infected with the pathogen, the banana seedlings increased significantly their soluble carbohydrate content in the leaves and pseudostem, but decreased their soluble carbohydrate content in roots. When the disease grade was ranked I, the infected banana seedlings increased the content of soluble carbohydrate in the leaves and pseudostem by 1.53 times and 1.62 times as against the non-infected plants, and reduced their content of soluble carbonhydrate in the root by 67%. At the disease grade II, the infected banana seedlings increased their amino acid content by 3.01 times, 5.38 times and 1.99 times in the leaves, pseudostem and root as against the noninfected plants, respectively. It is concluded that when infected with the pathogen banana plants synthesized the phenols and lignin to increase the activity of disease defense enzyme and at the same time, accumulated actively the soluble carbohydrates and amino acids to ease the osmotic stress caused by the pathogenic infection.
Keywords banana ; Fusarium oxysporum ; defense enzyme ; soluble carbohydrate ; amino acid
香蕉(Musa spp.)为芭蕉科(Musaceae)芭蕉属(Musa)多年生单子叶草本植物。香蕉枯萎病是由尖孢镰刀菌古巴专化型(Fusarium oxysporum f. sp. cubense(E. F. Smith) Snyder and Hansen)侵染引起的土传维管束病害[1-2]。病原菌通过根系侵入,并沿着维管束向地上部扩展,导致植物细胞膜破裂、维管束堵塞等,最终使植株枯萎死亡[3-4]。在寄主植物与病原微生物相互作用过程中,病原菌入侵寄主后能产生激素、酶类和毒素等物质,这些物质有利于病原菌更好地在寄主中生存和繁殖[5]。
香蕉枯萎病作为一种土传病害,在防治上难度比较大,其发生及危害程度与土壤物理和化学性质、耕作制度、管排水、施肥种类与措施、苗床管理、化学药品种类与用量、香蕉品种等有关。有研究表明,香蕉枯萎病抗病品种的根系分泌物抑制病原菌孢子的萌发,并且抑制能力随植株的衰老而减弱[6]。Ana等[7]用分离的病原菌细胞壁激发子处理香蕉根系后能引发细胞壁的木质化,并伴随着苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)、多酚氧化酶(PPO)等植物防御相关酶活性的增强。Patel[8]研究表明,激发子处理香蕉植株后,水杨酸(SA)含量相比对照植株显著增加,上述防御酶活性也显著提高。Thangavelu等[9]用病原菌处理香蕉后,得到相似的结论。现国内外研究多停留在用病原菌或其产物离体处理植株,单一研究某一方面的生理响应,缺乏对植物与微生物相互作用及植株抗病生理响应的系统研究。故本研究采用活体接种病原菌,分析接种病原菌的香蕉植株在不同发病程度下抗病生理响应方式,为降低香蕉枯萎病发生率、发展香蕉生产提供理论依据。
1 材料与方法
1.1 材料
香蕉(Musa paradisiaca) 品种:巴西香牙蕉,感病品种,由南京农业大学海南试验基地提供。香蕉枯萎病病原菌:尖孢镰刀菌古巴专化型4号生理小种,来自南京农业大学植物营养与施肥系菌种保存室。
1.2 方法
1.2.1 试验设计
组培香蕉苗栽培在无菌石英砂中,待组培苗长至2叶1心时,移栽至2.5 L塑料桶,每个塑料桶里培养4株,移苗后每4 d换营养液1次,采用Hoagland营养液配方[10],培养温度28℃,相对湿度(70±10)%,每天光照时间14 h。待香蕉幼苗长至5~6叶期时,随机选取幼苗30株在浓度为1×106的尖孢镰刀菌悬浮液中浸根2 h,另选取幼苗30株在无菌水中浸根相同时间作为空白对照。试验共设2个处理,即对照和接种病原菌处理。
尖孢镰刀菌悬浮液的制法:尖孢镰刀菌古巴专化型4号生理小种接种在PDA 培养基上,28℃恒温培养,待菌丝长满整个平板的时候取出,刮下菌丝用无菌水悬浮,摇床上摇匀,4层纱布过滤制得孢子悬浮液。
1.2.2 指标测定
1.2.2.1 病原菌侵染植株病情分级
待香蕉幼苗接種病原菌16 d后,根据病情严重程度将病害分为以下3个等级。
NI:未侵染植株,无菌水对照;
I:轻病株,有1~3片下位叶表现失绿病症;
Ⅱ:重病株,有4~5片下位叶表现失绿病症。
1.2.2.2 叶绿素含量的测定
叶绿素含量用 SPAD-502 型叶绿素仪对新完全展开叶进行测定,每片叶测定6次然后取平均数,以 SPAD 值表示。
1.2.2.3 苯基丙氨酸解氨酶(PAL)、过氧化物酶(POD)和多酚氧化酶(PPO)活性测定
苯基丙氨酸解氨(wujuns)酶活性的测定参照Else[11]的方法并有少许改变。准确称取1 g叶片组织,在内含14 mmol/L的2-巯基乙醇硼酸钾缓冲液(100 mmol/L,pH 8.8)中磨成匀浆,之后在转速为12 000 g下离心20 min,上清液即为酶提取物。100 μL酶提取物与1 mL的硼酸钾缓冲液(100 mol/L,pH 8.8)和2 μL的 100 mmol/L L-苯丙氨酸混匀后在37℃水浴中保温60 min后,加入1 mL 1 mol/L HCl反应终止液。空白对照即为酶提取物与 L-苯丙氨酸混合液。在分光光度计下得到波长在290 nm下的吸光度,其中一个单位酶活性被定义为每小时吸光度增加1。
准确称取1 g 叶片组织,在5 mL含有0.1 g聚乙烯吡咯烷酮(PVPP)的磷酸缓冲液中(100 mmol/L,pH 7.0)磨成匀浆,提取物用来测定过氧化物酶(POD)和多酚氧化酶(PPO)的活性[12]。
POD的活性测定采用如下方法:1 mL上述酶提取物上清液与3 mL含有20 mmol/L愈创木酚的磷酸缓冲液(20 mmol/L,pH 7.0)混匀,当 20 μL H2O2添加之后,立即测定其在波长为 470 nm下吸光度的增加值,其中一个单位酶活性被定义为每分钟吸光度增加1。
PPO 的活性测定采用如下方法[13]:1 mL上述酶提取物上清液与1 mL磷酸缓冲液(100 mmol/L,pH 7.0)和1 mL邻苯二酚(50 mmol/L)混匀,之后测定其在410 nm下的吸光度增加值。一个单位酶活性被定义为每分钟吸光度增加1。
可溶性蛋白含量采用考马斯亮蓝试剂测定,方法参照李合生[14]中描述,酶活性表示为U mg-1 protein。
1.2.2.4 总酚含量测定
植株总可溶性酚类含量测定采用福林酚法进行测定[2]。取0.5 g新鲜植株组织样品在液氮中充分磨碎,加入5 mL甲醇浸提1 h,12 000 g下离心10 min,取0.2 mL上清液,与福林酚试剂反应,在765 nm下测定吸光度。
1.2.2.5 木质素含量测定
木质素含量采用乙酰溴方法测定[2]。0.2 g 叶片干样用 95%乙醇提取3次,再用乙醇与正己烷(1∶2,V/V)溶液清洗3次,沉淀干燥后即为细胞壁。干燥的细胞壁(20 mg)置于含有5 mL 25%(V/V)乙酰溴醋酸溶液的试管中,封口,在70℃水浴中放置 30 min。待冷却至室温后,试管中的物质转移到另一只含有0.9 mL 2 mol/L NaOH 和 0.1 mL 7.5 mol/L氯化羟胺中,用醋酸定容,上清液用于测定其在280 nm下的吸光度,不加样品的作为空白调零。木质素含量按照如下公式[15]:木质素(%)=吸光度×100 ÷吸光系数×样品浓度(g/L),其中特异性吸光系数为20 g-1 l cm-1[16]。
1.2.2.6 可溶性糖含量测定
植株可溶性糖含量采用蒽酮法进行测定[14]。取烘干植物组织0.05 g,加入5 mL蒸馏水后沸水浴30 min(提取2次),冷却后过滤并定容至25 mL。将上清液酌情稀释后,取2 mL稀释液,加入0.5 mL的蒽酮乙酸乙酯试剂和5 mL浓硫酸,充分混匀后立即沸水浴1 min,冷却至室温后于630 nm处比色,测定其吸光值。
1.2.2.7 氨基酸含量測定
植株氨基酸含量测定采用茚三酮法进行测定[14]。取新鲜植株组织0.5 g放入研钵中,加入5 mL pH 5.4,0.2 mol/L醋酸盐缓冲液充分磨碎,2 500 g下离心15 min,取0.2 mL上清液稀释至2 mL,在580 nm下测定吸光度。
1.2.3 数据分析与处理
试验数据用Microsoft Excel和SAS 9.0软件进行数据的处理、统计分析和显著性水平检验,数据均为5个重复,“平均数±标准差”格式。
2 结果与分析
2.1 病原菌侵染对植株叶绿素含量的影响
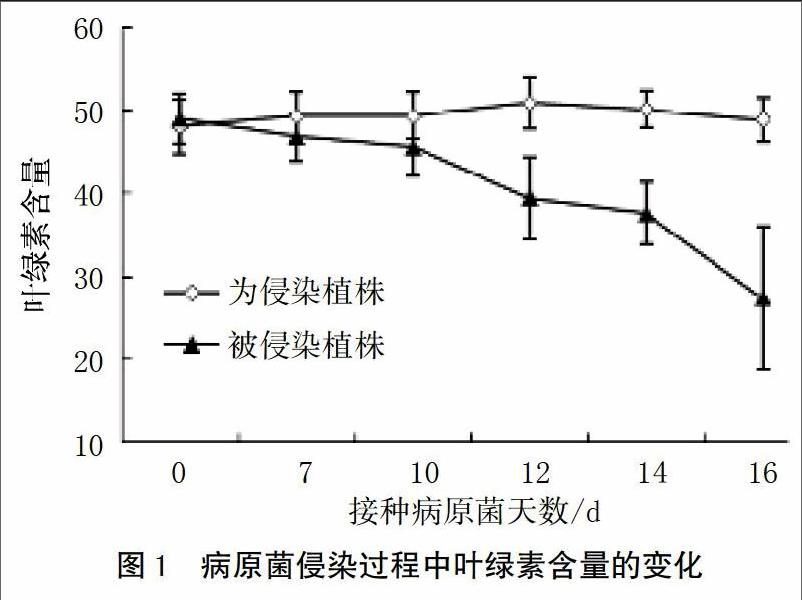
随着病原菌侵染植株的进行,植株叶绿素含量逐渐降低。在病原菌侵染10 d后,叶绿素含量相对于未侵染植株显著降低。在病原菌侵染植株第12天时,发病植株叶绿素含量降低了22%;第14天时,叶绿素含量降低了25%;第16天时,发病植株叶绿素含量相对于健康植株降低了44%(图1)。
2.2 病原菌侵染对植株抗病防御酶活性的影响
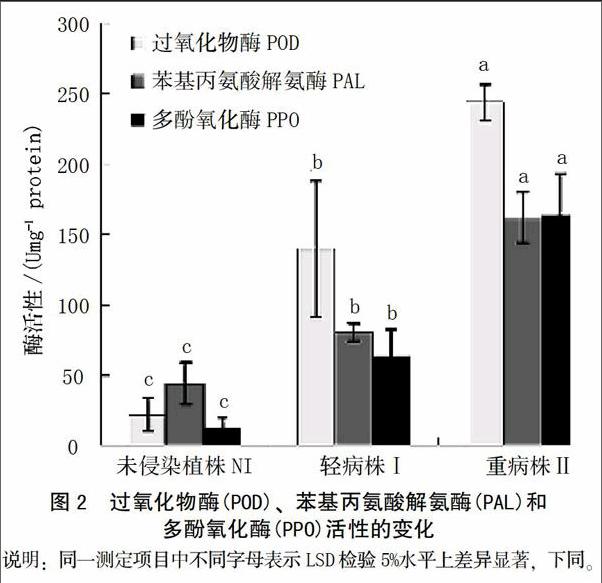
在本研究中,测定了3种抗病相关酶(PAL,POD,PPO)随病原菌侵染过程的活性变化。结果表明,3种酶的活性随着病情的加剧,活性逐渐升高。在发病等级为I级时,酶活性显著高于未侵染植株,相对于对照植株,PAL、POD和PPO的活性分别增加了6.47、1.82和5.31倍。当发病等级为II级时,PAL,POD和PPO的活性分别增加了11.29、3.67和13.77倍(图2)。
2.3 病原菌侵染对植株酚类含量的影响
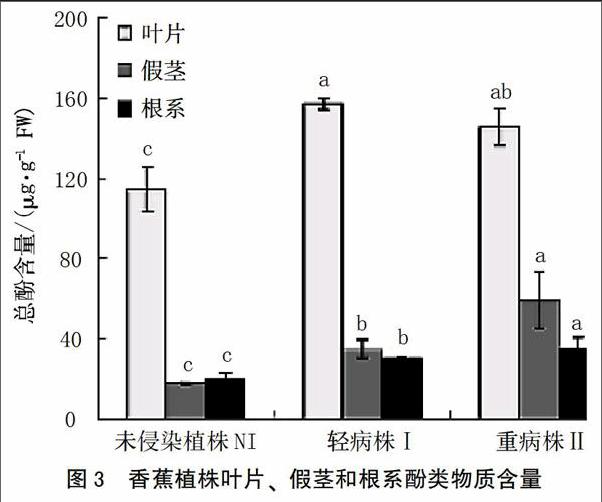
在本研究中,在发病等级为Ⅰ级时,即植株开始表现失绿症状时,酚类物质开始积累。叶片、假茎和根系的酚类物质含量分别增加至未侵染植株的1.37、1.96和1.52倍。随着病情的加剧,酚类物质继续在植株体内累积。当发病等级为Ⅱ级时,叶片、假茎和根系的酚类物质含量分别增加至未侵染植株的1.28、3.38和1.77倍(图3)。
2.4 病原菌侵染对植株木质素含量的影响
随着病原菌入侵植株,叶片、假茎和根系中木质素含量都显著增加。发病等级为I级植株,叶片,假茎和根系木质素含量分别增加至健康植株的1.17、1.64和1.23倍;当发病等级为II级时,叶片,假茎和根系木质素含量分别增加至健康植株的1.20、1.92和1.12倍(图4)。
2.5 病原菌侵染对植株可溶性糖含量的影响
病原菌侵染之后,香蕉植株叶片和假茎可溶性糖含量显著增加,但根系可溶性糖含量显著降低。当植株发病等级为I级时,叶片和假茎可溶性糖含量增加至未侵染植株的1.53和1.62倍,根系可溶性糖含量降低至未侵染植株的67%(图5)。
2.6 病原菌侵染对植株氨基酸含量的影响
病原菌侵染之后,香蕉植株各个部位氨基酸含量显著增加,当植株发病等级为I级时,叶片、假茎和根系氨基酸含量分别增加至未侵染植株的1.42、1.95和2.09倍。当植株发病等级为II级时,叶片和假茎氨基酸含量分别增加至未侵染植株的的3.01、5.38和1.99倍(图6)。
3 讨论与结论
尖孢镰刀菌(Fusarium oxysporum)是引起植物枯萎病的重要病原菌,为了定殖于寄主植物,病原真菌必须调节其形态、生理和代谢以适应寄主植物的各种不利于其生长繁殖的环境[17]。尖孢镰刀菌的侵染过程主要分为以下几个过程:侵染初期寄主与病原菌的信号识别、寄主根表面的定殖、对寄主植物物理和化学防御屏障的抵抗,直至成功进入寄主体内进行繁殖[18]。当尖孢镰刀菌到达木质部导管时,能够靠菌丝的繁殖进行大量扩增,并产生大量小型分生孢子,随着木质部蒸腾流迅速向植株地上部蔓延[19-20]。
植物发病是寄主植物与病原物相互识别、相互作用的结果。在植物与病原微生物的相互作用中,植物以多种抗病机制抵御病原的侵染。植物与病原相互识别,交换信息,同时植物体内也发生了一系列的信号传递,各信号转导途径之间相互交叉形成网络[5]。本研究结果表明,病原菌侵染植株使叶绿素含量显著降低,并且随着侵染时间的延长,叶绿素含量降低幅度越大(图1)。病原菌的侵染会导致叶绿素的降解及叶绿素含量的降低,使植株失绿发黄。曹学仁等[21]的研究表明,小麦感染白粉病后叶绿素含量显著降低。此外,Gamliel等[22]的研究也表明,马铃薯感染黄萎病后,叶绿素含量下降,叶绿素含量与病情指数存在显著负相关,发病程度越严重,叶绿素含量越低。
当植株被病原菌侵染之后,抗病或感病取决于植株是否能阻止病原菌的生长和繁殖。在此过程中,很多不同的反应例如通过细胞壁木质素的沉积和酚类物质的合成来增加细胞壁的强度、抗性相关酶例如苯基丙氨酸解氨酶(PAL)和多酚氧化酶(PPO)活性提高等[23]涉及到植株的抗性过程。在病原菌侵染过程中,酚类物质的沉积是重要的防御机制,因为其在超敏反应和细胞壁增强中起重要作用[24]。木质素是分布较为广泛的一种多聚体,能够增强抵抗病原菌酶降解的能力,在维管束植物防卫反应中有重要作用[25]。苯基丙氨酸解氨酶(PAL)、过氧化物酶(POD)和多酚氧化酶(PPO)在被侵染植株中显著增加。这3种酶的增加通常伴随着受伤害、伤口修复或者抗性反应等。同样,在本研究中,总酚类物质随着病原菌侵染有显著累积,这个结果与Kar和Mishra[26]研究结果一致。酚类是木质素和植保素合成的前体[27],通常,PAL活性的提高、酚类物质的积累以及酚类物质被PPO或者POD氧化导致褐变反应[12]。PPO以及酚类物质底物通常位于液泡中,因此当细胞受伤害这些物质会产生褐变。POD在过氧化氢存在时可以氧化酚类物质变成奎宁类物质[28]。 因此,这3种酶活性的提高与细胞受伤害、伤口修复和病害抗性显著相关[29]。
对于维管束枯萎病害的水分关系国外已有研究报道[30],其萎蔫症状被认为是由于水分胁迫或毒素引起的,尖孢镰刀菌的侵染会扰乱植株体内的水分平衡,最终导致植株的萎蔫[31]。在病原菌侵染过程中,碳水化合物可作为病原菌的养分来源。Vidhyasekara等[32]的研究指出,病原菌侵染后,寄主植物体内糖代谢会发生变化,导致体内大量积累糖类物质。在本研究中,病原菌侵染后铵态氮植株叶片可溶性糖含量显著升高,而根系可溶性糖含量显著降低。一方面,这可能是由于病原菌侵染后阻碍了叶片中糖向茎和根的运输;另一方面,也可能是由于病原菌侵染使得根系细胞膜系统受损,导致可溶性糖渗漏。
氨基酸是组成蛋白质的基本单位,也是蛋白质的分解产物,植物根系吸收、同化的氮素主要以氨基酸和酰胺的形式进行运输。大多数氨基酸在低浓度范围内可作为一种碳源,被微生物所吸收利用,因此对病原微生物的生长是有益的,但其被吸收利用的过程目前还不是十分清楚[33]。在本研究中,病原菌侵染后,植株各个部位氨基酸总量都显著提高。病原菌为了定殖于寄主植物,它需要适应寄主环境,并且调节自己的形态,生理代谢以及分泌的次生代謝产物和蛋白等。所以,病原菌为了侵染植株并在其体内生长,它会使得植株合成更多的有利于其定殖的氨基酸种类并运输到根系供其吸收利用。同时,可溶性糖和氨基酸又是植物在水分胁迫环境下的重要渗透调节物质,病原菌侵染之后,由于根系活力降低,维管束堵塞,细胞膜系统破坏等原因,会造成植株体内水分缺失,故植物合成大量的渗透调节物质以缓解体内水分胁迫环境。
综上所述,尖孢镰刀菌侵染植株,随着病情的加剧,会降低植株叶绿素含量,使得植株发黄萎蔫。植株通过抗病反应提高抗病防御酶(PAL,POD和PPO)的活性,合成酚类和木质素以抵御病原菌和次生代谢产物对植株的损害。病原菌的侵染使植株体内水分平衡被打破,植株通过在体内累积可溶性糖和氨基酸以缓解体内的水分胁迫环境。所以,植株会通过合成抗病物质和渗透调节物质以抵御病原菌入侵对植株造成的伤害,但其涉及的分子和生理机制有待进一步的分析研究。
参考文献
[1] 俞 鲁,凌 宁,张 楠,等. 香蕉枯萎病拮抗菌的筛选鉴定及其生防效果[J]. 南京农业大学学报,2012,35 (4):81-86.
[2] de Ascensao A R. Soluble and wall-bound phenolics and phenolic polymers in Musa acuminata roots exposed to elicitors from Fusarium oxysporum f. sp. cubense[J]. Phytochemistry, 2003, 63(6): 679-686.
[3] Baker R A. Soybean sudden death syndrome: isolation and identification of a new phytotoxin from cultures of the causal agent Fusarium solani[J].Phytopathology, 1994, 84: 1 144.
[4] 姬华伟,郑青松,董 鲜,等. 铜、锌元素对香蕉枯萎病的防治效果与机理[J]. 园艺学报,2012,39(6):1 064-1 072.
[5] Knogge W. Fungal infection of plants[J]. Plant Cell, 1996, 8 (10): 1 711.
[6] Buxton E. Root exudates from banana and their relationship to strains of the Fusarium causing Panama wilt[J]. Annals of Applied Biology, 1962, 50(2): 269-282.
[7] De Ascensao A R, Dubery I A. Panama disease: cell wall reinforcement in banana roots in response to elicitors from Fusarium oxysporum f. sp. cubense race four[J]. Phytopathology, 2000, 90(10): 1 173-1 180.
[8] Patel M, Kothari I, Mohan J. Plant defense induced in in vitro propagated banana (Musa paradisiaca) plantlets by Fusarium derived Elicitors[J]. Indian journal of experimental biology, 2004, 42 (7): 728-731.
[9] Thangavelu R, Palaniswami A, Doraiswamy S, et al. The effect of Pseudomonas fluorescens and Fusarium oxysporum f. sp. cubense on induction of defense enzymes and phenolics in banana[J]. Biologia Plantarum, 2003, 46 (1): 107-112.
[10] 毛达如. 近代植物营养科学的方法论[J]. 植物营养与肥料学报,1994,1(1):1-5.
[11] Else M A. Decreased root hydraulic conductivity reduces leaf water potential, initiates stomatal closure and slows leaf expansion in flooded plants of castor oil (Ricinus communis) despite diminished delivery of ABA from the roots to shoots in xylem sap[J]. Physiologia Plantarum, 2001, 111 (1): 46-54.
[12] Yingsanga P. Relationship between browning and related enzymes (PAL, PPO and POD) in rambutan fruit (Nephelium lappaceum Linn.) cvs. Rongrien and ee-Chompoo[J]. Postharvest Biology and Technology, 2008, 50 (2-3): 164-168.
[13] Luh B S. Characteristics of polyphenoloxidase related to browning in cling peaches[J]. Journal of Food Science, 1972, 37 (2): 264-268.
[14] 李合生. 植物生理生化實验原理和技术[M]. 北京:高等教育出版社, 2000:279.
[15] Sasaki M. Lignin deposition induced by aluminum in wheat (Triticum aestivum) roots[J]. Physiologia Plantarum, 1996, 96 (2): 193-198.
[16] Tyree M T, Nardini A, Salleo S, et al. The dependence of leaf hydraulic conductance on irradiance during HPFM measurements: any role for stomatal response[J]. Journal of Experimental Botany, 2005, 56 (412): 737-744.
[17] Michielse C B, Rep M. Pathogen profile update: Fusarium oxysporum[J]. Molecular Plant Pathology, 2009, 10 (3): 311-324.
[18] Lengeler K B, Davidson R C, D'souza C, et al. Signal transduction cascades regulating fungal development and virulence[J]. Microbiology and Molecular Biology Reviews, 2000, 64 (4): 746-785.
[19] Czymmek K J. In vivo time-lapse documentation using confocal and multi-photon microscopy reveals the mechanisms of invasion into the Arabidopsis root vascular system by Fusarium oxysporum[J]. Fungal Genetics and Biology, 2007, 44(10): 1 011-1 023.
[20] Di Pietro A. Fusarium oxysporum: exploring the molecular arsenal of a vascular wilt fungus[J]. Molecular Plant Pathology, 2003, 4 (5): 315-325.
[21] 曹学仁,周益林,段霞瑜,等. 白粉菌侵染后田间小麦叶绿素含量与冠层光谱反射率的关系[J]. 植物病理学报,2009,39(3):290-296.
[22] Gamliel A, Grinstein A, Peretz Y, et al. Reduced Dosage of Methyl Bromide for Controlling Verticillium Wilt of Potato in Experimental and Commercial Plots[J]. Plant Disease, 1997, 81(5): 469-474.
[23] Dempsey D, Klessig D. Signals in plant disease resistance[J]. Bulletin de l'Institut Pasteur, 1995, 93(3): 167-186.
[24] Franke R. Low-molecular-weight precursors for defense-related cell wall hydroxycinnamoyl esters in elicited parsley suspension cultures[J]. Plant Cell Reports, 1998, 17(5): 379-383.
[25] Huang Y H. Reaction of selected soybean genotypes to isolates of Fusarium solani f. sp. glycines and their culture filtrates[J]. Plant Disease, 1998, 82(9): 999-1 002.
[26] Kar M, Mishra D. Catalase, Peroxidase, and Polyphenoloxidase Activities during Rice Leaf Senescence[J]. Plant Physiology, 1976, 57(2): 315-319.
[27] Kessmann H. Stress responses in alfalfa (Medicago sativa L.): V. Constitutive and elicitor-induced accumulation of isoflavonoid conjugates in cell suspension cultures[J]. Plant Physiology, 1990, 94(1): 227-232.
[28] Bucheli C S. Contribution of enzymic browning to color in sugarcane juice[J]. Journal of Agricultural and Food Chemistry, 1994, 42(2): 257-261.
[29] Préstamo G. Peroxidases of selected fruits and vegetables and the possible use of ascorbic acid as an antioxidant[J]. HortScience, 1993, 28 (1): 48-50.
[30] Nemec S, Syversten J, Levy Y. Water relations of rough lemon citrus seedlings infected with Fusarium solani. Plant and Soil, 1986, 93(2): 231-239.
[31] Dong X, Ling N, Wang M, et al. Fusaric acid is a crucial factor in the disturbance of leaf water imbalance in Fusarium-infected banana plants.[J]. Plant Physiology & Biochemistry, 2012, 60(3): 171-179.
[32] Vidhyasekaran P. Carbohydrate Metabolism of Ragi Plants infected by Helminthosporium nodulosum[J]. Journal of Phytopathology, 1974, 79 (2): 130-141.
[33] 董 鮮,郑青松,王 敏,等. 香蕉幼苗三类有机小分子溶质对尖孢镰刀菌侵染的生理响应[J]. 生态学报,2015,35(10):3 309-3 319.

