不同浓度汞对3种水生植物光合特性的影响
王赛+王瑞莹+周童+王从梅+万可+王波


摘 要:采用液培法研究不同浓度的HgCl2(0,1.0,2.5,5.0,10.0,20.0,40.0,80.0 mg·L-1)对水慈姑等3种水生植物幼苗光合特性的影响。结果显示:随着营养液中HgCl2浓度的升高,水慈姑Chl、Pn、Gs、Ci和Tr也随着增加。Chl和Pn在1.0 mg·L-1(HgCl2)时达最大值,Gs、Ci和Tr在2.5 mg·L-1时达最大值,但随着HgCl2浓度进一步增大,上述指标均持续下降。随着营养液中HgCl2浓度的增加,大花美人蕉和水生鸢尾的Chl、Pn、Gs、Ci和Tr持续下降。结果表明,大花美人蕉、水生鸢尾对溶液中HgCl2胁迫敏感,水慈姑在低浓度的HgCl2胁迫下钝感,较高浓度的HgCl2胁迫下敏感。该研究结果可以为探究3种水生植物适应HgCl2胁迫的机制提供一定的理论依据。
关键词:水慈姑;大花美人蕉;水生鸢尾;汞胁迫;叶绿素含量;光合特性
中图分类号:Q945 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2017.06.004
Abstract: The paper investigated effects of HgCl2 on photosynthetic characteristics of three types hydrophyte under various concentrations(0,1.0,2.5,5.0,10.0,20.0,40.0,80.0 mg·L-1) . With the increasing of HgCl2 concentrations in nutrient solutions, Chl,Pn,Gs,Ci and Tr of sagittaria sagittifolia L.increased. The highest values of Chl and Pn were observed at 1.0 mg·L-1 HgCl2 in nutrient solutions, whlie the highest values of Gs,Ci and Tr were observed at 2.5 mg·L-1 HgCl2 concentrations in nutrient solutions. However, with the further increasing of HgCl2 concentrationsin nutrient solutions, these characters continued to decrease. With the increasing of HgCl2 concentrations in nutrient solutions, Chl, Pn, Gs, Ci and Tr of Canna generalis L. and Iris pseudacorus L. continued to decrease. The conclusion was that Canna generalis L. and Iris pseudacorus L. were sensitive to HgCl2 stress. Sagittaria sagittifolia L. was insensitive to low concentrations of stress, but sensitive to relatively high levels of stress conversely. The results of this research could provide a theoretical basis for exploring the adaptation of hydrophyte under HgCl2 stress.
Key words: Sagittaria sagittifolia L.; Canna generalis L.; Iris pseudacorus L.; mercury stresses; chlorophyll content; photosynthetic characteristics
汞污染由于其致毒性強、易迁移和易转化等的特点,已成为全球关心的重要问题[1]。大量数据表明,我国水体汞污染比较严重:如1970年代松花江流域就开始发生汞污染,江水平均汞含量为5 600 ng·L-1,虽然经过20多年的治理,仍高于背景含量[2];黄浦江中汞的平均含量则超过了400 ng·L-1[3];葫芦岛市五里河水中汞污染也非常严重,含量为84~10 446 ng·L-1,平均值为1 395 ng·L-1,远高于国家III类水标准[4]。许多植物对水体汞污染具有摄取并在体内富集的能力。已有研究表明:眼子菜、金鱼藻[5]、水芹和羽毛草等[6]水生植物对水体重金属污染都具有耐受性和富集能力。本研究以水慈姑(Sagittaria sagittifolia L.)、大花美人蕉(Canna generalis L.)、水生鸢尾(Iris pseudacorus L.)为试验材料,测定不同浓度HgCl2胁迫下对这3种水生植物部分光合特性的影响,以期进一步发掘其对汞污染的修复能力。
1 材料和方法
1.1 试验材料
将打捞上来的水慈姑、大花美人蕉、水生鸢尾幼苗于1/2霍格兰氏培养液中驯化1周测量其鲜质量,挑选出个体、长势以及鲜质量接近的幼苗作为研究材料。
1.2 试验设计
设定0,1.0,2.5,5.0,10.0,20.0,40.0,80.0 mg·L-1梯度HgCl2浓度处理,每个处理3次重复,每个重复3株幼苗,并尽量避免3株幼苗叶片不重叠。每天加2~5 滴双氧水以增加培养液中溶氧量。连续培养1个月后测定并计算其叶绿素含量和部分光合参数。
1.3 测定项目与方法
(1)叶绿素含量。叶绿素含量的测定采用丙酮乙烯混合液法——丙酮与乙醇的比例为1∶1,全程在暗光的条件下操作并在663,645 nm波长下比色并通过计算求得叶绿素a、叶绿素b、叶绿素总含量[7]。
(2)部分光合指标。Chl、Pn、Gs、Ci和Tr的测定采用LI-6400便携式光合测定仪(LI-COR, USA)测定,测定采用自然光源,设定样品室流速为500 μmol·s-1。测定选择时间在上午8:30—11:30,选择天气温度在25~27 ℃。
(3)以3个重复数据的平均值为试验结果,数据库的建立和绘图采用Excel软件;显著性差异分析和方差分析采用SPSS 17.0统计软件。
2 结果与分析
2.1 不同浓度HgCl2对3种水生植物叶绿素含量的影响
表1显示,处理30 d时水慈姑Chla、Chlb和Chl 含量随着浓度的升高呈上升趋势,均在1.0 mg·L-1(HgCl2)浓度下达到最大值,但随着营养液中HgCl2浓度的进一步上升,Chl a、Chl b含量反而逐渐下降。处理A、B、C、D、E、F、G叶绿素含量分别是CK的107.89%,91.98%,88.49%,83.18%,83.57%,81.63%和71.54%,且各组间较CK差异均达显著水平。除了处理D、E、F之间的差异不显著外,其他处理间的差异均达显著水平。这说明HgCl2浓度的变化对Chl含量有显著影响。
表2显示,处理30 d时大花美人蕉Chla、Chlb含量随着浓度的升高呈下降趋势,均在CK处为最大值。处理A、B、C、D、E、F、G叶绿素含量分别是CK的95.20%,80.09%,73.40%,65.99%,63.32%,50.63%和35.03%,且各组间较CK为达到显著水平。除了处理E、F之间的差异不显著外,其他处理间的差异均达显著水平。这说明HgCl2浓度的变化对Chla、Chlb含量有显著影响。
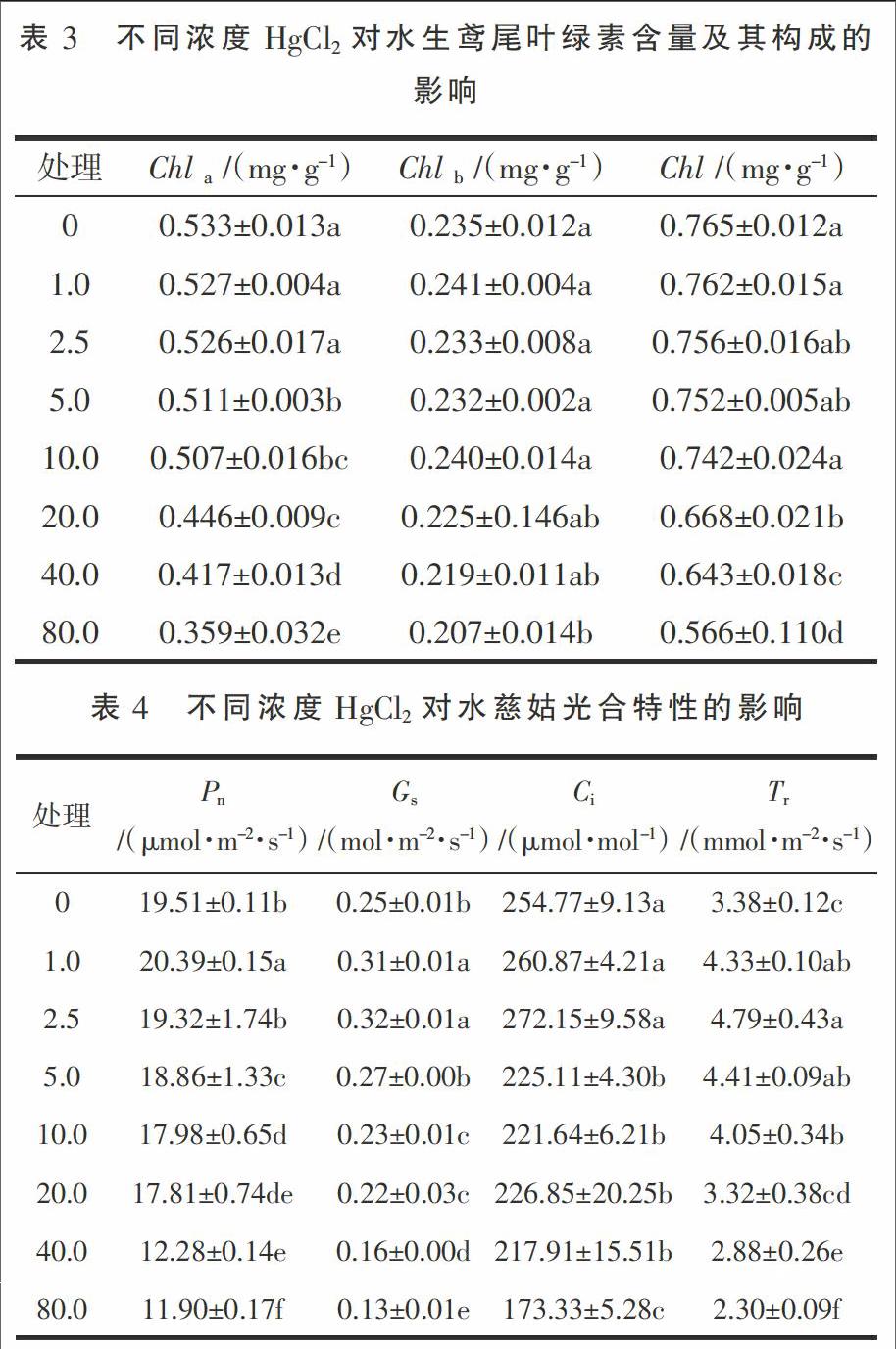
表3显示,处理30 d时水生鸢尾Chla、Chlb含量随着HgCl2浓度的升高总体呈下降趋势。处理A、B、C、D、E、F、G叶绿素含量分别是CK的99.61%,98.82%,98.30%,96.99%,87.32%,84.05%和73.99%,且处理A、B、C、D较CK差异均未达显著水平。这说明低浓度的HgCl2浓度的变化对Chl含量无显著影响,但高浓度HgCl2显著影响其Chl含量。
2.2 不同浓度汞对光合特性的影响
表4显示,不同浓度汞处理下的水慈姑Pn值随着营养液中汞浓度的升高呈现出先升高后下降的趋势,除了处理A大于CK外,其他组间处理均小于CK。其中B处理与CK、E处理与F处理间差异不显著,其他各处理间的差异均达显著水平。A、B、C、D、E、F、G处理的Pn值分别是CK的104.51%,99.03%,96.68%,92.16%,91.29%,62.94%和60.99%。研究表明:低浓度的HgCl2对水慈姑的Pn的提高起促进作用,高浓度的HgCl2对Pn起抑制作用,且浓度越高抑制的作用越明显。不同浓度汞处理下的水慈姑Gs值隨着营养液中汞浓度的升高呈现出先升高后下降的趋势,且在2.5 mg·L-1 HgCl2浓度下达到最大值,除了处理A、B、C大于CK外,其他组间处理均小于CK。其中C处理与CK、A处理与B处理、D处理与E处理间差异不显著,其他各处理间的差异均达显著水平。A、B、C、D、E、F、G处理的Gs值分别是CK的122.53%,126.48%,106.72%,90.91%,86.96%,63.24%和51.38%。研究表明:低浓度的HgCl2对水慈姑的Gs的提高起促进作用,高浓度的HgCl2对Gs起抑制作用,且浓度越高抑制的作用越明显。不同浓度汞处理下的水慈姑Ci值随着营养液中汞浓度的升高呈现出先升高后下降的趋势,除了处理A、B大于CK外,其他组间处理均小于CK。其中CK、A、B处理与CK,C、D、E、处理与F处理间差异不显著,其他各处理间的差异均达显著水平。A、B、C、D、E、F、G处理的Ci值分别是CK的102.39%,106.82%,88.36%,87.00%,89.04%,85.53%和68.03%。研究表明:低浓度的HgCl2对水慈姑的Ci的提高起促进作用,高浓度的HgCl2对Ci起抑制作用,且浓度越高抑制的作用越明显。不同浓度汞处理下的水慈姑Tr值随着营养液中汞浓度的升高呈现出先升高后下降的趋势,且在2.5 mg·L-1 HgCl2浓度下达到最大值,处理A、B、C、D大于CK外,其他组间处理均小于CK。其中E处理与CK,A、B处理与C处理间差异不显著,其他各处理间的差异均达显著水平。A、B、C、D、E、F、G处理的Tr值分别是CK的128.11%,141.72%,130.47%,119.82%,98.22%,85.21%和68.05%。研究表明:低浓度的HgCl2对水慈姑的Tr的提高起促进作用,高浓度的HgCl2对Tr起抑制作用,且浓度越高抑制的作用越明显。
表5显示,不同浓度汞处理下的大花美人蕉Pn值随着营养液中汞浓度的升高呈现出先升高后下降的趋势,且在2.5 mg·L-1(HgCl2)浓度下达到最大值,且除了处理A大于CK外,其他组间处理均小于CK。A、B、C、D、E、F、G处理的Pn值分别是CK的100.56%,89.52%,88.64%,87.76%,85.32%,81.12%和81.28%。除了处理A外,其他各组间处理较处理CK差异均显著。研究表明,低浓度的HgCl2对大花美人蕉的Pn的提高起促进作用,高浓度的HgCl2对Pn起抑制作用,且浓度越高抑制的作用越明显。不同浓度汞处理下的大花美人蕉Gs值随着营养液中汞浓度的升高呈现出下降的趋势。A、B、C、D、E、F、G处理的Gs值分别是CK的93.65%,92.06%,82.54%,84.13%,87.30%和76.29%。且各组间处理较CK差异均显著。研究表明,HgCl2对Gs起抑制作用,且浓度越高抑制的作用越明显。不同浓度汞处理下的大花美人蕉Ci值随着营养液中汞浓度的升高呈现出逐渐下降的趋势,且各组间处理均小于CK。A、B、C、D、E、F、G处理的Ci值分别是CK的98.82%,91.71%,97.06%,94.51%,91.99%,92.22%和76.36%。除了处理A外,其他各组间处理较处理CK差异均显著。研究表明,HgCl2对大花美人蕉的Ci起抑制作用,且浓度越高抑制的作用越明显。不同浓度汞处理下的大花美人蕉Tr值随着营养液中汞浓度的升高呈现出逐渐下降的趋势。A、B、C、D、E、F、G处理的Tr值分别是CK的87.58%,83.23%,86.81%,79.39%,82.71%,82.71%和54.42%。且各组间处理较CK差异均显著。研究表明,HgCl2对大花美人蕉的Tr起抑制作用,且浓度越高抑制的作用越明显。
表6显示,不同浓度汞处理下的水生鸢尾Pn值随着营养液中汞浓度的升高呈下降的趋势。A、B、C、D、E、F、G处理的Pn值分别是CK的99.39%,98.97%,93.91%,90.93%,90.26%,84.48%和79.37%。除了处理A、B外,其他各组间处理较CK差异均显著。研究表明,HgCl2对水生鸢尾的Pn的提高起抑制作用,且浓度越高抑制的作用越明显。而随着营养液中汞浓度的升高,A、B、C、D、E、F、G处理的Gs值分别是CK的92.16%,92.16%,96.08%,94.12%,96.08%,101.96%和92.16%,且各组间差异均不显著。研究表明,HgCl2浓度的升高对水生鸢尾的Gs无显著影响。不同浓度汞处理下的水生鸢尾Ci值随着营养液中汞浓度的升高呈现出下降的趋势,且各组间处理均小于CK。A、B、C、D、E、F、G处理的Ci值分别是CK的97.33%,96.35%,96.29%,92.36%,91.80%,92.11%和89.95%,除处理G较CK差异显著外,其他各组间处理较CK差异均显著。研究表明,低浓度的HgCl2对水慈姑的Ci的影响不显著,但随着其浓度的进一步升高则显著降低水生鸢尾Ci。随着HgCl2浓度的升高,水生鸢尾A、B、C、D、E、F、G处理的Tr值分别是CK的92.57%,93.12%,92.43%,93.95%,86.52%,90.51%的96.70%,各组间处理差异均不显著。这表明HgCl2浓度的升高对水生鸢尾Tr的影响不显著。
3 讨 论
绿色植物通过光合作用吸收太阳能、同化水和二氧化碳制造自身的有机物并释放氧气。Pn是指总光合作用产生的糖类减去呼吸作用消耗的糖类的速率,以每秒每平方米叶面积吸收的二氧化碳微摩尔数来表示。因此,Pn值真正体现了植物有机物的积累能力。本研究结果表明,低浓度的汞处理可以促进大花美人蕉和水慈姑Pn的积累,但随着浓度的升高,其Pn值反而下降。这可能是由于低浓度的HgCl2促进了叶绿素的生成或使少数的叶绿素a处于激发状态,增强了其对光能的利用率。但当HgCl2浓度过高时,则可能破坏植物的细胞膜或叶绿体,从而对植物造成了损伤。这与过昱辰[8]、顾艾博等[9]关于单一汞胁迫对单子叶植物光合特性的影响结果相类似。水生鸢尾的Pn值则随着HgCl2浓度的升高而持续下降,则可能是由于水生鸢尾较其他两种植物对汞胁迫更加敏感,因而即便是在HgCl2浓度比较低的情况下也会表现出差异。叶绿体是植物进行光合作用的最基本单位,植物叶片单位面积叶绿素含量的多少直接能反映出植物光合作用的效率。本研究表明,3种水生植物叶绿素含量都与各种的Pn的变化趋势保持一致,且各组间的显著差异性也总体相一致。
Tr是指单位时间内单位叶片面积蒸腾水的量,它不仅对于植物根系对水分、养分的吸收和降低叶片温度有重要的作用,同时对于Gs也有重要的影响。本研究表明,水慈姑和大花美人蕉Tr和Ci均随着汞浓度的升高,表现出相一致的变化规律,而水生鸢尾Tr和Ci几乎为恒定值。原因可能是Tr通过影响Ci的变化来适应对汞胁迫对植物造成的损伤。Gs是指植物气孔对水蒸气、二氧化碳等气体的传导度,因此其值的大小直接影响光合作用、呼吸作用及蒸腾作用。Ci代表植物叶肉细胞中CO2的浓度。Pn的影响可以分为气孔限制因素和非氣孔限制因素[10]。Farquhar等[11]认为,Ci和Gs的变化规律可以作为判断植物净光合速率的下降是属于受气孔限制因素还是非气孔限制因素的依据:如果Ci和Gs随着Pn同时下降,说明光合作用能力下降的限制因子是气孔限制;相反,如果当Pn下降的同时Ci反而上升,则说明光合作用能力下降的限制因子是非气孔所致。研究结果表明,水慈姑、大花美人蕉的Gs和Ci随着Pn的升高而升高,表明汞胁迫对这两种植物光合作用的影响是气孔的限制。而当水生鸢尾由于受到汞胁迫导致Pn显著下降时水生鸢尾的Ci未发生变化且Gs的变化也不显著,可以推测为非气孔限制因素,这与过昱辰[8]研究的汞胁迫对假俭草Gs和Ci影响的结果相似。
4 结 论
随着汞浓度的增加,水慈姑的Pn、Gs、Ci、Tr及叶绿素含量先上升后下降。这表明,低浓度的HgCl2对水慈姑的光合作用具有促进作用,而高浓度的HgCl2则对大水慈姑的光合具有抑制作用。而对于水慈姑的影响则表现为Pn、Gs、Ci、Tr及叶绿素含量持续下降,导致这两种光合能力下降的因素是叶绿素的破坏和气孔限制因素。而水生鸢尾对汞胁迫做出的反映是Pn、Gs、叶绿素含量随着HgCl2浓度升高的持续下降,但Ci、Tr变化不显著,导致其光合能力下降的因素是叶绿素的破坏和非气孔限制因素。
参考文献:
[1] FENG H, JIE G, ERIC P, et al. In situ remediation technologies for mercury-contaminated soil[J]. Environ sci pollut res,2015(22):8124-8147.
[2] 张磊,王起超,邵志国.第二松花江鱼及蚌汞含量现状及演变规律[J].生态环境,2015,14(2): 190-194.
[3] 丁振华.几个典型环境中汞的分布特征及生态影响[D].上海:上海交通大学,2003.
[4] 郑冬梅,王起超,志博.中国北方燃煤型和工业复合型城市汞污染对比研究[J].地球与环境,2007,35(3):273-278.
[5] SYED S A, ZAFAR A R, MANZOOR A S, et al. Heavy metal accumulation in the leaves of Potamogetonnatans and Ceratophyllum demersum in a Himalayan RAMSAR site: management implications[J]. Wetlands ecol manage,2016(24):469-475.
[6] 申华,黄鹤忠,张皓,等.3种观赏水草对水体镉污染修复效果的比较研究[J].水生态学杂志,2008,1(1):52-55.
[7] 张宪政.植物叶绿素含量测定—丙酮乙醇混合液法[J].辽宁农业科学,1986(3):26.
[8] 过昱辰.三种草坪草对土壤汞污染耐受性及富集效果的研究[D].苏州:苏州大学,2015.
[9] 顾艾博,董然,马家艳,等.重金属Cr胁迫下两种玉簪光合特性研究[J].北方园艺,2014(13):60-65.
[10] 孙光闻,陈日远,刘厚诚,等.镉对植物光合作用及氮代谢影响研究进展[J].中国农学通报,2005,21(9):234-236.
[11] FARQUHAR G D, SHARKEY T D. Stomatal conductance and photosynthesis[J].Annual review of plant molecular biology, 1982(33):317-345.

