有机化合物旋光异构体的判断及R/S构型简易标记
薛华丽
(甘肃农业大学理学院,甘肃兰州730070)
有机化合物旋光异构体的判断及R/S构型简易标记
薛华丽
(甘肃农业大学理学院,甘肃兰州730070)
通过介绍有机化学中旋光异构体的判断方法,给出了不同旋光异构体R/S构型的标记方法,该方法是一种简易、快速、准确的判断和标记命名方法,不仅适合于简单开链状旋光化合物,而且也适合于具有复杂结构的旋光化合物,经过多年的教学实践,已取得了良好效果。
旋光异构体;构型标记;R/S异构体;手性碳原子
有机化学中的异构包括构造异构、构型异构和构象异构。构造异构是分子中原子或原子团之间连接方式和连接顺序不同引起的异构;构型异构是分子中原子或原子团在空间排列形式不同引起的异构;构象异构是由于δ键的旋转使分子中原子或原子团在空间存在形式不同引起的异构[1]。其中,构型异构包括顺反异构和旋光异构,它们均属于立体异构。顺反异构与旋光异构不仅是判断许多有机化学反应历程的重要依据,而且也是生物体内许多物质具有不同生理活性的原因所在[2]。
旋光异构是有机化学中一个非常重要的教学内容[3]。目前国内外已出版的有机化学教材中对R/S构型标记和命名方法的教学,要求学生必须具备丰富的空间想象力,大脑中建立“汽车方向盘式或钟表式”的空间立体结构,再按照次序规则判断其旋转方向,最后确定其R/S构型。该方法对结构简单的开链状旋光化合物已具有一定难度,对结构复杂的旋光异构体就显得无能为力。为此,本文介绍一种简易、准确的旋光异构体的判断方法,并给出不同旋光异构体R/S构型的简便标记方法。该方法不仅有助于理解生物体内普遍存在的氨基酸、蛋白质和生物碱以及与生物农药结构与活性的关系[4],而且有利于激发学生学习的兴趣,提高学习的自觉性和解决实际问题的能力[5]。
1 旋光异构体的判断
有机化合物分子中手性碳原子的存在与否是判断该化合物具有旋光性的一个重要依据。其中“旋光性物质都具有手性,其结构中存在不对称因素”[6],这句话精辟地总结了手性碳原子与旋光性的关系。“手性”是具有实物和镜像关系,但不能完全重合的性质[6]。对有机化学中的异构体而言,其中的对称因素只包括对称面和对称中心,不包括对称轴。对称面是指能将有机化合物分子结构分为实物和镜像两部分的一个平面;对称中心是指通过其中一个点,任做一条直线,在该点等距离两端可以找出任意两个相同的原子或原子团。若有机分子结构中既不存在对称面,也不存在对称中心,则该化合物具有手性,具有旋光性,为旋光异构体[6]。
1.1 含一个手性碳原子的异构
以CH4为例,为正四面体结构,以H-C-H为对称面,类似的对称面有6个,无对称中心。因此甲烷分子不具有手性,没有旋光性;当甲烷分子中的一个氢原子H被氯原子Cl取代后生成CH3Cl,以H-C-Cl为对称面,类似的对称面有3个,无对称中心。因此CH3Cl也不具有手性,没有旋光性;当甲烷分子中的两个H被Cl取代后,生成CH2Cl2,以H-C-H或Cl-C-Cl为对称面,类似的对称面各有2个,无对称中心。因此CH2Cl2仍不具有手性,没有旋光性;当甲烷分子中的两个H被一个Cl和一个溴原子Br取代后生成CH2ClBr,以Cl-C-Br为对称面,类似的对称面有1个,无对称中心。因此CH2ClBr仍不具有手性,没有旋光性;但是,当甲烷分子中的三个H被一个氟原子F,一个Cl和一个Br取代后生成CHFClBr,该结构既无对称面,又无对称中心。故CHFClBr具有手性,具有旋光性(图1)[7]。由此表明:当一个碳原子周围连有4个不相同的原子或原子团时,该化合物具有手性,具有旋光性。其中的碳原子称为手性碳原子,用C﹡表示。
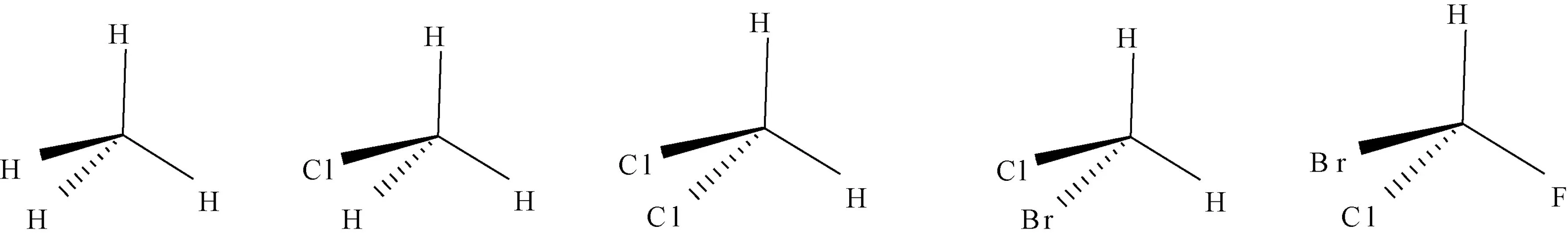
图1 CH4,CH3Cl,CH2Cl2,CH2ClBr和CHFClBr结构式
对于含有2个或多个手性碳原子的烷烃类化合物,若要判断其是否具有手性,与甲烷分子类似,只要观察每个手性碳原子周围所连接的4个基团,若不相同,则具有手性,具有旋光性;反之,则不具有手性,不具有旋光性。
1.2 环状化合物的异构
环状化合物的立体异构现象比链状化合物更复杂,往往顺反异构和旋光异构同时存在。在环烷烃结构中,当环上2个碳原子分别连有不相同的原子或原子团时,则该环烷烃存在顺反异构;同时,若环上还存在手性碳原子,则该环烷烃还具有旋光异构。通常,在判断环状化合物异构时,先确定其是否存在顺反异构,再判断其是否具有手性,最后写出该化合物的名称。如1,2-二甲基环丙烷可写出其顺反异构体(如图2),其中,顺-1,2-二甲基环丙烷,分子结构中具有1个对称面,无对称中心,不具有手性,不具有旋光性;而反-1,2-二甲基环丙烷,由于分子结构中既无对称面,又无对称中心,具有手性,具有旋光性。

图2 顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷结构式
1.3 丙二烯型化合物的异构
在丙二烯型分子结构中存在累积型双键,中间碳原子采取sp杂化,两端两个碳原子均采取sp2杂化。由于空间位阻的原因,分子中两个双键所在平面相互垂直。当两端两个碳原子分别连有不相同的基团时(如图3),例如:在3-甲基-1,2-丁二烯分子结构中,两个分子平面相互垂直,且一个分子平面是另一个分子平面的对称面,即3-甲基-1,2-丁二烯分子结构含有2个对称面,无对称中心,因此不具有手性,不具有旋光性。但是,在2,3-戊二烯分子结构中,两个分子平面相互垂直,既无对称面,又无对称中心,因此具有手性,具有旋光性。
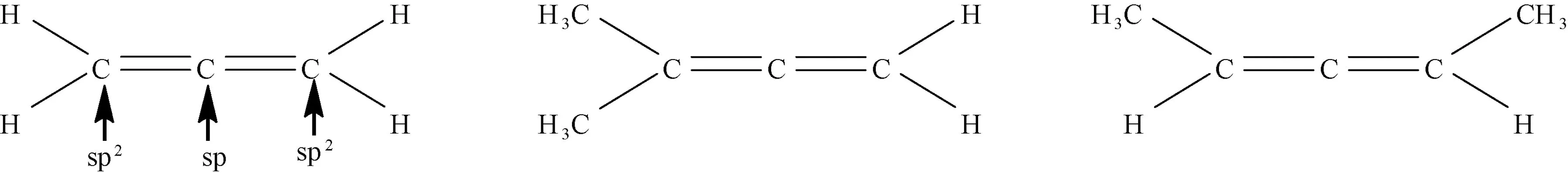
图3 1,2-丙二烯,3-甲基-1,2-丁二烯和2,3-戊二烯结构式
1.4 联苯型化合物的异构
在联苯型化合物分子中,当环上没有取代基时,两个苯环可以围绕中间的C-C单键自由旋转。若苯环上连有体积较大的原子或原子团,由于空间位阻的原因,两个苯环不再处在同一个平面上,而是相互垂直。若两个苯环的邻位分别连有不相同的基团,例如:6,6’-二硝基联苯-2,2’-二甲酸(如图4),虽然分子中不存在手性碳原子,但由于分子中既无对称面,又无对称中心,因此具有手性,具有旋光性。当两个苯环的邻位分别连接相同的基团,例如:2’,6’-二硝基联苯-2,6-二甲酸(图4),分子中存在对称面,无对称中心,因此不具有手性,不具有旋光性。

图4 6,6’-二硝基联苯-2,2’-二甲酸和2’,6’-二硝基联苯-2,6-二甲酸结构式
1.5 含氮或含磷化合物的异构
除含碳原子化合物具有旋光异构外,含氮或磷原子化合物,如季铵盐和季磷盐四价化合物也具有旋光异构(如图5)。由于氮原子或磷原子周围所连接的四个基团均不相同,因此此类化合物也具有旋光性,为旋光异构体。
由此表明:不一定具有手性碳原子的化合物才具有旋光性,具有旋光性的化合物也不一定都具有手性碳原子。判断化合物具有手性,具有旋光性的标准是化合物分子结构中是否存在对称因素,即若存在对称因素,则不具有手性,不具有旋光性;反之,则具有手性,具有旋光性。

图5 含氮和含磷化合物结构式
2 旋光异构体的标记
常见的旋光异构体构型有两种标记方法:D/L构型相对标记法和R/S构型绝对标记法。其中,D/L构型相对标记法是以甘油醛作为标准,在费歇尔投影式中,-OH处于右侧的为D-甘油醛,处于左侧的为L-甘油醛。规定了甘油醛的构型之后,其它旋光异构体的构型与甘油醛联系起来,凡由L-甘油醛转变而来的化合物,其构型均为L-型;凡由D-甘油醛转变而来的化合物,其构型均为D-型。然而,该方法在使用过程中不能涉及到手性碳原子上化学键的断裂,否则其构型会发生改变;同时,当结构式中含有多个手性碳原子时,采用此法很不方便。由此,旋光异构体的R/S构型绝对标记法应运而生。
R/S构型绝对标记法是根据手性碳原子上连接的4个不相同的原子或原子团在空间不同取向为特征的标记方法[8-9],无论该化合物为透视式还是费歇尔投影式,均可进行直接标记,不需要与其他化合物联系比较[10-11]。本文采用笔者多年来在教学过程中所建立的“手臂手指模型法”来确定手性碳原子的R/S构型。其主要步骤:(1)将手性碳原子上连接的4个基团按照次序规则排列先后顺序;(2)将最小基团用手臂代替,大拇指、食指和中指自然伸直,无名指和小指自然弯曲(如图6);(3)将其它3个基团分别用大拇指、食指和中指代替,(注意:此处并不代表大拇指、食指、中指所表示的基团有这样的优先顺序:大拇指>食指>中指),而是根据基团相对位置来放置3个手指,即当最小基团处于左侧时,用左手臂;当最小基团处于右侧时,用右手臂;(4)根据大拇指、食指、中指所表示基团的优先顺序确定其为顺时针或逆时针旋转方向,从而得出R或S构型。该方法对透视式和纽曼投影式的判断效果最佳。具体示例如下:
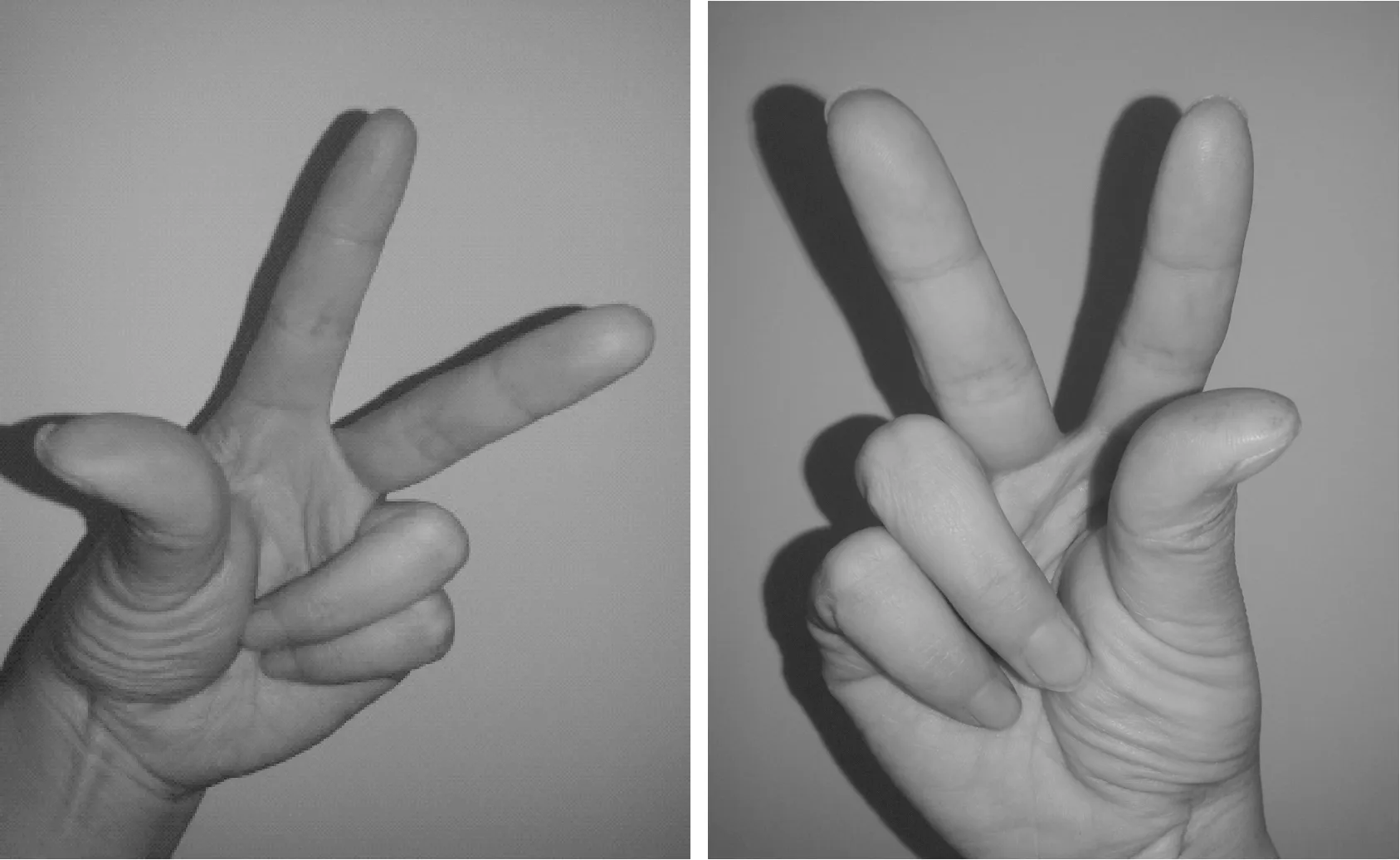
图6 手臂手指法模型示意图
例1:判断透视式3-氯-2-丁醇的构型并命名(如图7A)。
步骤:



(5)旋光异构体名称:(2S,3S)-3-氯-2-丁醇。

图7 透视式和纽曼投影式
例2:判断纽曼投影式2-甲基-3-溴-1-丁酸的构型并命名(如图7B)
步骤:




(5)旋光异构体名称:(2R,3S)-2-甲基-3-溴1-丁酸。
从以上2个例子可以看出:采用“手臂手指模型法”来标记费歇尔投影式和纽曼投影式时,如果最小基团在左侧,用左手臂代替,最小基团在右侧,用右手臂代替,手心根据基团的位置,可向着观测者,也可背着观测者。另外,需要注意3点:(1)以上的手势可能会因个人习惯的不同,稍做一些调整;(2)上述的“手臂手指模型法”不必要死记硬背,碰到不同的透视式或纽曼投影式时,摆出正确的手势即可;(3)对于含手性碳原子的环状化合物也可用“手臂手指模型法”来完成。
3 结论
多年的教学实践表明,旋光异构体的判断方法和“手臂手指模型法”是判断和标记旋光异构体的一种简易、快速、准确的方法,在学生手头没有模型的情况下可以快速准确完成旋光异构体的标记。在有机化学的教学中,学生灵活掌握了旋光异构体的判断方法和不同旋光异构体R/S构型的标记方法,有利于农科类各专业学生深入理解生物体中普遍存在的氨基酸、蛋白质和生物碱以及与生物农药之间的关系;领会不同旋光异构体在生物体内的生理、药理作用,了解旋光异构现象在动物、植物以及微生物研究和医药中的重要意义,更有利于提高学生学习的自觉性和解决实际问题的能力。
[1]夏百根,黄乾明.有机化学[M].北京:中国农业出版社,2008:97-116.
[2]Li Meng,Yang Jin,Liu Ying-Ying,Ma Jian-Fang. A series of chiral coordination polymers constructed by (S)-(-)-1,1′-binaphtho-2,2′-diacetic acid: Syntheses,structures and optical properties[J].Dyes and Pigments,2015,120:136-146.
[3]罗均,尚先梅,项光亚.大学有机化学中若干立体化学问题的解释[J].化学教育,2012(5):71-72.
[4]赖寒.高职化学制药中有机化学旋光异构说课设计[J].职业教育,2011(10):114-115.
[5]施丽娜.在有机化学旋光异构教学中培养学生的智力[J].昆明医学院学报,1986(4):71-74.
[6]向小莉,袁黎明.手性化合物[J].化学教育,2003(24):39-40.
[7]郁劲松.氯代物的同分异构体确定方法与例谈[J].化学教育,2004(10):57-57.
[8]何煦昌.有机立体化学中若干术语和命名的讨论[J].化学研究与应用,2000(3):242-248.
[9]杨志成.有机旋光异构体R/S构型的建议命名方法[J].华东地质学院学报,1994,17(1):88-93.
[10]程绍玲,谢运甫,王华静.有机化合物R/S立体构型的判断技巧[J].化学教育,2016(4):22-24.
[11]何煦昌,吴毓林.立体化学术语“手性”及其应用范围[J].中国科技术语,2008(4):29-32.
【责任编辑 答会明】
Judging of the Rotatory Isomer and labeling the R/S Configuration of Cubic Forms in Organic Chemistry
XUE Hua-li
(CollegeofScience,GansuAgriculturalUniversity,Lanzhou730070,Gansu)
A simple method of judging and labeling the R/S configuration of rotatory isomer of cubic forms in organic chemistry is introduced in this paper,which is suitable not only the simple open-chain rotatory compound,but also the complicated one. In recent years,practices have proven that the method is a simple,quick and precise for students in teaching.
rotatory isomer;configuration mark;R/S isomers;asymmetric carbon atom
1674-1730(2017)03-0048-04
2016-07-08
国家自然科学基金项目《钙离子介导的NOX对T-2毒素诱导马铃薯块茎ROS积累的调控机理研究》(31560475);甘肃农业大学伏羲青年英才培养计划项目《果蔬中单端孢霉烯族毒素的检测与脱除技术研究》(GSFR20130105)
薛华丽(1977—),女,山西临汾人,副教授,博士,主要从事农产品加工与管理研究。
G642
A

