Fisher-Bickerstaff综合征
陈 明,刘盼月,席召燕,于 彦,段淑荣
(哈尔滨医科大学附属第一医院神经内科,黑龙江 哈尔滨 150001)
Fisher-Bickerstaff综合征
陈 明,刘盼月,席召燕,于 彦,段淑荣
(哈尔滨医科大学附属第一医院神经内科,黑龙江 哈尔滨 150001)
Fisher综合征(Miller-Fisher syndrome,FS)、Bickerstaff脑干脑炎(Bickerstaff brainstem encephalitis,BBE)均为临床少见疾病,并且常叠加吉兰-巴雷综合征(Guillain-Barré syndrome,GBS),近年来认为FS、BBE、GBS及介于三者之间的疾病为同一疾病谱的组成部分,称之为Fisher-Bickerstaff综合征(Fisher-Bickerstaff syndrome,FBS),这种新的命名对疾病分类及诊断具有重要意义,此文对相关内容进行了综述,以期提高对该类疾病的认识。
Bickerstaff脑干脑炎;Miller-Fisher综合征;吉兰-巴雷综合征;Fisher-Bickerstaff综合征;GQ-1b
1951年,Bickerstaff和Cloake[1]首次报道3例以意识障碍、眼肌麻痹、共济失调为表现的病例,考虑定位在中脑,故命名为中脑炎(mesencephalitis)和菱脑炎(rhombencephalitis)。1956年Fisher[2]首次报道了3例上呼吸道感染后出现的以眼肌麻痹、共济失调、腱反射减退为主要表现的患者,认为是一种独立的疾病类型,此后将该三联征称为Fisher综合征(Miller-Fisher syndrome,FS)。1957年,Bickerstaff再次报道5例类似病例,发现患者脑脊液细胞数增多,命名为Bickerstaff脑干脑炎(Bickerstaff brainstem encephalitis,BBE)。前驱感染史、相同的自身抗体、神经影像学、神经电生理等有力地证明了BBE、FS、加吉兰-巴雷综合征 (Guillain-Barré syndrome,GBS)是从中枢神经系统到周围神经系统的一个连续的疾病谱。2009年,Yuki等[3]提出了Fisher-Bickerstaff综合征 (FBS)的概念,包括了经典的FS、BBE及FS和BBE的重叠型,对于同时存在中枢神经系统和周围神经系统受损的诊断有重要意义。
1 Fisher-Bickerstaff综合征病因及发病机制
1.1 Fisher-Bickerstaff综合征病因
Ito等[4]对34例BBE患者进行血清学监测发现,23%的患者存在空肠弯曲杆菌感染、6%的患者存在流感嗜血杆菌感染。空肠弯曲杆菌是从FS患者和BBE患者中最常分离出来的病原微生物,二者存在相同的感染源也说明其病因类似。68%的BBE患者和83%的FS患者抗GQ1b IgG抗体阳性,大多数患者也存在抗GT1a IgG抗体。GQ1b的IgG抗体存在3种:抗GQ1b、抗GQ1b/GM1、抗GQ1b/GD1a。Yuki N分析了3例BBE患者,发现存在高滴度抗GQ1b IgG抗体,并且其滴度随着患者临床症状的好转而降低[3]。Susuki等[5]发现从BBE、FS患者中提取的抗GQ1b IgG抗体均可与GT1a结合,证明二者抗GQ1b IgG抗体是相同的。然而一些FS患者和BBE患者的血清中没有检测到抗GQ1b抗体,却发现存在抗GM1b及抗GalNAc-GD1a抗体[5]。BBE患者和FS患者体内存在相同自身抗体进一步证明其免疫机制并非完全不同,而是存在一定的相同之处。
1.2 Fisher-Bickerstaff综合征发病机制
弯曲杆菌基因感染某些微生物可以引起多种自身免疫性疾病的机制尚未明确,而空肠弯曲杆菌引起FS及GBS的机制已经明确。CST-II唾液酸转移酶由291个氨基酸残基构成,其活性与第51个氨基酸残基密切相关[6]。CST-II(Thr51)可产生GM1和神经节苷脂GD1a的抗原表位,而CST-II(Asn51)可产生GT1a或GD1c的抗原表位,并模仿GQ1b[7]。CST-II(Asn51)菌株经常表达GQ1b表位,而CST-II(Thr51)具有GM1与神经节苷脂GD1a表位。GM1与神经节苷脂GD1a在运动神经轴索朗飞结处表达,还可能在四肢神经肌肉接头处表达,GQ1b在眼外肌的神经肌肉接头处表达程度较高。从BBE合并GBS的患者中分离出的空肠弯曲杆菌存在CST-II(Asn51)和GQ1b表达位点[8]。因此,感染空肠弯曲杆菌(CST-II Asn51)的患者经常表现为抗GQ1b IgG抗体阳性、眼肌麻痹和共济失调;感染空肠弯曲杆菌(CST-II Thr51)的患者更易表现出现抗GM1抗体阳性与抗神经节苷脂GD1a IgG抗体阳性及肢体瘫痪。换言之,感染空肠弯曲杆菌后CST-II多态性(Thr51/ Asn51)决定了患者的临床表现和发病类型。
2 Fisher-Bickerstaff综合征临床表现及诊治
2.1 损害部位
BBE与FS均为临床少见的神经系统炎性脱髓鞘性疾病,一般认为BBE常伴有意识障碍和(或)锥体束征阳性,3例死亡BBE患者活检发现,死亡的BBE患者脑干存在确切的感染表现[2],提示存在中枢神经系统病变;而FS腱反射消失且意识障碍罕见,考虑与外周神经病变有关。近年来相关学者认为,引起BBE和FS产生共济失调是同一个机制即本体感觉传入通路功能紊乱,中枢神经系统和周围神经系统同时被破坏,反驳了BBE是单纯中枢神经系统损害和FS是单纯周围神经损害的观点。
2.2 临床表现
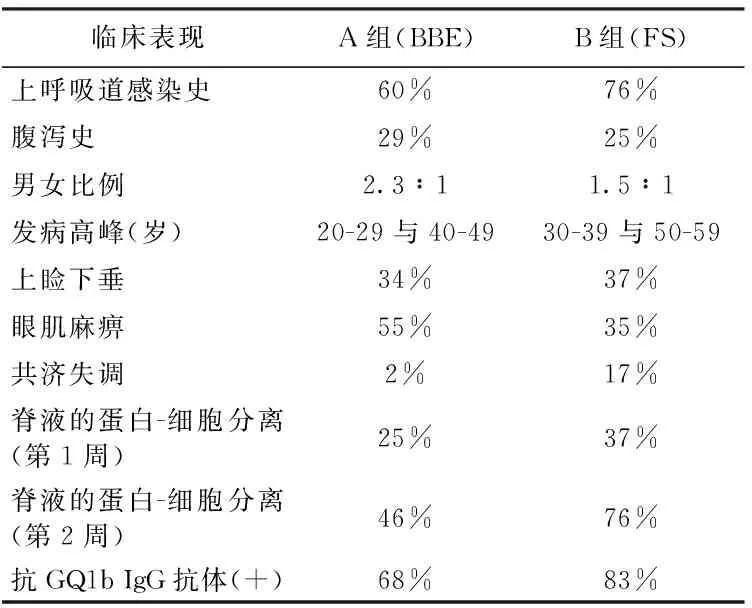
表1 BBE与FS临床表现及异同点
Ito等[4]将581例存在急性眼肌麻痹、共济失调症状的患者分为3组并进行研究(见表1),A组53例(存在意识障碍的典型BBE)、B组466例(腱反射减弱或消失而无意识障碍的FS)、C组62例(意识清楚且腱反射存在)。可以发现,BBE与FS的临床表现具有很高的相似性,只是同一表现出现的概率存在差异。此外,32%的BBE患者存在脑脊液细胞数增高而只有4%的FS患者出现这一症状,可能与BBE的血脑屏障更易破坏相关。尽管BBE出现脑脊液蛋白-细胞分离的概率低于FS,但表明二者具有相同的病因。这表明单纯的脑脊液化验不能区分BBE和FS。
2.3 预后
既往认为BBE预后良好,然而王志丽等[9]报道的32例BBE中9例死亡(免疫调节治疗组4例,未免疫调节治疗组5例),死亡患者占昏迷患者的70%,占需要机械辅助通气患者的75%,可能与脑干网状上行激活系统、呼吸中枢严重破坏有关;98%的FS患者症状完全消失,与既往报道的研究结果一致。
2.4 电生理及头颅影像学特点
Ito等[4]发现,75%的BBE患者、74%的FS患者出现H反射消失,但是常规的运动神经、感觉神经传导速度检查往往正常。57%的BBE和25%的FS患者脑电图出现弥漫性慢活动θ波或者δ波,但是全部FS患者都神志清楚。BBE及FS均很少出现SEP异常。11%的BBE患者的核磁T2相出现高信号,部位为脑桥、丘脑、小脑、延髓、中脑、小脑上脚、胼胝体,而1%的FS患者核磁出现异常。临床症状介于FS和BBE的其他患者中,7%出现异常信号主要位于脑桥、延髓、小脑中脚。
2.5 诊断
Odaka等提出FS、BBE及重叠型的诊断标准[10]:
必需条件
FS:①4周内出现进行性、相对对称的眼肌麻痹和共济失调;②腱反射减弱或消失;③肢体肌力≥4级。
BBE:①4周内出现进行性、相对对称的眼肌麻痹和共济失调;②意识障碍或锥体束征阳性;③肢体肌力≥4级。
支持条件:
①发病前4周内有感染史;②脑脊液蛋白细胞分离;③血清抗GQ1b抗体阳性。
FS+GBS(FS/GBS):具有眼肌麻痹和共济失调,且肌力≤3级。
国家卫生计生委重点临床专科建设项目——神经内科(No.Y29090752-0001)
陈明(1988-),男,河北沧县人,在读硕士,主要研究方向:脑血管病、神经系统脱髓鞘疾病。
段淑荣,女,黑龙江人,博士后,主任医师,教授,研究方向:神经系统疑难病。
R 74
C
10.3969/j.issn.1673-1492.2017.02.021
来稿日期:2016-08-29

