香格里拉本土葡萄酒酵母的筛选及其胁迫耐受性分析
秦伟帅,时磊,党明明,何霞红,朱书生,赵新节*
(1. 云南农业大学农业生物多样性与病害控制教育部重点实验室,昆明 650201;2. 齐鲁工业大学山东省微生物工程重点实验室,济南 250353;3. 山东省蓬莱万德福酒业有限公司,山东烟台 265600)
香格里拉本土葡萄酒酵母的筛选及其胁迫耐受性分析
秦伟帅1,2,时磊3,党明明3,何霞红1,朱书生1,赵新节2*
(1. 云南农业大学农业生物多样性与病害控制教育部重点实验室,昆明 650201;2. 齐鲁工业大学山东省微生物工程重点实验室,济南 250353;3. 山东省蓬莱万德福酒业有限公司,山东烟台 265600)
本文对香格里拉葡萄酒产区葡萄果实及土壤中分离获得76株酵母菌株进行序列测定和生理特征分析。结果表明,这些菌株在亲缘关系上可归类于9个属10个种,其中优势菌株为酿酒酵母(Saccharomyces cerevisiae),占52.6%,其次是巴布维红酵母(Rhodosporidium babjevae)和葡萄酒有孢汉生酵母(Hanseniaspora vineae),分别占22.4%和7.9%。利用改良模拟葡萄汁培养基对菌株进行胁迫耐受性分析发现,酿酒酵母菌株CZ11和BZL12具有较高的酒精度、高糖和低温耐受性,具有冰酒发酵应用潜力。
香格里拉;本土酵母;筛选;胁迫耐受性;分析
香格里拉位于中国青藏高原南部,海拔3300~3500 m,是中国新兴的葡萄酒产区。该地区气候寒冷干燥,紫外线辐射强,年平均降雨量在800~1000 mm之间,真菌病害少,是适宜种植优质酿酒葡萄的高海拔产区。高原冰葡萄酒的发酵是一个复杂的微生物代谢过程,酵母菌在发酵过程中起着关键作用。酵母性能的好坏关系到冰酒发酵是否能够顺利的进行[1]。
目前,国内冰酒生产大都选用进口商业活性干酵母,但是冰酒发酵的高糖和低温等因素引起的酵母起酵速度慢、发酵周期长的问题仍然没有得到有效解决,大大增加了葡萄酒的生产成本和感染杂菌的风险[2]。由于香格里拉葡萄适栽区的生态地理环境多种多样,蕴藏着丰富的葡萄酿酒酵母资源,本土酵母已经适应了当地的气候条件、土壤和葡萄品种,能较快的在葡萄酒发酵中占主导地位[1,3]。因此,在产区环境范围内,筛选优良耐受性的酵母菌株,并利用合理的葡萄酒发酵培养基对酵母酿造性能进行评价,对该产区高品质、特色冰酒的生产具有重要意义。
本研究从香格里拉产区土壤和酿酒葡萄品种中分离出本土葡萄酒酵母,采用26S rDNA D1/D2区域序列测定和5.8S-ITS区序列分析、生理特征分析方法对得到的酵母菌进行分类鉴定,并采用改良的模拟葡萄汁对分离菌株进行胁迫耐受性分析,为该产区适宜冰酒发酵的酵母菌资源的开发应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 样品来源
本研究共采集8个地区40份新鲜的土壤样品和55份葡萄果实,详见表1。葡萄品种包括赤霞珠、玫瑰蜜和霞多丽。
1.1.2 培养基
(1)豆芽汁蔗糖富集培养基[4-5]:黄豆芽200 g、蔗糖30 g、水1000 mL。
(2)孟加拉红-链霉素分离培养基[5-6]:葡萄糖10 g、蛋白胨5 g、KH2PO41g、MgSO4·7H2O 0.5 g、孟加拉红33.4 mg、蒸馏水100 mL、链霉素溶液30 μg/mL。
(3)YPD培养基:葡萄糖20 g、蛋白胨10 g、酵母粉10 g、水1000 mL。
(4)改良模拟葡萄汁培养基[3,7-8]:葡萄糖10 g/L,果糖10 g/L,酒石酸3 g/L,柠檬酸0.3 g/L,L-苹果酸0.3 g/L,KH2PO42 g/L,MgSO4·7H2O 0.2 g/L。其它成分包括氮源、无机盐、维生素和脂肪酸,pH值调整为5.8。所有固体培养基加入20 g/L琼脂。培养基灭菌条件为115 ℃,30 min。
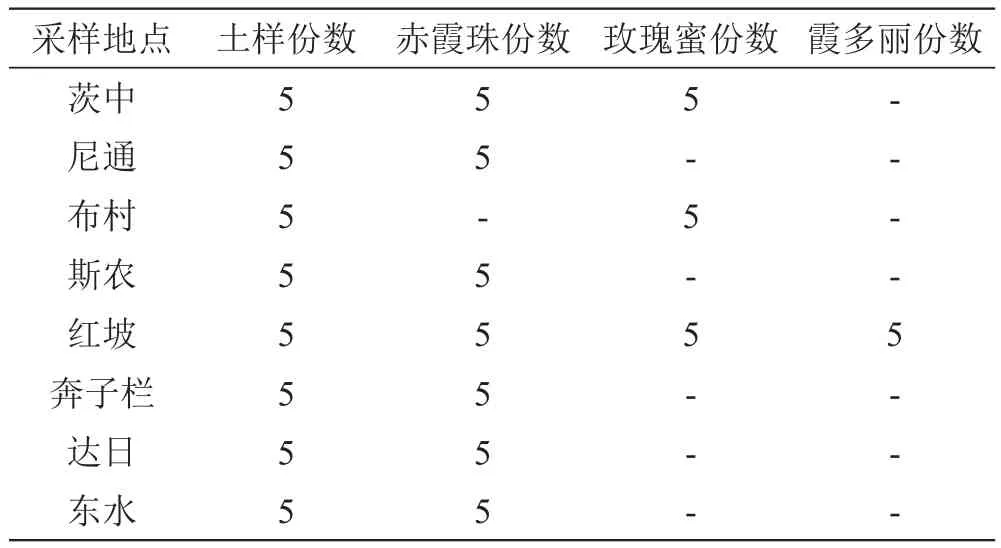
表1 样品来源
1.2 方法
1.2.1 酵母菌株的分离与保藏
土壤中酵母菌株分离[5]:称取土样1.0 g,加到100 mL灭菌富集培养基中,33 ℃、170 r/min摇床培养30 h。梯度稀释后涂布于分离选择培养基上,33 ℃静置培养2~3 d后挑取形态不同的单菌落,镜检。形态初步确定为酵母后,多次划线纯化,获得纯培养物。42 ℃恒温培养1~2 d,挑取生长良好的菌株纯化后转管低温保存。
葡萄中酵母菌株的分离[3]:葡萄酒自然发酵过程中取样,将样品梯度稀释后涂布于YPD平板以分离酵母,28 ℃恒温箱中培养3 d,结合镜检和菌落的形态观察,从平板上挑取分离良好、具有典型性的单菌落,经进一步纯化后转管低温保存。
1.2.2 酵母的菌种鉴定
将分离纯化的酵母菌种梯度稀释后涂布于YPD平板,25 ℃培养5~7 d。将酵母菌种送中科院微生物研究所进行酵母26S rDNA D1/D2区和5.8S-ITS区序列分析,测序结果采用DNAStar软件人工校对。用Mega 5.0软件邻接法,进行1000 次Bootstrap检验后构建系统发育树。
1.2.3 酵母胁迫耐受性试验
冰葡萄酒酿造过程中,葡萄醪含糖量高、发酵温度低等因素影响酵母的生长和代谢,因此要求酵母具有耐低温、耐高糖、耐酒精等抗逆性能[9],它是冰酒酵母菌种选育的重要指标。
(1)低温耐受性能试验
活化菌种转接于改良模拟葡萄汁中,接种量为1%。10 ℃和15 ℃静置培养,于7 d后观察杜氏管中产气量,记录酵母菌的低温耐受性。
(2)酒精耐受性能试验
活化菌种转接于酒精浓度调整为16%和18%的改良模拟葡萄汁中,接种量为1%,28℃静置培养,7 d后观察杜氏管中产气量,记录酵母菌的不同酒精度下耐受性。
(3)高糖耐受性能试验
将模拟葡萄汁培养基含糖量调整为500 g/L、600 g/L两个浓度,取10 mL分装于试管,放入倒置的杜氏发酵管(确保充满液体培养基且无气泡),接种量为1%,28 ℃静置培养,7 d后观察杜氏管中产气量,记录酵母菌的不同糖浓度耐受性。
以上所有试验,各处理重复次数均为3次。
1.3 数据分析
所有的试验进行3次重复,采用SPSS 19.0进行数据分析,多组间比较采用One-Way ANOVA法。差异显著性为P<0.05。
2 结果与分析
2.1 酵母菌株的分离鉴定及种群分布
本研究共分离获得酵母菌76株,经过26S rDNA D1/D2区和5.8S-ITS区序列分析发现76株酵母分属于9个属10个种,其中,大隐球酵母(Cryptococcus magnus)1株(占总分离株的1.3% )、巴布维红酵母(Rhodosporidium babjevae)17株(占22.4%)、皮杰普氏毕赤酵母(Pichia pijperi)1株(占1.3%)、酿酒酵母(Saccharomyces cerevisiae)40株(占52.6%)、铁杉假丝酵母(Candida railenensis)3株(占3.9%)、科特维乐红酵母(Rhodosporidium kratochvilovae)1 株(占1.3%)、德巴利酵母(Debaryomyces prosopidis)5株(占6.6%)、葡萄酒有孢汉生酵母(Hanseniaspora vineae)6株(占7.9%)、戴尔凯氏有孢圆酵母(Torulaspora delbrueckii)1株(占1.3%)和美极梅奇酵母(Metschnikowia pulcherrima)1株(占1.3%),优势菌株为酿酒酵母和巴布维红酵母,其次是德巴利酵母和葡萄酒有孢汉生酵母。茨中和奔子栏筛选和鉴定的菌株总数最多。从分离结果看,酿酒酵母的地域分布最广(表2),茨中、尼通、布村、奔子栏和达日5个地区的样品中均能筛选到。试验从土壤中共分离到酵母16株,葡萄果实中共分离到酵母59株。
2.2 酵母菌系统进化树
酵母26S rDNA D1/D2区序列分析[10],与已知种的相似性为99%以上并有形态特征的支持时,就可以做出种的鉴定,与最近缘的已知种的相似性在98%~99%之间时,就需要结合5.8S-ITS序列分析和生理生化特征比较,对其作出分类学鉴定。如果在98%或者以下时,则可初步确定为新种。图1为76株酵母系统发育树。
2.3 酵母胁迫耐受性分析
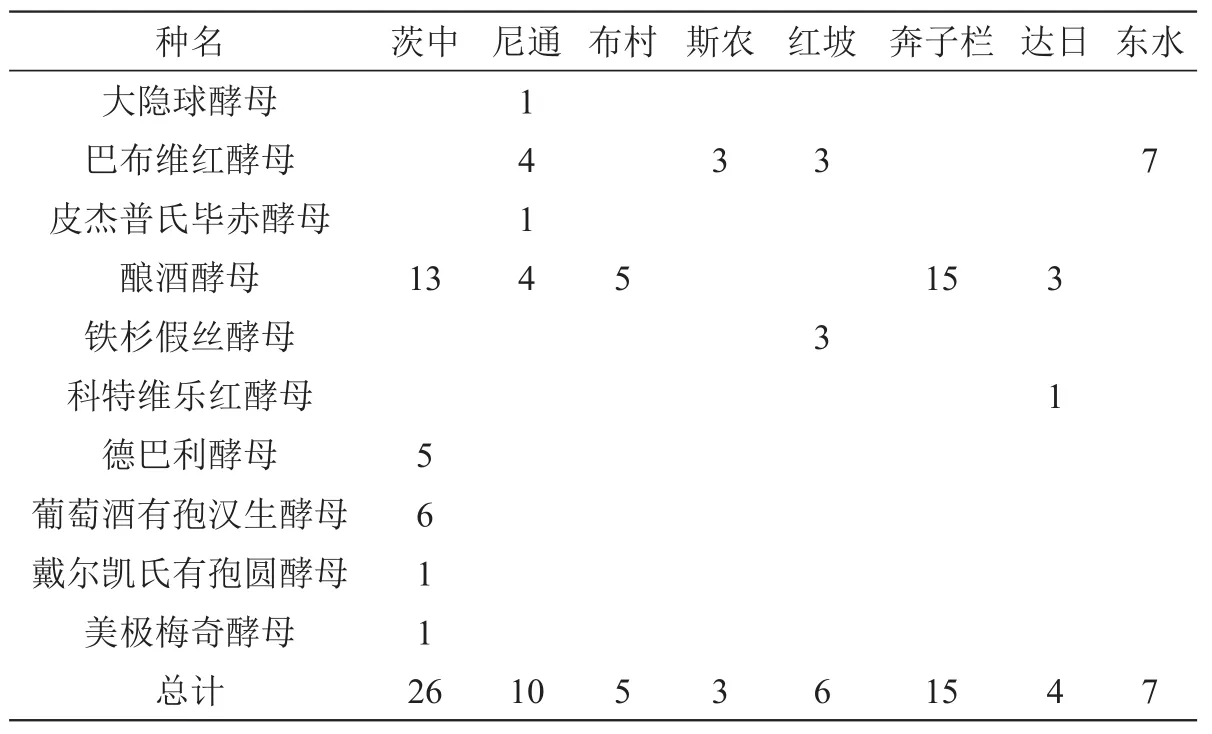
表2 酵母菌的地理分布 (单位:株)
2.3.1 酵母菌株的低温耐受性分析
本研究所筛选到的40株酿酒酵母中,有11株能在10 ℃条件下产气;而在6株葡萄酒有孢汉生酵母中,有1株能在10 ℃条件下产气;1株美极梅奇酵母能在10 ℃条件下产气。所有的大隐球酵母、巴布维红酵母、皮杰普氏毕赤酵母、铁杉假丝酵母、德巴利酵母、科特维乐红酵母、戴尔凯氏有孢圆酵母在10 ℃条件下均不能产气。上述结果表明,不同属酵母菌的耐低温能力不相同,同种酵母不同菌株之间的耐低温能力也存在明显差异,其中耐低温能力较好的是酿酒酵母菌株。不同温度条件下产气菌株见表3。
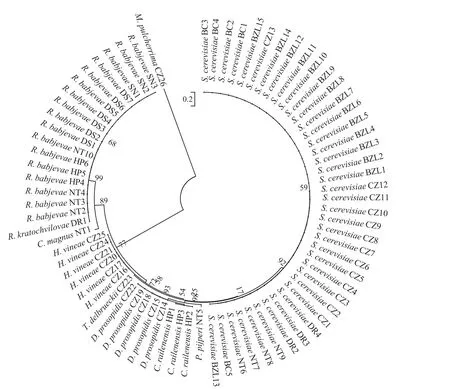
图1 根据26S rDNA D1/D2区域序列的系统发育进化树

表3 酵母菌耐低温能力检测结果
2.3.2 酵母菌株的酒精耐受性分析
本研究所筛选到的40株酿酒酵母中,有19株能在16%酒精浓度条件下产气;有2株酿酒酵母能在18%酒精浓度条件下产气(表4)。所有的大隐球酵母、巴布维红酵母、皮杰普氏毕赤酵母、铁杉假丝酵母、德巴利酵母、科特维乐红酵母、戴尔凯氏有孢圆酵母、葡萄酒有孢汉生酵母、美极梅奇酵母在16%酒精浓度条件下均不能产气。上述结果表明,酿酒酵母具有较好的酒精耐受性,同种酵母不同菌株之间的耐酒精能力也存在明显差异。
2.3.3 酵母菌株的高糖耐受性分析
本研究所筛选得到的40株酿酒酵母中,有20株能在500 g/L糖浓度条件下产气;有5株葡萄酒有孢汉生酵母能在500 g/L糖浓度条件下产气;有1株戴尔凯氏有孢圆酵母能在500 g/L糖浓度条件下产气。有3株酿酒酵母、1株葡萄酒有孢汉生酵母、1株戴尔凯氏有孢圆酵母能在600 g/L糖浓度条件下产气。所有的大隐球酵母、巴布维红酵母、皮杰普氏毕赤酵母、铁杉假丝酵母、德巴利酵母、科特维乐红酵母、美极梅奇酵母在500 g/L糖浓度条件下均不能产气。上述结果表明,不同酵母具有不同的高糖耐受性,同种酵母不同菌株之间的耐高糖能力也存在明显差异。不同糖浓度条件下产气菌株见表5。
3 讨论和结论
葡萄酒的品质很大程度上取决于酵母菌种的酿酒特性,充分利用各类酵母的特点和优势,有效控制败坏性酵母,会使葡萄酒的香气和口感更加复杂[1]。在冰酒酿造过程中,耐受性强的酵母菌种可以迅速起酵,缩短发酵周期。因此,本试验对云南香格里拉产区40份新鲜的土壤样品和55份葡萄果实的酵母菌进行了分离鉴定并对其胁迫耐受性进行研究。结果表明,茨中和奔子栏筛选和鉴定的菌株总数最多,酵母资源丰富。本土酵母菌的物种具有一定的多样性,而且在分布地域上存在一定的差异。其中优势菌株为酿酒酵母,地域分布最广,茨中、尼通、布村、奔子栏和达日5个地区的样品中均能筛选到。其次是巴布维红酵母和葡萄酒有孢汉生酵母。其中酿酒酵母和葡萄酒有孢汉生酵母主要在葡萄酒自然发酵过程中筛选得到。Paraggio 研究发现,葡萄汁有孢汉逊酵母在葡萄酒发酵过程中可以产生大量的酯类和甘油,能够增加葡萄酒口感的圆润度[11]。Wang 等人通过接种酿酒酵母和葡萄汁有孢汉逊酵母进行葡萄酒混菌发酵,可以加快葡萄酒酒精发酵进程,改变酿酒酵母的胁迫耐受性[12]。然而在本试验在葡萄酒发酵过程中并未筛选到葡萄汁有孢汉逊酵母。
本研究通过改良的模拟葡萄汁对筛选得到的76株酵母进行胁迫耐受性分析发现,不同种属的酵母菌以及同种酵母菌不同菌株之间在耐胁迫能力方面具有明显差异。其中,能够耐受18%酒精度的菌株为酿酒酵母BZL8和BZL10。能够耐受600 g/L葡萄糖的菌株为酿酒酵母CZ3、BZL7和BZL10,葡萄酒有孢汉生酵母CZ20,戴尔凯氏有孢圆酵母CZ23。能够耐受16%酒精度、500 g/L葡萄糖和低温10 ℃的菌株为酿酒酵母CZ11和BZL12,具有高耐受性冰酒酵母开发潜力。相关研究证实葡萄酒有孢汉生酵母和戴尔凯氏有孢圆酵母在葡萄酒酿造过程中可以增加葡萄酒香气的复杂性,并且和酿酒酵母连续接种发酵,可以控制酿酒酵母的乙醇生成量[13-15]。这为下一步香格里拉产区葡萄酒特征香气的形成机制研究及优良菌种选育奠定了基础。

表4 酿酒酵母菌耐酒精能力检测结果

表5 酵母菌耐高糖能力检测结果
[1] 张春芝, 莫寅斌. 宁夏产区酿酒葡萄酵母菌初步分类鉴定及多样性研究[J]. 中国酿造, 2014, 33(10): 49-54.
[2] 郑祖亮, 方连英, 赵辉, 等. 酿酒酵母低温耐受机制的研究进展[J]. 中国酿造, 2015, 34(1): 1-4.
[3] 李慧, 王惠玲, 吴雅琨, 等. 天然葡萄酒酵母菌种的分离、鉴定和酿造性能评价[J]. 食品与发酵工业, 2010, 36(11): 14-20.
[4] SANDEEP S D, HARINDER S O, SIMRANJEET K S, et al. Enhanced ethanol production from sugarcane juice by galactose adaptation of a newly isolated thermotolerant strain of Pichia kudriavzevii[J]. Bioresource Technology, 2011, 102(10): 5968-5975.
[5] 刘超帝, 缪礼鸿, 陈瑾, 等. 耐高温酵母菌的筛选及其乙醇发酵特性[J]. 食品科学, 2016, 37(19): 128-134.
[6] 赵斌, 何绍江. 微生物学实验[M]. 北京: 科学出版社, 2002: 51-65.
[7] MARULLO P, BELY M, MASNEUF-POMAREDE I, et al. Inheritable nature of enological quantitative traits is demonstrated by meiotic segregation of industrial wine yeast strains[J]. FEMS Yeast Research, 2004, 4(7): 711-719.
[8] MASNEUF-POMARÈDE I, MANSOUR C, MURAT M L, et al. Influence of fermentation temperature on volatile thiols concentrations in Sauvignon blanc wines[J]. International Journal of Food Microbiology, 2006, 108(3): 385-390.
[9] CARDONA F, CARRASCO P, PÉREA-ORTÍN J E, et al. A novel approach for the improvement of stress resistance in wine yeasts[J]. International Journal of Food Microbiology, 2007, 114(1): 83-91.
[10] FELL J W, NOEKHOUT T, FONSECA A, et al. Biodiversity and systematics of basidiomycetous yeasts as determined by largesubunit rDNA D1/D2 domain sequence analysis[J]. International Journal of Systematic and Evolutionary Microbiology, 2000, 50(3): 1351-1371.
[11] PARAGGIO M. Biodiversity of a natural population of Saccharomyces cerevisiae and Hanseniaspora uvarum from Aglianico del Vulture[J]. Food Technology and Biotechnology, 2004, 42(3): 165-168.
[12] WANG C, MAS A, ESTEVE-ZARZOSO B. Interaction between Hanseniaspora uvarum and Saccharomyces cerevisiae during alcoholic fermentation[J]. International Journal of Food Microbiology, 2015, 206: 67-74.
[13] FLEET G H. Yeast interactions and wine flavour[J]. International Journal of Food Microbiology, 2003, 86(1): 11-22.
[14] ANFANG N, BRAJKOVICH M, GODDARD M R. Cofermentation with Pichia kluyveri increases varietal thiol concentrations in Sauvignon Blanc[J]. Australian Journal of Grape & Wine Research, 2009, 15(1): 1-8.
[15] CONTRERAS A, CURTIN C, VARELA C. Yeast population dynamics reveal a potential 'collaboration' between Metschnikowia pulcherrima and Saccharomyces uvarum for the production of reduced alcohol wines during Shiraz fermentation[J]. Applied Microbiology & Biotechnology, 2014, 99(4): 1885-1895.
Screening and stress tolerance analysis of native wine yeasts in Shangri-La
QIN Weishuai1,2, SHI Lei3, DANG Mingming3, HE Xiahong1, ZHU Shusheng1, ZHAO Xinjie2*
(1.Key Laboratory of Agrobiodiversity and Pest Management, Ministry of Education, Yunnan Agricultural University, Kunming 650201, China; 2.Shandong Key Laboratory of Microbial Engineering, Qilu University of Technology, Jinan 250353,China; 3.Shandong Penglai Wandefu Wine Company Limited, Yantai 265600,China)
In this study, 76 wine yeast strains were isolated from different soil samples and grape fruits in Shangri-La. Based on 26S rDNA D1/D2 domain sequence analysis and physiological characterization, these strains were phylogenetically related to 10 species in 9 genera, Saccharomyces cerevisiae was the dominant strains with 40 strains accounted for 52.6%, followed by 22.4% of Rhodosporidium babjevae, and 7.9% of Hanseniaspora vineae. We analyzed the stress tolerance of the strains using the modifi ed grape juice culture medium and found that strains CZ11 and BZL12 had higher alcohol content, higher sugar content, and lower temperature tolerance.
Shangri-La; native yeast; screening; stress tolerance; analysis
S663.1;TS261.1
A
10.13414/j.cnki.zwpp.2017.03.006
2017-03-29
山东省现代农业产业技术体系果品产业创新团队(SDAIT-06-14);山东省现代农业产业技术体系专项基金(SDAIT-03-021-12)
秦伟帅,博士,研究方向为酵母菌种选育及代谢调控。E-mail: sdjnqws@163.com
*通讯作者:赵新节,博士,教授,研究方向为葡萄与葡萄酒。E-mail: zhaoxinjie1177@163.com

