Fkbp51基因敲除对小鼠肝脏转录组基因可变剪接的影响
周志强,杨志伟,雍伟东
(中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,卫生部人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,北京 100021)
研究报告
Fkbp51基因敲除对小鼠肝脏转录组基因可变剪接的影响
周志强,杨志伟*,雍伟东*
(中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,卫生部人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,北京 100021)
目的 通过分析Fkbp51基因敲除(knock out,KO)与野生型(wild type,WT)小鼠肝脏表达谱,研究Fkbp51基因敲除对肝脏组织基因可变剪接的影响。方法 利用二代测序对Fkbp51 KO与WT小鼠肝脏进行表达谱测序,用TopHat对RNA测序结果进行可变剪接分析,筛选出KO与WT小鼠肝组织中差异的内含子保留(intron retetion,RI)和外显子跳跃(exon skipping,SE)。通过在线工具DAVID对这些差异可变剪接体进行基因功能 (gene ontology, GO)和代谢通路(kyoto encyclopedia of genes and genomes,KEGG)富集分析,同时用NCBI 基因数据库对这些基因进行注释。结果 (1)Fkbp51缺失可导致小鼠肝脏mRNA可变剪接发生变化;(2)Fkbp51基因敲除造成小鼠肝脏mRNA可变剪接表达量的变化;(3)通过GO与KEGG分析,我们发现这些发生差异可变剪切的基因主要与脂肪相关衍生物的代谢、免疫、胆汁酸分泌等通路相关。(4)与差异内含子保留相关的基因主要与肌动蛋白细胞骨架调控,氨基酸及其衍生物代谢相关。结论Fkbp51基因敲除能够改变基因组中mRNA的可变剪切,进而影响小鼠肝脏的代谢功能。
Fkbp51基因敲除小鼠;肝脏; RNA-seq;可变剪接;内含子保留;外显子跳跃
Fkbp51是一种大分子免疫亲和蛋白,可介导蛋白与蛋白之间的相互作用。同时,Fkbp51作为共伴侣蛋白通过与热休克蛋白HSP90/HSP70形成复合物参与激素受体复合物的形成与调控[1]。研究表明Fkbp51可通过调节糖、脂代谢来发挥重要的调控作用。肝脏是进行糖、脂代谢的主要器官。在肝脏中,糖皮质激素可以促进糖异生,但它的过度分泌会造成糖代谢综合征,如向心性肥胖、糖尿病、胰岛素抵抗和脂肪病变等。糖皮质激素结合皮质激素受体后,激活后续通路,促进Fkbp51的表达,进而负反馈作用于糖皮质激素受体,降低其对糖皮质激素的敏感性,以维持机体平衡[2-4]。近年来,Fkbp51在脂肪细胞分化中所起的重要作用引起了研究者越来越多的关注,Stechschulte[5]发现脂肪生成需要Fkbp51的参与;Toneatto J[6]发现Fkbp51可抑制3T3-L1前脂肪细胞的分化。我们的研究发现,Fkbp51 KO小鼠能抵制高脂饮食诱导的肥胖,说明Fkbp51基因在能量代谢和脂肪代谢中发挥着重要的作用[7]。
可变剪接是mRNA前体通过不同的剪接方式产生的剪接异构体,可变剪接可以调节基因表达,同时也是产生蛋白质多样性的原因之一。可变剪接参与了多种重要的发育过程,如果蝇性别决定[8]、人类器官和组织发育[9, 10]、肌肉组织分化[11]、CD分子的差异表达[12]、mRNA产物的降解等[13]。异常的剪接会导致疾病的发生,如地中海贫血症[14],强直性肌营养不良、脊髓型肌萎缩症、色素性视网膜炎、囊性纤维化、帕金森式症、荷尔蒙缺陷等复杂疾病[15, 16]。
本文通过分析Fkbp51 KO与WT小鼠肝脏表达谱,研究Fkbp51基因敲除对其他基因可变剪接(内含子保留及外显子跳跃)的影响,并分析差异可变剪接参与的生物学过程及代谢通路,以期进一步探索Fkbp51在肝脏糖、脂代谢中的重要作用。
1 材料和方法
1.1 实验动物及测序
2月龄同窝SPF级Fkbp51 KO与WT雄鼠(C57BL/6),各3只,由中国医学科学院医学实验动物研究所提供[SYXK(京)2014-0029,SCXK(京)2014-0004],体重为20~24 g。动物实验方案经过中国医学科学院医学实验动物研究所实验动物使用与管理委员会(IACUC)批准。脱颈处死,取肝脏,Trizol法提取总RNA,样品交由华大基因建库和测序。
1.2 差异可变剪接的识别
原始序列去除低质量、污染序列及接头后,得到干净序列;用TopHat将干净序列比对到参考基因组,分析比对结果,寻找外显子间的结合位点。首先筛选出KO和WT表达量有差异的可变剪接(t检验,P< 0.05)。然后筛选新引入和缺失的可变剪接,所有可变剪接位点支持数都大于5。
1.3 差异可变剪接的GO功能和KEGG代谢通路分析
将发生差异可变剪接的基因通过DAVID在线工具[17, 18],以全基因组为背景进行GO功能及KEGG 代谢通路[19]富集分析。 统计方法为Fisher’s exact test,Benjamini算法校正P值,校正后p-value <0.05为差异有显著性。
1.4 受差异可变剪接影响的通路
内含子保留和外显子跳跃共同参与了生物学过程和代谢通路的调节。通过对差异外显子跳跃和内含子保留基因做GO生物学过程和KEGG代谢通路注释,来确定相关基因以SE、 RI、或两者的组合来参与生物学过程和代谢通路。
2 结果
2 差异可变剪接基因的识别
基因发生差异外显子跳跃事件统计如下:KO与WT共有,KO特异,WT特异的基因数分别为991、311、571个;发生内含子保留事件,KO与WT共有,KO特异,WT特异的基因数分别为1503、463、705个。以WT为例,我们定义Fkbp51KO造成WT中可变剪接消失的基因为WT特异基因、缺失的可变剪接为WT特异可变剪接;同理,我们也定义Fkbp51基因敲除造成KO中可变剪接出现的基因为KO特异基因、新增加的可变剪接为KO特异可变剪接。在KO和WT都出现相同可变剪接的基因为共有基因,可变剪接为共有可变剪接。统计分析发现在内含子保留和外显子跳跃事件中,占主要部分的是共有可变剪接,其次是WT特异、KO特异。
2.2 差异可变剪接的识别
以基因可变剪接位点是否表达以及表达量的多少为标准,我们筛选出了KO和WT差异共有(都表达,但表达量有差别)、KO特异、WT特异可变剪接。外显子跳跃中,差异共有、KO特异、WT特异可变剪接分别为122、15、12个。内含子保留中,分别为498、104、144个。Fkbp51基因敲除对SE和RI都有影响,但对RI影响较大,共有746个差异RI可变剪接,而SE只有139个。对SE和RI来说,Fkbp51基因敲除主要影响共有可变剪接的表达量,其次造成新可变剪接的引入和原有可变剪接的缺失。
2.3 差异可变剪接的GO功能注释
为了研究发生差异可变剪接的基因的功能,我们用DAVID做了GO功能富集分析,如表1、2。外显子跳跃基因的GO注释主要富集到四个过程,一是脂肪代谢衍生物相关的代谢过程,如脂肪酸,有机酸,甾体和胆固醇的代谢过程;二是免疫相关,如急性炎症反应中血浆蛋白的激活,体液免疫应答,急性炎症反应,激活免疫应答;三是补体的激活,包括补体激活的经典和替代途径;四是蛋白加工和成熟,如多肽键裂解的蛋白成熟;其他包括辅酶的代谢过程和芳香族化合物的分解代谢过程。在细胞组分的定位中,主要位于过氧化物酶体,线粒体和细胞质核周围。氧化物酶体的主要功能是利于脂肪、醇、氨基酸的分解,其主要的分子功能是与辅因子、维生素、脂质结合。
在表2中,差异内含子保留基因主要富集的生物学过程为mRNA的代谢过程、类固醇的生物合成过程、一碳代谢过程,肌动蛋白细胞骨架组织方式的调控,细胞氨基酸衍生物代谢过程,对未折叠蛋白的反应。主要的细胞组分位于核膜,脂质双层膜的细胞器,最靠近能动细胞的移动方向部分,内质网。主要的分子功能包括与核苷酸的结合、RNA结合、GTP酶结合、酸性氨基酸连接酶活性、RAB鸟嘌呤核苷酸交换因子活性和腺嘌呤核苷酸结合。mRNA的代谢过程中,结合活性是非常重要的。

表1 KO与WT发生差异外显子跳跃基因的GO注释
注:P-值<0.05。
Note.P-value<0.05.
2.4 差异可变剪接的KEGG代谢通路分析
为了研究差异可变剪接基因参与哪些代谢通路,我们用DAVID做了KEGG代谢通路分析,如表3、4所示。差异SE基因主要富集的通路有补体和凝血级联,初级胆汁酸合成,细胞色素P450介导的异源物代谢,PPAR信号通路。在表3中,富集在PPAR信号通路上的cyp450家族有Cyp4a14,主要参与脂肪酸的氧化;Apoc3参与脂质转运;Scp2和Ehhadh参与脂肪酸的氧化。在细胞色素P450介导的异源物代谢过程中,Gstz1和Gsta3是谷胱甘肽S-转移酶,参与对毒物,致癌物质和药理活性亲电子化合物的转化解毒;Gsta3属于谷胱甘肽S-转移酶α家族,编码的酶具有谷胱甘肽过氧化物酶活性;Gstz1参与氧化应激反应;Cyp2c50催化花生四烯酸分解成中链和ω末端羟酸;Ugt1a6a编码葡萄糖醛酸转移酶,转化小的亲脂性分子如固醇激素和胆红素等。

表2 KO与WT发生差异内含子保留基因的GO注释
注:P-值<0.05。
Note.P-value<0.05.
从表4可以看出,差异RI基因主要富集的通路与氨基酸代谢相关,包括半胱氨酸和蛋氨酸、含硒氨基酸代谢;另外一些富集与免疫相关,包括急性髓系白血病和慢性粒细胞白血病;还有一些富集到趋化因子信号转导通路,包括补体和凝血级联反应和黑素的合成等。已有研究发现,在肿瘤中异常可变剪接的比例高于正常细胞,而且可变剪接类型也不同。Skotheim的肿瘤研究结果表明,原本在正常细胞中占较小比例的内含子保留类型在肿瘤中上升,而外显子跳跃的比例则下降[20]。
2.5 受差异可变剪接影响的通路
Fkbp51基因敲除对生物是一种非生物胁迫,Fkbp51KO后,机体需要通过一些基因的调节来弥补Fkbp51基因的功能,而可变剪接就是这样一种转录水平的调节。在表5中,在类固醇代谢过程,急性炎症反应中血浆蛋白的激活,补体激活,有机酸的代谢过程,羧酸代谢过程,胺的代谢过程,急性炎症反应,多肽键裂解的蛋白成熟等过程,都发现了基因通过不同的可变剪接来参与生物过程和代谢通路。
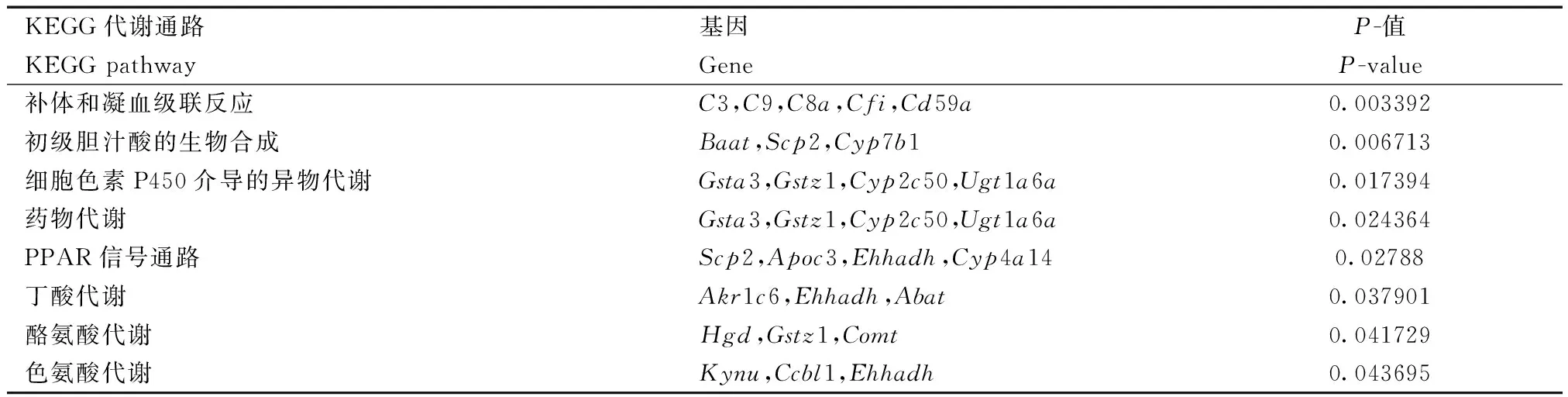
表3 KO与WT发生差异外显子跳跃基因的KEGG pathway
注:P-值<0.05。
Note.P-value<0.05.

表4 KO与WT发生差异内含子保留基因的KEGG pathway
注:P-值<0.05。
Note.P-value<0.05.

表5 几个通路相关的基因可变剪接事件
注:‘+’代表该类型可变剪接事件出现,‘-’代表该类型可变剪接事件未出现。
Note. ‘+’ represents the occurrence of alternative splicing event, ‘-’ represents the opposite.
3 讨论
Fkbp51在糖、脂代谢过程中所扮演的具体角色目前仍不清楚,其作用机制可能涉及多个方面,这是一个多基因、多途径、多步骤、多信号通路相互作用和相互影响的过程。因此,基于RNA测序比较Fkbp51 KO与WT小鼠肝脏表达谱,鉴定差异可变剪接并分析其功能,是揭示Fkbp51基因在糖、脂代谢中作用的一个重要突破口。
我们观察到,Fkbp51KO小鼠,高脂饲喂时,体重明显减轻,肝脏脂滴减少。在基础和高脂诱导条件下,氧气消耗量,二氧化碳产生量,呼吸交换速率及产热量均高于WT[7]。已有研究报道可变剪接因子和其他一些基因的敲除能够影响可变剪接[21]。因此我们想了解Fkbp51基因敲除是否能影响其他基因的可变剪接,进而影响Fkbp51表型相关的生物过程和代谢通路。
首先,通过分析数据共筛选出139个差异外显子跳跃。通过进一步的基因功能(GO)和KEGG代谢通路分析,我们发现这些差异基因主要参与脂肪衍生物相关的代谢过程,如脂肪酸,有机酸,类固醇和胆固醇的代谢过程。其中,PCTP是磷脂转移蛋白,具有脂质结合和磷脂酰胆碱转运活性;APOC1是载脂蛋白,在结合磷脂酰胆碱和抑制磷脂酶中发挥重要作用;BAAT是胆汁酸辅酶A,具有受体结合和棕榈酰辅酶A水解酶的活性,在胆汁分泌中扮演重要角色;Akr1c6编码酮类还原酶,利用NADH/NADPH催化醛与酮之间的转换;Apoc3是载脂蛋白,与脂质结合和胆固醇结合相关。Fdps编码法尼基焦磷酸合酶,可以催化合成香叶基焦磷酸酯和法尼基焦磷酸酯,而法尼基焦磷酸酯是胆固醇和甾醇生物合成过程中重要的中间物质。Pex5是过氧化物酶体因子5,与酶和蛋白的N端结合相关。Hgd是尿黑酸1,2双加氧酶,能催化尿黑酸的加氧。Ehhadh编码的蛋白是一个双功能酶,是过氧化物酶体β-氧化途径4种酶的一种。Gstz1是谷胱甘肽S-转移酶,具有谷胱甘肽过氧化物酶的活性。因此深入研究Fkbp51与这些基因的关系,对于探究Fkbp51在脂代谢中的作用具有重要意义。
其次,我们筛选出746个差异内含子保留,这些差异基因主要参与肌动蛋白细胞骨架组织方式的调控,氨基酸及其衍生物的代谢,与脂代谢和糖代谢相关性不大,但与类固醇的代谢相关。这说明和内含子保留相比,外显子跳跃在脂代谢和糖代谢中的作用更重要。内含子保留可能更多地参与翻译前转录过程的调控,如通过无义介导的mRNA降解,而不是通过翻译成蛋白质来发挥作用。
本文主要讨论了Fkbp51基因敲除对可变剪接的影响,对研究其在脂肪代谢中的作用提供一个新的思路。为了验证Fkbp51基因敲除造成的可变剪切的生物学意义,下一步我们将重点研究Ehhadh、Gsta3、Comt、Glo1、Acox1、Ahcy、Rpl17和Hc这些可变剪接体的变化,通过3‘或5’ RACE方法,对相应剪切体克隆,通过体外和体内实验进一步研究这些可变剪切体的生物学功能,以期有新的发现。
[1] Zannas AS, Wiechmann T, Gassen NC,etal. Gene-Stress-Epigenetic Regulation of FKBP5: Clinical and Translational Implications[J]. Neuropsychopharmacology,2016, 41(1): 261-274.
[2] Hubler TR, Scammell JG. Intronic hormone response elements mediate regulation of FKBP5 by progestins and glucocorticoids[J]. Cell Stress Chaperones,2004, 9(3): 243-252.
[3] U M, Shen L, Oshida T,etal. Identification of novel direct transcriptional targets of glucocorticoid receptor[J]. Leukemia,2004, 18(11): 1850-1856.
[4] Paakinaho V, Makkonen H, Jaaskelainen T,etal. Glucocorticoid receptor activates poised FKBP51 locus through long-distance interactions[J]. Mol Endocrinol,2010, 24(3): 511-525.
[5] Stechschulte LA, Hinds TJ, Khuder SS,etal. FKBP51 controls cellular adipogenesis through p38 kinase-mediated phosphorylation of GRalpha and PPARgamma[J]. Mol Endocrinol,2014, 28(8): 1265-1275.
[6] Toneatto J, Guber S, Charo NL,etal. Dynamic mitochondrial-nuclear redistribution of the immunophilin FKBP51 is regulated by the PKA signaling pathway to control gene expression during adipocyte differentiation[J]. J Cell Sci,2013, 126(Pt 23): 5357-5368.
[7] 张曼,邱彬,曹勇,等. 共伴侣蛋白FKBP51在高脂诱导肥胖中的作用[J]. 中国比较医学杂志,2015(07): 53-58.
[8] Schutt C, Nothiger R. Structure, function and evolution of sex-determining systems in Dipteran insects[J]. Development,2000, 127(4): 667-677.
[9] Black DL. Mechanisms of alternative pre-messenger RNA splicing[J]. Annu Rev Biochem,2003, 72: 291-336.
[10] Maniatis T, Tasic B. Alternative pre-mRNA splicing and proteome expansion in metazoans[J]. Nature,2002, 418(6894): 236-243.
[11] Carstens RP, Wagner EJ, Garcia-Blanco MA. An intronic splicing silencer causes skipping of the IIIb exon of fibroblast growth factor receptor 2 through involvement of polypyrimidine tract binding protein[J]. Mol Cell Biol,2000, 20(19): 7388-7400.
[12] Wang HY, Xu X, Ding JH,etal. SC35 plays a role in T cell development and alternative splicing of CD45[J]. Mol Cell,2001, 7(2): 331-342.
[13] Maquat LE. Nonsense-mediated mRNA decay: splicing, translation and mRNP dynamics[J]. Nat Rev Mol Cell Biol,2004, 5(2): 89-99.
[14] Caceres JF, Kornblihtt AR. Alternative splicing: multiple control mechanisms and involvement in human disease[J]. Trends Genet,2002, 18(4): 186-193.
[15] Wang ET, Sandberg R, Luo S,etal. Alternative isoform regulation in human tissue transcriptomes[J]. Nature,2008, 456(7221): 470-476.
[16] Pan Q, Shai O, Lee LJ,etal. Deep surveying of alternative splicing complexity in the human transcriptome by high-throughput sequencing[J]. Nat Genet,2008, 40(12): 1413-1415.
[17] Huang DW, Sherman BT, Lempicki RA. Systematic and integrative analysis of large gene lists using DAVID bioinformatics resources[J]. Nat Protoc,2009, 4(1): 44-57.
[18] Huang DW, Sherman BT, Lempicki RA. Bioinformatics enrichment tools: paths toward the comprehensive functional analysis of large gene lists[J]. Nucleic Acids Res,2009, 37(1): 1-13.
[19] Ogata H, Goto S, Sato K,etal. KEGG: Kyoto Encyclopedia of Genes and Genomes[J]. Nucleic Acids Res,1999, 27(1): 29-34.
[20] Skotheim RI, Nees M. Alternative splicing in cancer: noise, functional, or systematic?[J]. Int J Biochem Cell Biol,2007, 39(7-8): 1432-1449.
[21] Moroy T, Heyd F. The impact of alternative splicing in vivo: mouse models show the way[J]. RNA,2007, 13(8): 1155-1171.
Effects ofFkbp51 gene knockout on the alternative splicing of liver transcriptome in mice
ZHOU Zhi-qiang, YANG Zhi-wei*, YONG Wei-dong*
(Institute of Laboratory Animal Science,Chinese Academy of Medical Sciences (CAMS) & Comparative Medical Center,Peking Union Medical College (PUMC); Key Laboratory of Human Disease Comparative Medicine, Ministry of Health; Key Laboratory of Human Disease Animal Models, State Administration of Traditional Chinese Medicine, Beijing 100021, China)
Objective The purpose of this study is to understand the influence ofFkbp51 gene knockout on alternative splicing of mRNA in liver tissues. Methods mRNAs of liver from bothFkbp51 knockout(KO) and wild type(WT) mice were isolated. mRNA expression profiling was performed using RNA-seq reads. The mRNA reads produced from RNA-seq was analysed by TopHat for alternative splicing. Exon skipping and intron retetion were identified according to alignment analyses. Gene Ontology (GO) and Kyoto Encyclopedia of Genes and Genomes (KEGG) pathway enrichment were analyzed using online tools DAVID. All genes which had differently expressed alternative splicing between WT and KO were annotated using NCBI database. Results (1)Fkbp51 KO can introduce new mRNA alternative splicing; (2)Fkbp51 KO also cause mRNA alternative splicing expression change; (3) According to GO and KEGG analysis, it was found that the mRNA alternative splicing changes mainly enriched in fat metabolism, immune, bile acid secretion, and PPAR signaling pathway etc. (4) The genes which have different intron retetion events are mainly involved in regulation of actin cytoskeleton organization and amino acids metabolism. ConclusionsFkbp51 gene knockout can cause the change of mRNA alternative splicing, and thereby affect the metabolism of liver in mice.
FKBP51 knockout mice;Liver;RNA-seq;Alternative splicing;Intron retention;Exon skipping
艾滋病和病毒性肝炎传染病重大专项(2014ZX10004002);国家自然科学基金(81272273)。
周志强(1986-),男,硕士生,研究方向:基因与发育生物学。E-mail: 522845911@qq.com
雍伟东(1968-),男,研究方向:生殖与发育生物学。Email: wyong@cnilas.org; 杨志伟(1969-),男,研究方向:高血压。Email: zhw_yang@hotmail.com
R-33
A
1671-7856(2017) 05-0031-06
10.3969.j.issn.1671-7856. 2017.05.009
2016-11-15

