林下药材植物淋出物对太白杨枯落物分解及土壤酶活性的影响*
卢玉鹏许纪元张晓曦王博雅谢 博石 飞刘增文,4†
(1 西北农林科技大学林学院,陕西杨凌 712100)
(2 西北农林科技大学水土保持研究所,陕西杨凌 712100)
(3 西北农林科技大学资源环境学院,陕西杨凌 712100)
(4 农业部西北植物营养与农业环境重点实验室,陕西杨凌 712100)
林下药材植物淋出物对太白杨枯落物分解及土壤酶活性的影响*
卢玉鹏1许纪元2张晓曦2王博雅3谢 博3石 飞3刘增文3,4†
(1 西北农林科技大学林学院,陕西杨凌 712100)
(2 西北农林科技大学水土保持研究所,陕西杨凌 712100)
(3 西北农林科技大学资源环境学院,陕西杨凌 712100)
(4 农业部西北植物营养与农业环境重点实验室,陕西杨凌 712100)
林下种植药材植物是提高林地经济收入的有效途径,然而药材植物淋出物是否会对林木枯落物分解和土壤产生化感影响是必须考虑的重要问题,也是构建科学合理的林药复合模式的关键。以秦岭山区典型太白杨(Populus purdomii)林以及9种常见林下药材植物为对象,通过以药材植物茎叶淋出物(水浸提法)喷浇林木枯落物的分解模拟试验,研究了药材植物淋出物对太白杨枯落物分解、养分释放及土壤酶活性的潜在化感影响。结果表明:蒲公英(Taraxacum mongolicum)浸提液处理后太白杨枯落物分解周转期和半衰期分别延长了230%和29%,薄荷(Mentha haplocalyx)处理后分解周转期和半衰期分别延长了67%和23%,鱼腥草(Houttuynia cordata)处理后分解周转期和半衰期分别延长了120%和34%;且这3种药材植物对太白杨枯落物分解过程中养分(C、N、P、K、Cu、Zn 和Mn)释放和土壤酶(蔗糖酶、羧甲基纤维素酶、β-葡糖苷酶、脱氢酶、多酚氧化酶、蛋白酶和磷酸酶)活性均有显著抑制作用。因此,建议在太白杨林下应该尽量避免种植蒲公英、薄荷和鱼腥草,或者通过降低套种密度来减少药材植物的化感影响。
林药复合;枯落物分解;养分释放;土壤酶活性;化感
秦岭山区拥有丰富的森林和野生药材植物资源,由于人工纯林在生长后期或多代连栽情况下往往会出现土壤退化、更新困难、生产力降低等问题[1-2],利用林药共生原理,发展林药复合是一种有效的解决方法[3]。林下种植药材,不仅可以改善土壤环境、提高群落多样性,还能增加经济收益。然而,选择合适的药材植物种类是构建林药复合模式的基础,其中,林药种间关系是决定林药是否适宜复合间作的关键。因此,化感作用作为林药复合系统中种间关系之一,具有重要的研究意义。
有关化感研究发现,植物释放出的化感物质,会对土壤理化性质、土壤酶活性和微生物群落产生影响[4-6],而这些因素是影响林木枯落物分解的关键。在林药复合生态系统中,药材植物释放出的化感物质极有可能会通过影响这些因素,进而影响林木枯落物的分解过程。而林木枯落物是生态系统物质循环过程中的重要组成,对恢复土壤肥力、维持生态系统稳定性有重要作用[7-9],因此,研究林药复合系统中药材植物对林木枯落物分解过程的化感影响在研究林药种间关系中不可或缺。目前关于枯落物分解影响因素方面的研究,主要集中在枯落物基质质量、气候因素和混合分解等方面[10-12],而很少涉及化感问题。
太白杨(Populus purdomii)集中分布于陕西秦岭[13],速生期长且材质优良,是中低山区的主要造林树种,为此,本文以太白杨林为研究对象,通过当地9种常见的林下药材植物水浸提液喷浇枯落物的室内控制分解模拟试验,研究药材植物淋出物对太白杨枯落物分解及土壤的潜在化感影响,旨在为秦岭山区林药复合模式选择提供科学依据。
1材料与方法
1.1供试材料
研究区位于陕西秦岭山区周至县厚畛子林场镇安沟流域境内,地属秦岭中段北坡,暖温带湿润气候,海拔1 500~2 500 m,年均气温7.4℃,年均降水量900 mm,该区分布有丰富的天然和人工林植被及大量的药材植物资源,土壤属山地褐土。于2015年10月在研究区采集太白杨完整的当年枯落叶,自然风干剪碎成大小为1.5 cm左右的碎片。准确称量6.00 g试样装入规格为10 cm×20 cm、网眼孔径为0.5 mm的尼龙网袋中,总计150袋(共10个处理,每个处理15袋)。同时采集当地无林荒地的表层(0~10 cm)土壤,清除根系、石块等杂物,直接以鲜土过5 mm土壤筛后充分混合,适当风干(以便于实验过程中控制水分)备用。此外,在当地购买最新收获的9种林下药材植物蒲公英(Taraxacum mongolicum)、地丁(Corydalis bungeana)、薄荷(Mentha haplocalyx)、鱼腥草(Houttuynia cordata)、细辛(Asarum sieboldii)、金银花(Lonicera japonica)、荆芥(Nepetacataria)、绞股蓝(Gynostemma pentaphyllum)和夏枯草(Prunella vulgaris)茎叶样品,风干磨碎过2 mm筛。
1.2试验方法
为了模拟自然状况下的药材植物茎叶淋出物产生的影响,将不同药材植物茎叶样品,分别与蒸馏水配制成质量浓度为80 mg ml-1(即相当于8 g植物样品浸泡于100 ml蒸馏水)的浸提液(基于当地林下药材植物最大生物量和最大降雨量确定),浸泡48 h,经离心过滤后装入棕色瓶中,冰箱4℃低温冷藏待用。
分别称取2.85 kg的制备好的过筛土壤,装入20 cm×40 cm×20 cm规格的塑料培养钵中,将装有枯落物的分解袋5个分别斜插埋入土壤,保证分解袋与土壤均匀接触。9种药材植物茎叶水浸提液,加蒸馏水作对照,共10个处理,每个处理3个重复,共计30个培养钵。埋设完毕后,每个培养钵用喷雾器分别均匀喷浇相应的浸提液或蒸馏水150 ml(根据预先测定土壤田间持水量,此时土壤湿度为田间持水量的60%),统一调节土壤湿度。置于室温下(20~25℃)进行分解培养,每隔2周喷浇一次浸提液(浸提液体积按50 ml浸提液/1 kg土壤比例计算),保持土壤湿度基本不变(根据预实验结果,该比例喷浇浸提液土壤湿度基本不变),连续培养0.5 a终止。
1.3样品采集与分析
在分解试验过程中,分5次回收分解袋(回收时间分别为分解开始后第1、2、3、5和6个月时),每个处理从3个培养钵中分别回收1袋,作为3个重复;同时分3次回收土壤样本(回收时间分别为分解开始后第1、3和6个月时,每次500 g)。取出枯落叶分解残余物置于0.15 mm土壤筛中除去表面杂物,自然风干至恒重后,测定分解残留质量及养分含量。
C含量采用重铬酸钾容量法—外加热法测定;N、P、K采用H2SO4-H2O2混合液消煮后分别以AA3连续流动分析仪、紫外分光光度计(钒钼黄比色法)、火焰光度计测定;Cu、Zn、Mn采用干灰化、原子吸收光度计法测定。蔗糖酶和羧甲基纤维素酶活性采用3,5-二硝基水杨酸比色法测定;β-葡萄糖苷酶活性采用硝基酚比色法测定;脱氢酶采用三苯基四唑氯化物比色法测定;多酚氧化酶活性采用邻苯三酚比色法测定;蛋白酶活性采用茚三酮比色法测定;磷酸酶活性采用磷酸苯二钠比色法测定。同时,参照Takemura等[14]的方法对药材植物浸提液通过GC-MS进行定性测定。
1.4数据处理
枯落物分解速率采用SigmaPlot 12.5软件,依据改良的指数衰减模型R=ae-bt+ce-dt(式中,R为枯落物分解残余率,a、b、c和d为模型参数,t为分解进行时间)对同种处理枯落物残留量(换算为残余率)进行拟合,计算分解周转期(干物质分解95%的时间,T0.95)和分解半衰期(干物质分解50%的时间,T0.50)。同时,采用SPSS 20软件对不同处理进行单因素方差分析(one-way ANOVA)得出差异显著性,多重比较采用单因素方差分析(LSD)法(α=0.05);采用SigmaPlot 12.5软件绘图。
2 结 果
2.1 药材植物水浸提液对太白杨枯落叶分解速率
的影响
根据太白杨枯落叶分解过程中残余物的质量变化,建立分解模型并计算出枯落叶质量分解周转期(整体分解)和半衰期(前期分解)(表1)。其中,蒲公英浸提液处理枯落叶质量分解周转期和半衰期分别延长了230%和29%;薄荷浸提液处理枯落叶质量分解周转期和半衰期分别延长了67%和23%;鱼腥草浸提液处理枯落叶质量分解周转期和半衰期分别延长了120%和34%;金银花浸提液处理后半衰期延长了21%,周转期影响不显著;绞股蓝浸提液处理周转期延长了81%,半衰期影响不显著;夏枯草浸提液处理后周转期和半衰期分别延长了51%和43%;其他处理影响不显著。综上分析可见,蒲公英、薄荷、鱼腥草和夏枯草浸提液处理对太白杨枯落叶质量前期分解和后期分解均有抑制作用,金银花浸提液处理仅对枯落叶质量前期分解有抑制作用,绞股蓝浸提液处理仅对枯落叶质量后期分解有抑制作用。

表1 药材植物水浸提液对太白杨枯落叶分解速率的影响Table 1 Effects of water extracts of the medicinal plants on decomposition rate of P. purdomii litter
2.2 药材植物水浸提液对太白杨枯落叶分解过程中养分释放的影响
一般而言,在林木枯落叶分解过程中,残余物中不同养分的释放动态因自身性质、微生物活动和环境状况而存在很大差异。根据太白杨枯落叶分解过程中残余物中C、N、P、K、Cu、Zn和Mn养分储量(残留量)变化结果(图1),分解过程中残余物的C和K均呈递减的“释放”趋势,N和Zn呈“富集—释放”且逐步减少趋势,P和Cu均呈“释放—富集—释放”模式,Mn呈“释放—富集—释放”的波动变化模式。根据枯落物分解“由快到慢”的规律以及土壤酶活性测定时间,将本试验分为前期(前1个月)、中期(第2~3个月)和后期(第4~6个月)进行分析。结果表明:
蒲公英、薄荷、鱼腥草和细辛浸提液处理对太白杨枯落叶分解过程中养分释放抑制作用较强。该4种处理对N、K、Cu、Zn和Mn释放的影响规律基本一致,即在前期和后期抑制了N、Cu、Zn和Mn的释放,在中期和后期抑制了K的释放。而对C和P释放的影响规律则存在差异,其中,蒲公英在后期抑制了C的释放,在前期抑制了P的释放;薄荷在中期抑制了C的释放,在后期抑制了P的释放;鱼腥草在前期抑制了C的释放,在前期和后期抑制了P的释放;细辛在后期抑制了C的释放,在中期和后期抑制了P的释放。
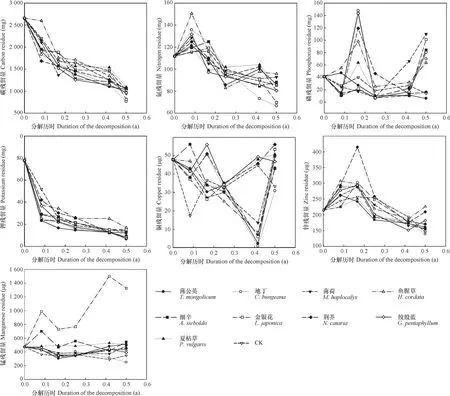
图1 药材植物水浸提液对太白杨枯落叶分解过程中养分释放(残留量)的影响Fig. 1 Effects of water extracts of medicinal plants on nutrient release(resedue)in P. purdomii litter decomposition
地丁、金银花、荆芥、绞股蓝和夏枯草浸提液处理对太白杨枯落叶分解过程中养分释放抑制作用相对较弱。该5种处理对K、Cu、Zn和Mn释放的影响规律较为一致,即在中期或后期抑制了K的释放,在前期或后期抑制了Cu、Zn和Mn的释放。而对C、N和P释放的影响规律则存在差异,其中,地丁在中期抑制了C的释放,在前期抑制了N的释放,在后期抑制了P的释放;金银花在中期抑制了C和N的释放,在中期和后期抑制了P的释放;荆芥在中期和后期抑制了C的释放,在前期抑制了N的释放,在中期抑制了P的释放;绞股蓝在后期抑制了C的释放,在前期抑制了N的释放,在中期和后期抑制了P的释放;夏枯草在中期和后期抑制了C 和P的释放,在前期和中期抑制了N的释放。
2.3 药材植物水浸提液对土壤酶活性的影响
根据太白杨枯落叶分解过程中土壤酶活性变化结果(图2),蔗糖酶、蛋白酶和磷酸酶在前期和中期活性较高,羧甲基纤维素酶和β-葡糖苷酶活性在中期和后期活性较高,多酚氧化酶和脱氢酶活性在前期和中期持续升高,中期达到峰值后降低但后期活性仍高于前期。
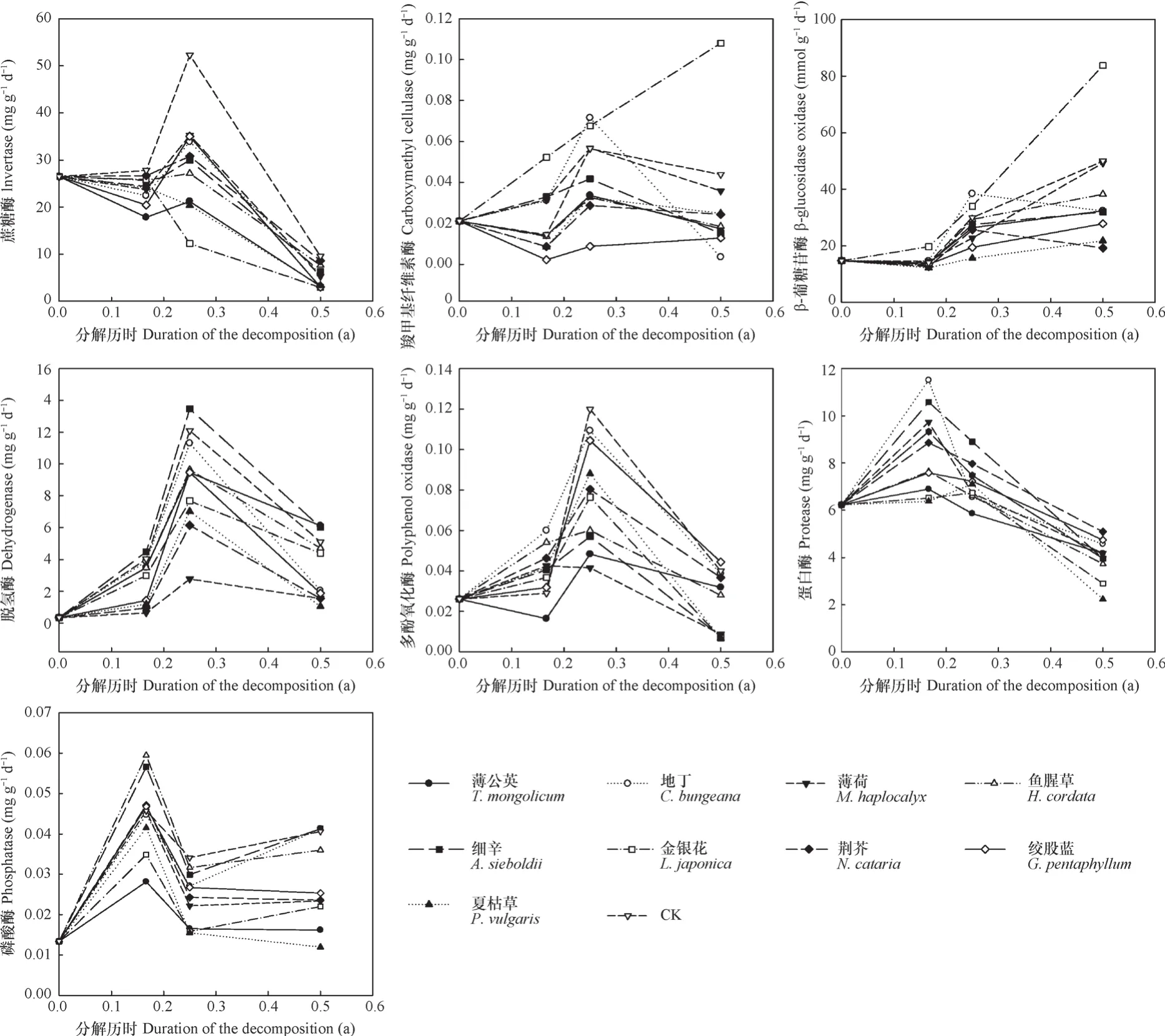
图2 药材植物水浸提液对土壤酶活性的影响Fig. 2 Effects of water extracts of the medicinal plants on soil enzyme activities
蒲公英、薄荷、鱼腥草和夏枯草浸提液处理对7种土壤酶活性均有显著抑制作用。该4种处理对蔗糖酶和多酚氧化酶活性影响规律基本一致,即在前期和中期降低了蔗糖酶活性,在中期和后期降低了多酚氧化酶活性(蒲公英在前期也降低了该酶活性)。而对其他5种酶活性影响则存在差异,其中,蒲公英在中期和后期降低了羧甲基纤维素酶活性,在后期降低了β-葡糖苷酶活性,在前期和中期降低了脱氢酶和蛋白酶活性,在前期、中期和后期降低了磷酸酶活性;薄荷在后期降低了羧甲基纤维素酶活性,在中期降低了β-葡糖苷酶和蛋白酶活性,在前期、中期和后期降低了脱氢酶活性,在中期和后期降低了磷酸酶活性;鱼腥草在中期和后期降低了羧甲基纤维素酶活性,在前期和后期降低了β-葡糖苷酶活性,在前期和中期降低了脱氢酶和蛋白酶活性,在后期降低了磷酸酶活性;夏枯草在前期、中期和后期降低了羧甲基纤维素酶、β-葡糖苷酶和脱氢酶活性,在前期和后期降低了蛋白酶活性,在中期和后期降低了磷酸酶活性。
地丁、细辛、金银花、荆芥和绞股蓝浸提液处理对土壤酶活性抑制作用相对较弱。该5种处理对蔗糖酶和磷酸酶活性影响规律较为一致,即在前期或中期降低了蔗糖酶活性,在中期或后期降低了磷酸酶活性。而对其他5种酶活性影响差异较大,其中,地丁在后期降低了羧甲基纤维素酶、β-葡糖苷酶和脱氢酶活性,在中期降低了蛋白酶活性,对多酚氧化酶活性影响不显著;细辛在中期和后期降低了羧甲基纤维素酶和多酚氧化酶活性,在后期降低了β-葡糖苷酶活性,在中期降低了磷酸酶活性,对脱氢酶和蛋白酶活性影响不显著;金银花在前期和中期降低了脱氢酶活性,在中期和后期降低了多酚氧化酶活性,在前期和后期降低了蛋白酶活性,对羧甲基纤维素酶和β-葡糖苷酶活性影响不显著;荆芥在前期、中期和后期降低了羧甲基纤维素酶和脱氢酶活性,在前期和后期降低了β-葡糖苷酶活性,在中期降低了多酚氧化酶活性,对蛋白酶活性影响不显著;绞股蓝在前期、中期和后期降低了羧甲基纤维素酶和脱氢酶活性,在中期和后期降低了β-葡糖苷酶活性,在前期降低了蛋白酶活性,对多酚氧化酶活性影响不显著。
2.4 药材植物化感物质特性
根据GC-MS测定结果,9种药材植物水浸提液中共含有34种化感物质,主要可分为5大类:第1类物质为萜类;第2类物质为苯甲酸衍生物;第3类物质为饱和脂肪酸;第4类为糖类;第5类为其他物质。具体为:蒲公英水浸提液中主要含有邻苯二甲酸二丁酯、烷烃、醇类和酮类等;地丁主要含有邻苯二甲酸正丁异辛酯、叶绿醇、β-谷甾醇和烷烃等;薄荷主要含有邻苯二甲酸二丁酯、薄荷醇、香芹酮和石竹素等;鱼腥草主要含有邻苯二甲酸二丁酯、烷烃和癸醚等;细辛主要含有邻苯二甲酸二丁酯、烷烃和十二烯基丁二酸酐等;金银花主要含有邻苯二甲酸正丁异辛酯、1,6-脱水吡喃葡萄糖和阿洛糖等;荆芥主要含有邻苯二甲酸二异辛酯、薄荷酮、β-谷甾醇、棕榈酸、烷烃和十四酸十四酯等;绞股蓝主要含有β-谷甾醇、角鲨烯、棕榈酸、十五烷酸、二十酸和醇类等;夏枯草主要含有邻苯二甲酸二丁酯、β-谷甾醇、角鲨烯、烷烃和醇类等。
3 讨 论
根据本研究结果,药材植物浸提液对太白杨枯落叶分解存在抑制作用,可能是浸提液中所含的化感物质影响了土壤中相关酶活性以及分解者数量种类等因素,进而影响了枯落叶分解速率和养分释放。其中,枯落物在不同分解阶段和不同养分释放过程中,分别承担主要作用的分解者和土壤酶种类不同[15-17],因此,不同种类分解者和土壤酶受外部条件影响可能会导致枯落物在不同分解阶段,分解速率和不同养分释放出现差异。同时,枯落物中养分含量又会影响土壤酶活性[18]。
3.1 药材植物浸提液对枯落叶分解速率的潜在化感影响
以蒲公英、薄荷、鱼腥草和夏枯草浸提液处理对太白杨枯落叶前期分解和后期分解均表现为抑制作用,原因可能是浸提液中所含的邻苯二甲酸二丁酯影响了土壤性质。研究表明,邻苯二甲酸二丁酯可以影响土壤呼吸和微生物量以及土壤酶活性,对枯落物分解中起主要作用的丝状真菌活性有显著抑制作用,对过氧化氢酶和酸性磷酸酶活性表现为显著抑制,对蔗糖酶和蛋白酶活性表现为低浓度促进而高浓度抑制[19-20]。本试验中,以该4种药材植物浸提液处理土壤中蔗糖酶、蛋白酶、磷酸酶、多酚氧化酶和脱氢酶活性均显著降低。其中,蔗糖酶、蛋白酶和磷酸酶主要在前期分解起主要作用,多酚氧化酶和脱氢酶主要在后期分解起主要作用[21],因此,相关酶类活性受到抑制可能是以该4种药材植物浸提液处理前期分解和后期分解受到抑制的原因。
以金银花浸提液处理对太白杨枯落叶前期分解表现为抑制作用,而整体分解无显著影响,说明该处理后期分解受到一定程度的促进作用。金银花浸提液中所含的邻苯二甲酸二甲酯对相关土壤酶和微生物的抑制作用可能是其前期分解受到抑制的原因,而其中所含的1,6-脱水吡喃葡萄糖和阿洛糖等糖类物质,为微生物提供了碳源,促进了微生物的生长和繁殖[22],可能是其后期分解受到一定促进作用的原因。
以绞股蓝浸提液处理对太白杨枯落叶整体分解表现为抑制作用,而前期分解无显著影响,说明该处理在后期分解受到一定的抑制作用。原因可能是该浸提液中所含的棕榈酸、十五烷酸、二十酸等物质对土壤性质的影响。研究表明,棕榈酸会降低土壤中真菌的数量和组成比例[23],而真菌是参与枯落物后期分解的主要分解者,后期难分解物质如木质素,只能被真菌分解。同时,十五烷酸和二十酸等有机酸进入土壤,使土壤pH降低,会使土壤中脱氢酶、脲酶、碱性磷酸酶和多酚氧化酶活性降低[24]。本研究中,在分解试验中后期,该处理羧甲基纤维素酶、β-葡糖苷酶、磷酸酶和脱氢酶均显著降低。因此,真菌和相关土壤酶类受到抑制可能是以绞股蓝浸提液处理太白杨枯落叶后期分解受到抑制的原因。
3.2 药材植物浸提液对太白杨枯落叶养分释放的潜在化感影响
枯落物C释放伴随整个分解过程,前期阶段主要体现在纤维素和半纤维素的分解过程,后期阶段主要体现在木质素的分解过程,与此相关的土壤酶主要有淀粉酶、蔗糖酶和纤维素酶等水解酶类以及脱氢酶、过氧化物酶和多酚氧化酶等氧化还原酶类[25-26]。本试验中,以蒲公英、薄荷、鱼腥草和细辛浸提液处理C释放受到显著抑制。同时,该4种处理蔗糖酶、羧甲基纤维素酶、β-葡糖苷酶、脱氢酶和多酚氧化酶活性均受到显著抑制。因此,该4种药材植物浸提液中所含物质可能通过对相关土壤酶类的抑制作用进而抑制了枯落叶分解过程中C的释放。
枯落物N、P含量变化是分解者根据自身需求和周围环境中N、P含量作用的结果,当枯落物中N、P含量不能满足土壤微生物的生理需求,微生物就会从土壤中吸收一定量的N、P从而使枯落物中N、P含量升高,出现“富集”现象[27],这个过程中发挥主要作用的土壤酶类是蛋白酶和磷酸酶。因此,枯落物分解过程中N、P释放受到抑制作用与微生物活动以及土壤中蛋白酶和磷酸酶活性有关。本试验中,多数处理枯落叶N、P含量变化与蛋白酶和磷酸酶活性变化一致,比如,蒲公英浸提液处理在分解试验前期N、P释放受到抑制作用,同时蛋白酶和磷酸酶活性也受到抑制作用。少数处理则不一致,比如,夏枯草浸提液处理在分解试验后期,蛋白酶活性受到抑制而N的释放并没有受到抑制。这可能是由于药材植物浸提液中含有N、P元素,外源施加N、P改变了土壤中微生物的生物量和组成,同时也对土壤酶活性产生影响[18,28]。
枯落物中K、Cu、Zn和Mn含量变化主要是通过淋溶作用和分解者降解有机质过程中的释放,其主要受到枯落物基质质量、环境条件、分解者、元素自身性质等因素的影响[29]。本实验中,药材植物浸提液处理对太白杨枯落叶中K和微量元素释放的影响,K含量变化大致表现为在试验分解前期受到促进而在中后期受到显著抑制,Cu、Zn和Mn含量变化大致表现为在分解实验前期和后期受到显著抑制,但不同药材植物浸提液处理间也存在差异。原因可能是,K、Cu、Zn和Mn含量变化主要由淋溶作用决定,但也会受到土壤环境条件影响。不同药材植物浸提液中所含的物质(如邻苯二甲酸二甲酯、棕榈酸等)影响了分解者的数量种类以及组成比例[20,23],进而导致了土壤环境条件的不同,造成了枯落叶中K、Cu、Zn和Mn含量变化的差异。
3.3 药材植物浸提液对太白杨枯落叶分解及土壤的综合潜在化感影响
综合本研究结果,根据药材植物浸提液对太白杨枯落叶分解及土壤的潜在化感影响程度,可将9种药材植物分为3类。第1类药材植物包括蒲公英、薄荷和鱼腥草,该3种药材植物浸提液处理对太白杨枯落叶分解速率、养分释放及土壤酶活性均有显著抑制作用。3种处理其药材植物浸提液中均含有邻苯二甲酸二丁酯,影响了土壤生物化学性质,7种土壤酶活性均受到显著抑制,因此枯落物分解速率和养分释放均受到显著抑制。第2类药材植物包括金银花、绞股蓝和夏枯草,该3药材植物浸提液处理对太白杨枯落叶分解速率、养分释放及土壤酶活性有有一定抑制作用,但较第1类药材植物程度较小。3种处理其药材植物浸提液中虽然含有对微生物有抑制作用的物质,但同时也含有一些对微生物生长或繁殖有利的物质(比如1,6-脱水吡喃葡萄糖可以为微生物提供了碳源,棕榈酸可以增加土壤中细菌和放线菌的数量和组成比例[22-23]等)。第3类药材植物包括地丁、细辛和荆芥,该3种药材植物浸提液处理对太白杨枯落叶分解速率影响不显著,对养分释放和土壤酶活性影响相对较小。而3种处理浸提液中也被检测出含有比如邻苯二甲酸二丁酯等对分解者和土壤酶活性有抑制作用的物质,且该3种处理部分土壤酶活性也受到一定抑制作用(比如蔗糖酶和磷酸酶活性在分解试验中期降低,羧甲基纤维素酶活性在分解试验后期降低)。一方面原因是枯落物分解并不是单一分解者或土壤酶单独作用的结果,且某一种细菌、真菌或土壤酶在不同分解阶段发挥的作用不同[30]。比如蔗糖酶在分解前期起着关键作用,而在分解后期的作用较小。另一方面原因可能是虽然该种药材植物浸提液中含有某种物质,但该物质浓度过低或者过高,发挥的作用发生了变化[31];也可能是浸提液中其他物质与该种物质的互相作用[32],使最终的化感作用结果不同。
4 结 论
林下药材植物通过雨水淋溶等途径释放出的化感物质,可能会对太白杨枯落叶的分解速率和养分释放及土壤酶活性等产生影响,不利于维持土壤肥力以及生态系统中物质循环并影响到生态系统稳定性。本研究表明,以蒲公英、薄荷和鱼腥草浸提液处理对太白杨枯落叶分解速率、养分释放以及土壤酶活性均有显著抑制作用,所以,建议在太白杨林下应尽量避免种植或者通过降低套种密度来减少药材植物的化感影响。
[1] 刘增文,段而军,付刚,等. 一个新概念:人工纯林土壤性质的极化. 土壤学报,2007,44(6):1119—1126
Liu Z W,Duan E J,Fu G,et al. A new concept:Soil polarization in planted pure forest(In Chinese). ActaPedologicaSinica,2007,44(6):1119—1126
[2] 刘增文,段而军,付刚,等. 秦岭北山几种典型人工纯林土壤性质极化问题研究. 土壤,2008,40(6):997—1001
Liu Z W,Duan E J,Fu G,et al. Soil polarizations of several typical artificial pure forests in North Mountain of Qinling(In Chinese).Soils,2008,40(6):997—1001
[3] 刘晓鹰,程颂. 林药人工复合生态系统的初步研究. 北京林业大学学报,1992,14(2):65—71
Liu X Y,Cheng S. A preliminary study on the artificial forest-medicinal plant complex ecosystem (In Chinese). Journal of BeijingForestryUniversity,1992,14(2):65—71
[4] Zhang J,Salahuddin,Ji L,et al. Effects of larch (Larix gmelinii)phenolic acids on manchurian ash (Fraxinus mandshurica)soil microbial community structure. Allelopathy Journal,2016,37(1):123—135
[5] Li M Q,Li S,Zhou X G,et al. Effects of cover crops on cucumber growth,soil microbial communities and soil phenolic content. Allelopathy Journal,2016,37 (2):161—174
[6] Qu X H,Wang J G. Effect of amendments with different phenolic acids on soil microbial biomass,activity,and community diversity.Applied Soil Ecology,2008,39 (2):172—179
[7] Berg B. Litter decomposition and organic matter turnover in northern forest soils. Forest Ecology and Management,2000,133(1):13—22
[8] Koukol O,Novák F,Hrabal R,et al. Saprotrophic fungi transform organic phosphorus from spruce needle litter Soil Biology & Biochemistry,2006,38(12):3372—3379
[9] Krivtsov V,Liddell K,Bezginova T,et al.Forest litter bacteria:Relationships with fungi,microfauna,and litter composition over a winter-spring period. Polish Journal of Ecology,2005,53(3):383—394
[10] Tian G,Brussaard L,Kang BT. Biological effects of plant residues with contrasting chemical compositions under humid tropical conditions:Effects on soil fauna. Soil Biology & Biochemistry,1993,25(6):731—737
[11] García‐Palacios P,Maestre F T,Kattge J,et al. Climate and litter quality differently modulate the effects of soil fauna on litter decomposition across biomes. Ecology Letters,2013,16(8):1045—1053
[12] Hättenschwiler S,Tiunov A V,Scheu S. Biodiversity and litter decomposition in terrestrial ecosystems. Annual Review of Ecology,Evolution,and Systematics,2005,36:191—218
[13] 胡有宁,王得祥,黄青平,等.陕西周至老县城自然保护区天然林物种组成及主要种群生态位. 西北植物学报,2012,32(6):1238—1244
Hu Y N,Wang D X,Huang Q P,et al. Species composition and population niche of natural forests in Zhouzhi Laoxiancheng Natural Reserve of Shaanxi(In Chinese). ActaBotanicaBoreali-OccidentaliaSinica,2012,32(6):1238—1244
[14] Takemura T,Kamo T,Sakuno E,et al. Discovery of coumarin as the predominant allelochemical in Gliricidia sepium. Journal of TropicalForest Science,2013,25(2):268—272
[15] Kubartová A,Ranger J,Berthelin J,et al. Diversity and decomposing ability of saprophytic fungi from temperate forest litter. Microbial Ecology,2009,58 (1):98—107
[16] McTiernan K B,Coûteaux M M,Berg B,et al. Changes in chemical composition of Pinus sylvestris needle litter during decomposition along a European coniferous forest climatic transect. Soil Biology & Biochemistry,2003,35(6):801—812
[17] Fioretto A,Papa S,Curcio E,et al. Enzyme dynamics on decomposing leaf litter of Cistus incanus and Myrtus communis in a Mediterranean ecosystem. Soil Biology & Biochemistry,2000,32(13):1847—1855
[18] Sinsabaugh R L,Carreiro M M,Repert D A. Allocation of extracellular enzymatic activity in relation to litter composition,N deposition,and mass loss. Biogeochemistry,2002,60(1):1—24
[19] Roy R N,Laskar S,Sen S K. Dibutyl phthalate,the bioactive compound produced by Streptomyces albidoflavus 321.2. Microbiological Research,2006,161(2):121—126
[20] 王志刚,赵晓松,徐伟慧,等. 黑土微生物量和酶活性对邻苯二甲酸二丁酯污染的响应. 生态毒理学报,2015,10(6):199—205
Wang Z G,Zhao X S,Xu W H,et al. Response ofmicrobial biomass and enzyme activities in black soil to di-n-butyl phthalate contamination(In Chinese).Asian Journal of Ecotoxicology,2015,10(6):199—205
[21] Sinsabaugh R L,Carreiro M M,Alvarez S. Enzyme and microbial dynamics of litter decomposition//Burns R G, Dick R P. Enzymes in the environment:Activity,ecology,and applications. New York:Marcel Dekker Inc,2002:249—265
[22] Singh G,Mukerji K G. Root exudates as determinant of rhizospheric microbial biodiversity//Mukerji K G,Manoharachary C,Singh J. Microbial activity in the rhizoshere. New Delhi,India:Springer BerlinHeidelberg,2006:39—53
[23] 周宝利,韩琳,尹玉玲,等. 化感物质棕榈酸对茄子根际土壤微生物组成及微生物量的影响. 沈阳农业大学学报,2010,41(3):275—278
Zhou B L,Han L,Yin Y L,et al. Effects of allelochemicalshexadecanoic acid on soil microbial composition and biomass in rhizosphere of eggplant (In Chinese). Journal of Shenyang Agricultural University,2010,41(3):275—278
[24] 王涵,王果,黄颖颖,等. pH变化对酸性土壤酶活性的影响. 生态环境,2008,17(6):2401—2406
Wang H,Wang G,Huang Y Y,et al. The effects of pH change on the activities of enzymes in an acid soil (In Chinese). Ecology and Environment,2008,17 (6):2401—2406
[25] Fioretto A,Papa S,Pellegrino A,et al. Decomposition dynamics of Myrtus communis and Quercus ilex leaf litter:Mass loss,microbial activity and quality change. Applied Soil Ecology,2007,36(1):32—40
[26] 严海元,辜夕容,申鸿. 森林凋落物的微生物分解. 生态学杂志,2010,29(9):1827—1835
Yan H Y,Gu X R,Shen H. Microbial decomposition of forest litter(In Chinese). Chinese Journal of Ecology,2010,29(9):1827—1835
[27] 胡霞,吴宁,吴彦,等.川西高原季节性雪被覆盖对窄叶鲜卑花凋落物分解和养分动态的影响. 应用生态学报,2012,23(5):1226—1232
Hu X,Wu N,Wu Y,et al. Effects of snow cover on the decomposition and nutrient dynamics of Sibiraea angustata leaf litter in western Sichuan Plateau,Southwest China(In Chinese). Chinese Journal of Applied Ecology,2012,23(5):1226—1232
[28] Manzoni S,Trofymow JA,Jackson RB,et al. Stoichiometric controls on carbon,nitrogen,and phosphorus dynamics in decomposing litter.Ecological Monographs,2010,80(1):89—106
[29] Aerts R,Wallén B,Malmer N,et al. Nutritional constraints on Sphagnum-growth and potential decay in northern peatlands. Journal of Ecology,2001,89 (2):292—299
[30] Vitousek P M. Nutrient cycling and limitation:Hawai'i as a model system. New Jersey:PrincetonUniversity Press,2004
[31] 张瑞清,孙振钧,王冲,等.西双版纳热带雨林凋落叶分解的生态过程.Ⅲ.酶活性动态. 植物生态学报,2008,32(3):622—631
Zhang R Q,Sun Z J,Wang C,et al. Ecological process of leaf litter decomposition in tropical rainforest in Xishuangbanna,SW China. Ⅲ. Enzyme dynamics (In Chinese).Journal of Plant Ecology,2008,32 (3):622—631
[32] Koricheva J. Interpreting phenotypic variation in plant allelochemistry:Problems with the use of concentrations. Oecologia,1999,119(4):467—473
[33] Olofsdotter M,Rebulanan M,Madrid A,et al. Why phenolic acids are unlikely primary allelochemicals in rice. Journal of Chemical Ecology,2002,28(1):229—242
Effects of Leachates from Understory Medicinal Plants on Decomposition of Populus Purdomii Litters and Soil Enzyme Activity
LU Yupeng1XU Jiyuan2ZHANG Xiaoxi2WANG Boya3XIE Bo3SHI Fei3LIU Zengwen3,4†
(1 College of Forestry,NorthwestA&FUniversity,Yangling,Shaanxi 712100,China)
(2 Institute of Soil and Water Conservation,NorthwestA&FUniversity,Yangling,Shaanxi 712100,China)
(3 College of Natural Resources and Environment,NorthwestA&FUniversity,Yangling,Shaanxi 712100,China)
(4 Key Lab for Agricultural Resources and Environmental Remediation in Loess Plateau of Agriculture Ministry of China,Yangling,Shaanxi 712100,China)
【Objective】Planting medicinal plants is an effective way to improve economic benefit offorest lands. However,it is important to take into account whether leachates from medicinal plants would have allelopathic effects on decomposition of forests litter and soil,and it is also the key to selection of medicinal plant species to build a scientific and reasonable compound system of forest-medicinal plants.【Method】In this paper,a Populus purdomii forest typical of the Qinling Mountains and nine species of medicinal plants(Taraxacum mongolicum,Corydalis bungeana,Mentha haplocalyx,Houttuynia cordata,Asarum sieboldii,Lonicera japonica,Nepeta cataria,Gynostemma pentaphyllum and Prunella vulgaris)common in the area were cited as objects in the study,a simulation experiment was carried out on litter decomposition by spraying leachate in water-extraction solution from stems and leaves of the medicinal plants,to study effects of the leachates on litter decomposition,nutrient release and soil enzyme activity. The sampling area in this experiment is the Houzhenzi Forest Farm of Zhouzhi County in the Qinling Mountains of Shaanxi. The decomposing bag method was used in the indoors litter decomposition experiment with constant temperature and humidity and the experiment lasted for six months. During the experiment,leachate from the litter of medicinal plants was sprayed once every two weeks,and the decomposing bags were retrieved five times (in the first,second,third,fifth and sixth month after the start of the decomposition experiment),soil samples collected three times(in the first,third and sixth month after the start of the decomposition experiment),to determine decomposition rate,nutrient release and soil enzyme activity. At the same time,GC-MS was used to analyze chemical substances in the medicinal plants leachate.【Result】Turnover period and half-life of the decomposition of P. purdomii litter was extended by 230% and 29%,respectively,in the treatment using T. mongolicum leachate,by 67% and 23% in the treatment using M. haplocalyx leachate,and by 120% and 34% in the treatment using H. cordata leachate. And leachate from all these three species of medicinal plants displayed significant inhibitory effects on nutrient release and soil enzyme activities during decomposition of P. purdomii litter. In order to facilitate the analysis,the experiment was divided into three phases;i.e. early(first month),middle(second to third months)and later(fourth to sixth months)phases. The inhibitory effects were significant on the release of nitrogen,copper,zinc and manganese in the early and late phases in all the three treatments,on the release of potassium in the middle and late phases,on the release of carbon in the early,middle or late phases,and on the release of phosphorus in the early or late phases. And the inhibitory effects were also observed on the activities of invertase,dehydrogenase and protease in the early or middle phase,on the activities of carboxymethylcellulase,polyphenol oxidase and phosphatase in the middle or late phase,and on the activity of β-glucosidase the early,middle or late phases.【Conclusion】The allelopathic substances released by the understory medicinal plants through rain or other ways,may affect decomposition of forest litter,nutrient release,soil enzyme activity,which hinders the maintenance of soil fertility and material recycling in the ecosystem and affects stability of the ecosystem. Therefore,it is suggested that T. mongolicum,M. haplocalyx and H. cordata should not be planted as understory in P. purdomii forests,or interplanting density of these plants should be kept lower to reduce the allelopathic effects.
Compound forest-medicinal plant system;Litter decomposition;Nutrient release;Soil enzyme activity;Allelopathy
S714.2
A
(责任编辑:卢 萍)
* 国家自然科学基金项目(30471376)和西北农林科技大学大学生创新实验计划项目(2015年)资助 Supported by the National Natural Science Foundation(No. 30471376)and the College Students Innovation Experiment Project of Northwest A&F University(2015)
† 通讯作者 Corresponding author,E-mail:zengwenliu2003@aliyun.com
卢玉鹏(1992—),男,山东泰安人,硕士研究生,主要从事森林生态研究。E-mail:luyp1992@163.com
2016-10-27;
2017-01-03;优先数字出版日期(www.cnki.net):2017-01-17
10.11766/trxb201610270522

