基于高通量测序的两种植被恢复类型根际土壤细菌多样性研究*
戴雅婷闫志坚解继红吴洪新徐林波侯向阳†高 丽崔艳伟
(1 中国农业科学院草原研究所,呼和浩特 010010)
(2 农业部草地生态与修复治理重点实验室,呼和浩特 010010)
基于高通量测序的两种植被恢复类型根际土壤细菌多样性研究*
戴雅婷1,2闫志坚1解继红1吴洪新1徐林波1侯向阳1,2†高 丽1,2崔艳伟1
(1 中国农业科学院草原研究所,呼和浩特 010010)
(2 农业部草地生态与修复治理重点实验室,呼和浩特 010010)
为研究库布齐沙地生态恢复过程中不同植被恢复类型土壤微生物细菌群落结构、多样性的变化特征,以流动沙地为对照,运用高通量测序技术,对自然恢复的油蒿群落、人工种植的中间锦鸡儿群落根际和非根际土壤细菌多样性进行了研究,并分析了土壤理化性质对其分布的影响。结果表明:(1)与流沙对照相比,两种植被恢复类型对细菌多样性产生了正效应,细菌群落丰度、多样性和均匀度明显增加。其中,自然恢复的油蒿群落土壤细菌丰度高于人工种植的中间锦鸡儿群落;(2)变形菌门、酸杆菌门和放线菌门为研究区土壤中的优势细菌类群,其中变形菌门在各样地丰度比例最高,变形菌的4个亚群变化趋势一致,α-变形菌相对含量在油蒿和中间锦鸡儿群落根际土壤中明显增加,尤其是自然恢复的油蒿群落根际土壤中α-变形菌得到了很好的恢复;(3)土壤有机质、全氮、速效氮、速效钾含量和土壤含水量是影响土壤细菌群落丰度和多样性的主要土壤因子,典型相关分析表明土壤有机质、全氮、全钾、速效钾、速效氮含量对于研究区土壤细菌群落遗传多样性的变化起着重要作用。
根际土壤;细菌群落多样性;高通量测序
土壤微生物参与碳、氮循环,有机化合物分解以及能量传输、运送等多种过程的维护和调节[1-2],是土壤生态系统中最具有生命活力的重要组成部分。微生物群落多样性与土壤生态系统的结构、功能密切相关,在维持土壤肥力和土壤生态平衡中发挥着重要作用[3],其结构和功能对于周围环境条件特别敏感,是土壤变化的重要指示之一[4]。细菌是土壤微生物中数量最多的类群,通常占土壤微生物的70%~90%,具有最为丰富的遗传多样性[5],能有效促进有机质分解、营养物质的释放[6],参与碳、氮等物质循环过程,维持了生态系统能量流动和物质循环[7]。
库布齐沙地是我国西北沙漠与东部农业的生态屏障,由于自然和人为原因,该地区土壤沙化和荒漠化问题严重,已成为退化生态系统恢复与重建的重点区域,植被恢复与重建是荒漠化综合防治最主要途径[8]。在库布齐沙地植被恢复过程中形成了自然恢复状态下的植被群落和人工种植的植被群落类型,其中半灌木油蒿是当地分布最广泛的自然植被固沙群落,灌木中间锦鸡儿是当地广泛种植的沙地建群种,两种植物均是多年来被广泛用于当地固沙的植被类型。大量研究表明,流动沙地建立植物群落后,土壤微生物数量和活性显著提高[9],根际土壤微生物以其独特的环境和性质在改善沙地土壤环境、促进植物根系生长、参与物质能量流动等方面发挥着重要作用[10]。不同植被恢复方式[11]、固沙植物[12]、土壤类型[13]对土壤微生物群落的影响不同。微生物种类及多寡是土壤质量的重要指标,它们对环境极为敏感,又是恢复环境的先锋,提高了生态系统的缓冲能力,微生物指标已经用来评价退化生态系统中生物群系与恢复功能之间的联系并能为退化土壤恢复提供有用信息[14]。笔者前期对油蒿和中间锦鸡儿群落根际和非根际土壤微生物数量、土壤理化性质等方面进行了研究,发现植被恢复后土壤理化性质、微生物数量均有不同程度的提高,油蒿群落对土壤的改善作用优于中间锦鸡儿群落,但对两种植被恢复类型下土壤细菌群落结构、多样性的具体变化情况尚不明确。目前针对固沙植被根际土壤细菌群落的组成和多样性的报道较少,且主要集中在可培养微生物、PCRDGGE分析等方面,传统DNA测序方法耗时长且信息量少,制约着人们对土壤微生物群落深入研究,高通量测序技术具有高准确性、高灵敏度等优势。为此,本研究运用高通量测序技术,以库布齐流动沙地为对照,研究自然恢复的油蒿群落、人工种植的中间锦鸡儿群落根际和非根际土壤细菌多样性,并分析土壤理化性质对其分布的影响,为构建库布齐沙地生态系统恢复技术体系提供科学参考和理论支持,并为库布齐沙地相关微生物资源的研究、保护和开发利用提供一定的基础资料。
1 材料与方法
1.1 研究区概况
本试验以农业部鄂尔多斯沙地草原生态环境重点野外科学观测试验站为研究地点。该区域位于内蒙古鄂尔多斯市达拉特旗黄河南岸的库布齐沙带东段,地处库布齐沙漠和沿河平原的交界处,气候干旱,风沙较大,形成典型的荒漠草原干旱、半干旱的风沙地貌。该区域属于温带大陆性气候,年平均气温6.1 ℃,最低温度为-32.3 ℃,最高温度为38.3 ℃,年降水量310 mm左右,而且均集中在6、7、8三个月中,夏季降水变率在33%~43%之间,地表蒸发强烈,全年蒸发量为2 130 mm,湿润度为0.4,无霜期156 d。该区域植被在长期的人类活动影响下,形成天然灌丛、人工灌丛、人工草地等多种植被群落类型,主要为耐风蚀与干旱的灌木中间锦鸡儿(Caragana intermedia)、油蒿(Artemisia ordosica)、羊柴(Hedysarum mongolicum)、沙柳(Salix psammophila)、白沙蒿(Artemisia sphaerocephala)等。
1.2 试验设计与样品采集
本试验在研究区选择两种不同的植被恢复类型:油蒿群落(Artemisia ordosica)、中间锦鸡儿群落(Caragana intermedia),并以流动沙地(LS)作对照(表1)。其中,油蒿群落(YH)是研究区固定沙地自然恢复19年的植被群落;中间锦鸡儿群落( NT )是研究区人工种植19年后形成的植被群落。文中以YH_R表示油蒿根际,NT_R表示中间锦鸡儿根际,YH_S表示油蒿非根际,NT_ S表示中间锦鸡儿非根际。土壤样品于2014年8月采集,每个植被群落选择3个样地,在各样地中分散设置3个区域为采样区,每个采样区按蛇型选取9株植物,采集0~20 cm土层根际、非根际土壤,多点混合,然后再将每个样地的3个采样区土壤样品混合。根际、非根际土壤采集方法参考Riley和Barber[15]的抖落法,附着植物根系周围1 cm的土壤作为根际土壤,采集离植物根系20 cm以外的土壤作为非根际土壤。将土样分为两部分,一部分用于土壤理化性质测定,另一部分装入无菌袋中包扎密封,低温条件下带回实验室,于-70 ℃保存用于DNA提取。各样地土壤理化性质见表2。
1.3 测定方法
土壤理化性质测定:土壤含水量采用烘干法,pH采用1∶2.5土水比浸提酸度计法,有机质采用重铬酸钾外加热容量法,全氮采用凯氏定氮法,速效氮采用碱解蒸馏法,全磷采用NaOH熔融―钼锑抗比色法,有效磷采用Olsen法,速效钾采用乙酸铵浸提―火焰光度计法测定。
细菌总DNA的提取:采用OMEGA土壤提取试剂盒提取细菌总DNA,用Qubit2.0检测DNA浓度,琼脂糖凝胶检测DNA完整性。每个样品3个重复,将同一样品的土壤DNA混合,作为每份土壤样品的总DNA。细菌的PCR扩增采用的是16S rRNA 基因中的V3-V4高变区通用引物341F(CCTACGGGNGGCWGCA)和805R(GACTACHVGGGTATCTAATCC)。扩增条件设置:94 ℃预变性3 min,94 ℃变性30 s,45 ℃退火20 s,65 ℃延伸30 s,5个循环;94 ℃延伸20 s,55 ℃退火20 s,72 ℃延伸30 s,20个循环。进一步采用匹配Illumina测序接头和标签引物扩增,采用生工琼脂糖回收试剂盒(cat:SK8131)对DNA进行回收。回收产物用Qubit2.0定量,根据测得的DNA浓度,将所有样品按照1∶1的比例进行混合,该混合样品可用于后续的测序,从而省去建库过程。
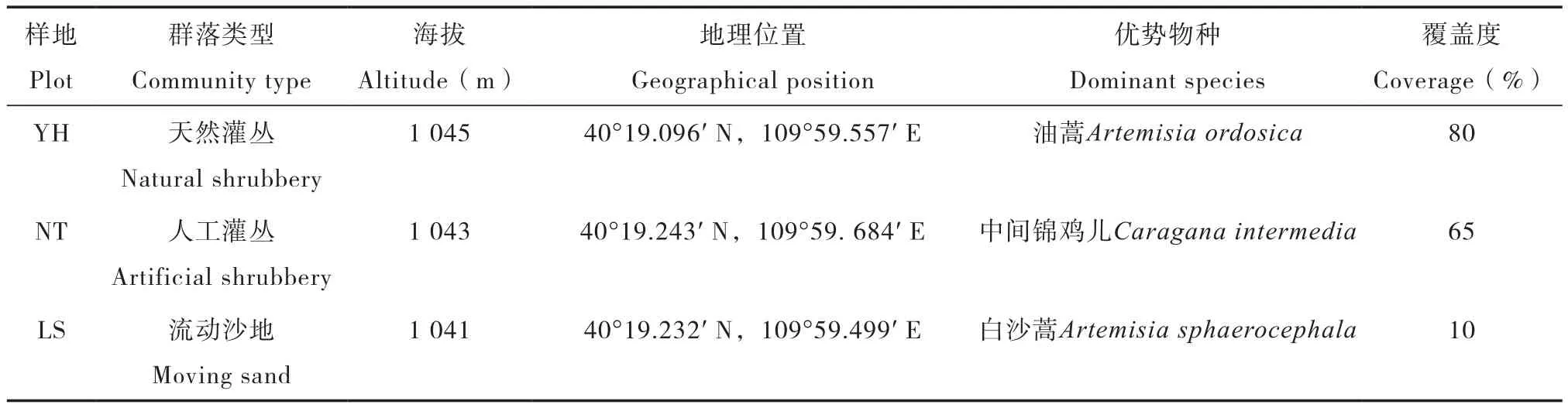
表1 研究样地基本情况Table 1 Basic information of the plots under study
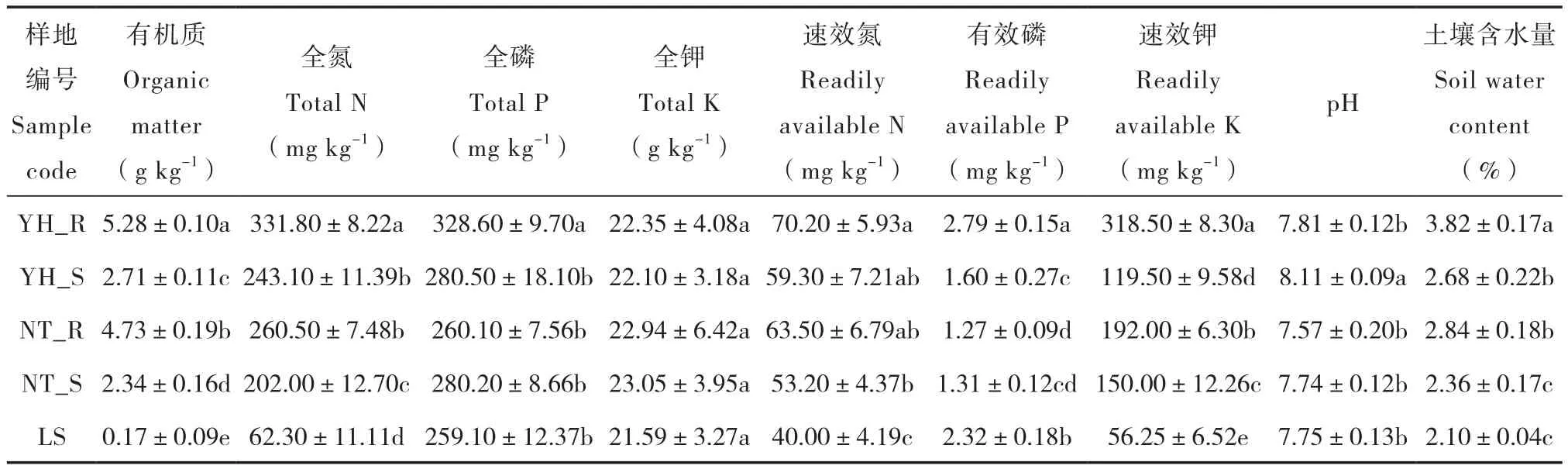
表2 不同样地土壤的基本理化性质Table 2 Physico-chemical properties of the soils in the plots
16S rRNA V3-V4区高通量测序:16S rRNA基因的PCR产物由上海生工生物工程技术服务有限公司完成测序,测序仪器为Illlumina 公司Miseq,测序所得结果,采用prinseq软件对reads1、reads2的3端进行质控,截掉质量低的数据,以提高后续序列融合比率。通过Flash 软件融合双末端序列,使其形成一条序列。采用prinseq软件对各个样品进行去引物序列、短片段、低复杂度序列、低质量序列。
1.4 数据分析
运用uclust软件对序列进行聚类,序列相似性定为0.97,操作分类单元被认为可能接近于属。采用软件RDP classifier进行物种分类。采用mothur软件进行Alpha多样性分析和构建venn图。
采用SPSS 18.0对土壤理化数据进行方差分析、多重比较,使用R语言分析微生物多样性数据,运用Canoco软件分析环境因子对微生物群落结构的影响。
2 结 果
2.1 两种植被恢复类型根际与非根际土壤细菌群落结构丰度与多样性
通过对V3-V4区测序,各样地土壤样品共获得有效序列57 314条,平均长度为427 bp,测序覆盖率除YH_R、NT_R样品在65%~68%,其他样品覆盖率均在78%以上。由此可以得出在97%相似度下的聚类也没有全部调查出土壤细菌遗传多样性,尤其是油蒿和中间锦鸡儿群落根际土壤实际细菌遗传多样性比测序获得的数据更丰富。但是,基于这样的测序深度基本能够反映该区域细菌群落的种类和结构,可以定量比较整个群落组成和多样性的相对差异[16]。
如表3所示,Chao1指数、Shannon指数由高到低的顺序均为:YH_R>NT_R>YH_S>NT_S>LS,Chao1指数在各样地间差异显著,Shannon指数在两种植被恢复类型根际、非根际土壤间无显著差异;ACE指数由高到低排列的结果为:YH_ R>NT_R>NT_S>YH_S>LS,各样地间差异显著。可以看出,LS的Chao1指数、Shannon指数和ACE指数均为最低,显著低于其他样地。YH_R的Chao1指数和ACE指数为最高,NT_R次之。YH_ R与NT_R、YH_S与NT_S的Shannon指数无显著差异。结果表明,与流沙对照相比,两种植被恢复类型土壤细菌群落丰度、多样性和均匀度均明显增加,其中,油蒿根际土壤细菌群落丰度和均匀度显著高于中间锦鸡儿根际,在非根际土壤中,细菌群落丰度表现为油蒿高于中间锦鸡儿,细菌群落均匀度表现为中间锦鸡儿高于油蒿。在细菌群落多样性方面两种植被恢复类型根际、非根际土壤间没有明显差异。
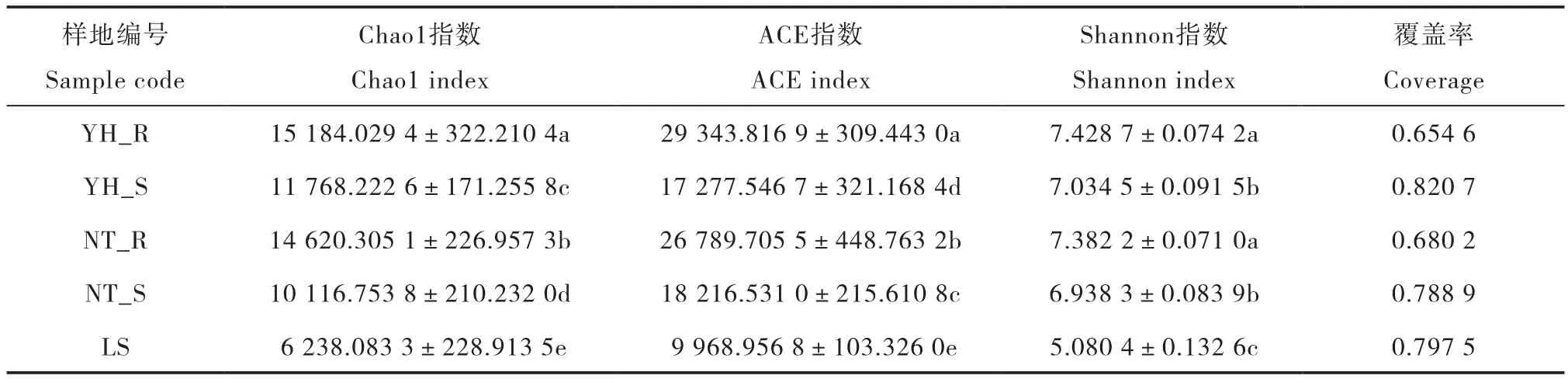
表3 土壤样品细菌多样性与丰度Table 3 Diversity and richness of soil bacteria in soil sample
2.2 两种植被恢复类型根际与非根际土壤细菌类群的相关性
为分析不同样地土壤细菌群落组成的差异,以各样地土壤样品分布的OTU数为依据,用mothur软件对各样地土壤细菌菌种的多样性进行相关分析,并构建韦恩图(图1)。从不同样地土壤细菌种类多样性的相互关系看,各样地土壤样品的共有OTU比例仅为10.6%~14.5%,两种植被恢复类型土壤细菌菌群中有79.7%~84.4%的OUT在LS土壤中没有出现。分析两种植被恢复类型土壤样品相关性,发现YH_R有66%的OTU在其他样品中没有出现,NT_R这一数值为63.6%,YH_S、NT_S这一数值分别为54.3%、57.2%。同一种植被类型内,YH_R、NT_R分别有68.6%、66.8%的OTU与其非根际土壤无关。根据这些数值推断,各样地土壤细菌菌种多样性差异比较明显,尤其是两种植被恢复类型土壤细菌菌种多样性与流沙对照差异较为明显。两种植
被恢复类型根际和非根际间土壤细菌菌群的OTU具有一定的相似性,但总体表现为差异显著。其中,根际土壤细菌种类与其他环境差异更明显。结果表明植被恢复后,土壤细菌菌种的多样性明显改变,尤其是根际土壤。两种植被恢复类型根际和非根际间土壤细菌菌群有一定的相似性,但总体表现为差异显著。
2.3 两种植被恢复类型根际与非根际土壤细菌类群
在门分类水平上,各样地土壤细菌主要包含9个类群(相对丰度>1%),分别是变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、芽单胞菌门(Gemmatimonadetes)、浮霉菌门(Planctomycetes)、疣微菌门(Verrucomicrobia)、厚壁菌门(Firmicutes)、绿弯菌门(Chloroflexi),占据约88.67%~94.19%。还含有硝化螺旋菌门(Nitrospirae)、侯选门TM7(Candidate division TM7)、侯选门OD1(Candidate division OD1)、装甲菌门(Armatimonadetes)、衣原体门(Chlamydiae)、绿菌门(Chlorobi)等,相对丰度较低(相对丰度<1%)(图2)。此外,各样品中还有3.96%~8.19%的菌,依据目前分类学研究无法划分到任何菌门中。
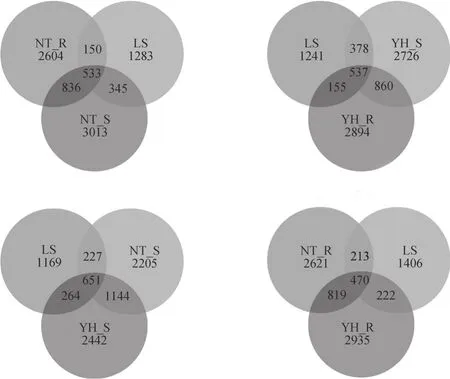
图1 各样地土壤细菌OTUs venn图Fig. 1 OTUs venn of soil bacteria in the soil samples from different plots
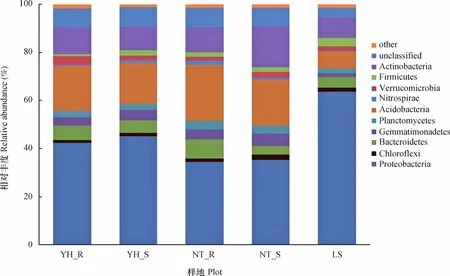
图2 各样地细菌群落在门水平上的组成和相对丰度Fig. 2 Composition at the phylum level and relative abundance of the bacterial communities in the soil samples from different plots
各样地土壤细菌的优势菌群为变形菌门、酸杆菌门和放线菌门。变形菌门在土壤样品中的丰度最高,其中丰度比例最高的为LS,相对含量为63.69%,其次为YH_R(42.35%)和YH_S (45.08%),相对含量较少的为NT_R(34.52%)和NT_S(35.23%)。可以看出,随着植被恢复,两种植被恢复类型土壤中变形菌相对含量明显减少,同时伴随着其他微生物类群相对丰度呈不同程度增加趋势。变形菌的4个亚群变化趋势一致,与流沙对照相比,两种植被恢复类型土壤α-变形菌和δ-变形菌相对含量呈增加趋势(图3),尤其是油蒿根际土壤中α-变形菌相对含量增加了106.46%,中间锦鸡儿根际土壤中α-变形菌增加了70.60%。两种植被恢复类型β-变形菌和γ-变形菌相对含量呈减少趋势,尤其是γ-变形菌从LS样地相对含量的46.53%下降至11.08%~27.41%。油蒿和中间锦鸡儿根际土壤中变形菌的4个亚群分布关系均为α->γ->β->δ-变形菌,而两种植被非根际、流沙对照土壤则为γ->α->β->δ-变形菌。
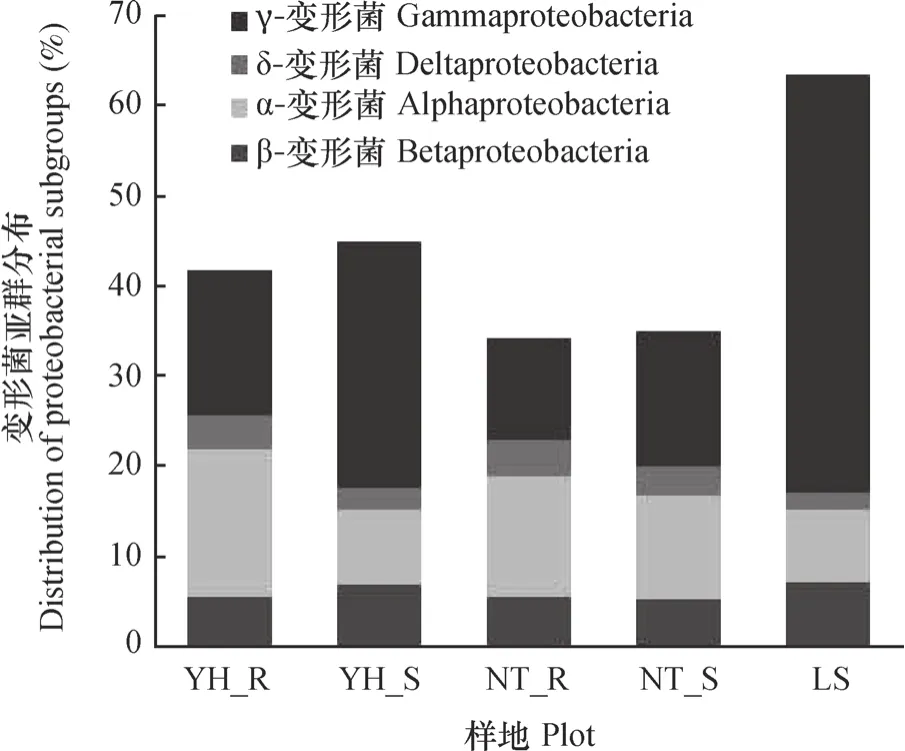
图3 各样品中变形菌亚群所占比例Fig. 3 Proportions of proteobacteria subgroups in the soil samples from different plots
酸杆菌门在样品中的丰度占有较大比例,丰度比例最高的为NT_R,相对含量为23.39%,NT_S、YH_R、YH_S相对含量分别为18.88%、18.76%、17.15%,LS相对含量最低,仅为6.99%。表明随着植被恢复,酸杆菌门明显增加,尤其是中间锦鸡儿土壤环境更有利于酸杆菌门生长,其分布与土壤pH、有机碳、全氮、碳氮比、磷、土壤水分、温度等有关[17];放线菌门在土壤样品中也是优势菌门,因其形态多样生理活性丰富,又能产生种类繁多的胞外酶和次生代谢产物,在生态系统中扮演着重要的角色。与流沙对照相比,两种植被恢复类型土壤放线菌门所占比例呈增加趋势,但差异较不明显;拟杆菌门、芽单胞菌门、绿弯菌门、浮霉菌门、硝化螺旋菌门在两种植被恢复类型土壤中所占比例总体表现为较流沙对照样地有不同程度的提高。
在属的分类水平上,假单胞菌属(Pseudomonas)是LS、YH_R、YH_S和NT_S的优势分类单元,相对含量分别为42.07%、13.5%、23.94%和13.07%,在NT_R中优势地位不明显(8.28%),Gp6是NT_R的优势菌属(图4)。在不同样地土壤中还有一些丰度发生显著变化的属,如具有芳香化合物的生物降解作用的Sphingomonas、Sphingosinicella在油蒿根际土壤中显著高于其他样地,流沙对照中相对含量很少。与碳元素循环相关的Porphyrobacter,在油蒿根际中显著高于其他样地1.6倍至2.85倍,该属可降解有机污染物。分属于黏细菌的Chondromyces、Phaselicystis在油蒿根际中最高,中间锦鸡儿根际次之,流沙对照中较少。黏细菌具有分解复杂有机质(纤维素、几丁质、脂等)的能力;Gp6、Gp4、与磷代谢相关的芽单胞菌属(Gemmatimonas)、嗜热能降解纤维素的Ktedonobacter属菌群在中间锦鸡儿群落相对含量最高,油蒿群落次之,流沙对照最低;氢噬胞菌属(Hydrogenophaga)在流沙对照土壤中相对丰度明显高于其他样品。该属细菌可降解多种有机污染物,尤其对芳烃类污染物有很好的降解作用,但利用碳水化合物能力弱,随着植被恢复而大量减少。Escherichia、Enterococcus一般被认为是土壤中的致病菌,从流沙对照样地(1.86% 和0.16%)到植被恢复后逐步消失。根据数值推断,Pseudomonas、Gp6、Gp4、Gemmatimonas、Sphingomonas、Hydrogenophaga等菌属在植被恢复过程中有着很好的响应,随着植被恢复,升高或下降较为明显。
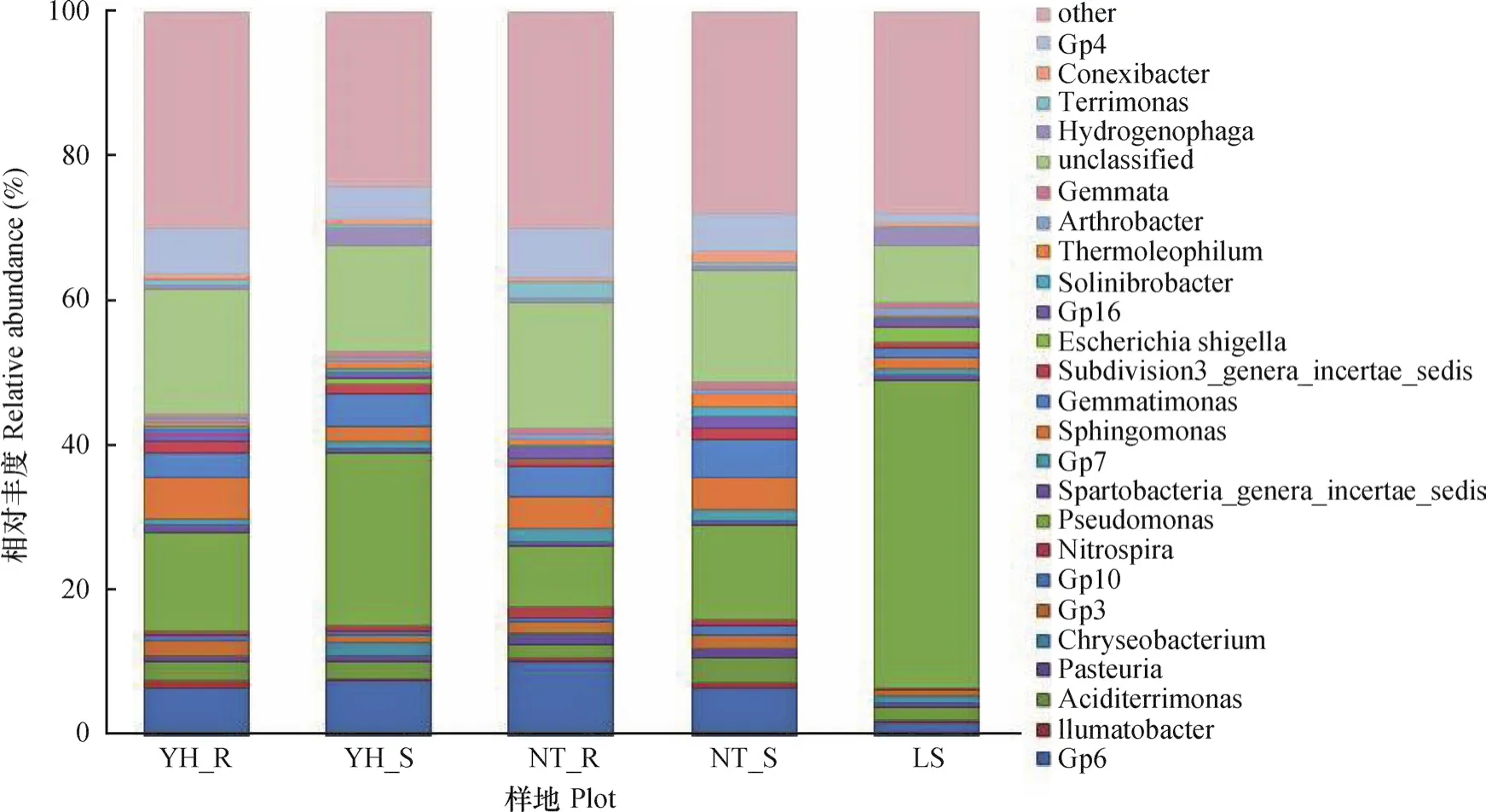
图4 各样地细菌群落在属水平上的组成和相对丰度Fig. 4 Composition at genus level and relative abundance of the bacteria communities in the soil samples from different plots
有许多研究已经证明一些具有固氮功能的菌群,在研究区不同样地土壤中固氮细菌群落不同,流动沙地中主要以假单胞菌属(Pseudomonas)、硫杆菌(Thiobacillus)、固氮菌属(Azotobacter)、芽孢杆菌(Bacillus)居多;油蒿根际土壤中有假单胞菌属(Pseudomonas)、红假单胞菌属(Rhodopseudomonas)、中慢生根瘤菌属(Mesorhizobium),以及有其他样地没有检测出的拜叶林克氏菌属(Beijerinckia );中间锦鸡儿根际土壤中以假单胞菌属(Pseudomonas)、红假单胞菌属(Rhodopseudomonas)、根瘤菌属(Rhizobium)、中慢生根瘤菌属(Mesorhizobium)、慢生根瘤菌属(Bradyrhizobium)为主。固氮菌属OTU数目总体表现为中间锦鸡儿根际高于油蒿根际土壤;在研究区发现一些参与硝化作用的氨氧化细菌,仅在中间锦鸡儿根际土壤中发现了亚硝化单胞菌属(Nitrosomonas);亚硝化螺菌属(Nitrosospira)在油蒿根际最高,中间锦鸡儿次之,流沙对照最低;硝化杆菌属(Nitrobacter)、硝化螺旋菌属(Nitrospira)以及具有反硝化作用的生丝微菌属(Hyphomicrobium)、土微菌属(Pedomicrobium)在中间锦鸡儿根际土壤中相对含量最高,油蒿根际次之,流沙对照土壤中很少。
还有一些菌属仅在一个样地中发现,如在油蒿根际土壤中发现四球菌属(Tetrasphaera)、希瓦氏菌属(Shewanella)、Pannonibacter、Patulibacter、Ferrimicrobium等菌属;在中间锦鸡儿根际土壤中发现硫单胞菌属(Thiomonas)、纤发菌属(Leptothrix)等菌属;在流动沙地中发现脱硫弧菌属(Desulfovibrio)。此外,两种植被根际、非根际土壤中还有约17.3%、15%无法划分到目前分类学研究的菌属中,流沙对照土壤中有7.84%无法分类的菌属。在两种植被恢复类型土壤中未分类的细菌几乎成了除Pseudomonas以外的第二大类群,说明两种植被恢复类型根际和非根际土壤中含有一定数量潜在的新种和细菌分类。
2.4 两种植被恢复类型土壤细菌群落特征与土壤理化因子的相关性
土壤理化性质与地表植物的种类密切相关,同时对土壤微生物群落结构造成影响[18]。对研究区各样地土壤理化因子与土壤细菌群落多样性进行相关分析,从表4可以看出,土壤有机质、全氮、速效氮、速效钾含量和土壤含水量与土壤细菌群落多样性间均有极显著正相关关系。土壤理化因子与土壤细菌群落丰度之间的相关分析表明,土壤有机质、全氮、速效氮、速效钾含量和土壤含水量与土壤细菌群落丰富度间均有极显著正相关关系(p<0.01),与土壤全磷含量具有显著正相关关系(p<0.05)。通过数据推断,土壤有机质、全氮、速效氮、速效钾含量和土壤含水量是影响土壤细菌群落多样性和丰度的主要土壤因子,土壤细菌群落多样性和丰度随着土壤有机质、全氮、速效氮、速效钾含量和土壤含水量的增加而增加。
对研究区各样地土壤理化因子与土壤细菌优势类群相对多度进行相关分析(表4),得出土壤有机质、全氮含量与变形菌门有极显著负相关关系(p<0.01),速效氮、有效磷、速效钾含量与变形菌门有显著相关关系(p<0.05)。土壤有机质、全氮、速效氮含量与酸杆菌门呈极显著正相关关系(p<0.01),速效钾含量与酸杆菌门呈显著正相关关系(p<0.05)。放线菌门与土壤理化因子间没有显著的相关性。综合分析,土壤有机质、全氮、速效氮、速效钾是影响细菌优势类群相对多度的主要土壤因子。
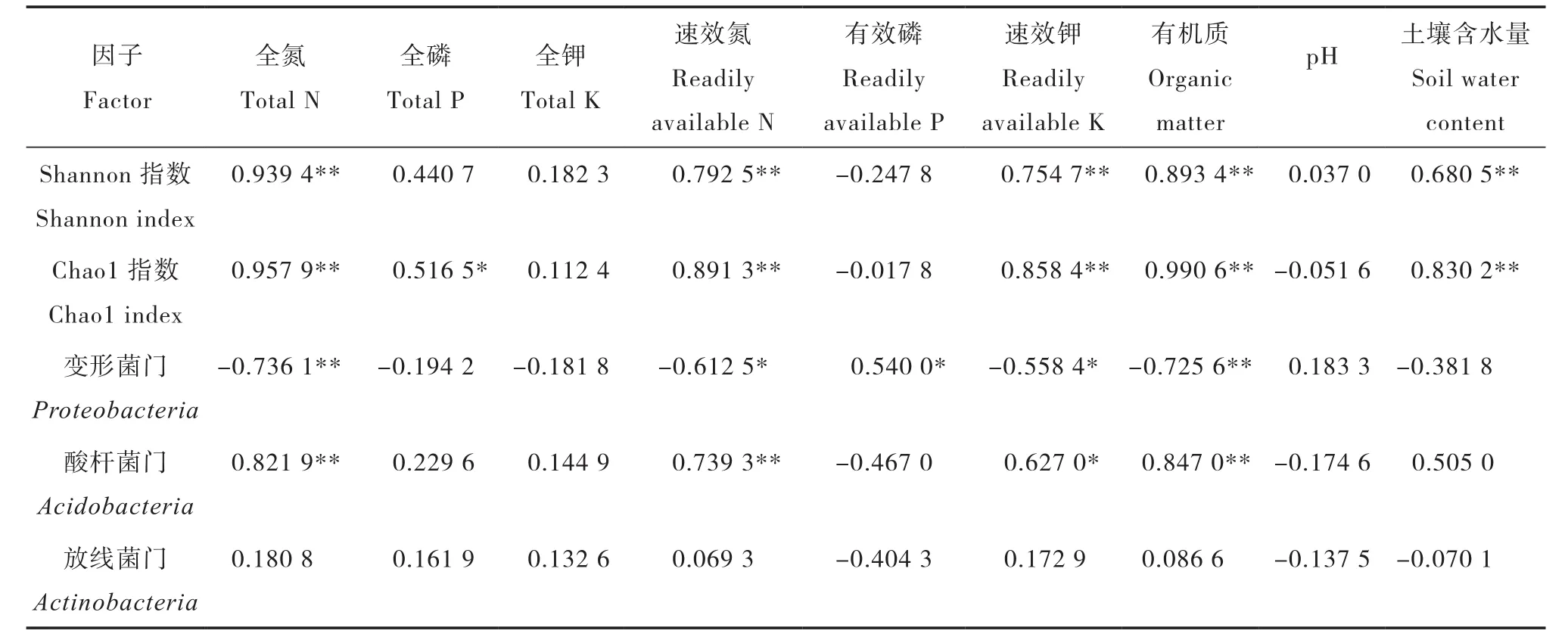
表4 土壤因子相关矩阵Table 4 Correlation matrix between soil quality factors
为分析细菌菌群结构与土壤理化因子的关系,以细菌群落在门和纲水平上的相对丰度数据作为物种数据,土壤理化数据作为土壤环境变量,进一步分析各样地土壤细菌类群相对多度与土壤理化因子间的相关关系,用Canoco软件作典型对应分析(CCA)图(图5)。第一排序轴、第二排序轴解释了细菌群落变化的78.7%和10.4%,其中第一排序轴对土壤细菌群落变化解释最多。第一排序轴主要与土壤有机质(r=-0.874 6)、全氮(r=-0.829 6)、全钾(r=-0.905 7)、速效钾(r=-0.695 7)高度相关;第二排序轴主要与土壤速效氮(r=-0.878 1)高度相关。结果表明,土壤有机质、全氮、全钾、速效钾、速效氮含量对于研究区土壤细菌群落遗传多样性的变化起着重要作用。
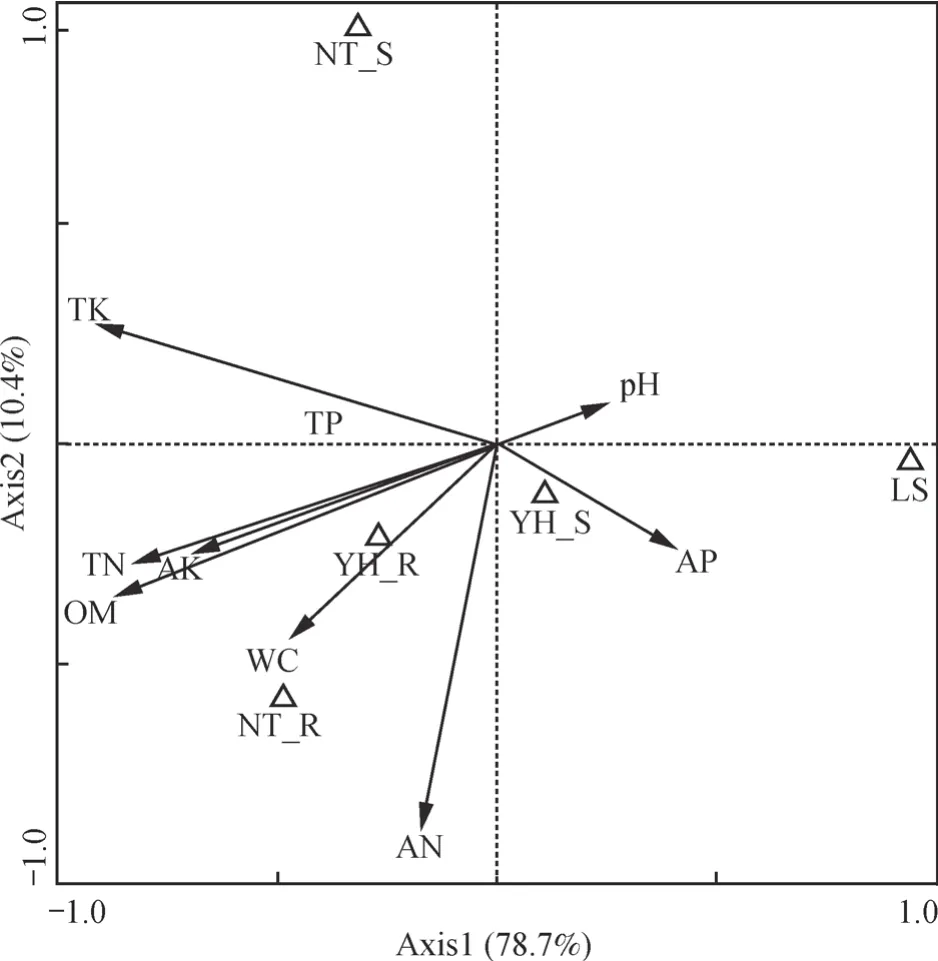
图5 细菌群落与土壤理化因子的典型对应分析Fig. 5 Cononical correspondence analysis(CCA)of sampling sites,soil factors and bacterial community
3 讨 论
目前,库布齐沙地植被群落结构和土壤理化性质、微生物数量及生物量等方面已有比较深入的研究,但土壤微生物多样性等方面研究较少。本研究采用高通量测序技术对两种植被恢复类型土壤细菌群落遗传多样性进行了分析研究。从土壤样品分布的OTU数目来看,两种植被恢复类型与流沙对照土壤相同细菌种类不超过25%,两种植被类型土壤相同的细菌种类不超过40%,表明植被恢复后土壤细菌菌群发生较大改变,两种植被恢复类型土壤细菌群落尽管有一定的相似性,但总体上存在较大差异。这可能是由于土壤微生物以植物根系分泌物及凋落物为养分,植物群落结构的改变引起土壤有机质变化,进而引起土壤微生物群落结构的改变[19]。
在本研究中,用土壤细菌群落丰度、多样性和均匀度指数分析土壤细菌多样性,结果显示,两种植被恢复类型土壤细菌群落丰度、多样性和均匀度较流沙对照土壤显著增加,其中,油蒿根际土壤细菌群落丰度和均匀度显著高于中间锦鸡儿根际,但细菌多样性在两种植被恢复类型根际、非根际间没有显著差异。一般而言,在稳定良好的生态环境中,微生物数量增加,种群丰富[20]。两种植被恢复类型土壤细菌丰度和多样性增加,说明植被恢复后,植物生长旺盛,地上部凋落物、根系代谢产物和分泌物等不断积累,改善土壤环境,适合微生物繁殖生长。而微生物能够释放土壤酶,催化氧化还原、有机质矿化、污染物降解、腐殖物质在土壤中的合成、以及生长活性物的释放等多种生物化学反应[21],因此种类繁多的微生物有益于土壤养分循环转化,是土壤健康的标志之一。油蒿根际土壤有着较高的土壤细菌丰度,表明不同植被恢复类型对于微生物群落结构有重要影响[22],这与油蒿根际提供了良好的微环境有关,油蒿根际具有较高的土壤有机质、土壤含水量、氮、磷、钾等营养元素,说明土壤细菌群落的丰度与土壤限制性资源的有效性和细菌对资源利用能力密切相关[23]。土壤细菌群落多样性在两种植被类型根际、非根际间没有显著差异,分析其原因,可能由于土壤中细菌多样性极为丰富[24],不仅受到土壤理化性质影响,根际分泌物、枯落物中可能含有特殊的次级代谢产物等也会对细菌群落结构和多样性产生重要影响[25],导致两种植被类型间差异不显著。
土壤细菌群落丰度和多样性与土壤理化因子的相关分析结果指出,土壤有机质、全氮、速效氮、速效钾含量和土壤含水量是影响土壤细菌群落丰度和多样性的主要土壤因子,从CCA分析可知土壤有机质、全氮、全钾、速效钾、速效氮含量对于研究区土壤细菌群落遗传多样性的变化起着重要作用。这与Liu等[26]、尹娜[27]的研究结果相似,土壤碳、氮等营养元素对细菌多样性有显著影响。本研究中土壤细菌丰度和多样性与土壤含水量呈极显著正相关,有研究指出,土壤含水量是干旱、半干旱生态系统限制植物生长的重要因素,对土壤细菌多样性有着重要影响[28]。对研究区各样地土壤理化因子与土壤细菌优势类群相对多度研究得出,变形菌门、酸杆菌门的相对多度与土壤有机质、全氮、速效氮、速效钾含量有显著相关性,这说明土壤有机质、全氮、速效氮、速效钾不仅是影响细菌多样性的主要土壤因子,也是影响细菌优势类群相对多度的主要土壤因子。
按照细菌各类群所占比例,将土壤细菌菌群分为优势类群、常见类群和稀有类群。本研究中,在门分类水平上,各样地土壤细菌以变形菌门、酸杆菌门和放线菌门为优势菌群,其中变形菌门丰度最高。这与韩亚飞等[29]、Zhang等[30]的研究相一致。与流沙对照比较,油蒿、中间锦鸡儿群落土壤中变形菌相对丰度在逐渐降低,同时伴随着其他微生物类群的出现及相对丰度增加。值得关注的是,在植被恢复过程中,变形菌的亚群分布发生了变化,γ-变形菌从LS样地相对含量的46.53%下降至11.08%~27.41%,α-变形菌相对含量在油蒿和中间锦鸡儿群落根际土壤中明显增加,自然恢复的油蒿群落根际土壤对α-变形菌恢复效果最为明显。这与陈香碧等[31]发现自然恢复大大增加了α-变形菌比例的研究结果相一致。Janssen[32]研究指出,丰富的α-变形菌可能与高营养状态的土壤有关,柳春林等[33]也认为土壤有机质及全氮含量高与土壤中含有较多的α-变形菌有关。尹娜[27]研究得出土壤有机碳含量对α-变形菌相对多度有正向促进作用。
在属分类水平上,假单胞菌属是研究区域的优势分类单元,从流沙对照(42.07%)到植被恢复(8.28%~23.94%),有较好的响应。假单胞菌广泛存在于土壤、水、植物及动物活动环境中,营养要求低,绝大多数不需要生长因子,且代谢类型多,代谢能力强,能利用多种碳源和氮源底物,因此,能适应不同的环境。在生物防治和生防菌剂的开发及应用方面有巨大的潜力[34]。该属异质性很强,也有很多致病种。具有固氮功能的菌群在各样地中表现为中间锦鸡儿根际高于油蒿根际土壤,流沙对照最低。结果表明植被恢复过程中,固氮菌种类发生了变化,中间锦鸡儿根际固氮菌具有较为丰富的遗传多样性,这可能与能与豆科植物建立固氮共生体系的根瘤菌有关。在土壤中重要的固氮菌类群如固氮螺菌属(Azospirillum)在样地中均未发现。
目前报道的具有解磷作用的微生物有:芽孢杆菌(Bacillus)、假单胞杆菌(Pseudomonas)、黄杆菌(Flavobacterium)、固氮菌(Azotobacter)、慢生根瘤菌(Bradyrhizobium)、节细菌(Arthrobacter)、硫杆菌(Thiobacillus)、埃希氏菌(Escherichia)、假单胞菌属(Pseudomonas)[35]。研究区流动沙地中解磷菌较为丰富,假单胞杆菌(Pseudomonas)、芽孢杆菌(Bacillus)、节细菌(Arthrobacter)、硫杆菌(Thiobacillus)为主,而YH_R中以黄杆菌(Flavobacterium)、中慢生根瘤菌(Mesorhizobium)为主,NT_R中以慢生根瘤菌(Bradyrhizobium)、中慢生根瘤菌(Mesorhizobium)为主。从目前报道的具有解磷作用的微生物类群来看,两种植被恢复类型解磷菌趋于单一化,且相对含量较少。解磷细菌受土壤类型、植物类型、植物生育期及长势、环境因素和微生物的相互作用等影响[36-37],土壤中磷源不同,其微生物种类也不尽相同,也可能受限于目前已知的具有解磷作用的微生物类群,有待进一步研究。
综合分析,与流沙对照相比,库布齐沙地两种植被恢复类型对土壤细菌菌群结构和多样性均产生了影响,发生了较大变化。两种植被恢复类型对细菌多样性产生了正效应,细菌群落总数和多样性明显增加。其中,自然恢复的油蒿群落土壤细菌丰度高于人工种植的中间锦鸡儿群落。两种植被恢复类型根际土壤α-变形菌明显增加,油蒿根际对α-变形菌的恢复效果尤为明显。从细菌类群来看,植被恢复明显改变了流动沙地的菌群结构,细菌菌群从流动沙地较为单一的结构,随着植被恢复,优势菌属丰度在逐渐降低,同时伴随着其他微生物类群出现,很多与碳循环、光合作用、降解作用、硝化和反硝化作用、固氮、分解复杂有机物和纤维素等菌群呈显著增加趋势,其中一些参与碳循环、光合作用、分解复杂有机质、降解等过程的菌群丰度总体表现为油蒿根际高于中间锦鸡儿根际,而中间锦鸡儿群落根际土壤固氮、硝化作用菌群较为丰富。此外,在流动沙地中发现的大肠杆菌、肠球菌等动植物致病菌,相对含量随着植被恢复显著减少,在油蒿根际土壤中未出现,说明植被恢复尤其是自然恢复的植被类型抑制了致病菌的生长。总体而言,植被恢复改变了流动沙地土壤较为单一的细菌菌群结构,尤其是自然恢复的油蒿群落在增加土壤细菌群落丰度,促进有益菌群生长,抑制致病菌群等方面表现更优。可见,沙地土壤中蕴含着不同微生物种群,可为功能微生物的发掘与筛选提供微生物来源。
4 结 论
与流沙对照相比,两种植被恢复类型对土壤细菌菌群结构和多样性产生了正效应,细菌群落丰度、多样性和均匀度明显增加。其中,自然恢复的油蒿群落土壤细菌丰度高于人工种植的中间锦鸡儿群落。变形菌门、酸杆菌门和放线菌门为研究区土壤中的优势细菌类群,其中变形菌门在各样地丰度比例最高,随着植被恢复,两种植被恢复类型土壤中变形菌相对含量明显减少,同时伴随着其他微生物类群相对丰度呈不同程度增加趋势。α-变形菌相对含量在油蒿和中间锦鸡儿群落根际土壤中明显增加,尤其是自然恢复的油蒿群落根际土壤中α-变形菌得到了很好的恢复。土壤有机质、全氮、速效氮、速效钾含量对于研究区土壤细菌群落丰度、多样性、优势类群相对多度、遗传多样性的变化起着重要作用。
[1] Zak D R,Holmes W E,White D C,et al. Plant diversity,soil microbial communities,and ecosystem function:Are there any links? Ecology,2003,84 (8):2042—2050
[2] 纳小凡,郑国琦,彭励,等. 不同种植年限宁夏枸杞根际微生物多样性变化. 土壤学报,2016,53(1):241—252
Na X F,Zheng G Q,Peng L,et al. Microbial biodiversity in rhizosphere of Lycium bararum L. relative to cultivation history(In Chinese). Acta Pedologica Sinica,2016,53(1):241—252
[3] Jacobsen C S,Hjelms M H. Agricultural soils,pesticides and microbial diversity. Current Opinion in Biotechnology,2014,27:15—20
[4] 张薇,魏海雷,高洪文,等. 土壤微生物多样性及其环境影响因子研究进展. 生态学杂志,2005,24(1):48—52
Zhang W,Wei H L,Gao H W,et al. Advances of studies on soil microbial diversity and environmental impact factors(In Chinese). Chinese Journal of Ecology,2005,24(1):48—52
[5] Dunbar J,Barns S M,Ticknor L O,et al. Empirical and theoretical bacterial diversity in four Arizona soils. Applied and Environmental Microbiology,2002,68 (6):3035—3045
[6] Wardle D A,Bonner K I,Barker G M,et al. Plant removals in perennial grassland:vegetation dynamics,decomposers,soil biodiversity and ecosystem properties. Ecological Monographs,1999,69(4):535—568
[7] Högberg P,Nordgren A,Buchmann N,et al. Largescale forest girdling shows that current photosynthesis drives soil respiration. Nature,2001,411(6839):789—792
[8] 杨俊平. 库布齐地区土地荒漠化及其防治研究. 北京:北京林业大学,2006
Yang J P. A preliminary study of land desertification and its combating in Kubuqi area(In Chinese). Beijing:Beijing Forestry University,2006
[9] 陈家模. 四种人工固沙植物群落对土壤养分及生物活性的改良作用. 沈阳:东北大学,2009
Chen J M. Improvement effects of four plantations for sand-fixation on soil nutrient contents and biological activities(In Chinese). Shenyang:Northeastern University,2009
[10] Johansen J E,Binnerup S J. Contribution of cytophagalike bacteria to the potential of turnover of carbon,nitrogen,and phosphorus by bacteria in the rhizosphere of barley(Hordeum vulgare L). Microbial Ecology,2002,43(3):298—306
[11] 曹成有,蒋德明,滕晓慧,等. 小叶锦鸡儿固沙群落土壤微生物生物活性的季节动态. 水土保持学报,2011,25(3):185—188
Cao C Y,Jiang D M,Teng X H,et al. Seasonal variations of soil microbiological activities in Caragana microphylla sand-fixation plantations(In Chinese). Journal of Soil and Water Conservation,2011,25 (3):185—188
[12] 苏永中,赵哈林,张铜会. 几种灌木、半灌木对沙地土壤肥力影响机制的研究. 应用生态学报,2002,13 (7):802—806
Su Y Z,Zhao H L,Zhang T H. Influencing mechanism of several shrubs and subshrubs on soil fertility in Keerqin sandy land(In Chinese). Chinese Journal of Applied Ecology,2002,13(7):802—806
[13] Salles J F,van Veen J A,van Elsas J D. Multivariate analyses of Burkholderia species in soil:Effect of crop and land use history. Applied and Environmental Microbiology,2004,70(7):4012—4020
[14] Harris J A. Measurements of the soil microbial community for estimating the success of restoration. European Journal of Soil Science,2003,54:801—808
[15] Riley D,Barber S A. Salt accumulation at the soybean (Glycine max(L.)Merr)root-soil interface. Soil Science Society of America Journal,1970,34(1):154—155
[16] Shaw A K,Halpern A L,Beeson K,et al. It's all relative:Ranking the diversity of aquatic bacterial communities. Environmental Microbiology,2008,10 (9):2200—2210
[17] Naether A,Foesel B U,Naegele V,et al. Environmental factors affect acidobacterial communities below the subgroup level in grassland and forest soils. Applied & Environmental Microbiology,2012,78(20):7398—7406
[18] Shang Z H,Ding L L,Long R J,et al. Relationship between soil microorganisms,above-ground vegetation,and soil environment of degraded alpine meadows in the headwater areas of the Yangtze and Yellow River,Qinghai-Tibetan Plateau. Acta Prataculturae Sinica,2007,16(1):34—40
[19] Hooper D U,Bignell D E,Brown V K,et al. Interactions between above and belowground biodiversity in terrestrial ecosystems:Patterns,mechanisms,and feedbacks. Bioscience,2000,50(12):1049—1061
[20] 贺纪正,李晶,郑袁明. 土壤生态系统微生物多样性-稳定性关系的思考. 生物多样性,2013,21(4):411—420
He J Z,Li J,Zheng Y M. Thoughts on the microbial diversity-stability relationship in soil ecosystems(In Chinese). Biodiversity Science,2013,21(4):411—420
[21] 叶协锋,张友杰,鲁喜梅,等. 土壤微生物与土壤营养关系研究进展. 土壤通报,2009,40(6):233—237
Ye X F,Zhang Y J,Lu X M,et al. Research advance on relationship between the soil microbes and soil nutrition(In Chinese). Chinese Journal of Soil Science,2009,40(6):233—237
[22] 隋心,张荣涛,钟海秀,等. 利用高通量测序对三江平原小叶章湿地土壤细菌多样性的研究. 土壤,2015,47(5):919—925
Sui X,Zhang R T,Zhong H X,et al. Study on bacterial diversity of Deyeuxia angustifolia wetland by application of high-throughput sequencing technology in Sanjiang Plain(In Chinese). Soils,2015,47(5):919—925
[23] Berg G,Smalla K. Plant species and soil type cooperatively shape the structure and function of microbial communities in the rhizosphere. FEMS Microbiology Ecology,2009,68(1):1—13
[24] Horner-Devine M C,Leibold M A,Smith V H,et al. Bacterial diversity patterns along a gradient of primary productivity. Ecology Letters,2003,6(7):613—622
[25] Somers E,Vanderleyden J,Srinivasan M. Rhizosphere bacterial signaling:A love parade beneath our feet. Critical Reviews in Microbiology,2004,30(4):205—240
[26] Liu Z F,Fu B J,Zheng X X,et al. Plant biomass,soil water content and soil N∶P ratio regulating soil microbial functional diversity in a temperate steppe:A regional scale study. Soil Biology & Biochemistry,2010,42(3):445—450
[27] 尹娜. 中国北方主要草地类型土壤细菌群落结构和多样性变化. 长春:东北师范大学,2014
Yin N. Changes in structure and diversity of soil microbial communities across the main grasslands in Northern China(In Chinese). Changchun:Northeast Normal University,2014
[28] Fierer N,Jackson R B. The diversity and biogeography of soil bacterial communities. Proceedings of the National Academy of Sciences,2006,103(3):626—631
[29] 韩亚飞,伊文慧,王文波,等. 基于高通量测序技术的连作杨树人工林土壤细菌多样性研究. 山东大学学报(理学版),2014,49(5):1—6
Han Y F,Yi W H,Wang W B,et al. Soil bacteria diversity in continuous cropping poplar plantation by high throughput sequencing(In Chinese). Journal of Shandong University(Natural Science),2014,49 (5):1—6
[30] Zhang T,Shao M F,Ye L. 454 pyrosequencing reveals bacterial diversity of activated sludge from 14 sewage treatment plants. The ISME Journal,2012,6(6):1137—1147
[31] 陈香碧,苏以荣,何寻阳,等. 不同干扰方式对喀斯特生态系统土壤细菌优势类群—变形菌群落的影响. 土壤学报,2012,49(2):354—363
Chen X B,Su Y R,He X Y,et al. Effect of human disturbance on composition of the dominant bacterial group—Proteobacteria in Karst soil ecosystem(In Chinese). Acta Pedologica Sinica,2012,49(2):354—363
[32] Janssen P H. Identifying the dominant soil bacterial taxa in libraries of 16S rRNA and 16S rRNA genes. Applied & Environmental Microbiology,2006,72(3):1719—1728
[33] 柳春林,左伟英,赵增阳,等. 鼎湖山不同演替阶段森林土壤细菌多样性. 微生物学报,2012,52(12):1489—1496
Liu C L,Zuo W Y,Zhao Z Y,et al. Bacterial diversity of different successional stage forest soils in Dinghushan (In Chinese). Acta Microbiologica Sinica,2012,52 (12):1489—1496
[34] Beneduzi A,Ambrosini A,Passaglia L M. Plant growthpromoting rhizobacteria(PGPR):Their potential as antagonists and biocontrol agents. Genetics & Molecular Biology,2012,35(Suppl 4):1044—1051
[35] Vessey J K. Plant growth promoting rhizobacteria as biofertilizers. Plant and Soil,2003,255(2):571—586
[36] Gupta C P,Dubey R C,Maheshwari D K. Plant growth enhancement and suppression of Macrophomina phaseolin a causing charcoal rot of peanut by fluorescent Pseudomonas. Biology and Fertility of Soils,2002,35 (6):399—405
[37] Mondal K K,Dureja P,Verma J P. Management of Xanthomonas camprestris pv. malvacearuminduced blight of cotton through phenolics of cotton rhizobacterium. Current Microbiology,2001,43 (5):336—339
Soil Bacteria Diversity in Rhizosphere under Two Types of Vegetation Restoration Based on High Throughput Sequencing
DAI Yating1,2YAN Zhijian1XIE Jihong1WU Hongxin1XU Linbo1HOU Xiangyang1,2†GAO Li1,2CUI Yanwei1
(1 Grassland Research Institute,Chinese Academy of Agricultural Sciences,Huhhot 010010,China)
(2 Key Laboratory of Grassland Ecology and Restovation,Ministry of Agriculture,Huhhot 010010,China)
【Objective】Artemisia ordosica and Caragana intermedia are the two widely-distributed and efficient sand-fixing shrubs in the Hobq Desert that have
considerable attention because of the roles they may play in the vegetation restoration. Soil bacteria diversity is an important indicator of the state of soil microbial communities and one indicating progress of ecological restoration. This project is oriented to study changes in community structure and diversity of soil bacteria in the process of vegetation and ecological restoration in the Hobq Desert relative to type of vegetation.【Method】In this study,two types of vegetations,naturally restored Artemisia ordosica and artificially planted Caragana intermedia,were chosen for comparison to see effects of the vegetations on community structure and diversity of soil bacteria with a tract of moving sand land as control. The sample plots were set up in 1995 and soil samples were collected from the rhizospheres of A. ordosica and C. intermedia and bulk soil in the 0~20 cm soil layer and CK in August 2014 for analysis of soil bacteria diversity using the high throughput sequencing method. And relationship between soil bacterial diversity and soil physic-chemical properties,and the effect of soil physical and chemical properties on distribution of bacterial community were also studied through canonical correlation analysis and cononical correspondence analysis.【Result】(1)Chao1 index,Shannon index and ACE index are important indicators of soil bacterial diversity and richness. In terms of Chao1 index and Shannon index,the sample plots displayed an order of rhizosphere soil of A. ordosica > rhizosphere soil of C. intermedia > non-rhizosphere soil of A. ordosica > non-rhizosphere soil of C. intermedia > soil of CK,while in terms of ACE index,they followed another order:rhizosphere soil of A. ordosica > rhizosphere soil of C. intermedia > non-rhizosphere soil of C. intermedia > non-rhizosphere soil of A. ordosica > soil of CK.(2)Classification at the phylum level shows the bacterial communities in the samples were mainly composed of Proteobacteria,Acidobacteria,Actinobacteria,Bacteroidetes,Gemmatimonadetes,Planctomycetes,Verrucomicrobia,Firmicutes and Chloroflexi,accounting for 88.67%~94.19%. Proteobacteria,Acidobacteria and Actinobacteria were the dominant bacterial groups in the samples,and Proteobacteria was the highest in abundance. The four subgroups under Proteobacteria followed a similar trend in variation. Relative abundance of α-proteobacteria in the rhizosphere and bulk soils under either vegetation exhibited a sharply rising trend,increasing in the rhizosphere of A. ordosica and C. intermedia increased by 106.46% and 70.60% respectively.(3)Soil organic matter,total N,total K,readily available N,readily available K,and soil water are the main soil factors affecting abundance and diversity of soil bacteria communities. Correlation analysis of soil physic-chemical properties with relative abundance of dominant soil bacteria groups shows that the abundance of Proteobacteria was significantly related to soil organic matter,total N,readily available N,readily available P,and readily available K,while the abundance of Acidobacteria was to soil organic matter,total N,readily available N,readily available P andreadily available K. Intrestingly,the abundance of Actinobacteria was not so much related to soil factors. Cononical correspondence analysis indicates that soil organic matter,total N,total K,readily available K and readily available N play an important role in triggering variation of genetic diversity of the bacterial communities in the soils.【Conclusion】Results show that compared to moving sand land,the two tracts of lands with vegetation restored have demonstrated positive effects on community structure and diversity of soil bacteria,whose abundance,diversity and evenness have been significantlt improved. Between the two types of vegetation restoration,the naturally restored A. ordosica vegetation was higher than the artificially plated C. intermedia vegetation in effect increasing abundance of soil bacterial community. Bacterial community in the untreated soil is quite simple in structure. The restoration of vegetation enriches soil microbial groups,making the community of soil bacteria diversified in the rhizosphere and non-rhizosphere soils. Relative abundance of a-proteobacteria under the vegetation of A. ordosica and C. intermedia significantly increased,especially under the vegetation of A. ordosica.
Rhizosphere soil;Bacterial community diversity;High throughput sequencing
S15
A
(责任编辑:陈德明)
* 国家重点基础研究发展计划(973计划)(2014CB138806)和中央级公益性科研院所基本科研业务费专项资金项目(1610332014026 )资助 Supported by the National Basic Research Program of China(973 Program)(No. 2014CB138806)and the Fundamental Research Funds for the Central Public Research Institutes(No. 1610332014026)
† 通讯作者 Corresponding author,E-mail:houxy16@126.com
戴雅婷(1983—),女,内蒙古呼和浩特人,硕士,助理研究员,主要从事土壤生态、微生物生态研究。E-mail:daiyating1983@163.com
2016-03-15;
2017-02-23;优先数字出版日期(www.cnki.net):2017-03-01
10.11766/trxb201603150062

